Похожие презентации:
Аммиак. Состав вещества
1. Повторение
• Напомните, какую тему рассматривалина прошлом уроке?
• Какие химические элементы входят в
данную подгруппу?
• Укажите возможные значения степеней
окисления этих атомов?
• Назовите соединения, образованные
атомом азота?
1
2. Историческая справка
• Еще в древности арабские алхимики изоазиса Амон, находившегося посредине
ливийской пустыни, получали бесцветные
кристаллы. Они звали вещество
«нушадир», его растирали в ступках,
нагревали – и всякий раз получался едкий
газ. Сначала его именовали аммониак.
• В средние века этот газ называли
«щелочным воздухом», а его раствор и
поныне называется «нашатырный спирт». 2
3. Тема урока
«Можно не любить химию, нопрожить без неё сегодня и завтра
нельзя»
О.М.Нефёдов
3
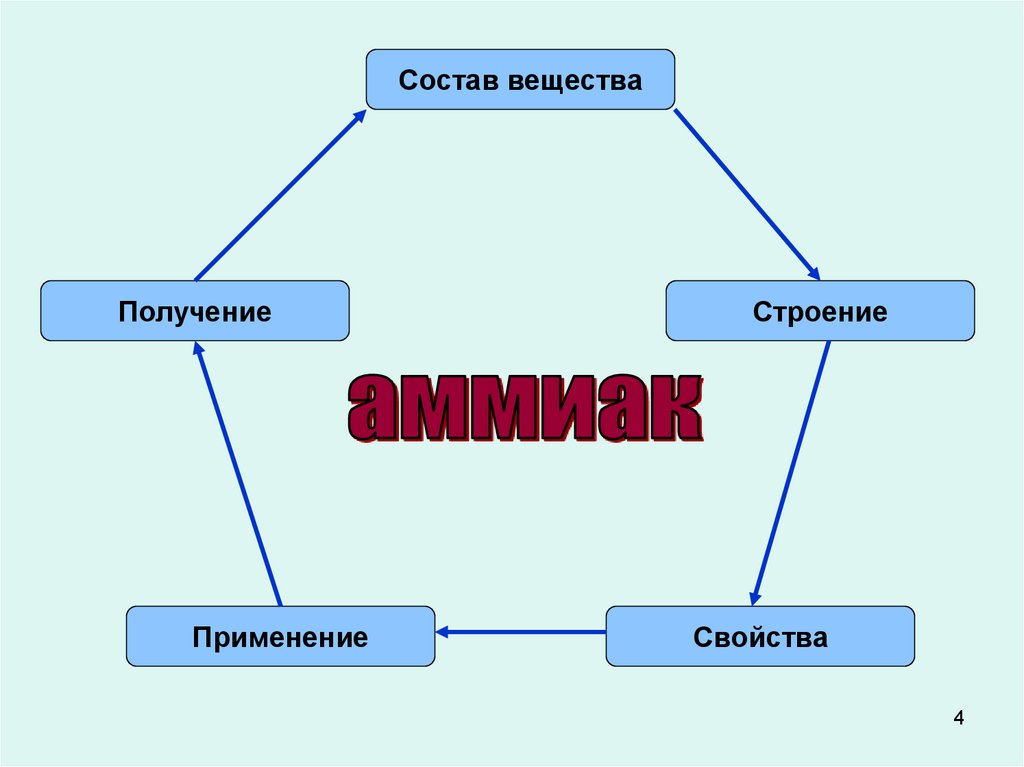
4.
Состав веществаПолучение
Применение
Строение
Свойства
4
5. Цель урока:
- изучить строение аммиака ,-доказать как строение отражается на
его свойствах,
-разобрать способы получения,
- обобщить знания об областях
применения аммиака
5
6.
7.
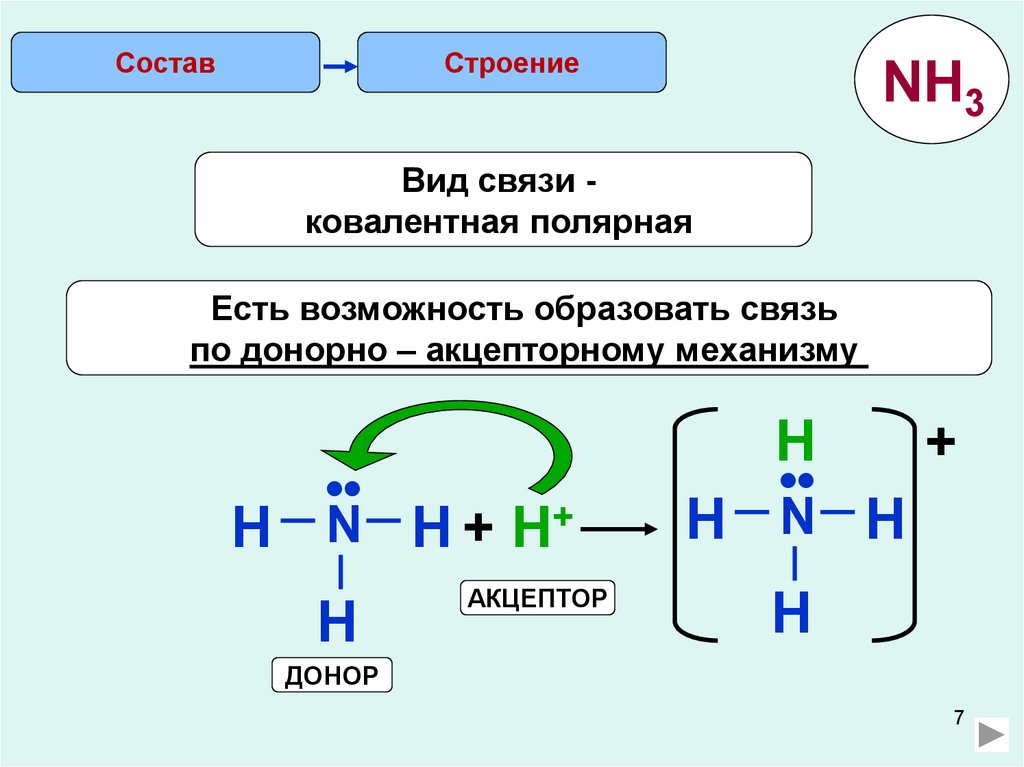
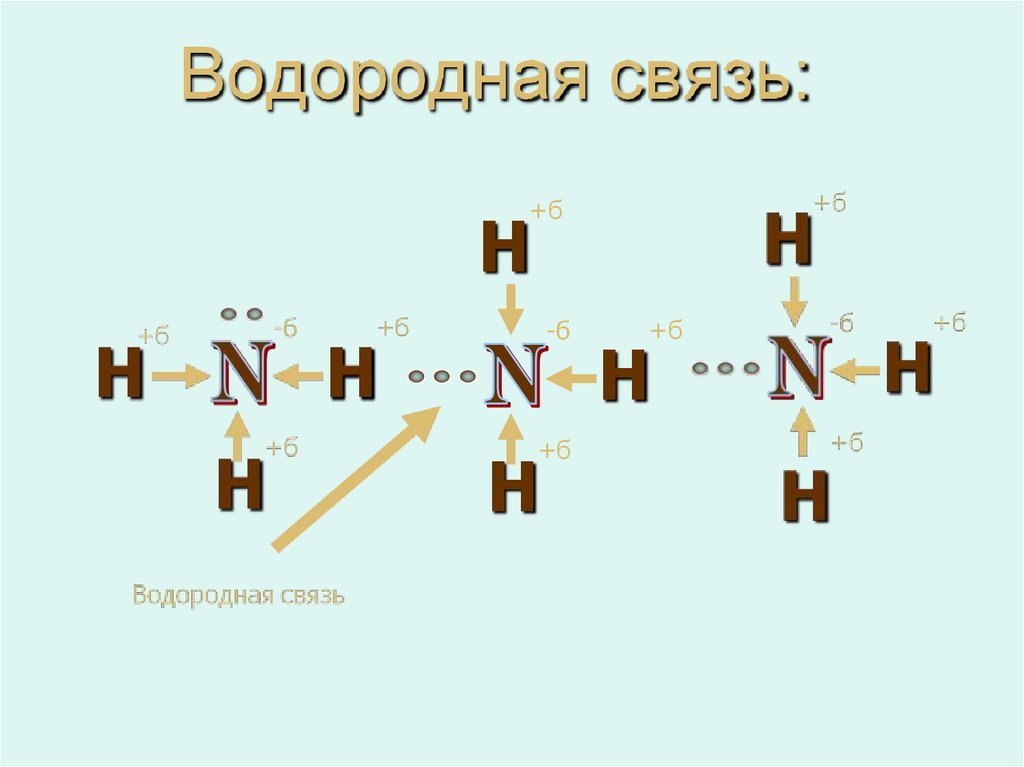
СоставСтроение
NH3
Вид связи ковалентная полярная
Есть возможность образовать связь
по донорно – акцепторному механизму
H
•
N H + H+
H
АКЦЕПТОР
H
H
•
N H
+
H
ДОНОР
7
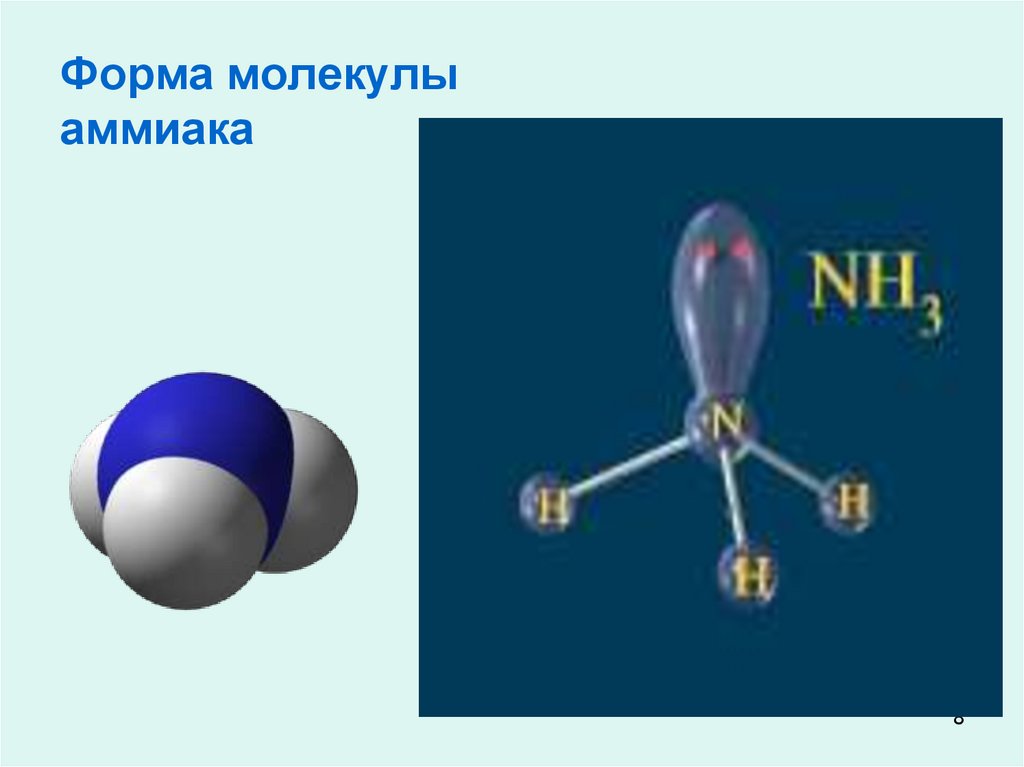
8. Форма молекулы аммиака
89.
10. Как строение молекулы отражается на свойствах?
1011.
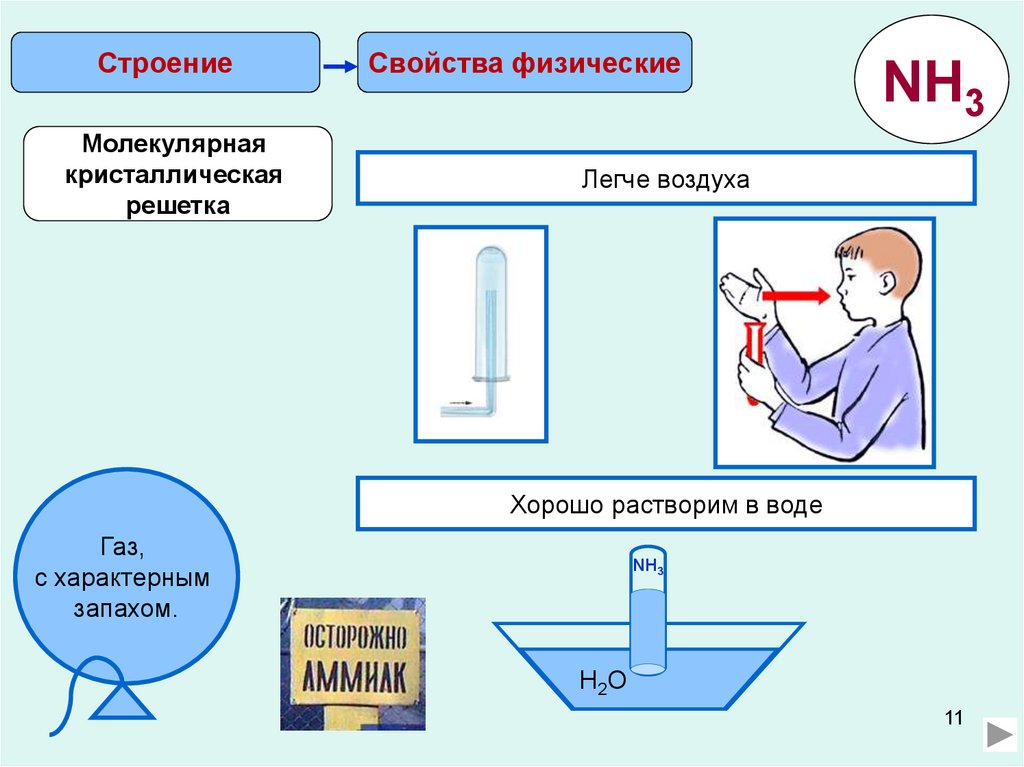
СтроениеМолекулярная
кристаллическая
решетка
Свойства физические
NH3
Легче воздуха
Хорошо растворим в воде
Газ,
с характерным
запахом.
NH3
H2O
11
12.
В растворе аммиака фенофталеин - малиновый13.
14.
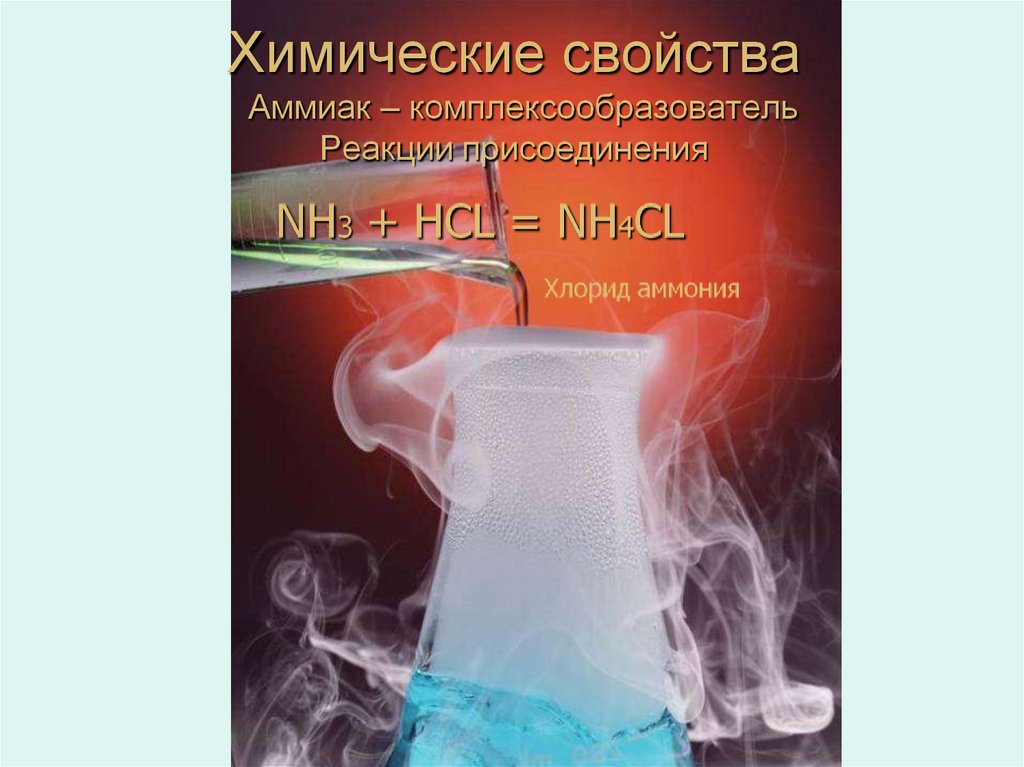
СтроениеСвойства химические
NH3
Горит ли аммиак?
+ О2
N2 + Н2О
катализатор
+ О2
NО + Н2О
Запишите
уравнения
реакции
аммиака
с серной и
Допишите
уравнения
реакции,
составьте
ортофосфорной
кислотой,
назовите
продукты
электронный баланс,
укажите
окислитель
и
реакции.
восстановитель.
14
15.
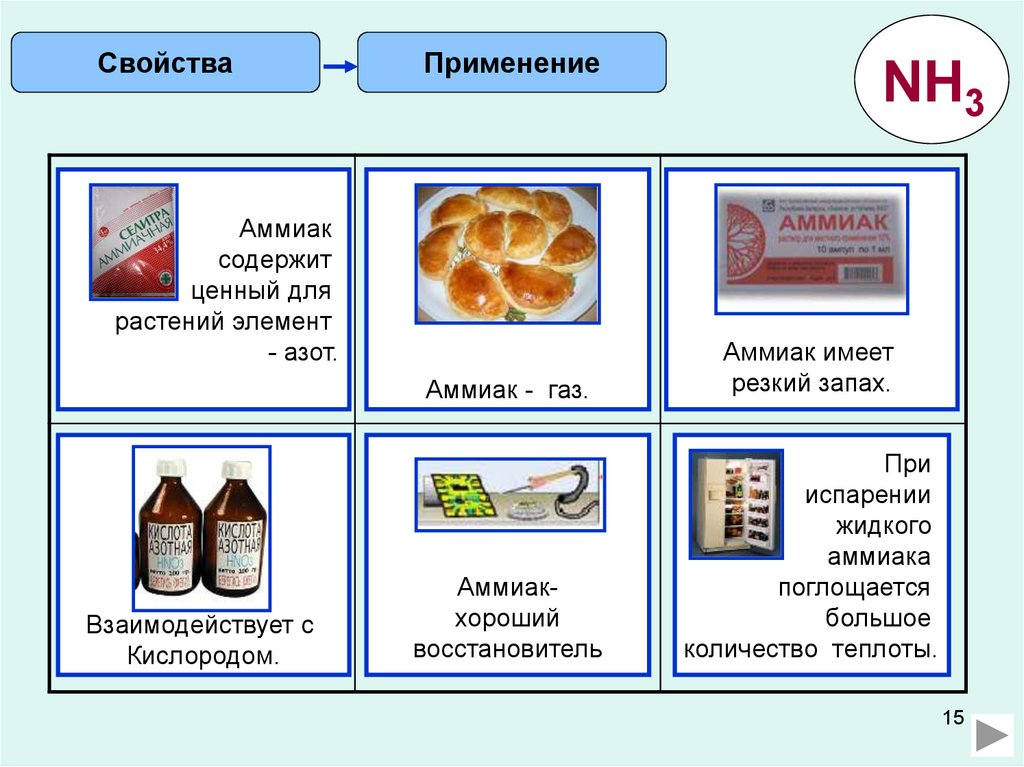
СвойстваПрименение
NH3
Рассчитайте
Аммиак
массовую
содержит
долю азота
в
ценный для
растений элемент
аммиачной
- азот.
селитре
Запишите
уравнение
реакции
разложения
гидрокарбоната
Аммиак
- газ.
аммония
Рассчитайте объем
аммиака для
приготовления 50г
5% - ного
нашатырного
спирта
Аммиак имеет
(при запах.
н.у.)
резкий
Как осуществить
превращения?
NH3 → NO → NO2
HNO3
Составьте
окислительновосстановительную
реакцию
взаимодействия
Аммиакхлорида
аммония с
хороший
оксидом
меди.
восстановитель
Какой объем При
при
испарении
нормальных
условияхжидкого
будет
аммиака
занимать
1 кг
поглощается
большое
жидкого
количество
теплоты.
аммиака.
Взаимодействует с
Кислородом.
15
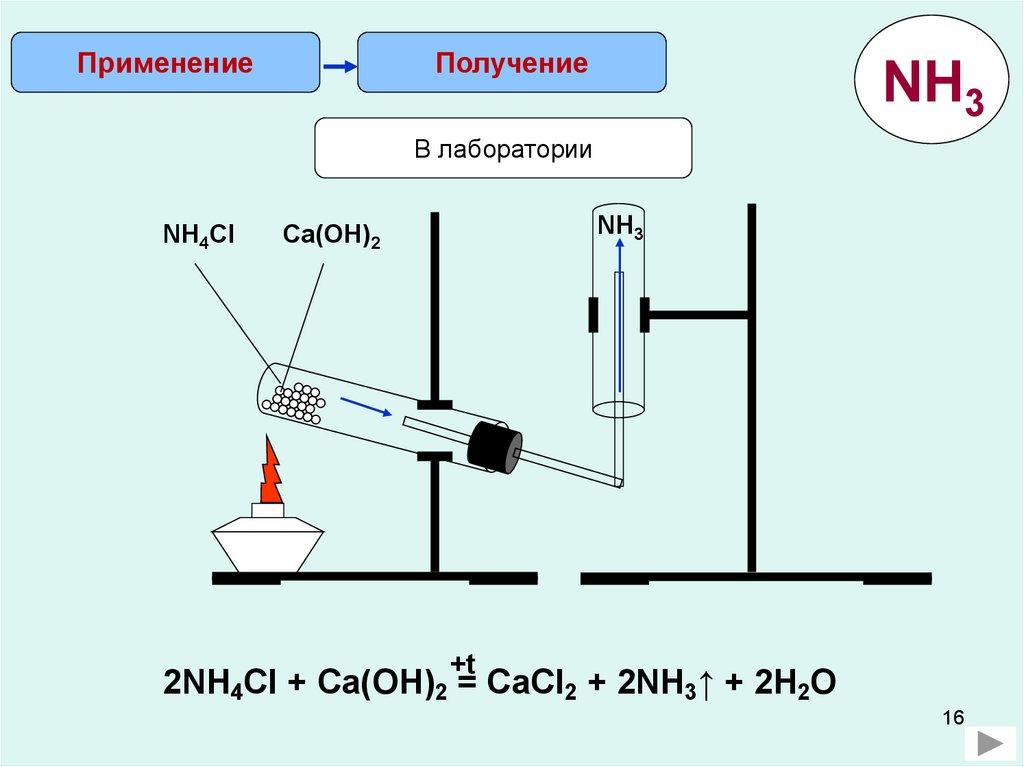
16.
ПрименениеПолучение
NH3
В лаборатории
NH4Cl
NH3
Ca(OH)2
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
16
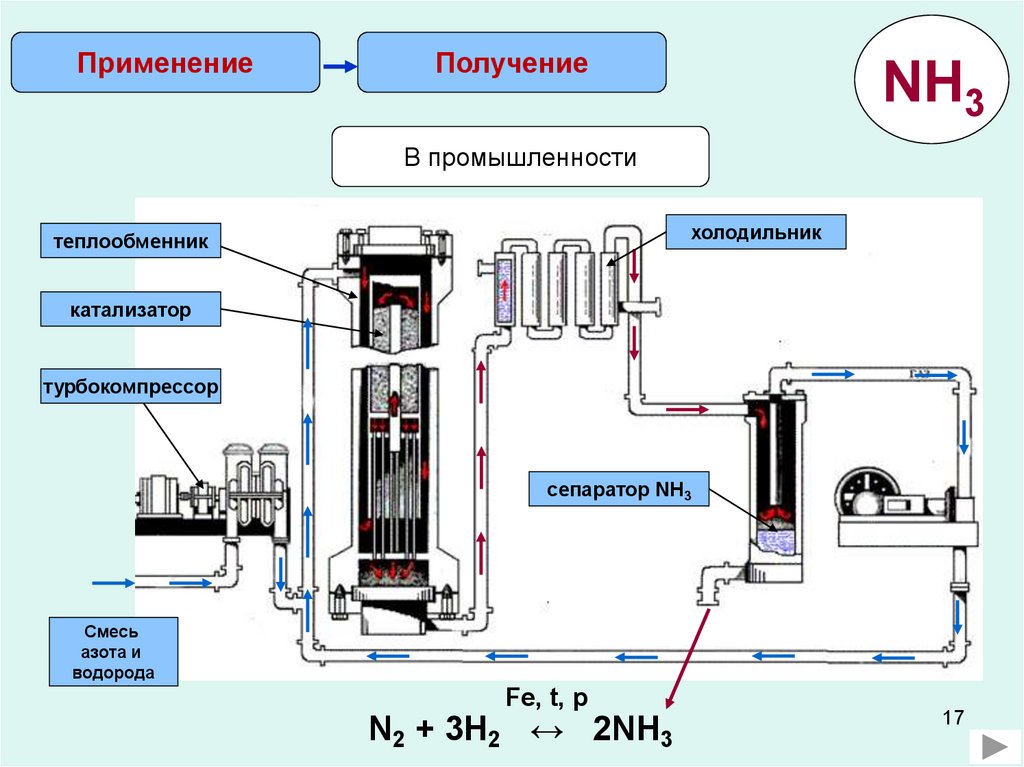
17.
ПрименениеПолучение
NH3
В промышленности
холодильник
теплообменник
катализатор
турбокомпрессор
сепаратор NH3
Смесь
азота и
водорода
Fe, t, p
N2 + 3H2 ↔ 2NH3
17
18. Подведем итоги.
• 1.АММИАК – легкий газ с резкимзапахом.
• 2. АММИАК – слабое неорганическое
основание. Причина этого-наличие у
атома азота свободной пары
электронов.
• 3. АММИАК- восстановитель.
• 4. АММИАК- горюч
18
19. Домашнее задание:
1. Прочитать § 17, записи втетради выучить
2. Упражнения 6,7, 8 письменно
3. Создать памятку- рекомендации
по использовании аммиака в
быту.
19




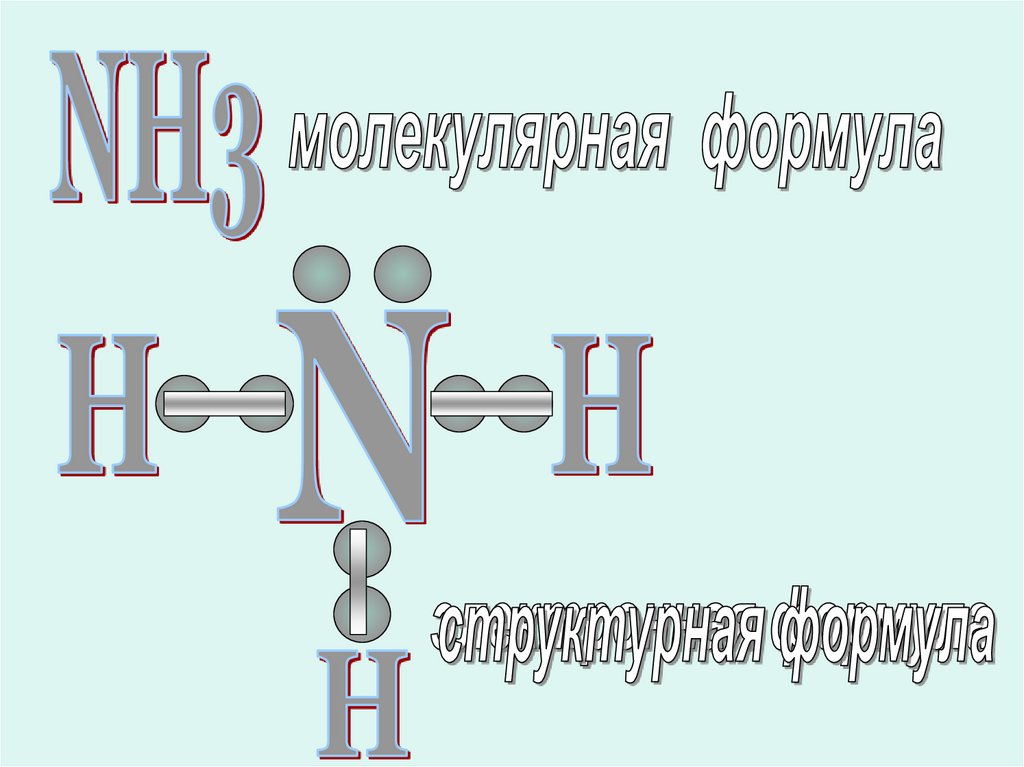





 Химия
Химия








