Похожие презентации:
Мембранный транспорт
1.
Транспорт через мембрану2.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯРОЛЬ КЛЕТОЧНОЙ МЕМБРАНЫ
• отграничить живое от неживого
• организовать внутри клетки компартменты с
различными свойствами
• контролировать проникновение в клетку и выход
из нее метаболитов
• служить запасом ряда биологически активных
соединений (арахидоната, холестерина, сфингозина,
инозитол-трис-фосфата)
• реагировать на внешние сигналы (хемо-, электро- и
механорецепторы)
3.
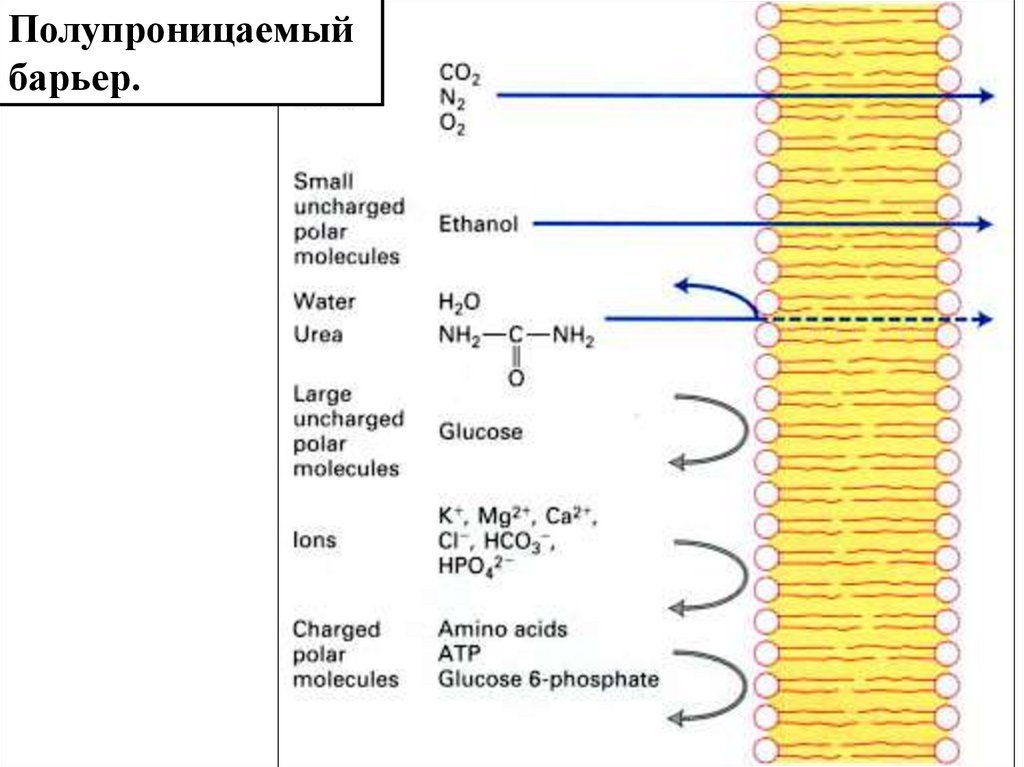
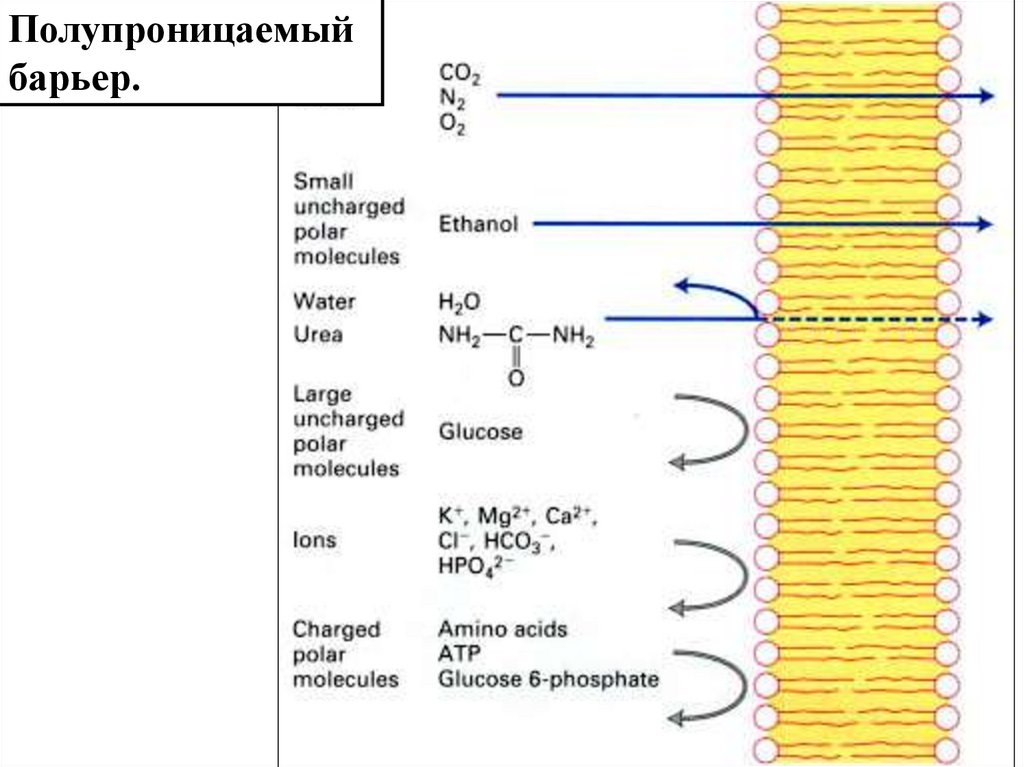
Полупроницаемыйбарьер.
4.
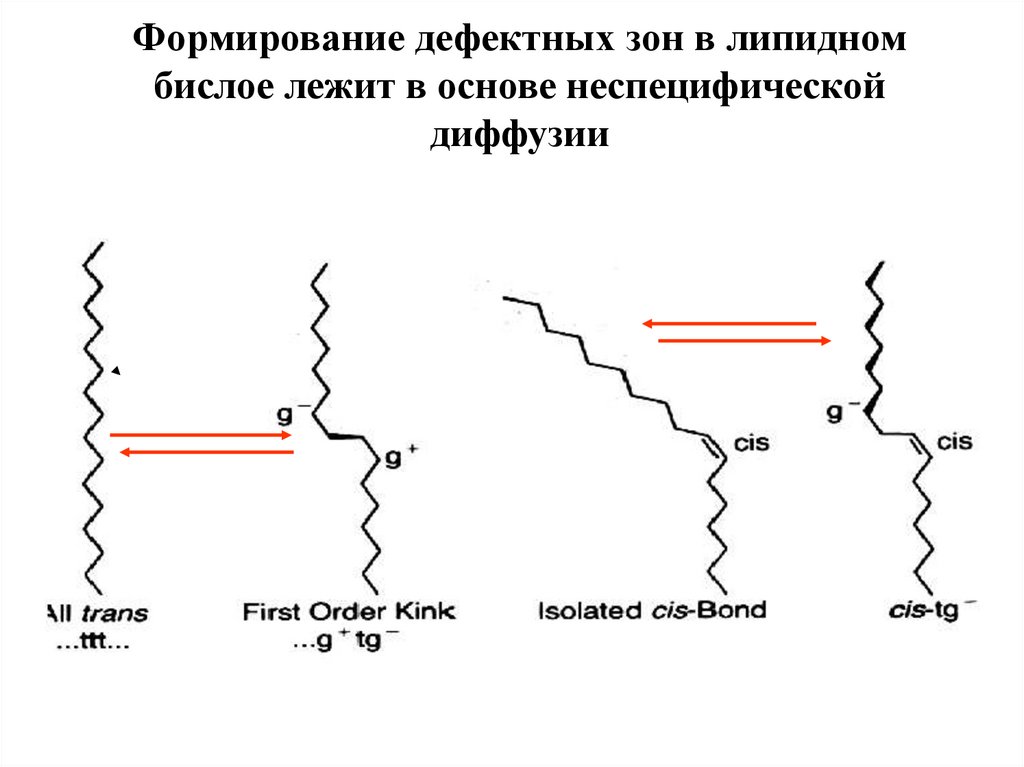
Формирование дефектных зон в липидномбислое лежит в основе неспецифической
диффузии
5.
Полупроницаемыйбарьер.
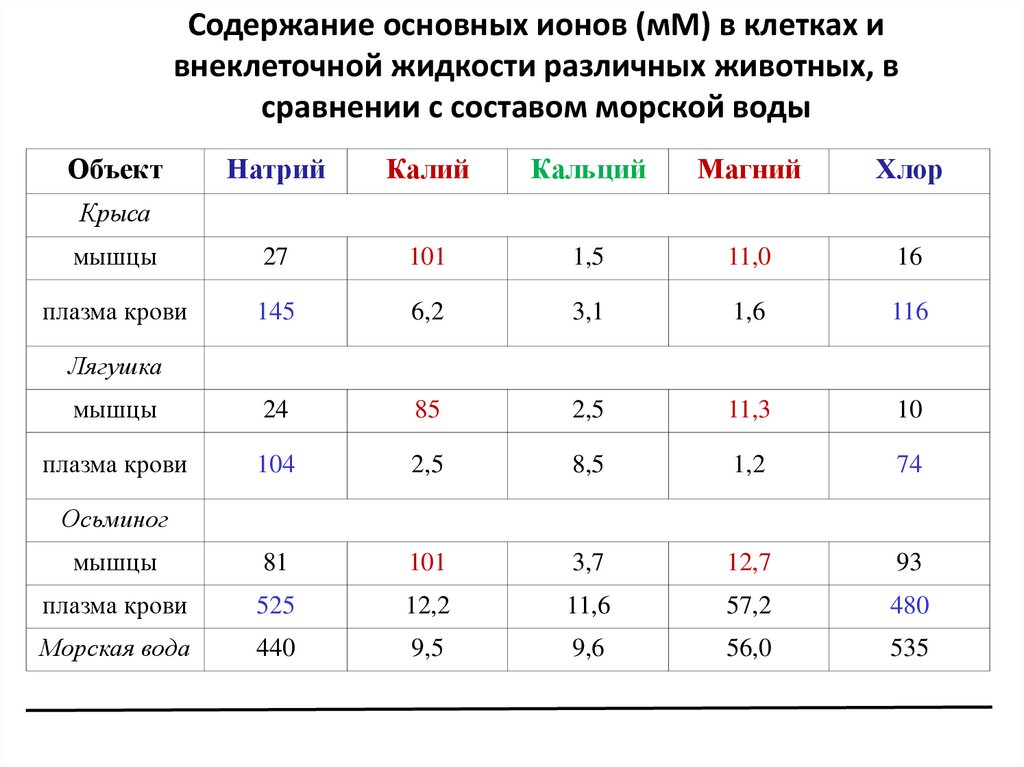
6.
Содержание основных ионов (мМ) в клетках ивнеклеточной жидкости различных животных, в
сравнении с составом морской воды
Объект
Натрий
Калий
Кальций
Магний
Хлор
мышцы
27
101
1,5
11,0
16
плазма крови
145
6,2
3,1
1,6
116
мышцы
24
85
2,5
11,3
10
плазма крови
104
2,5
8,5
1,2
74
мышцы
81
101
3,7
12,7
93
плазма крови
525
12,2
11,6
57,2
480
Морская вода
440
9,5
9,6
56,0
535
Крыса
Лягушка
Осьминог
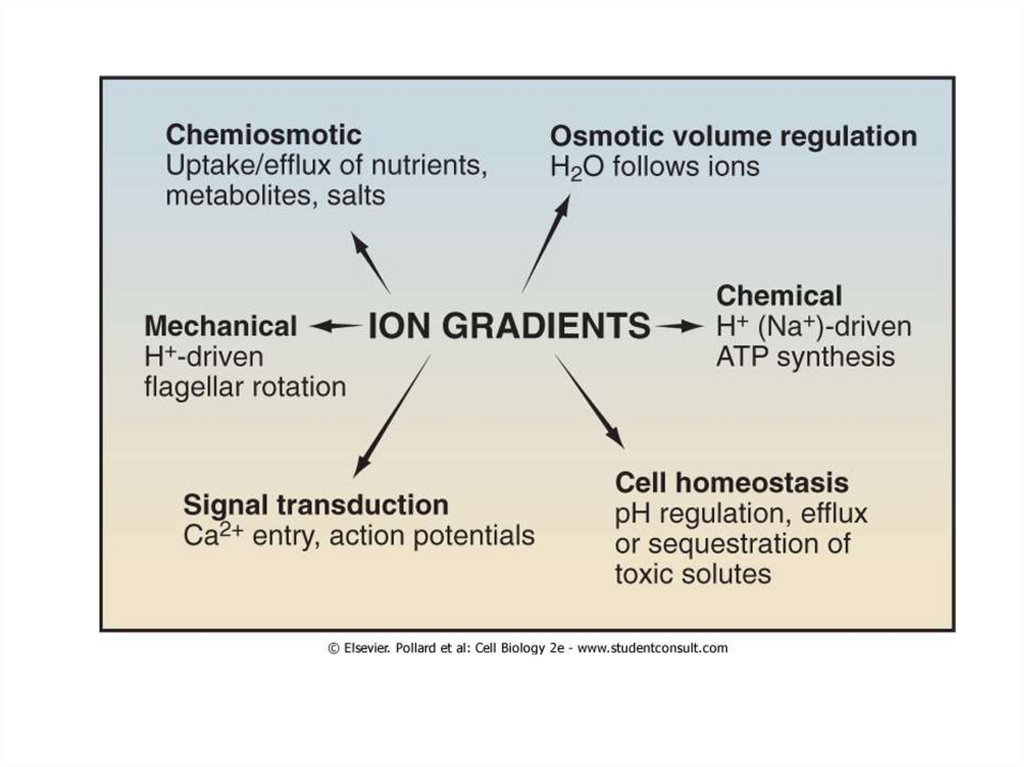
7.
8.
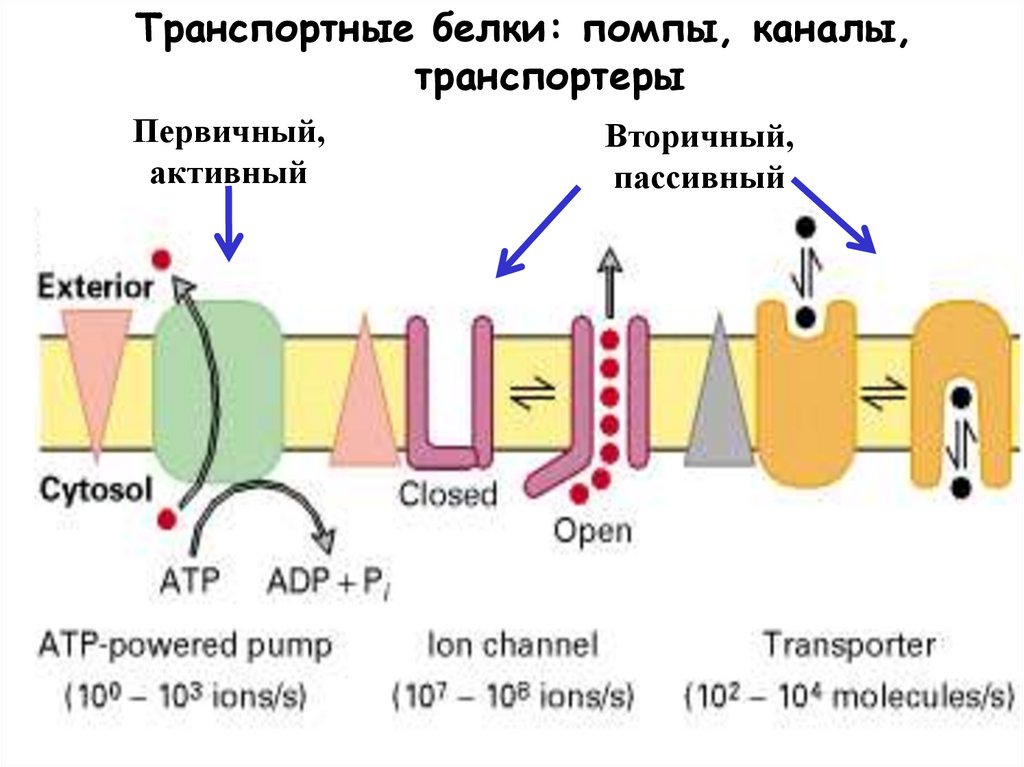
Транспортные белки: помпы, каналы,транспортеры
Первичный,
активный
Вторичный,
пассивный
9.
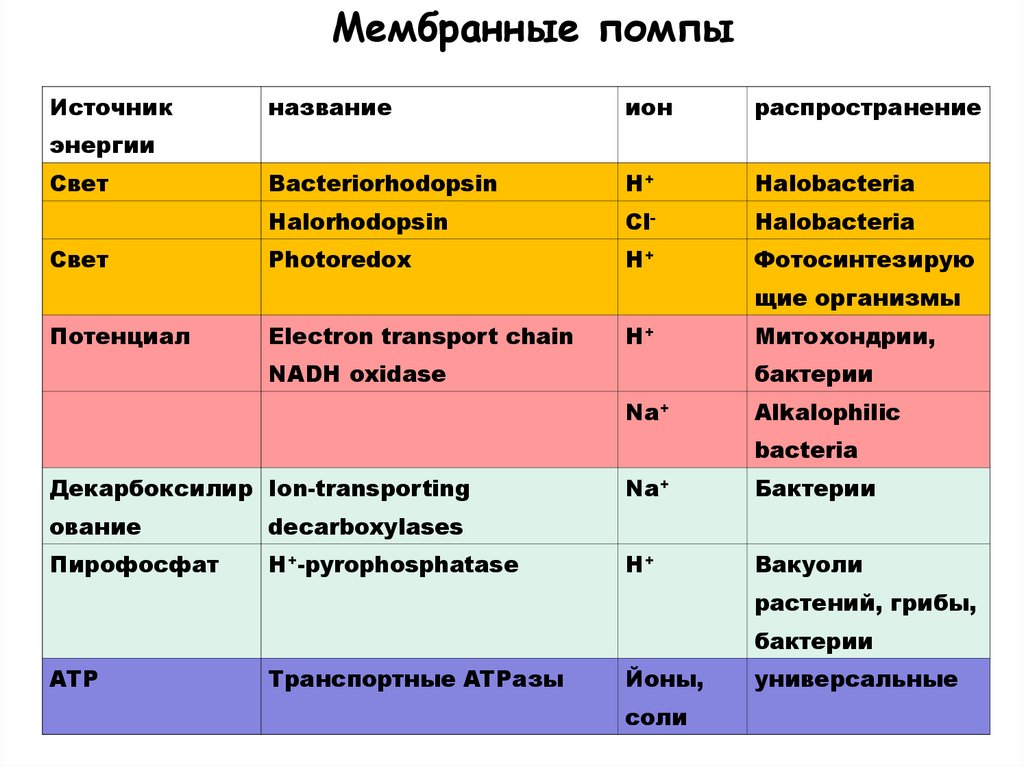
Мембранные помпыИсточник
название
ион
распространение
Bacteriorhodopsin
H+
Halobacteria
Halorhodopsin
Cl-
Halobacteria
Photoredox
H+
Фотосинтезирую
энергии
Свет
Свет
щие организмы
Потенциал
Electron transport chain
H+
NADH oxidase
Митохондрии,
бактерии
Na+
Alkalophilic
bacteria
Декарбоксилир Ion-transporting
ование
decarboxylases
Пирофосфат
H+-pyrophosphatase
Na+
Бактерии
H+
Вакуоли
растений, грибы,
бактерии
ATP
Транспортные ATPазы
Йоны,
соли
универсальные
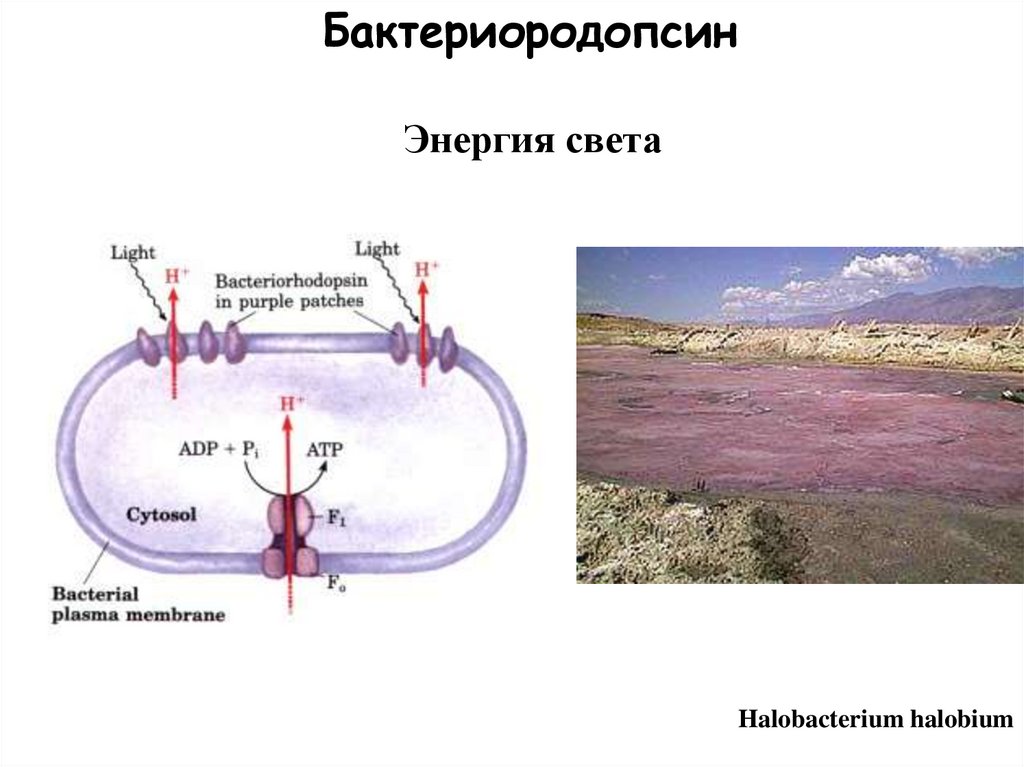
10.
БактериородопсинЭнергия света
Halobacterium halobium
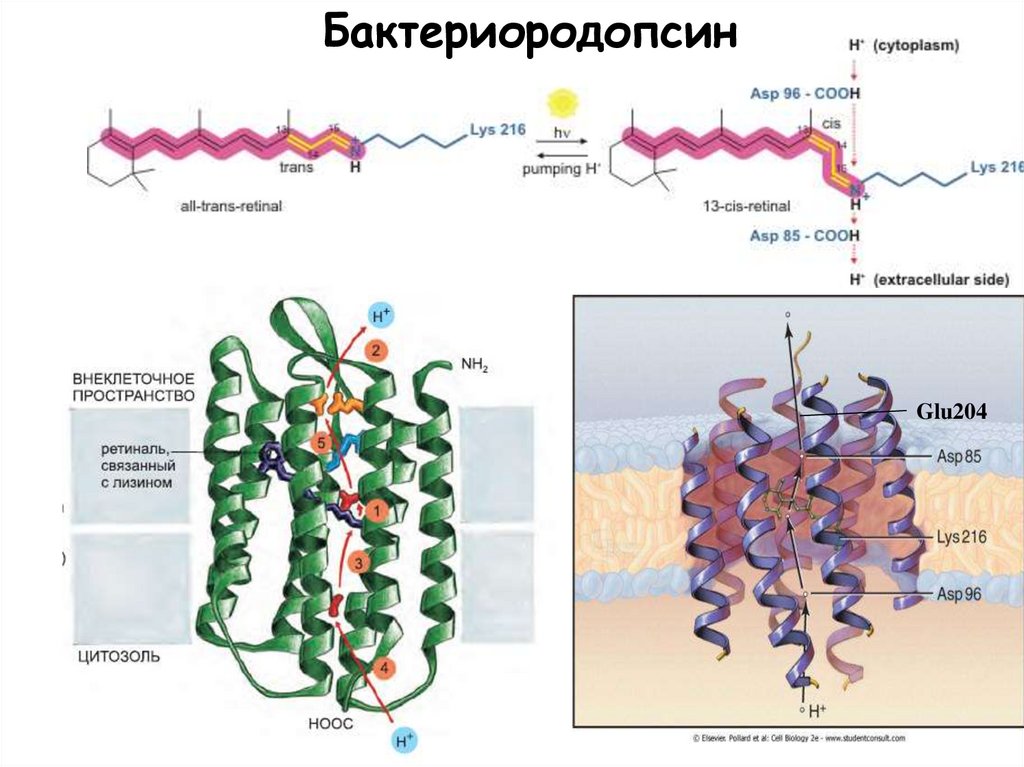
11.
БактериородопсинGlu204
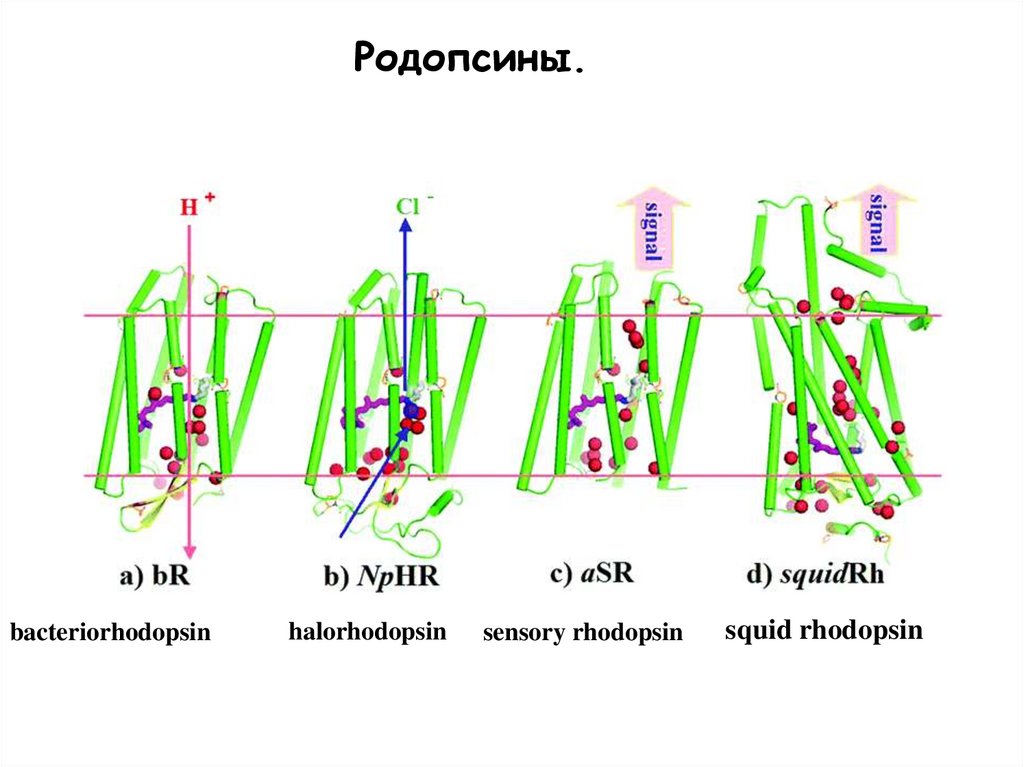
12.
Родопсины.bacteriorhodopsin
halorhodopsin
sensory rhodopsin
squid rhodopsin
13.
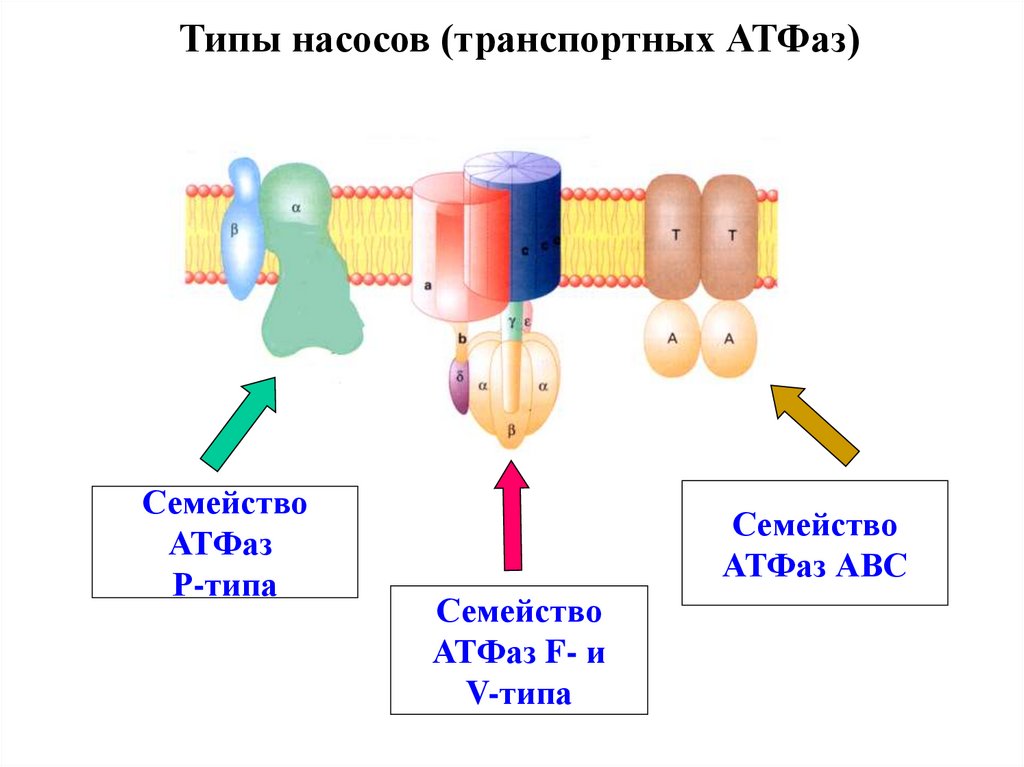
Типы насосов (транспортных АТФаз)Семейство
АТФаз
Р-типа
Семейство
АТФаз АВС
Семейство
АТФаз F- и
V-типа
14.
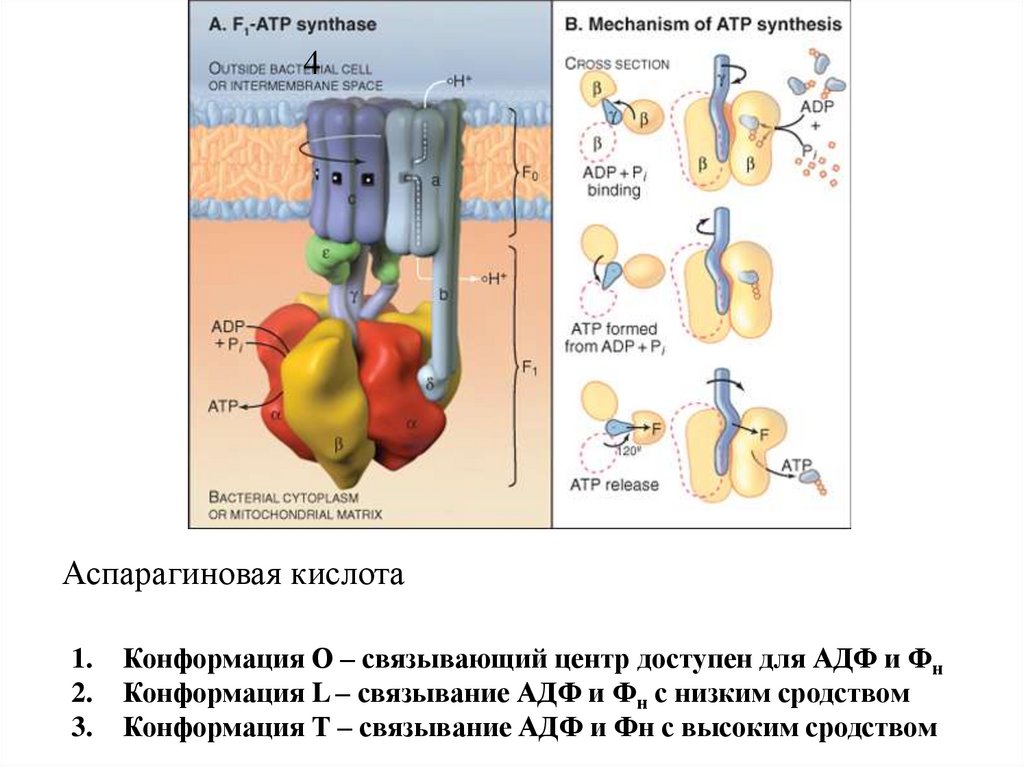
4Аспарагиновая кислота
1.
2.
3.
Конформация О – связывающий центр доступен для АДФ и Фн
Конформация L – связывание АДФ и Фн с низким сродством
Конформация Т – связывание АДФ и Фн с высоким сродством
15.
16.
17.
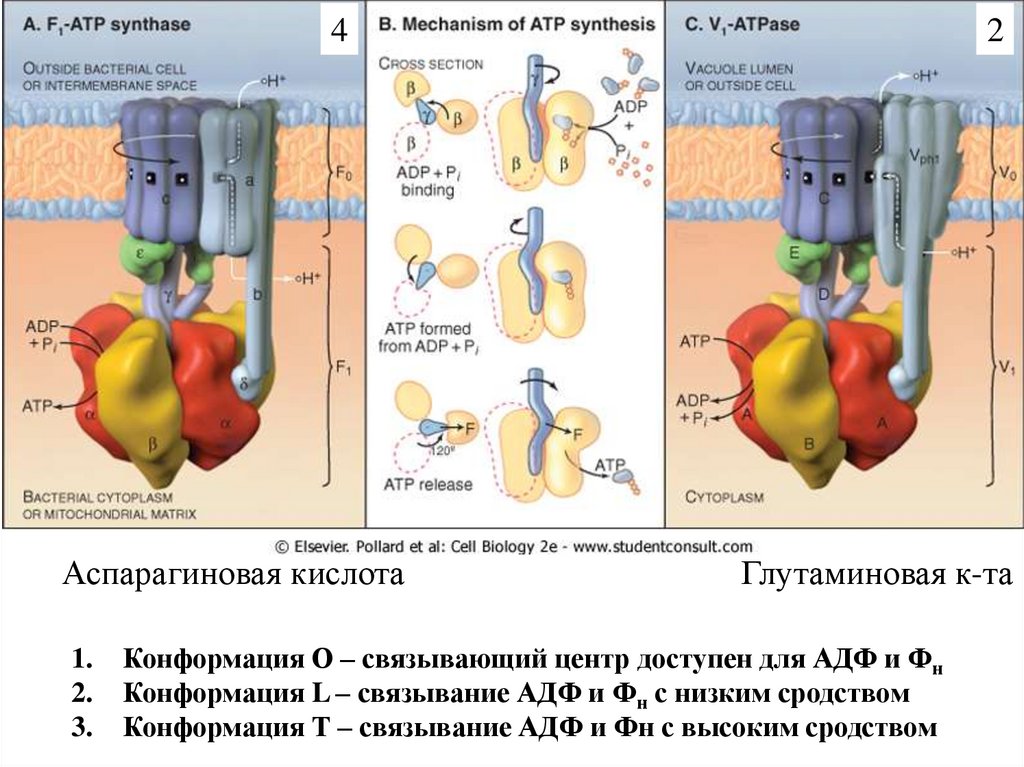
4Аспарагиновая кислота
1.
2.
3.
2
Глутаминовая к-та
Конформация О – связывающий центр доступен для АДФ и Фн
Конформация L – связывание АДФ и Фн с низким сродством
Конформация Т – связывание АДФ и Фн с высоким сродством
18.
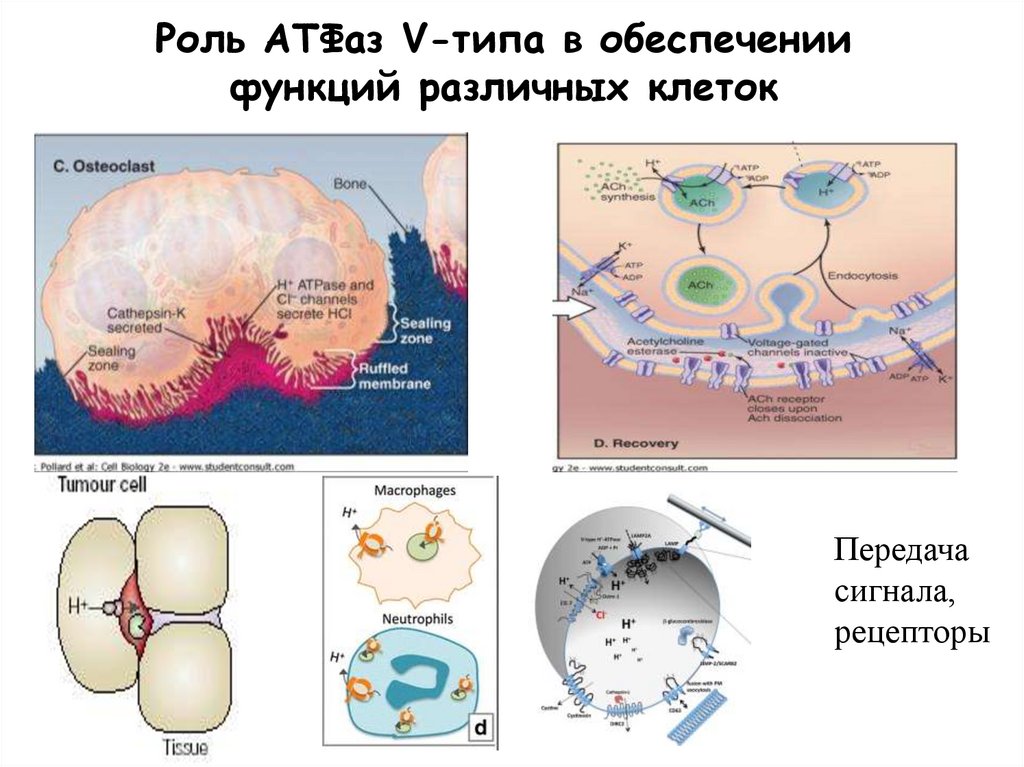
Роль АТФаз V-типа в обеспечениифункций различных клеток
Передача
сигнала,
рецепторы
19.
ПомпыСубъедин
ицы
Расположение
Субстрат
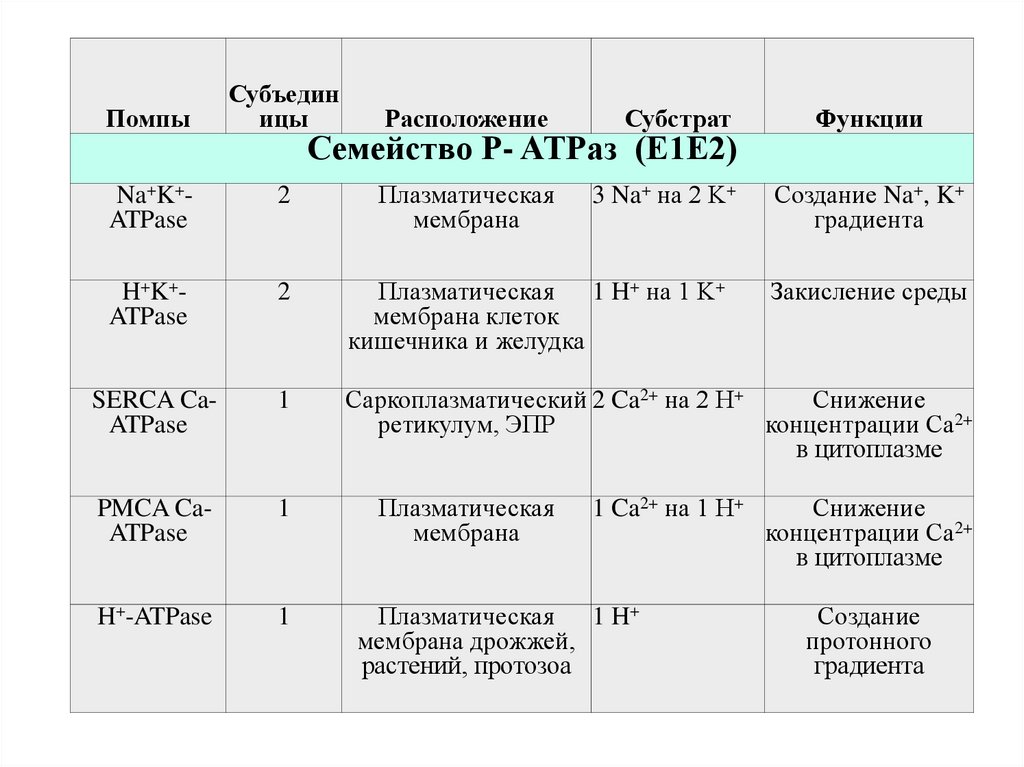
Na+K+ATPase
2
Плазматическая
мембрана
3 Na+ на 2 K+
H+K+ATPase
2
Плазматическая 1 H+ на 1 K+
мембрана клеток
кишечника и желудка
SERCA CaATPase
1
Саркоплазматический 2 Ca2+ на 2 H+
Снижение
ретикулум, ЭПР
концентрации Ca2+
в цитоплазме
PMCA CaATPase
1
H+-ATPase
1
Семейство P- ATPаз (Е1Е2)
Плазматическая
мембрана
1 Ca2+ на 1 H+
Плазматическая 1 H+
мембрана дрожжей,
растений, протозоа
Функции
Создание Na+, K+
градиента
Закисление среды
Снижение
концентрации Ca2+
в цитоплазме
Создание
протонного
градиента
20.
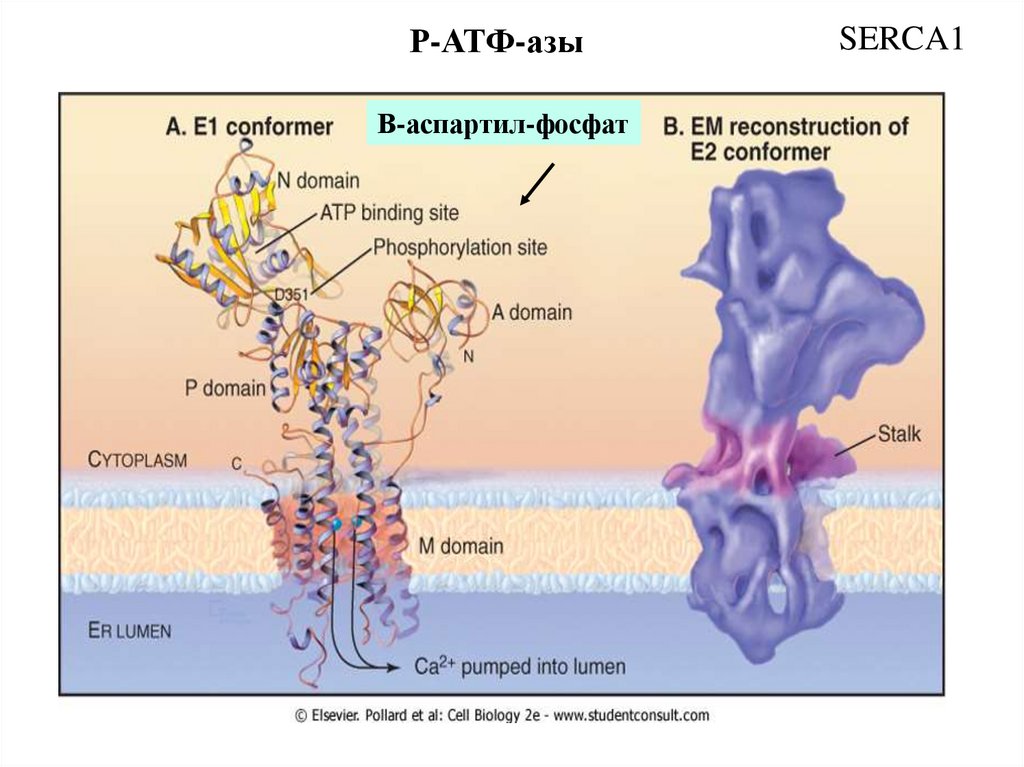
Р-АТФ-азыΒ-аспартил-фосфат
SERCA1
21.
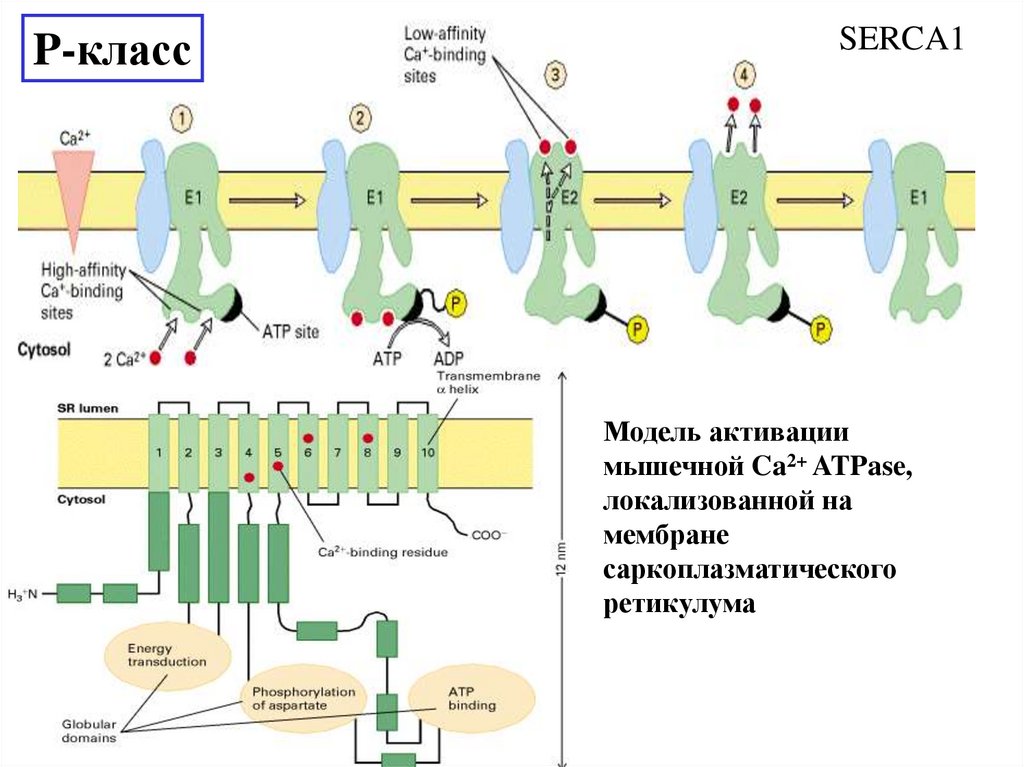
P-классSERCA1
Модель активации
мышечной Ca2+ ATPase,
локализованной на
мембране
саркоплазматического
ретикулума
22.
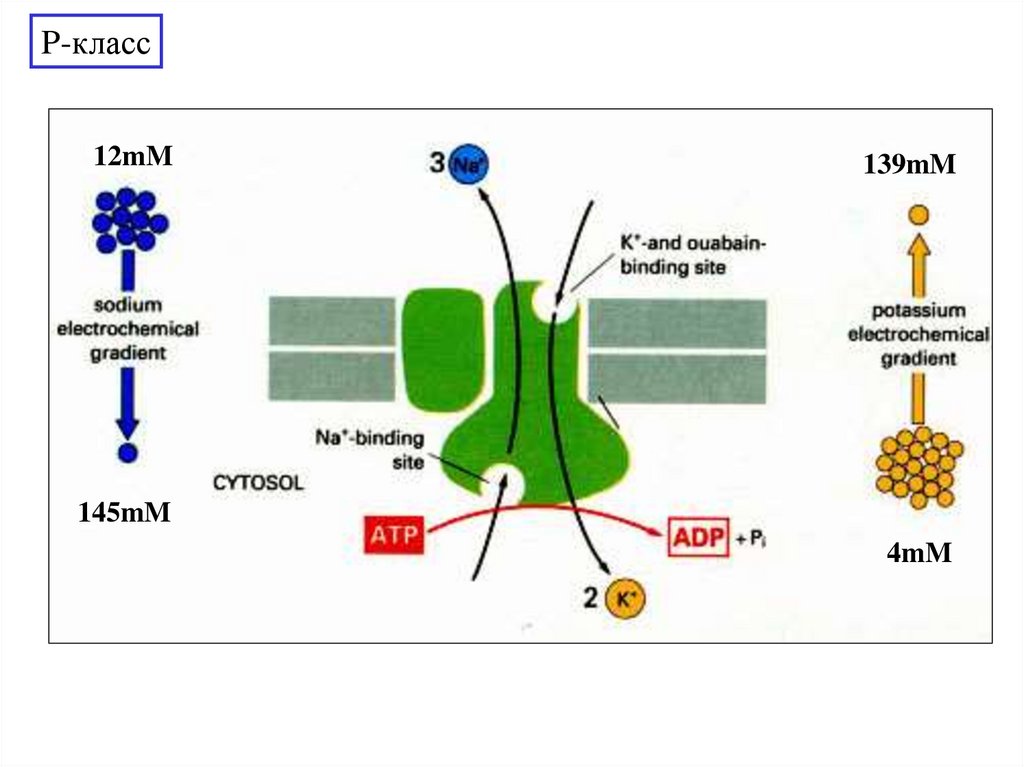
P-класс12mM
139mM
145mM
4mM
23.
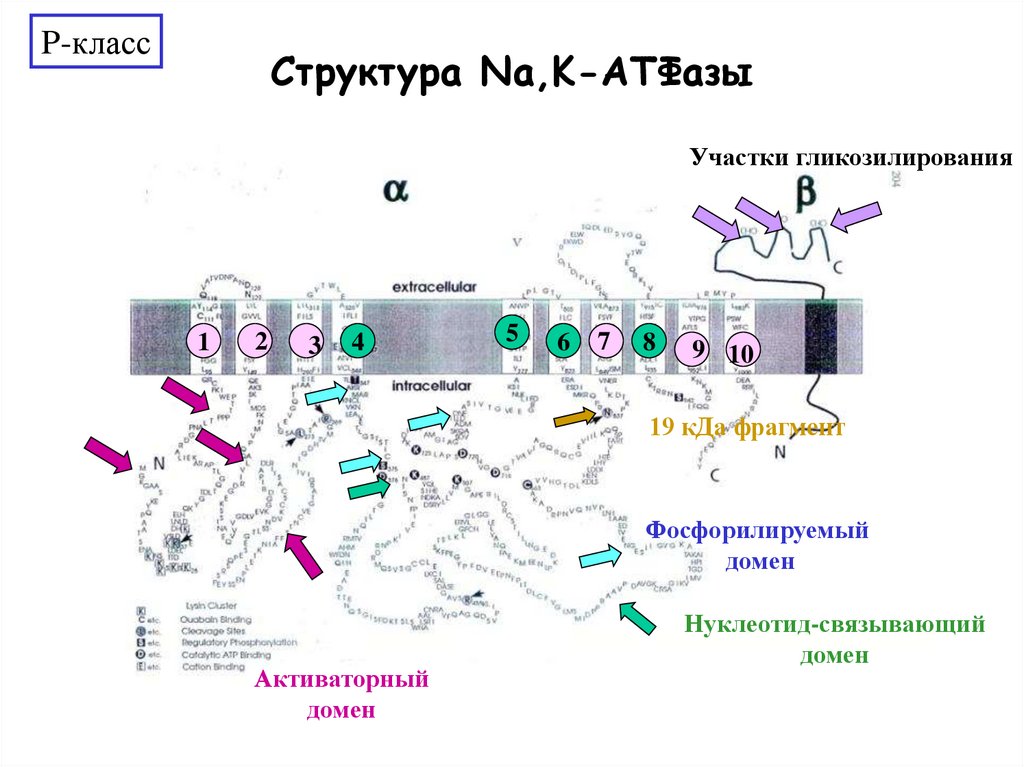
P-классСтруктура Na,K-АТФазы
Участки гликозилирования
1
2
3
4
5
6
7
8
9 10
19 кДа фрагмент
Фосфорилируемый
домен
Активаторный
домен
Нуклеотид-связывающий
домен
24.
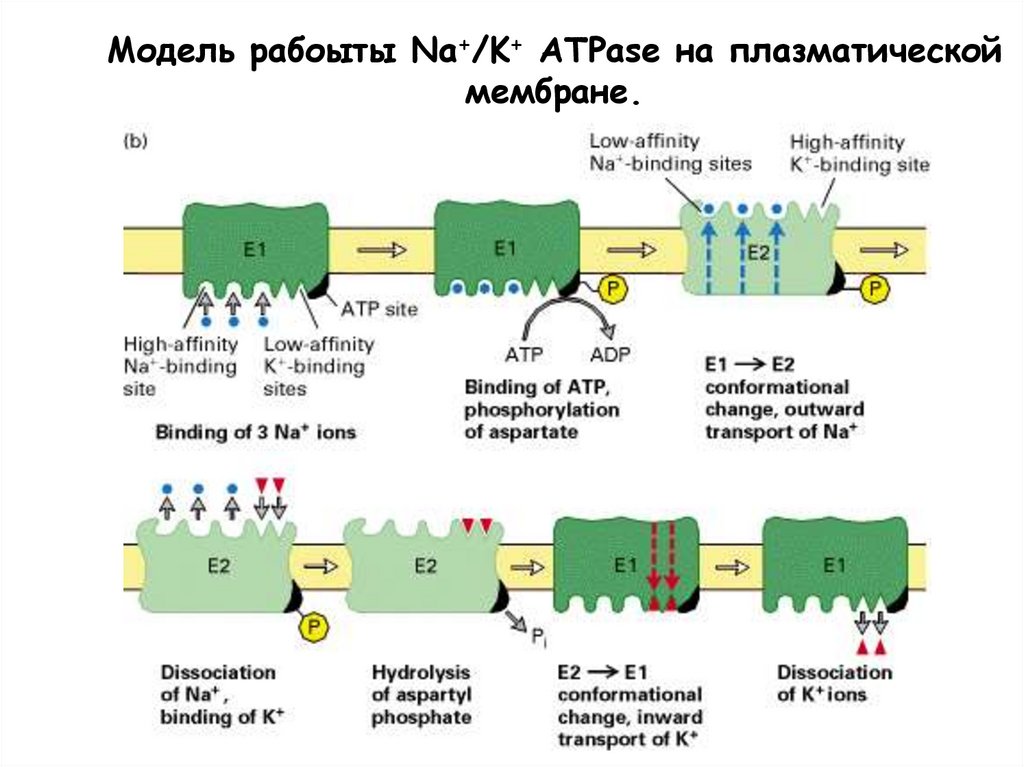
Модель рабоыты Na+/K+ ATPase на плазматическоймембране.
25.
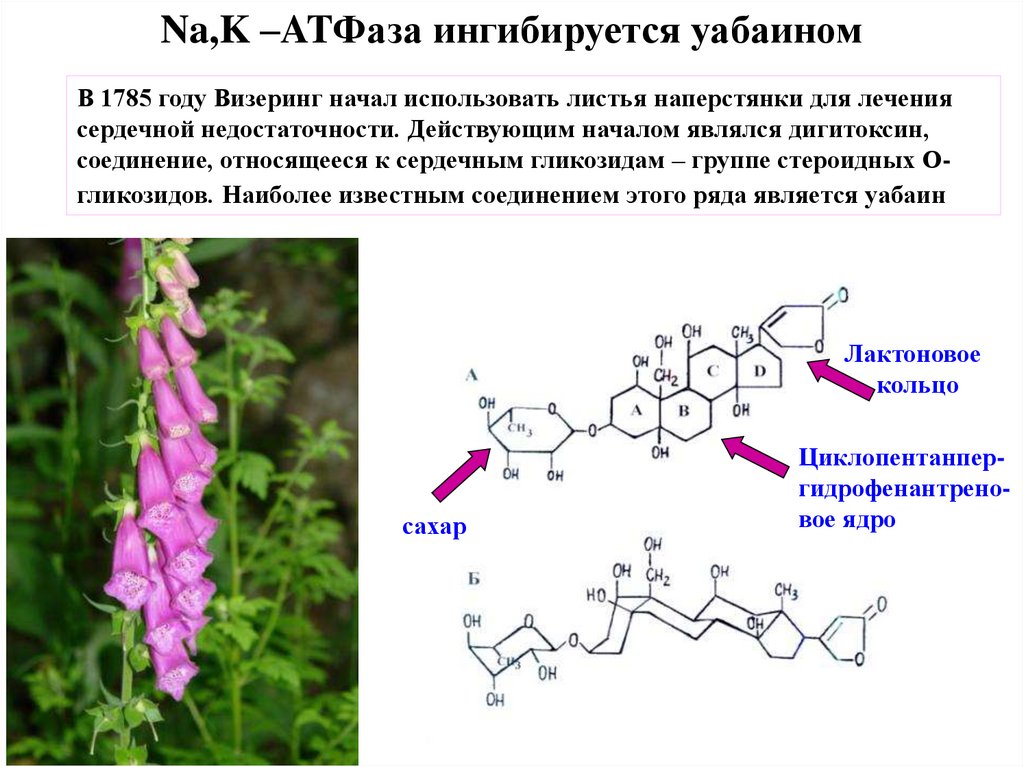
Na,K –ATФаза ингибируется уабаиномВ 1785 году Визеринг начал использовать листья наперстянки для лечения
сердечной недостаточности. Действующим началом являлся дигитоксин,
соединение, относящееся к сердечным гликозидам – группе стероидных Огликозидов. Наиболее известным соединением этого ряда является уабаин
Лактоновое
кольцо
сахар
(Digitalis purpurea)
Циклопентанпергидрофенантреновое ядро
26.
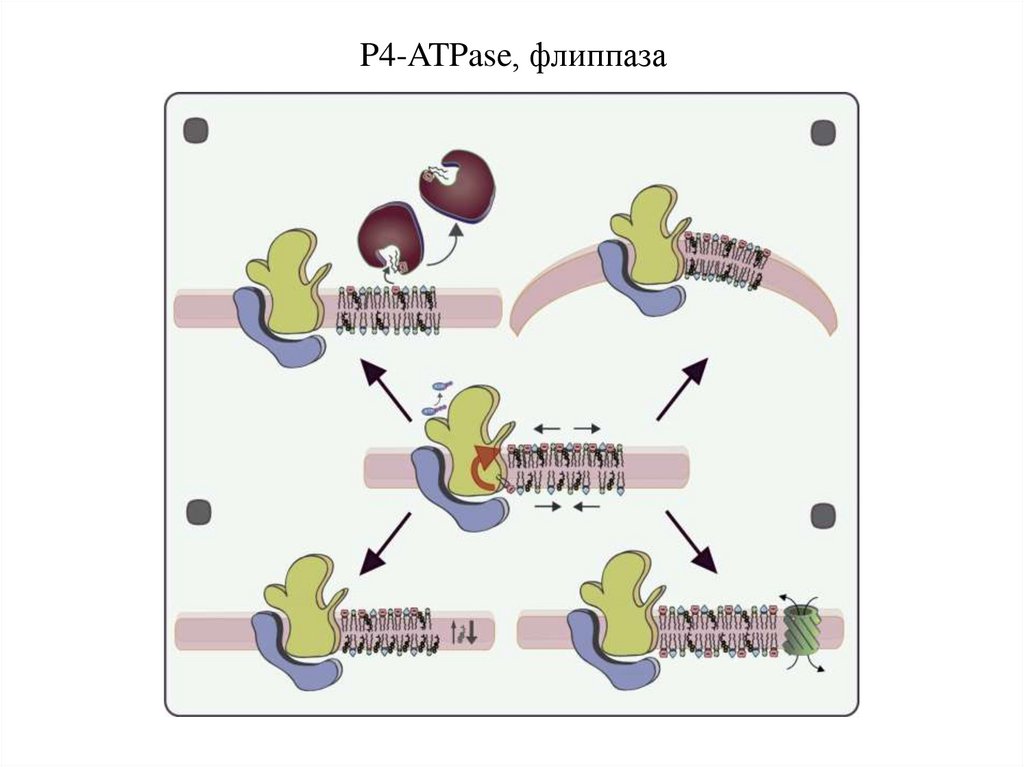
P4-ATPase, флиппаза27.
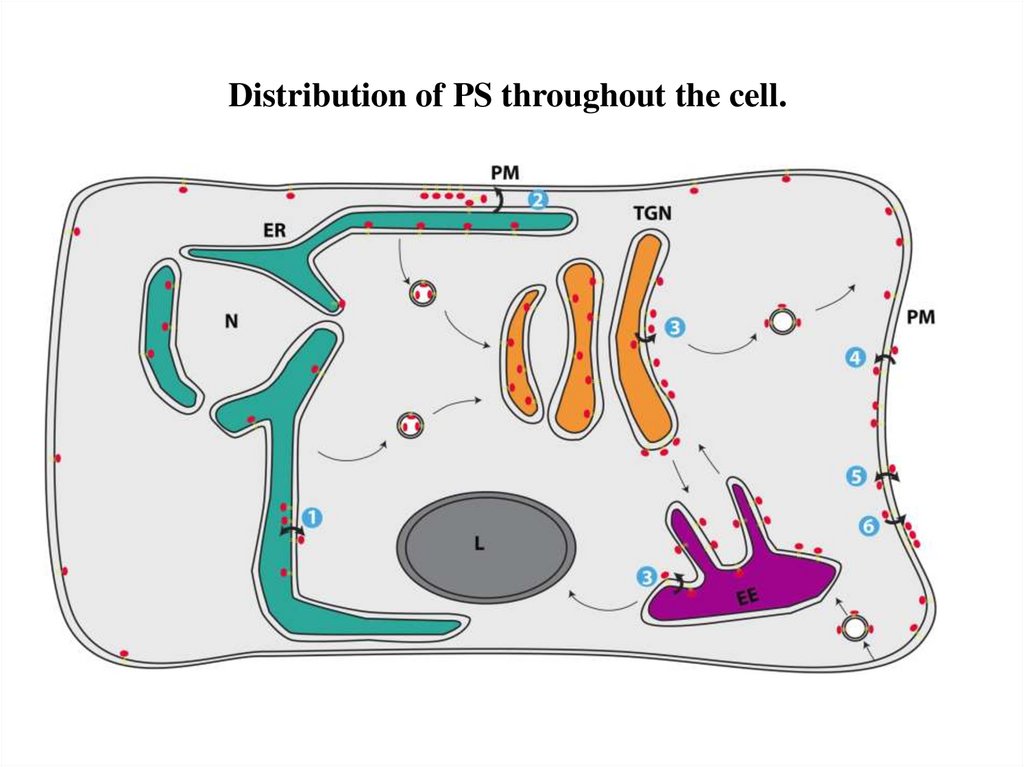
Distribution of PS throughout the cell.28.
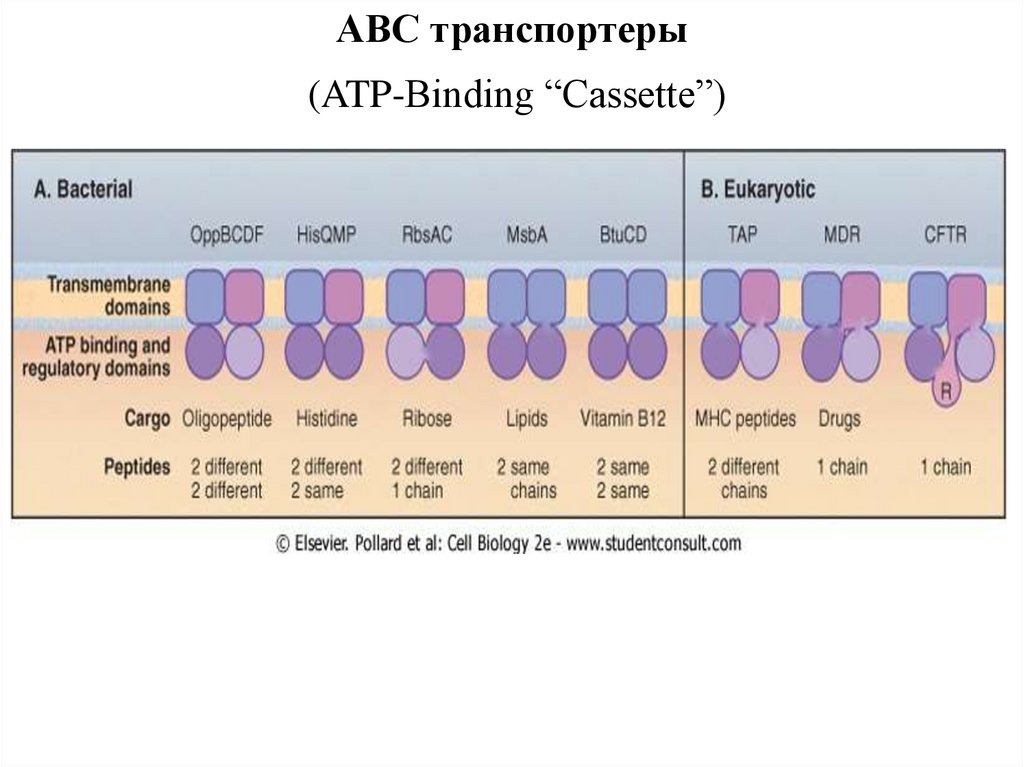
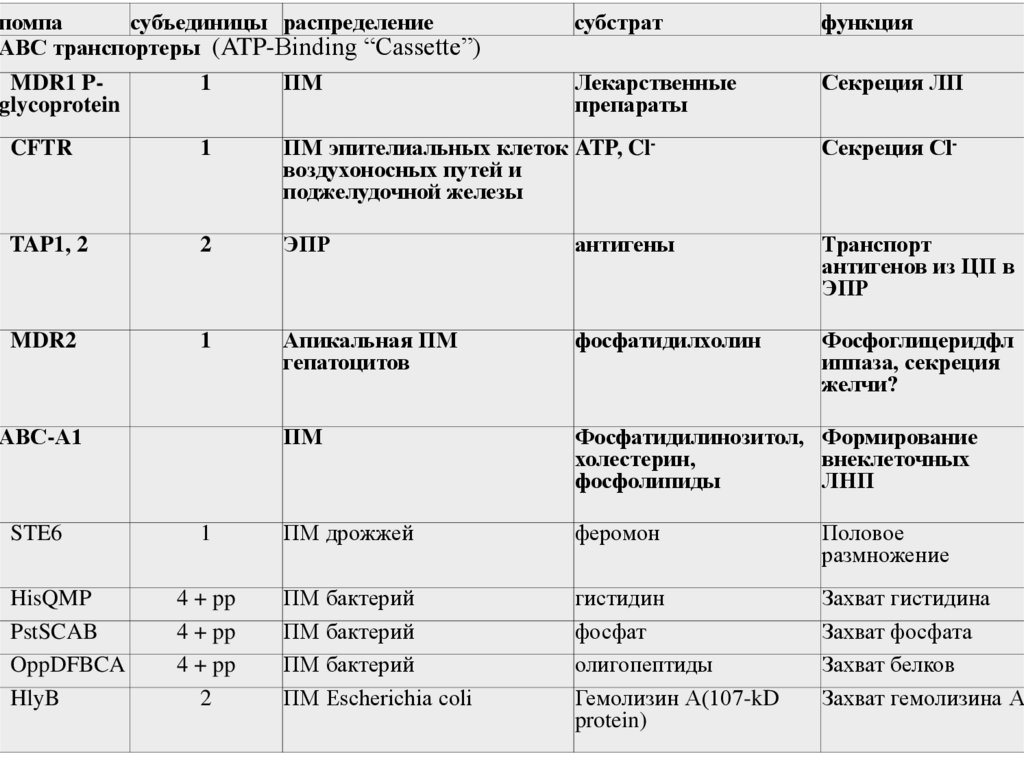
ABC транспортеры(ATP-Binding “Cassette”)
29.
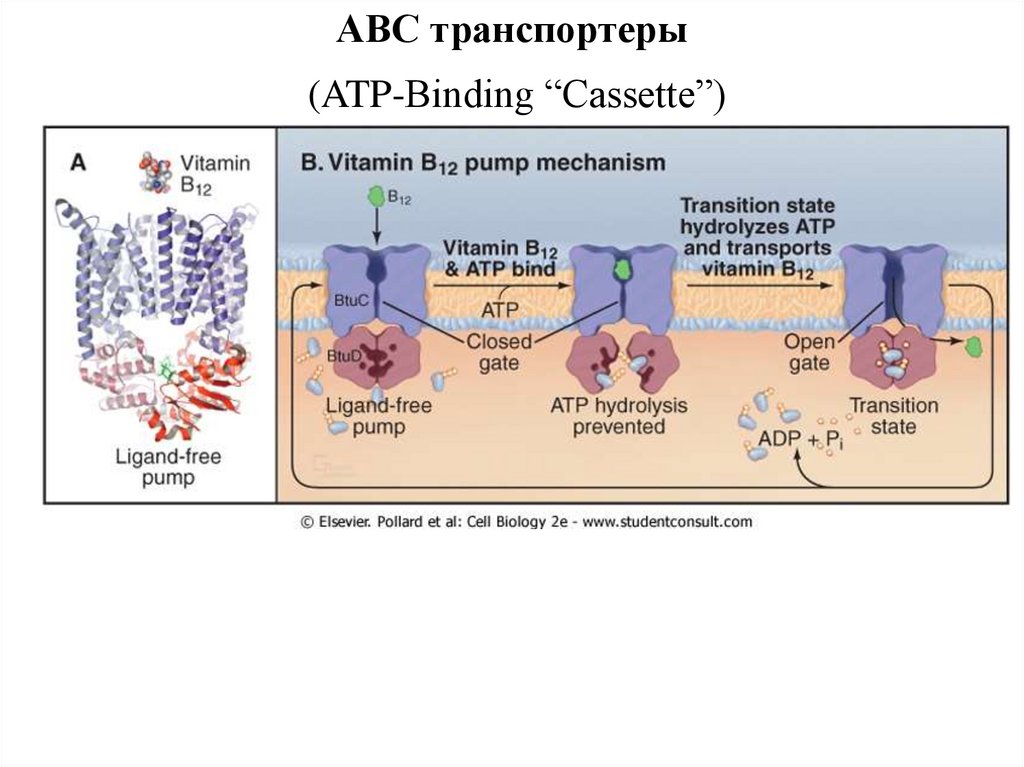
ABC транспортеры(ATP-Binding “Cassette”)
30.
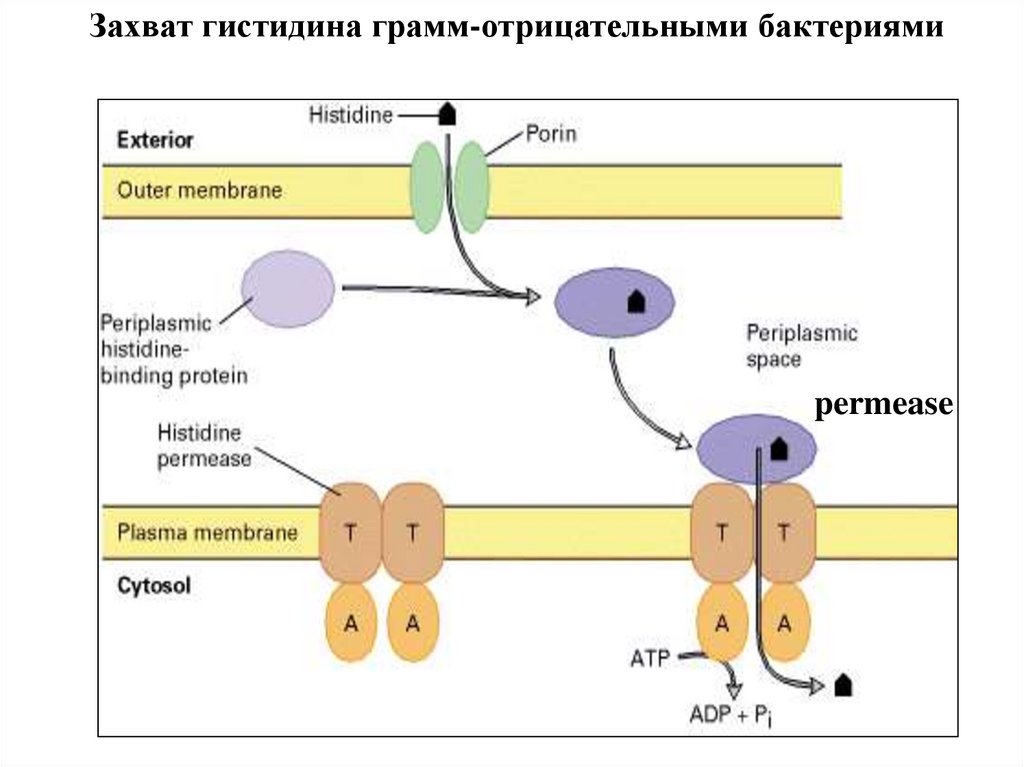
Захват гистидина грамм-отрицательными бактериямиpermease
31.
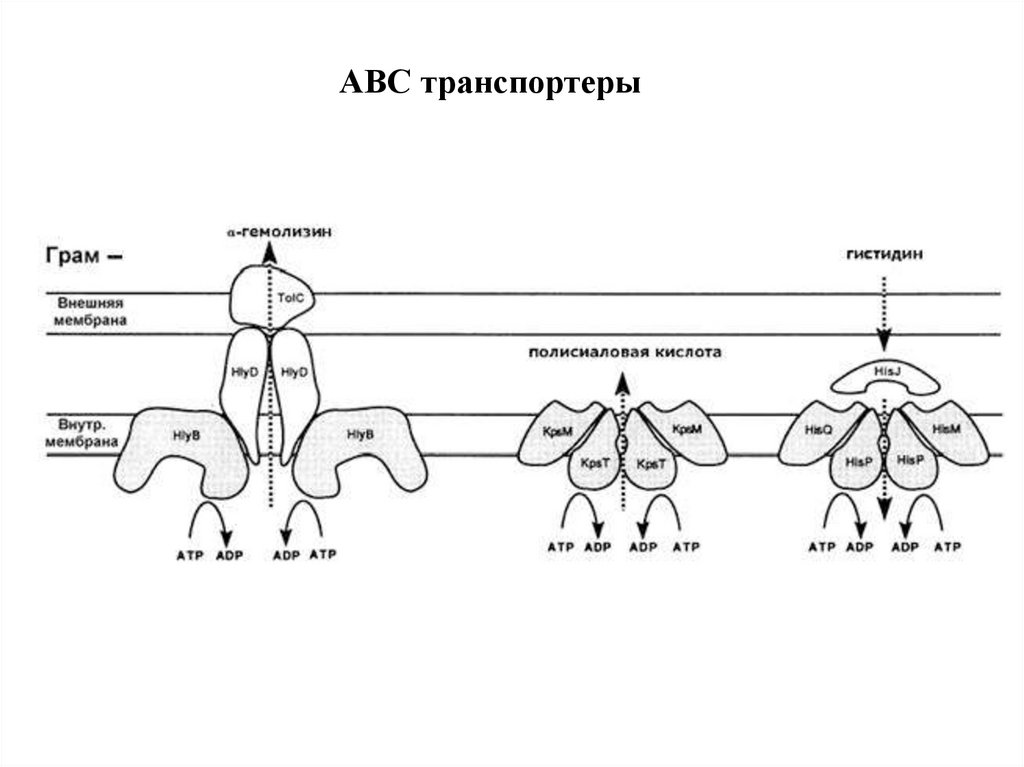
ABC транспортеры32.
33.
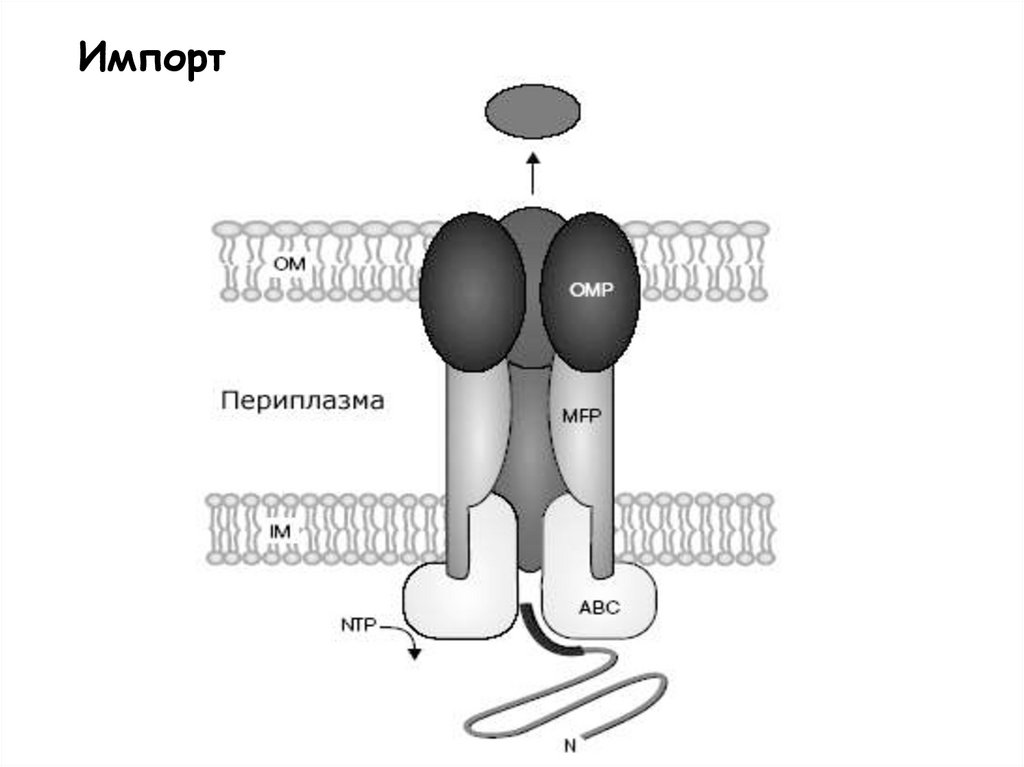
Импорт34.
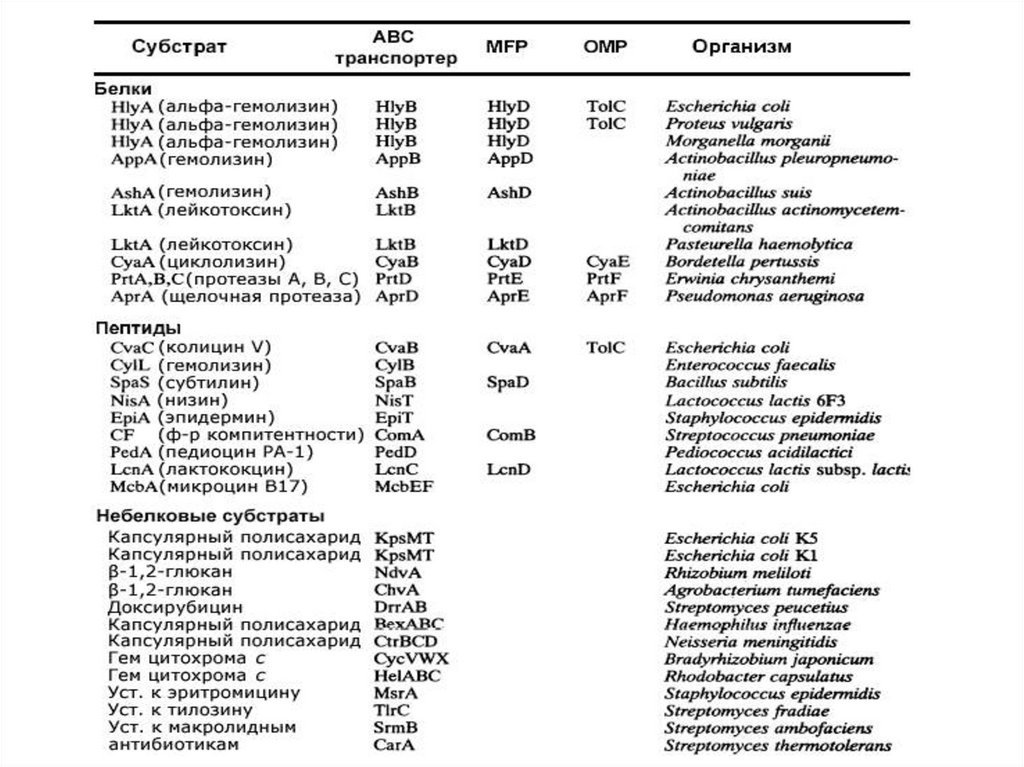
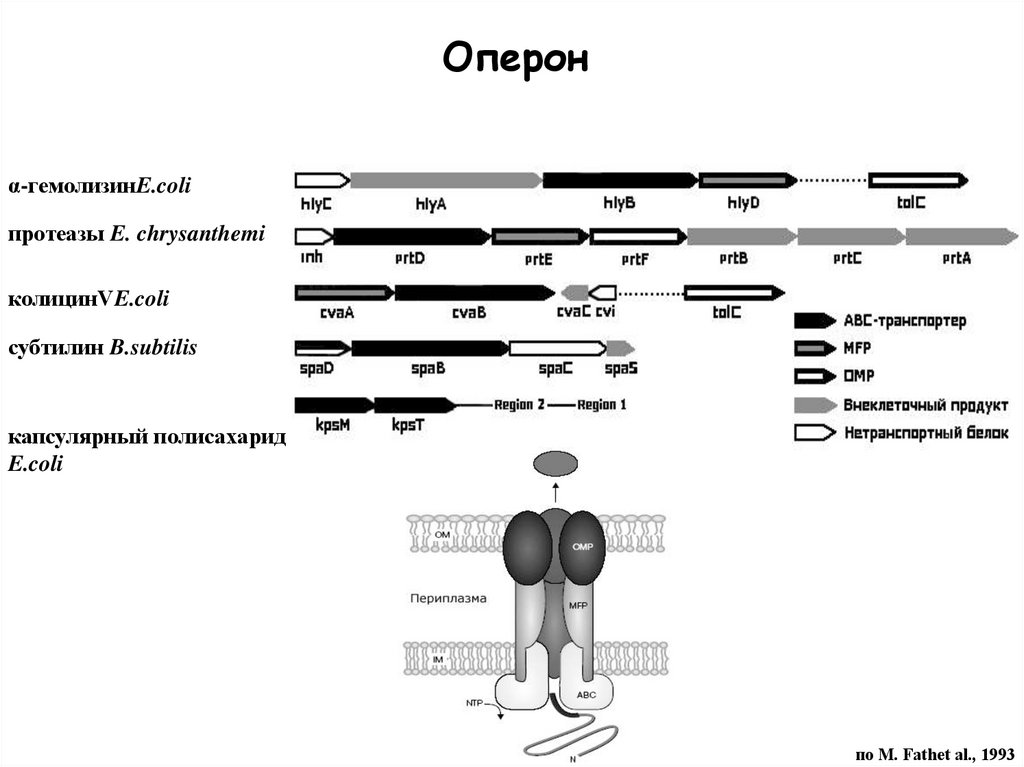
Оперонα-гемолизинE.coli
протеазы E. chrysanthemi
колицинVE.coli
субтилин B.subtilis
капсулярный полисахарид
E.coli
по M. Fathеt al., 1993
35.
помпасубъединицы распределение
ABC транспортеры (ATP-Binding “Cassette”)
субстрат
функция
Лекарственные
препараты
Секреция ЛП
1
ПМ
CFTR
1
ПМ эпителиальных клеток ATP, Clвоздухоносных путей и
поджелудочной железы
Секреция Cl-
TAP1, 2
2
ЭПР
антигены
Транспорт
антигенов из ЦП в
ЭПР
MDR2
1
Апикальная ПМ
гепатоцитов
фосфатидилхолин
Фосфоглицеридфл
иппаза, секреция
желчи?
ПМ
Фосфатидилинозитол, Формирование
холестерин,
внеклеточных
фосфолипиды
ЛНП
ПМ дрожжей
феромон
Половое
размножение
ПМ бактерий
ПМ бактерий
ПМ бактерий
ПМ Escherichia coli
гистидин
фосфат
олигопептиды
Гемолизин А(107-kD
protein)
Захват гистидина
Захват фосфата
Захват белков
Захват гемолизина А
MDR1 Pglycoprotein
АВС-А1
STE6
HisQMP
PstSCAB
OppDFBCA
HlyB
1
4 + pp
4 + pp
4 + pp
2
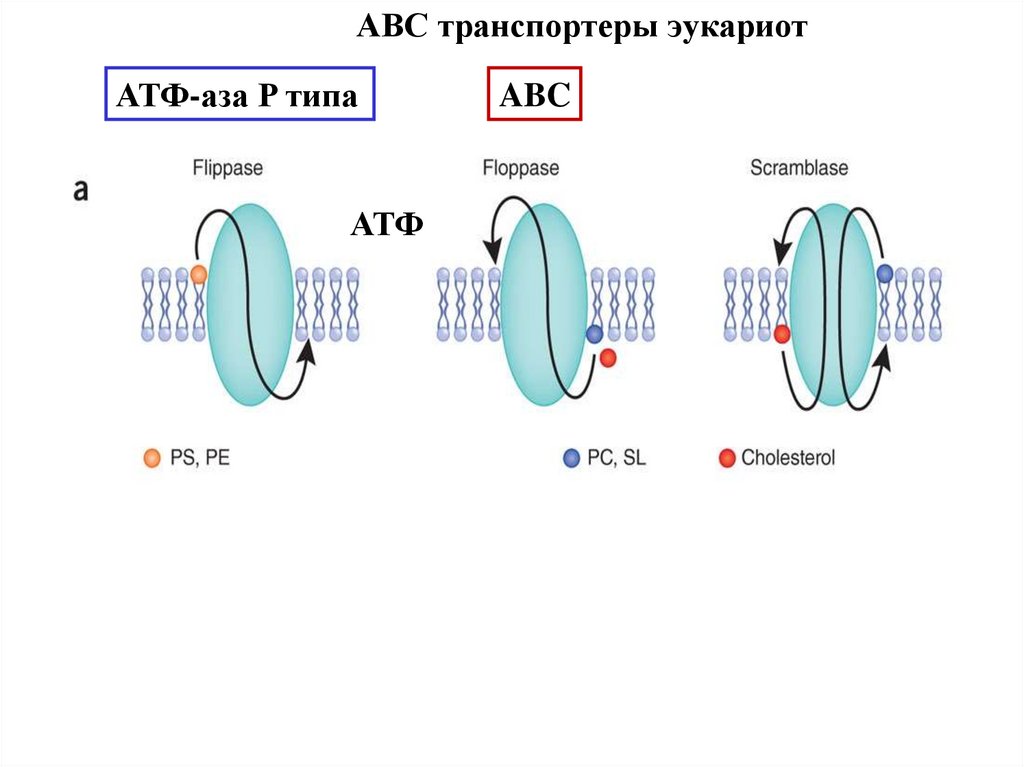
36.
ABC транспортеры эукариотАТФ-аза P типа
АТФ
ABC
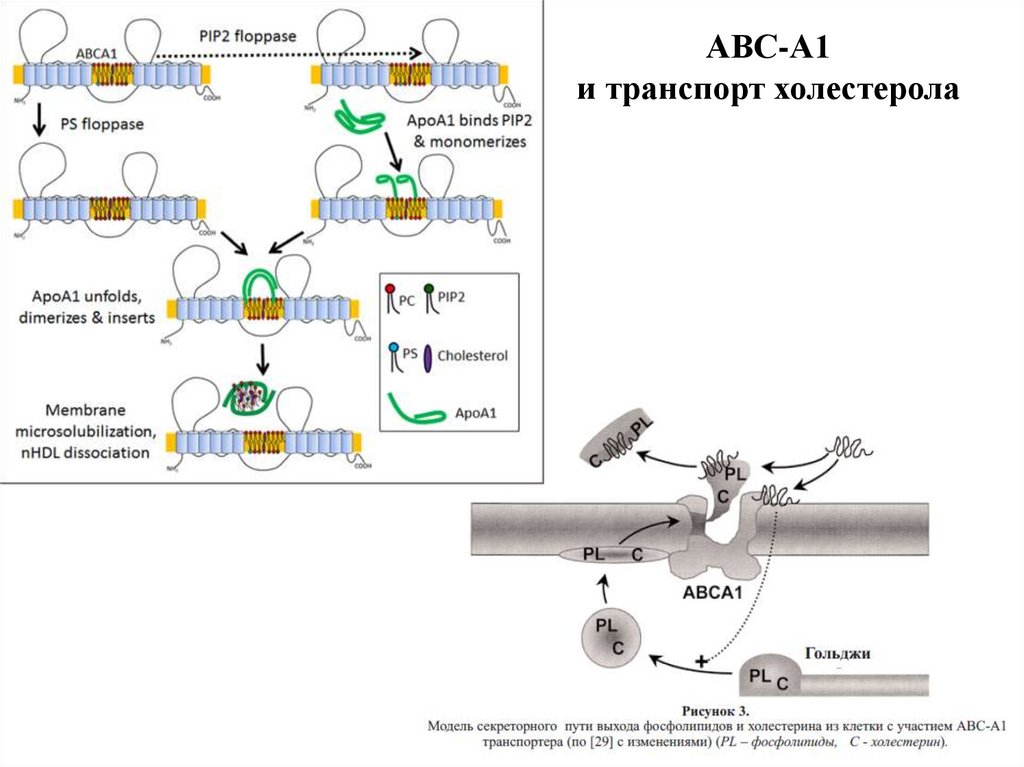
37.
АВС-А1и транспорт холестерола
38.
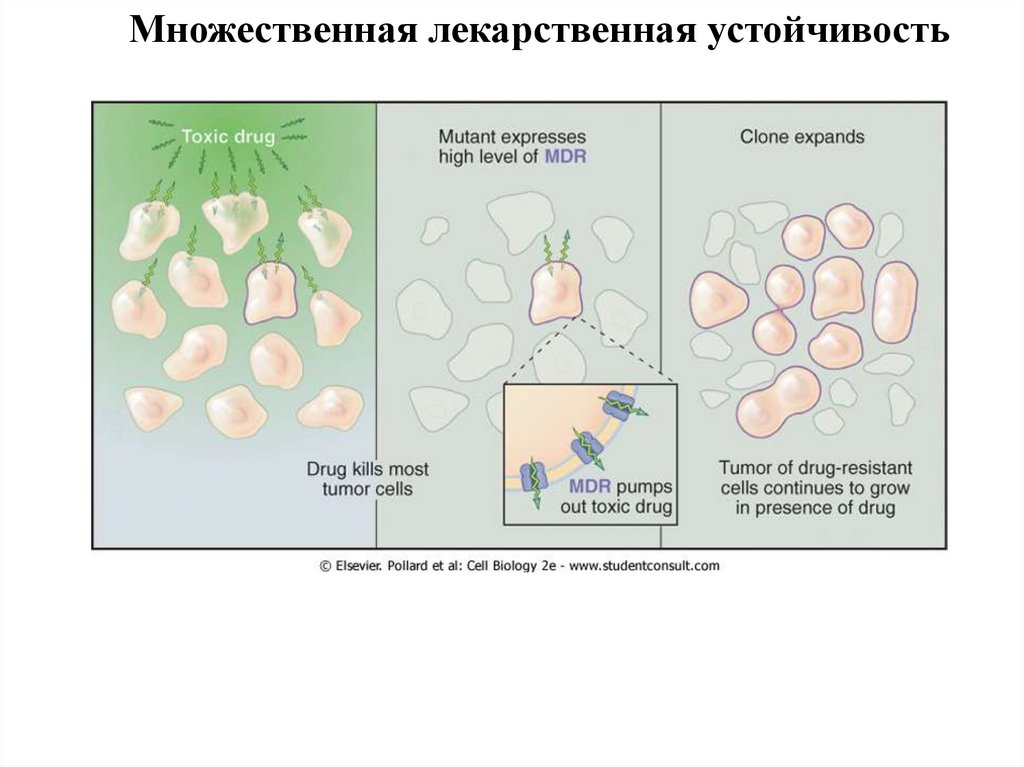
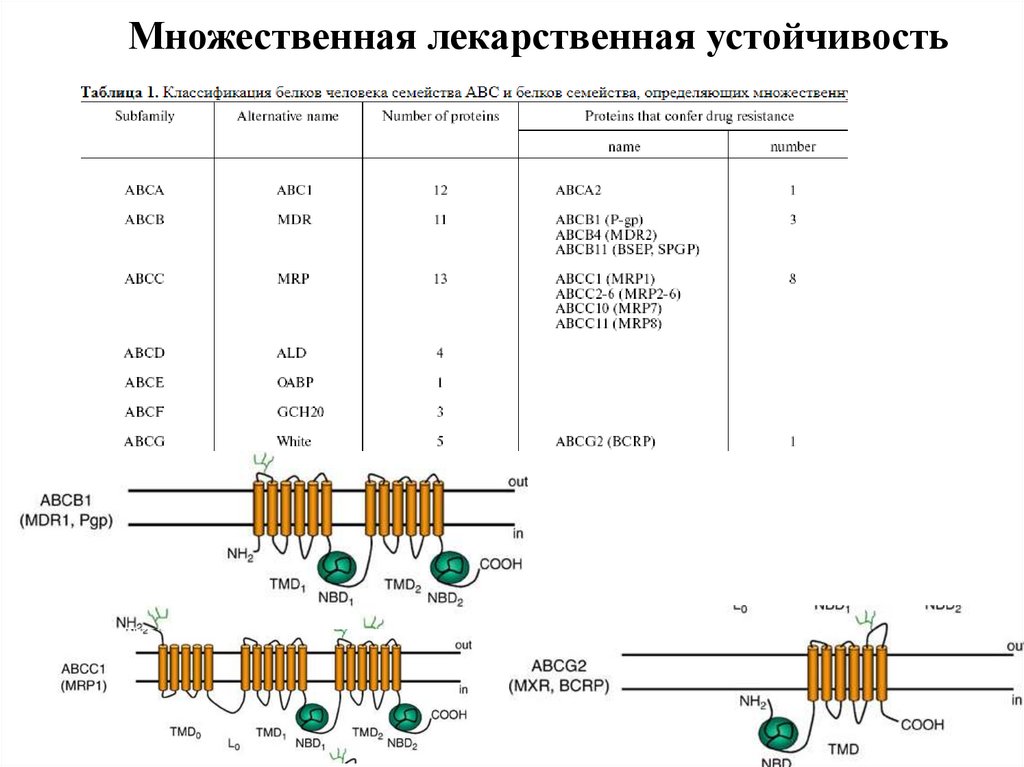
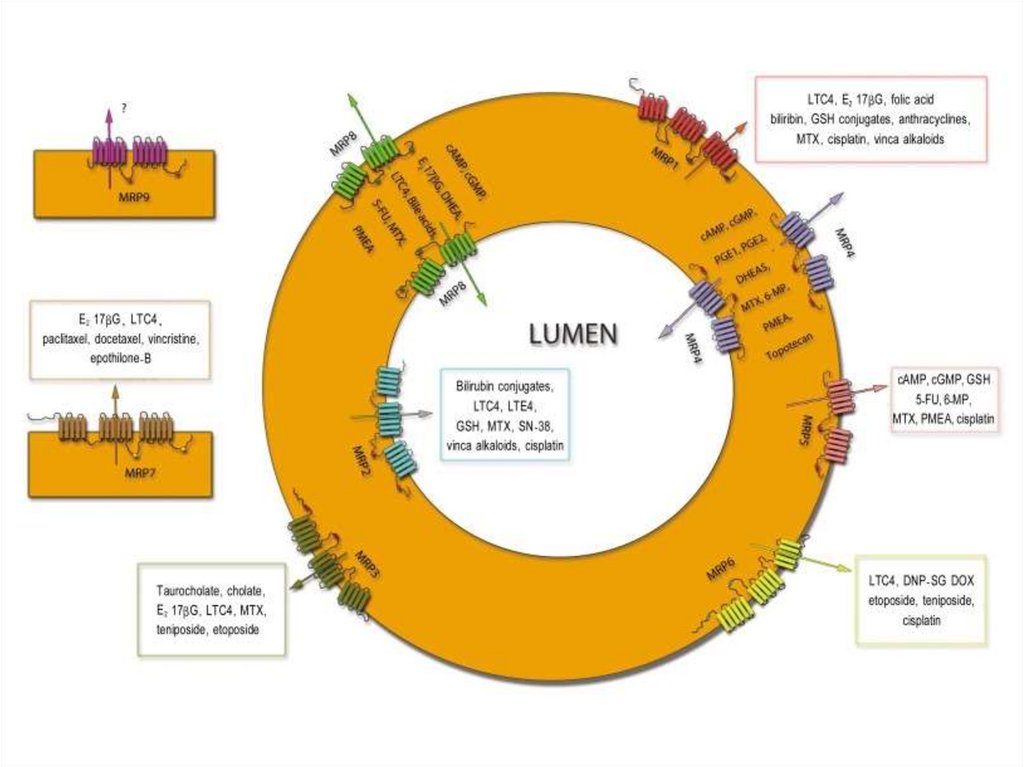
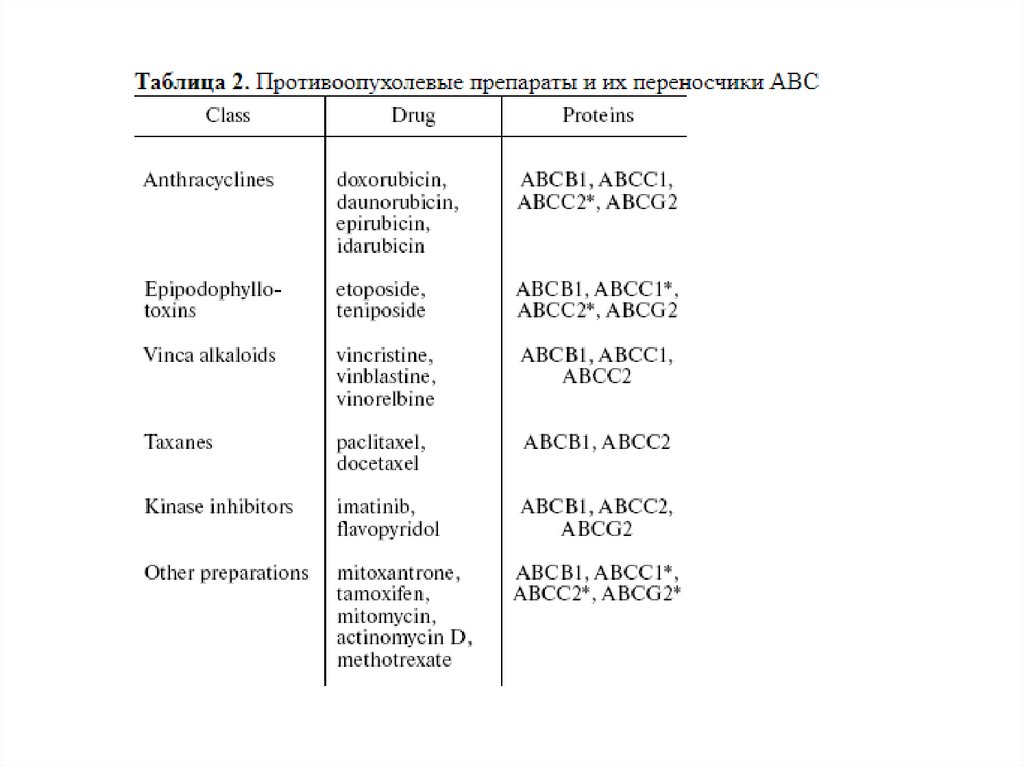
Множественная лекарственная устойчивость39.
Множественная лекарственная устойчивость40.
41.
42.
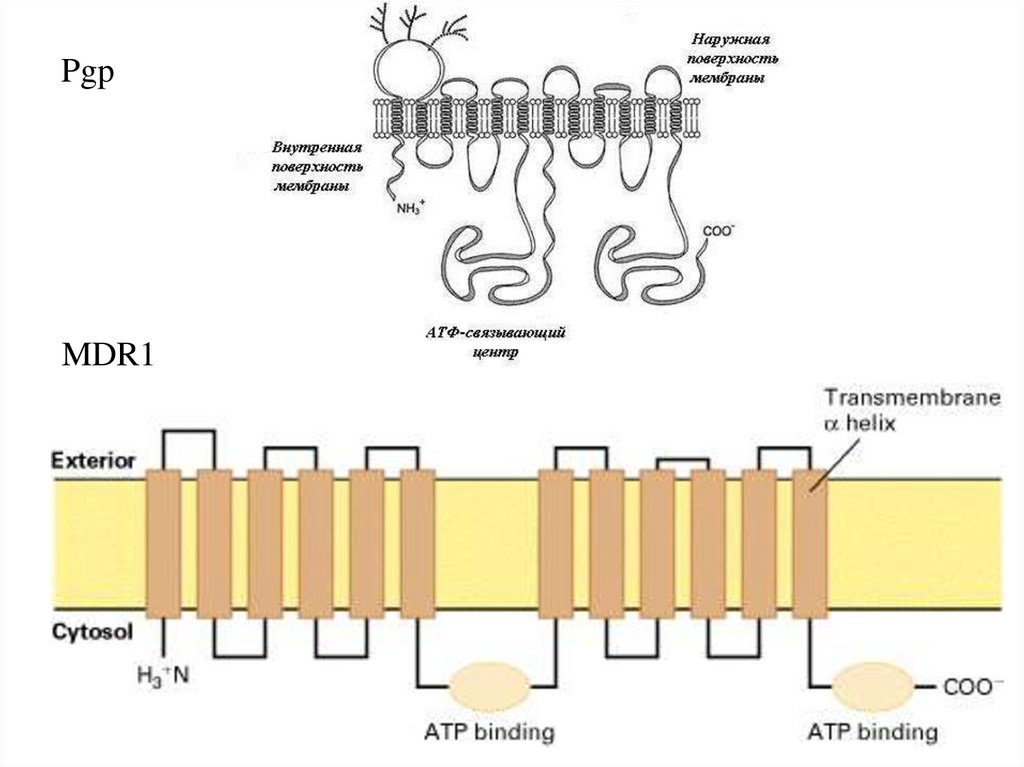
PgpMDR1
43.
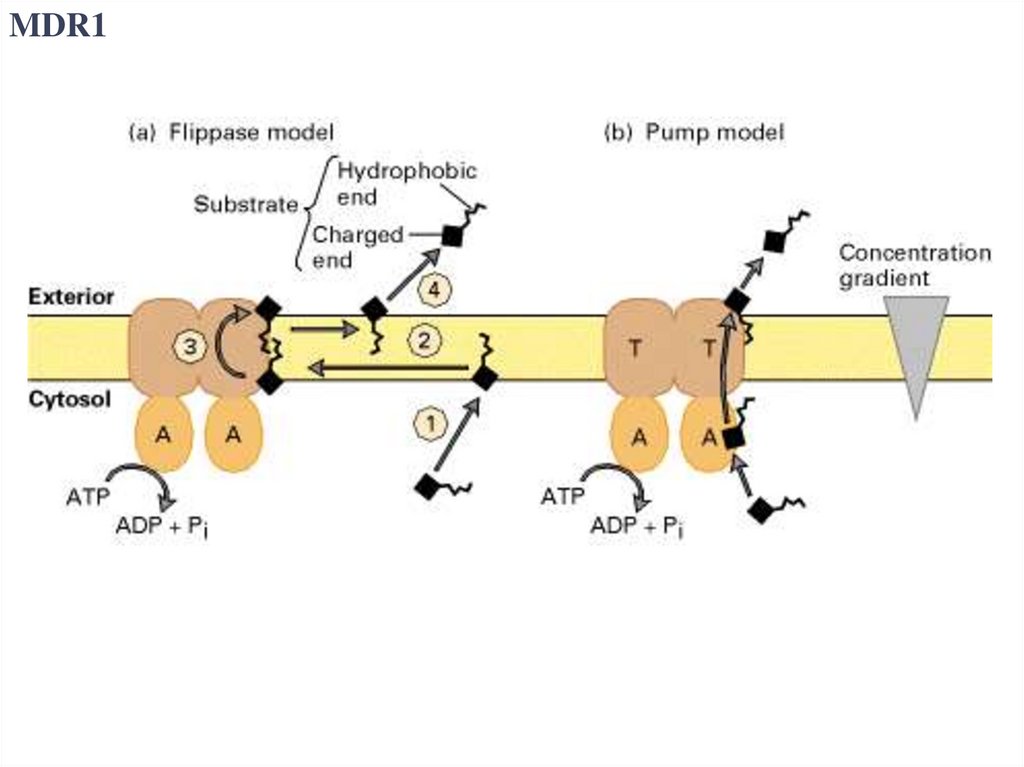
MDR144.
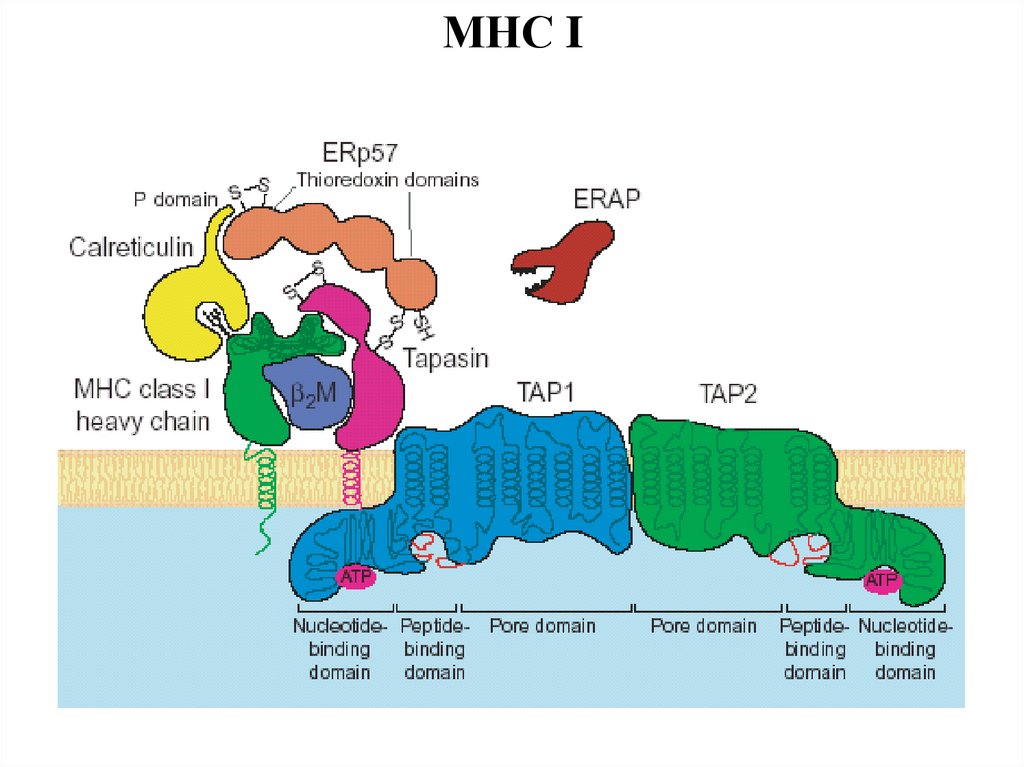
МНС I45.
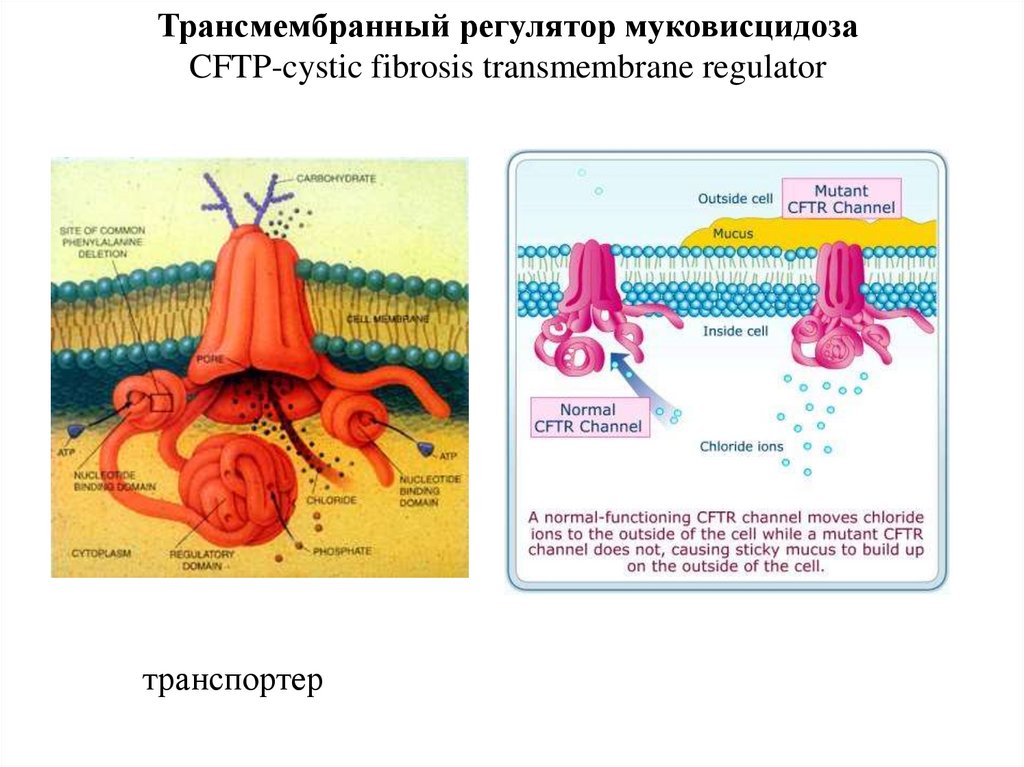
Трансмембранный регулятор муковисцидозаCFTP-cystic fibrosis transmembrane regulator
транспортер
46.
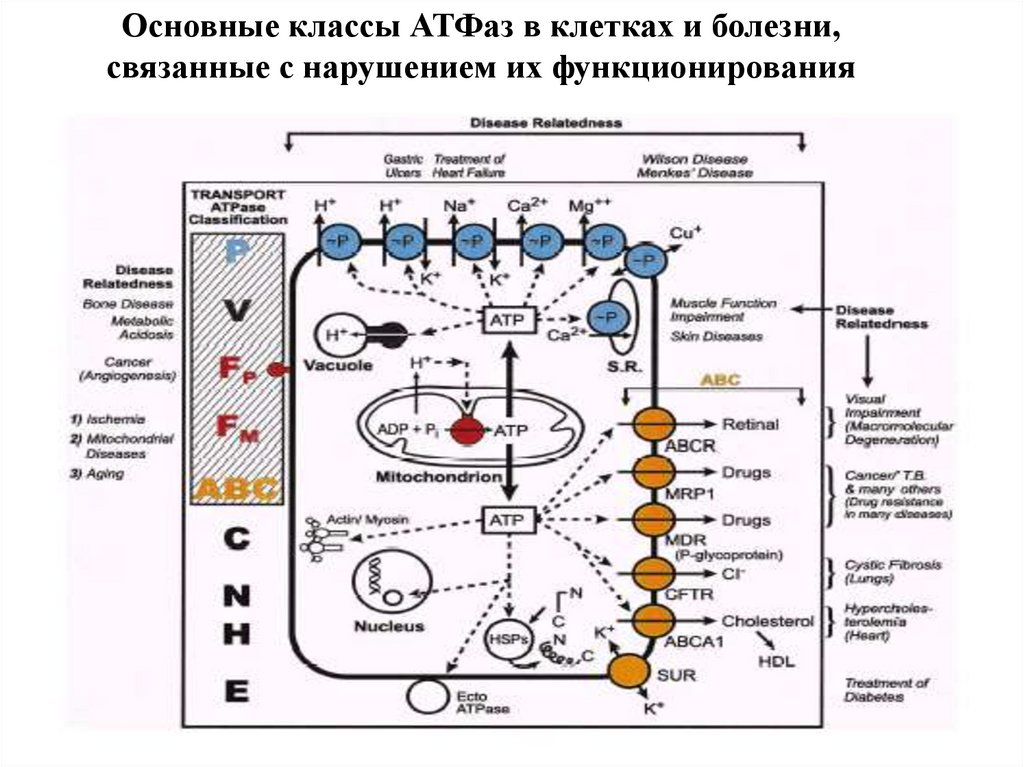
Основные классы АТФаз в клетках и болезни,связанные с нарушением их функционирования
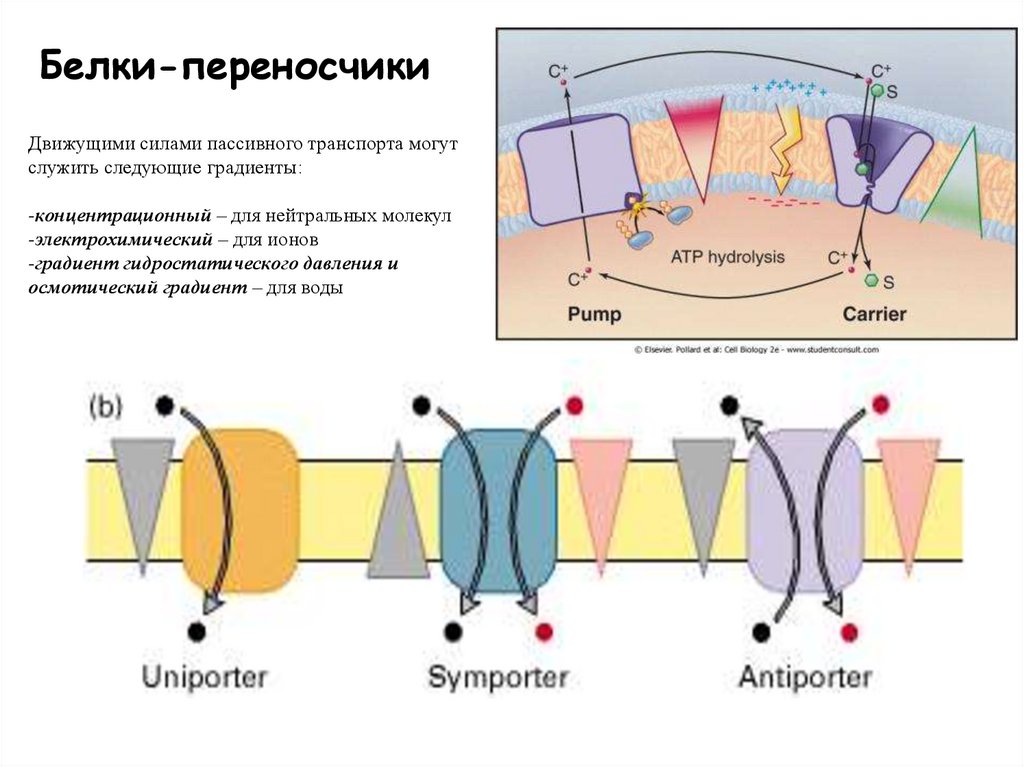
47.
Белки-переносчикиДвижущими силами пассивного транспорта могут
служить следующие градиенты:
-концентрационный – для нейтральных молекул
-электрохимический – для ионов
-градиент гидростатического давления и
осмотический градиент – для воды
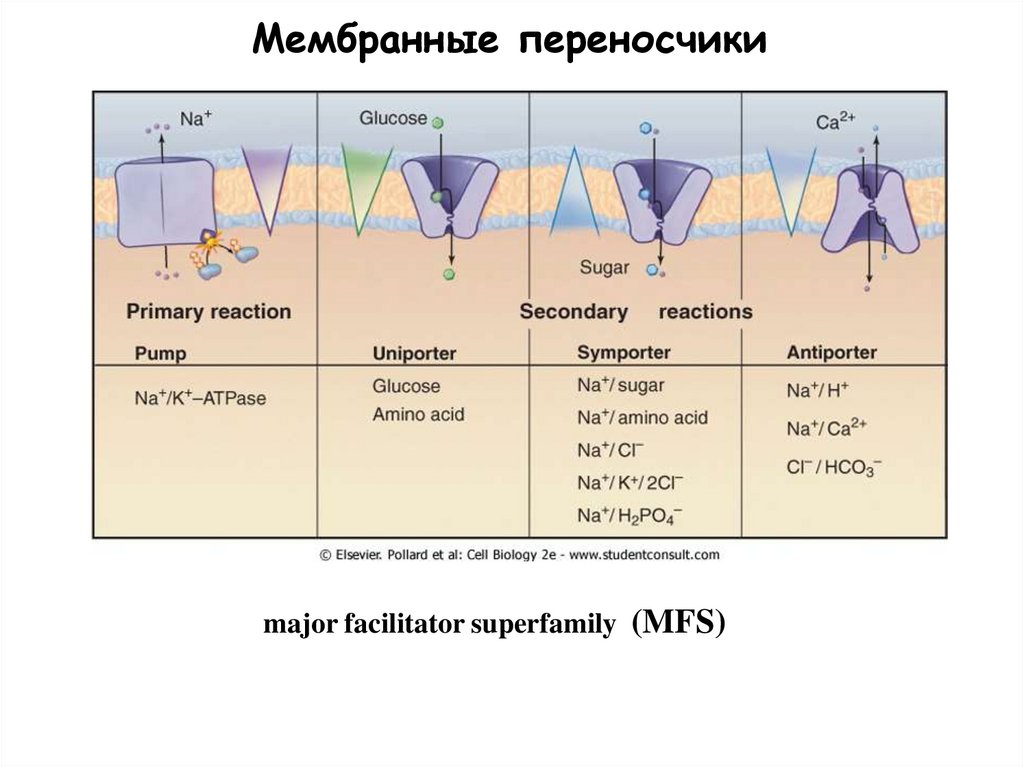
48.
Мембранные переносчикиmajor facilitator superfamily (MFS)
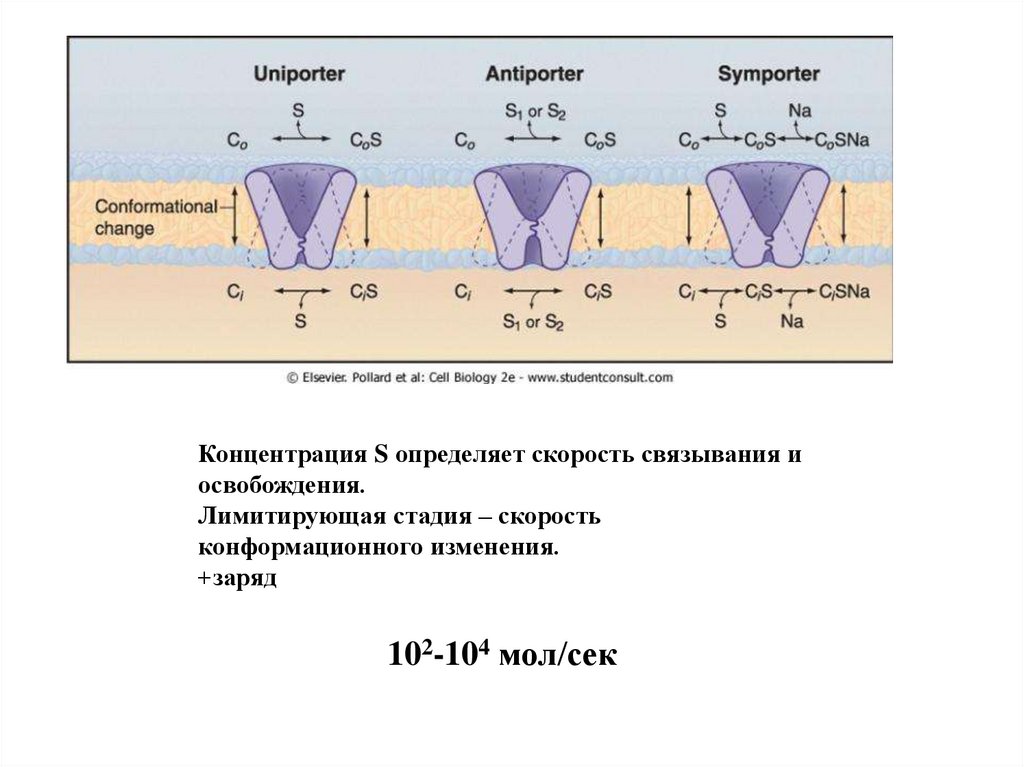
49.
Концентрация S определяет скорость связывания иосвобождения.
Лимитирующая стадия – скорость
конформационного изменения.
+заряд
102-104 мол/сек
50.
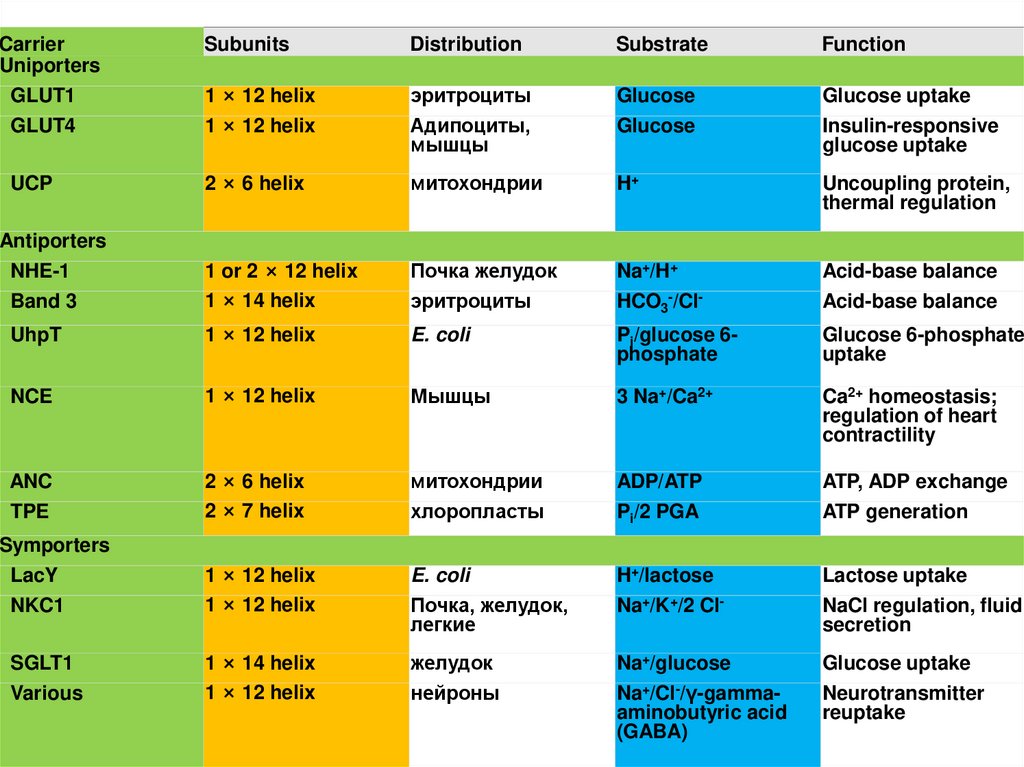
CarrierUniporters
GLUT1
GLUT4
Subunits
Distribution
Substrate
Function
1 × 12 helix
1 × 12 helix
эритроциты
Адипоциты,
мышцы
Glucose
Glucose
Glucose uptake
Insulin-responsive
glucose uptake
2 × 6 helix
митохондрии
H+
Uncoupling protein,
thermal regulation
1 or 2 × 12 helix
1 × 14 helix
Почка желудок
эритроциты
Na+/H+
HCO3-/Cl-
Acid-base balance
Acid-base balance
UhpT
1 × 12 helix
E. coli
Pi/glucose 6phosphate
Glucose 6-phosphate
uptake
NCE
1 × 12 helix
ANC
TPE
2 × 6 helix
2 × 7 helix
митохондрии
хлоропласты
ADP/ATP
Pi/2 PGA
ATP, ADP exchange
ATP generation
1 × 12 helix
1 × 12 helix
E. coli
Почка, желудок,
легкие
H+/lactose
Na+/K+/2 Cl-
Lactose uptake
NaCl regulation, fluid
secretion
1 × 14 helix
1 × 12 helix
желудок
нейроны
Na+/glucose
Na+/Cl-/γ-gammaaminobutyric acid
(GABA)
Glucose uptake
Neurotransmitter
reuptake
UCP
Antiporters
NHE-1
Band 3
Symporters
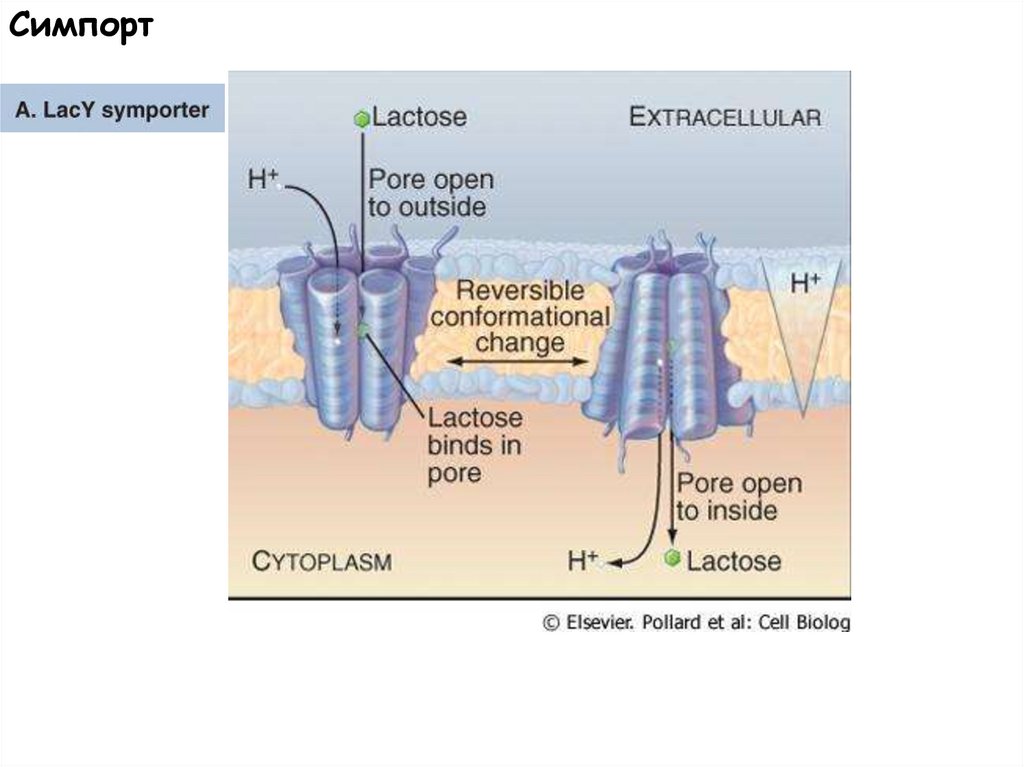
LacY
NKC1
SGLT1
Various
Table 9-1.
EXAMPLES OF CARRIER PROTEINS
Mышцы
3 Na+/Ca2+
Ca2+ homeostasis;
regulation of heart
contractility
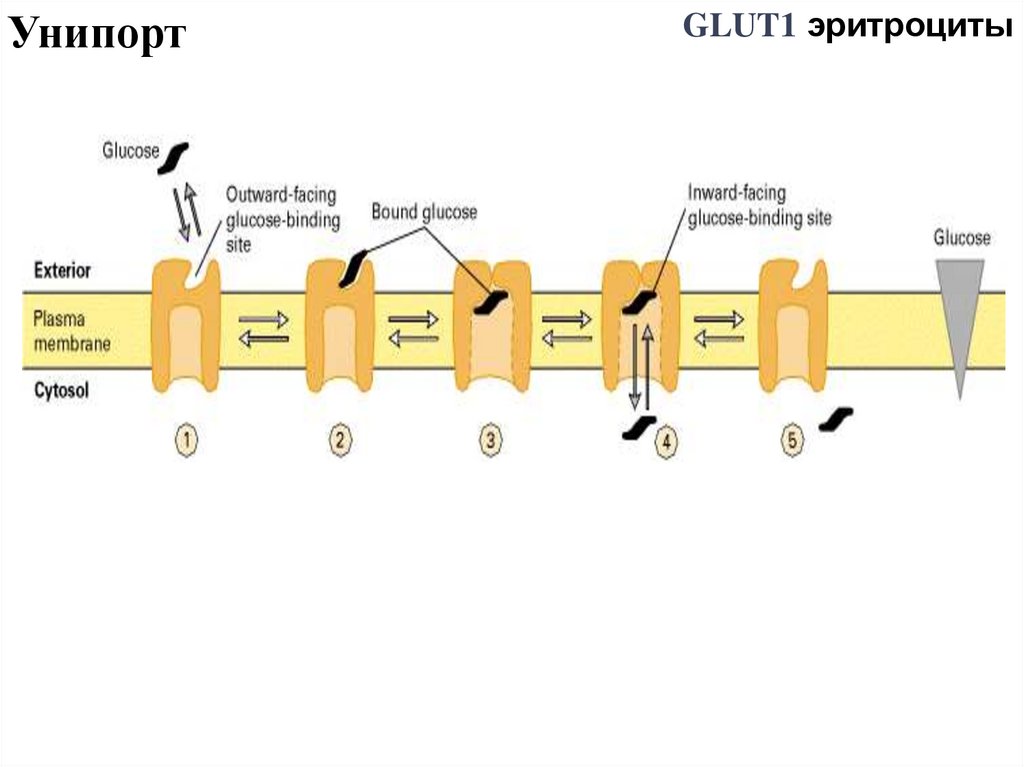
51.
УнипортGLUT1 эритроциты
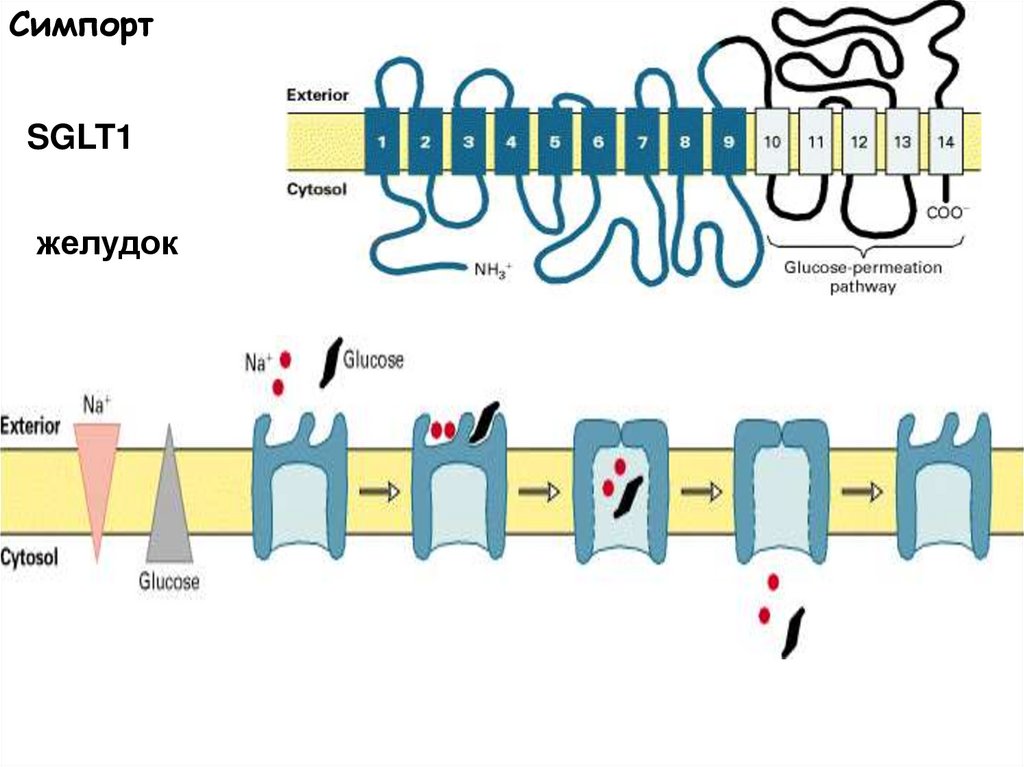
52.
СимпортSGLT1
желудок
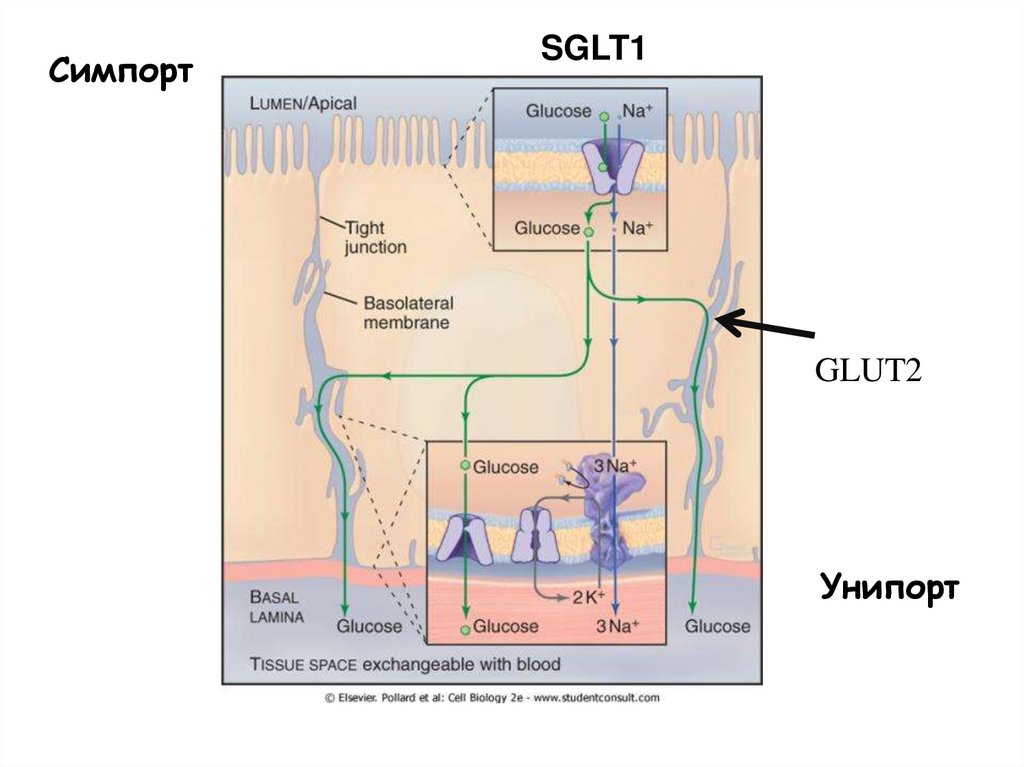
53.
СимпортSGLT1
GLUT2
Унипорт
54.
Симпорт55.
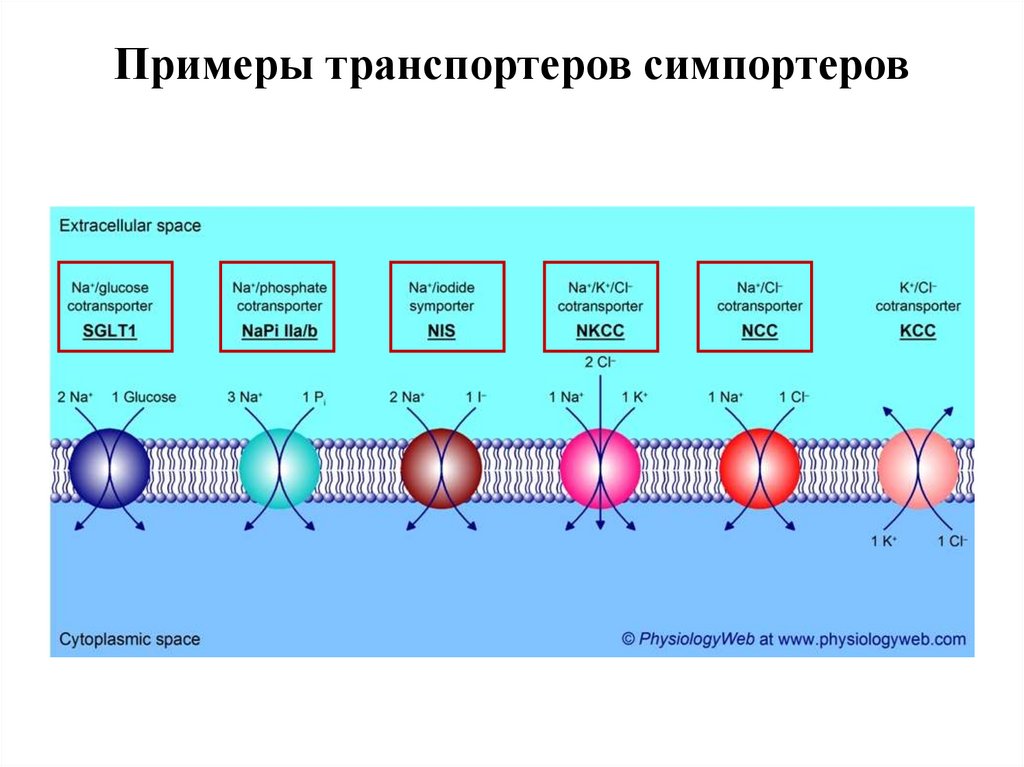
Примеры транспортеров симпортеров56.
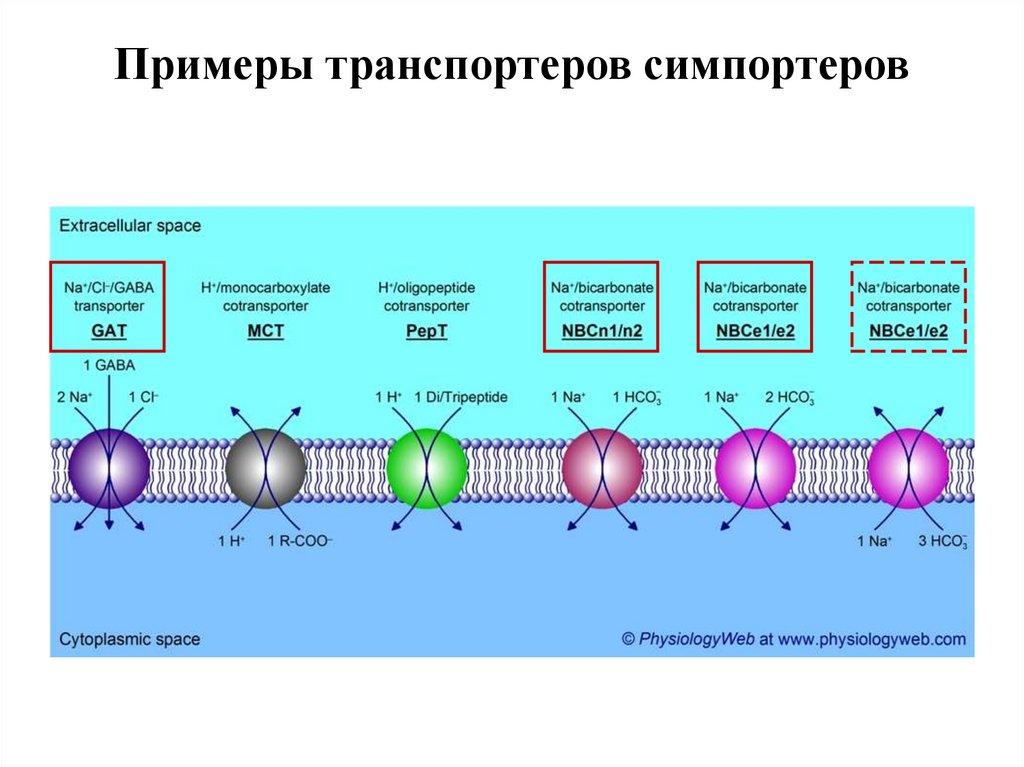
Примеры транспортеров симпортеров57.
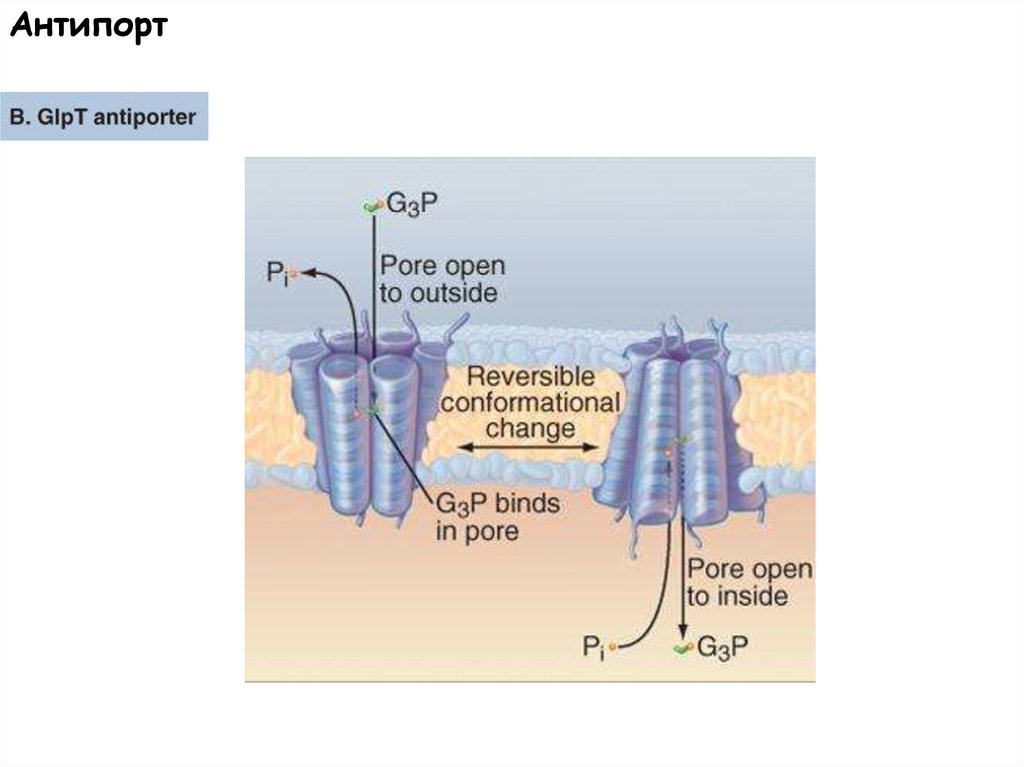
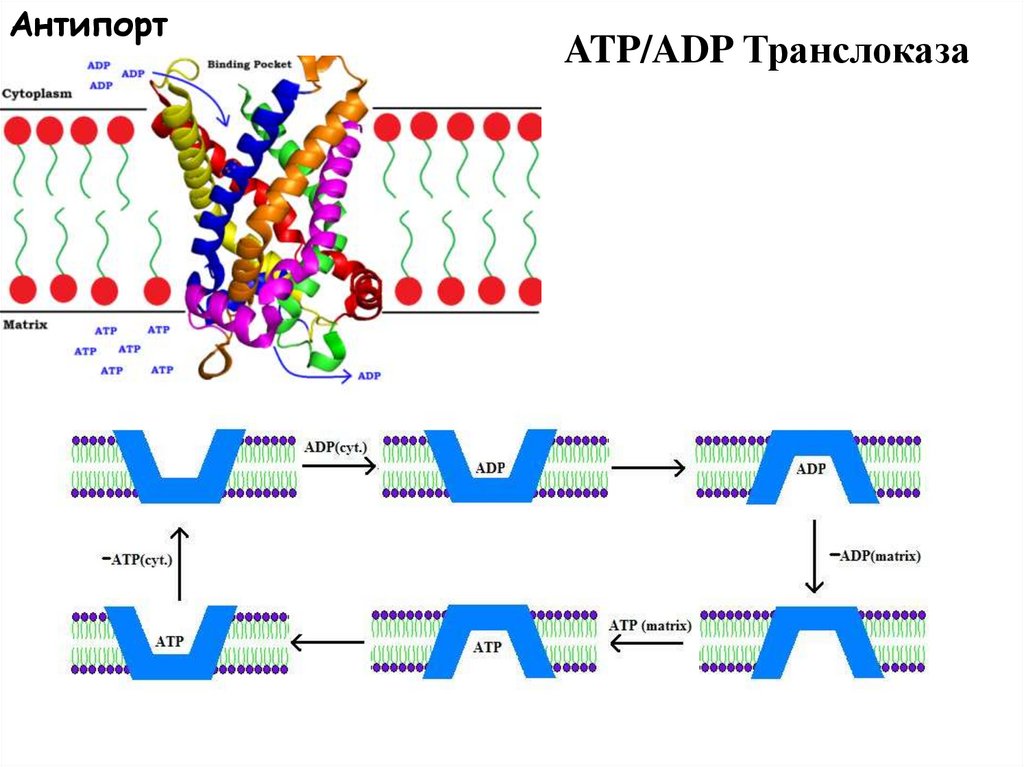
Антипорт58.
АнтипортATP/ADP Транслоказа
59.
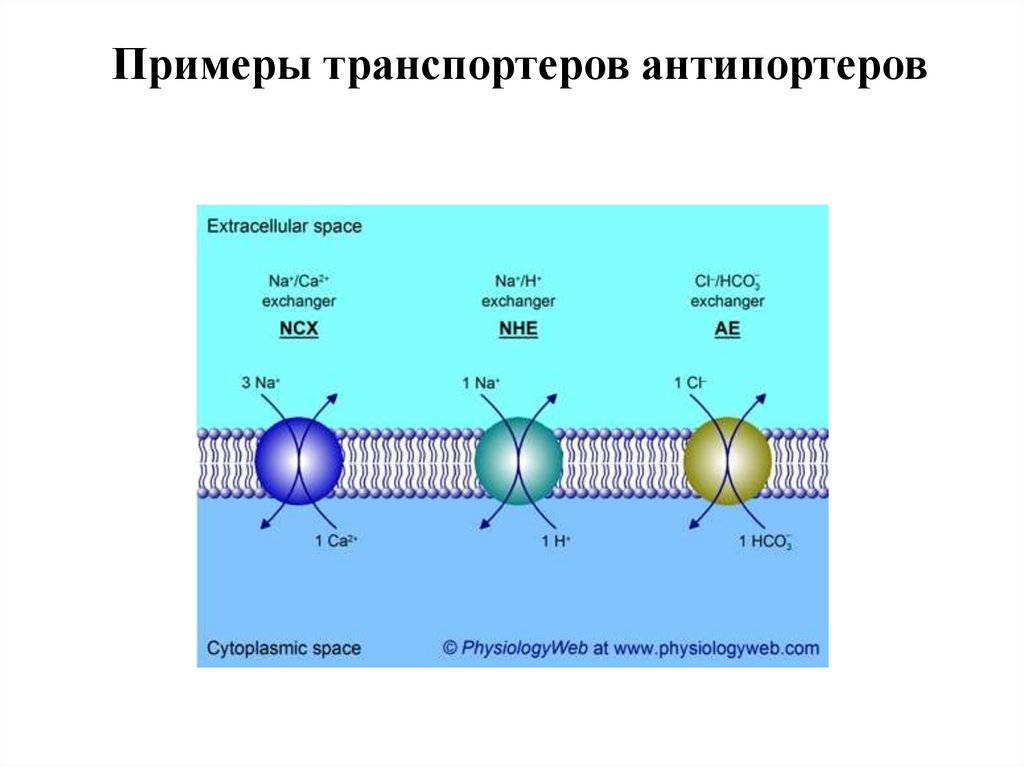
Примеры транспортеров антипортеров60.
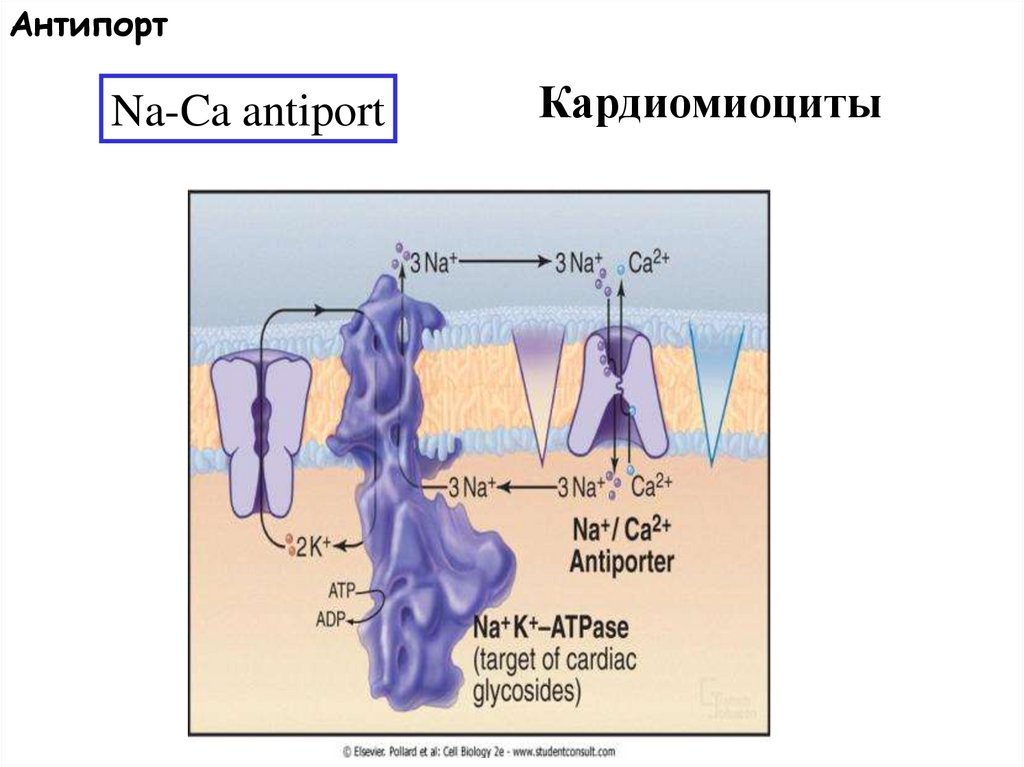
АнтипортNa-Ca antiport
Кардиомиоциты
61.
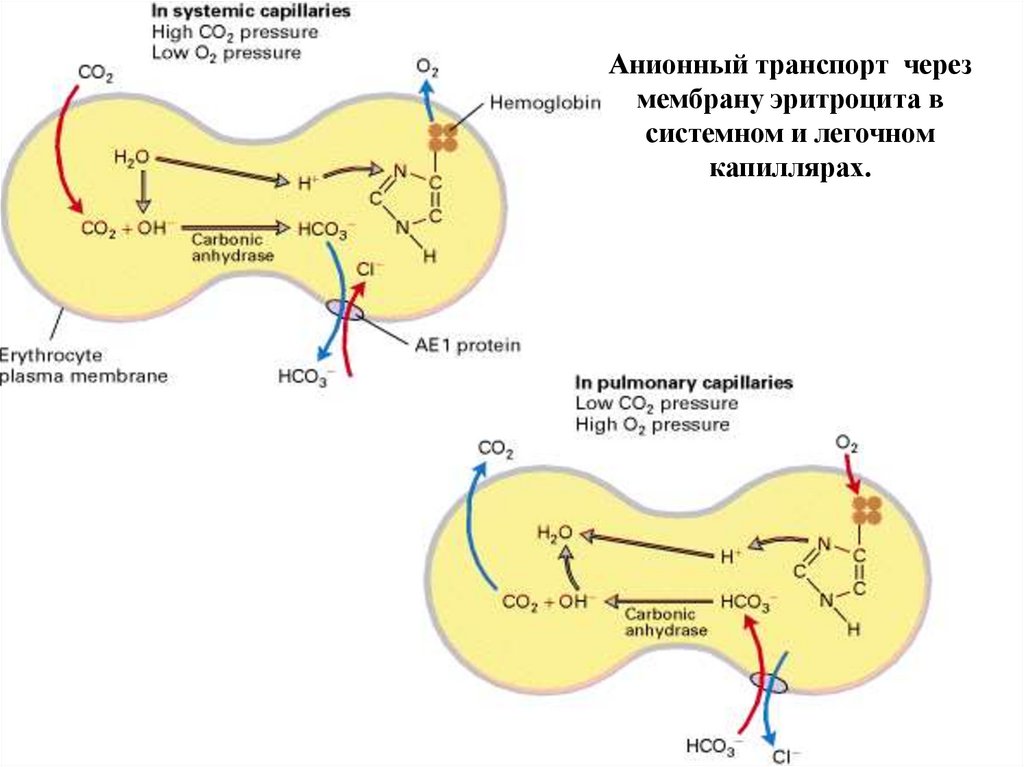
Анионный транспорт черезмембрану эритроцита в
системном и легочном
капиллярах.
62.
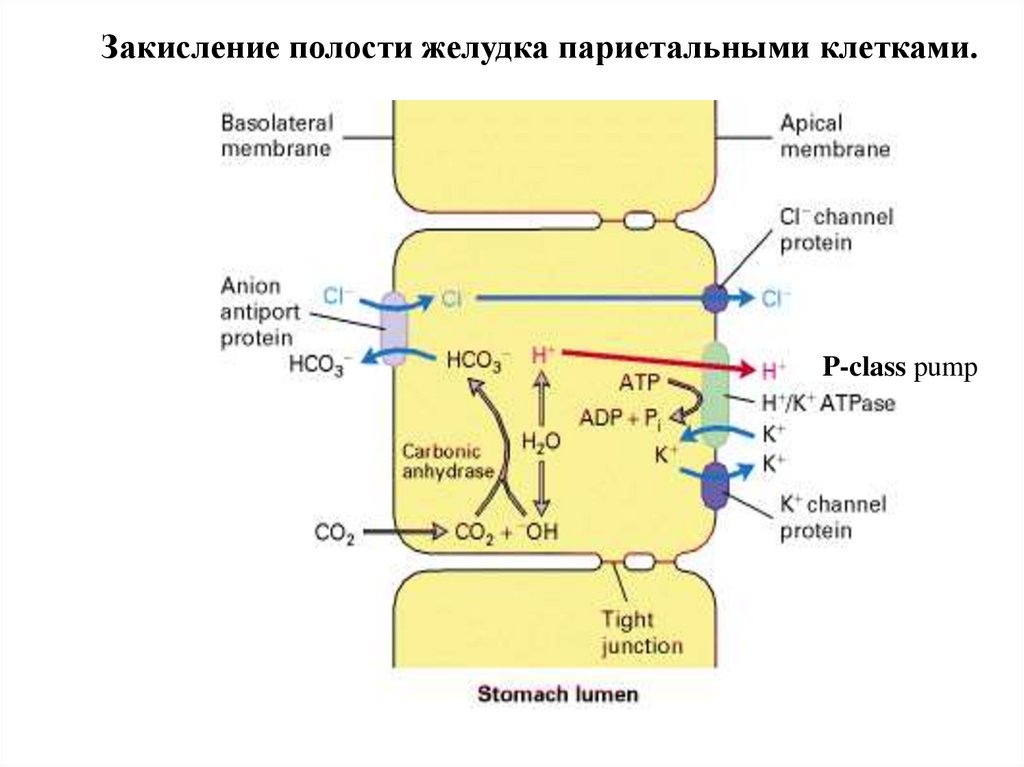
Закисление полости желудка париетальными клетками.P-class pump
63.
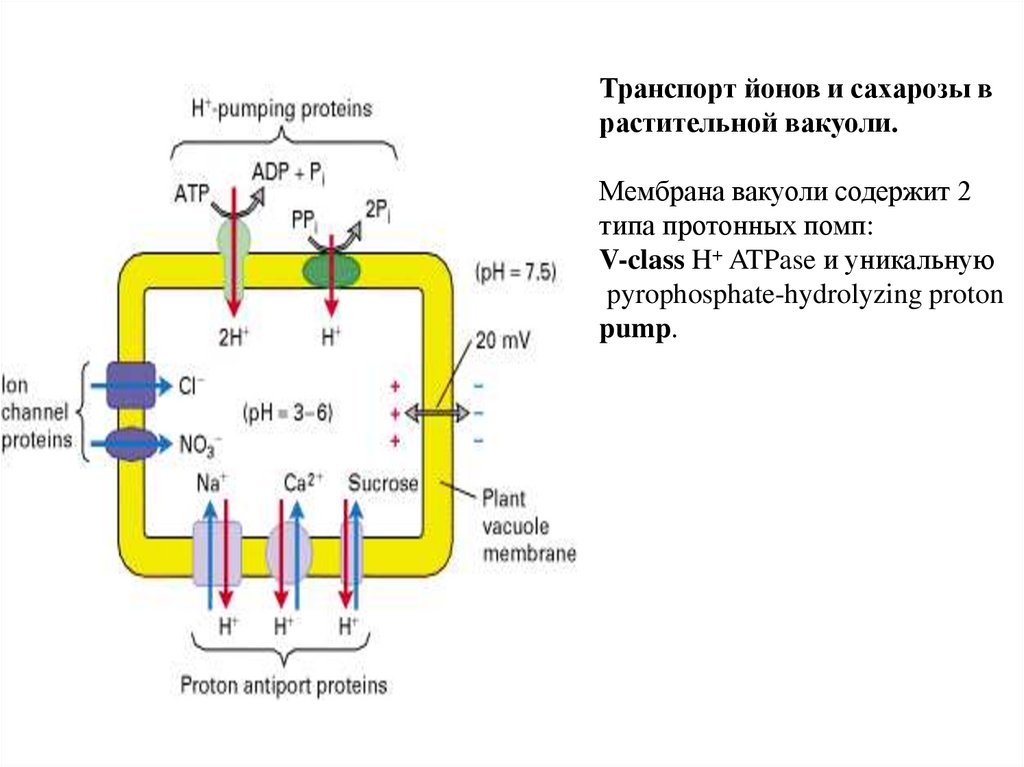
Транспорт йонов и сахарозы врастительной вакуоли.
Мембрана вакуоли содержит 2
типа протонных помп:
V-class H+ ATPase и уникальную
pyrophosphate-hydrolyzing proton
pump.
64.
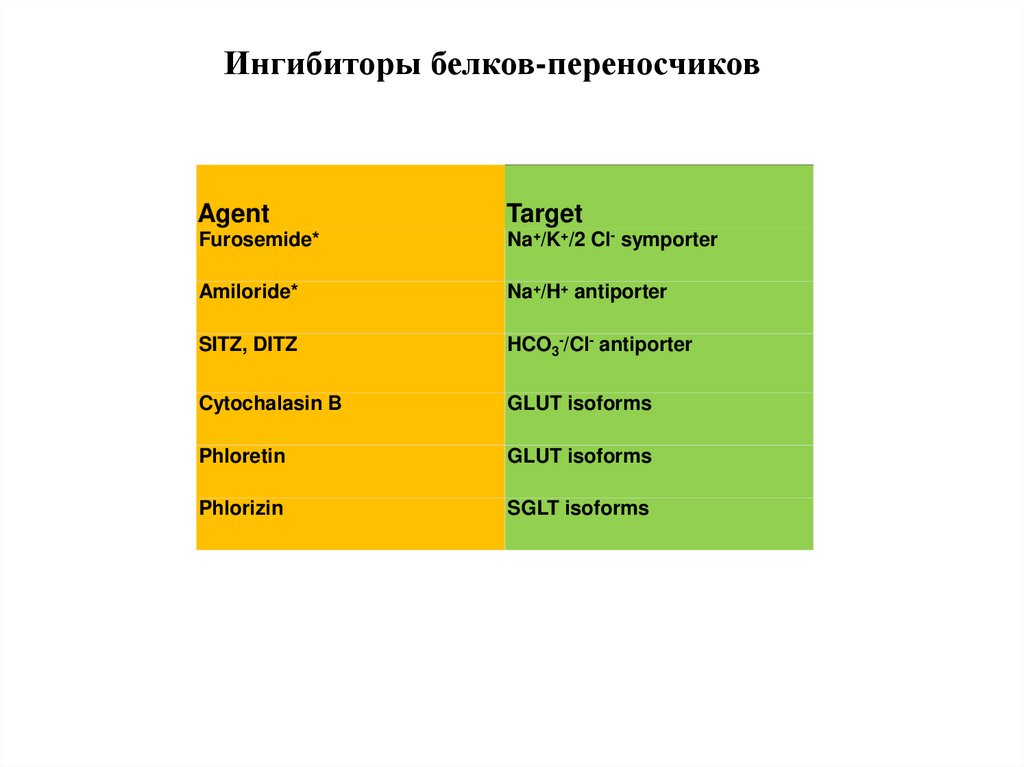
Ингибиторы белков-переносчиковAgent
Target
Furosemide*
Na+/K+/2 Cl- symporter
Amiloride*
Na+/H+ antiporter
SITZ, DITZ
HCO3-/Cl- antiporter
Cytochalasin B
GLUT isoforms
Phloretin
GLUT isoforms
Phlorizin
SGLT isoforms
65.
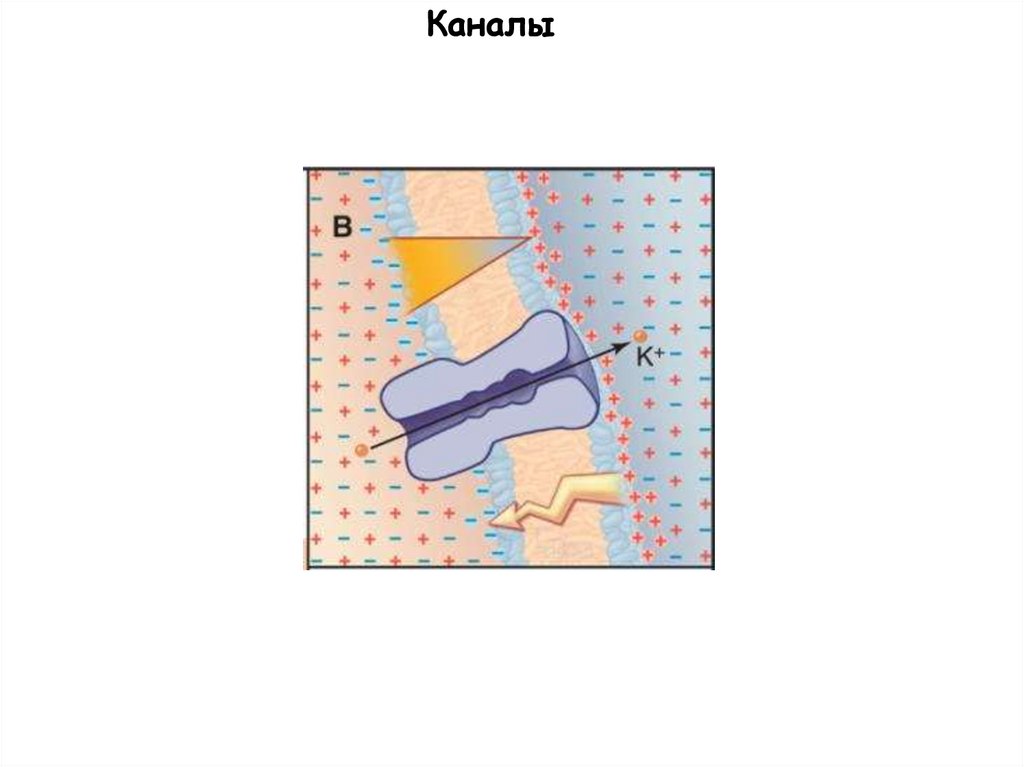
Каналы66.
Функции йонных каналов:1.Регуляция водного обмена клетки: объём и тургор.
2. Регуляция pH: закисление и защелачивание.
3. Регуляция ионного обмена (обмен солей): изменение
внутриклеточного ионного состава и концентрации.
4. Создание и изменение мембранных потенциалов: потенциал покоя;
в возбудимых клетках - локальные потенциалы, потенциал действия.
5. Проведение возбуждения в возбудимых клетках: обеспечение
движения нервных импульсов.
6. Трансдукция в сенсорных рецепторах: преобразование раздражения
(стимула) в возбуждение.
7. Управление активностью клетки: за счёт обеспечения потоков
вторичного мессенджера - Са2+.
67.
Классификации каналов1.
По строению (родству их химического строения и происхождения
образующих их белков). По строению (структуре) и по
происхождению от однотипных генов различные ИК объединяются
в отдельные семейства.
1.
По селективности (степени избирательной проницаемости к
определённым ионам). Натриевые, калиевые, хлорные и т.п.
3. По способу управления их состоянием. Потенциал-управляемые,
хемо-управляемые и т.д.
4. По связывающимся с ними лигандам (в том числе веществаммаркёрам) и т.д. Выделяют три семейства лиганд-активируемых
ИК: 1) семейство с пуриновыми рецепторами (АТФ-активируемые),
2) с никотиновыми АХ-рецепторами, ГАМК-, глицин- и серотонинрецепторами, 3) с глутаматными рецепторами.
68.
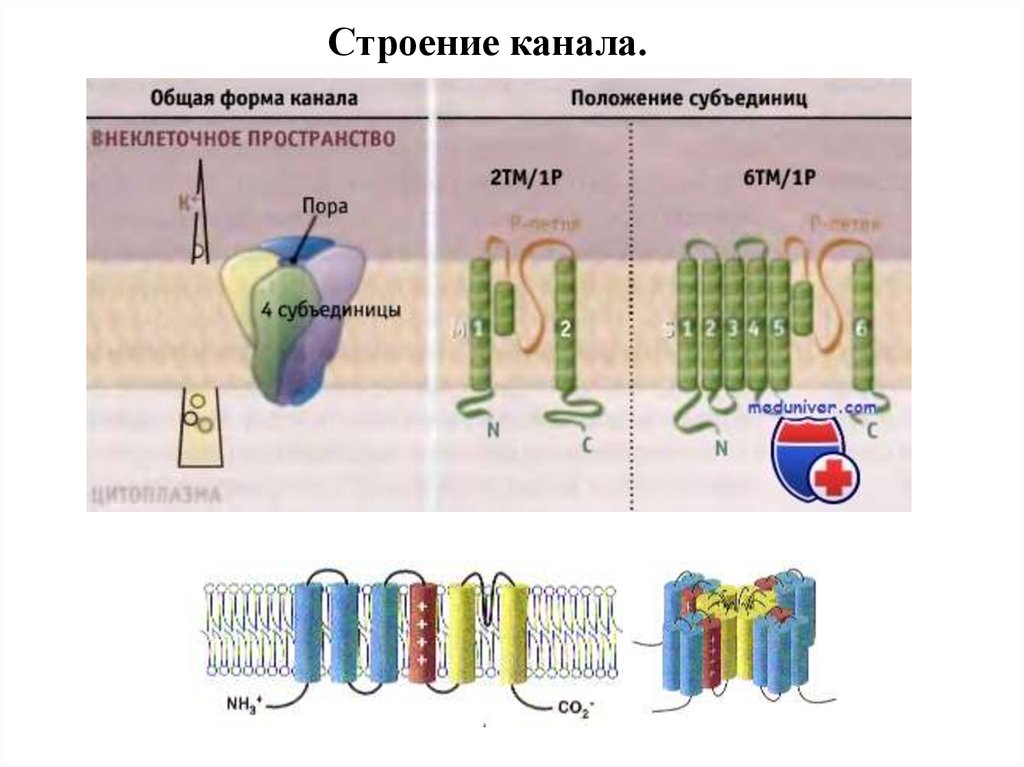
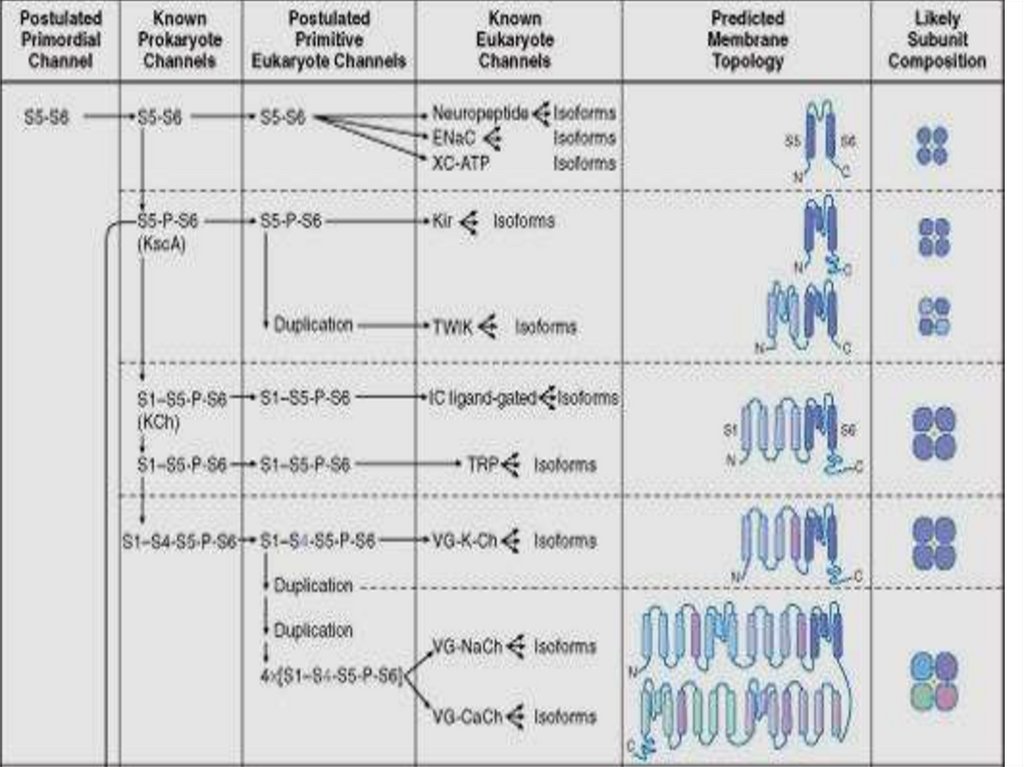
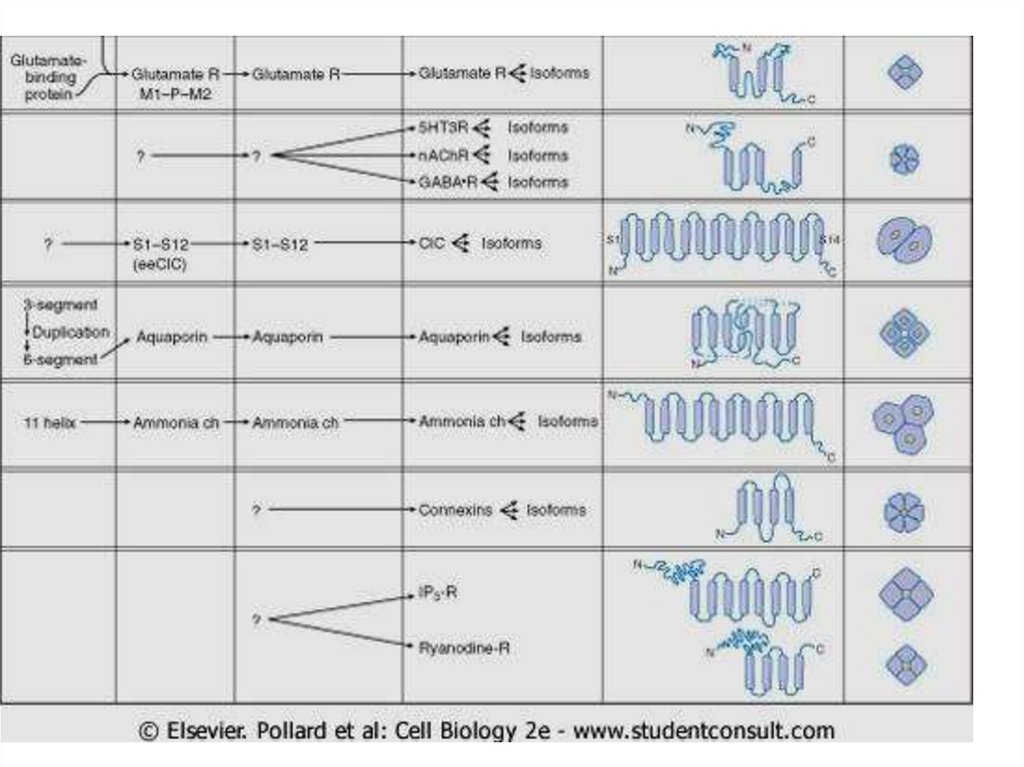
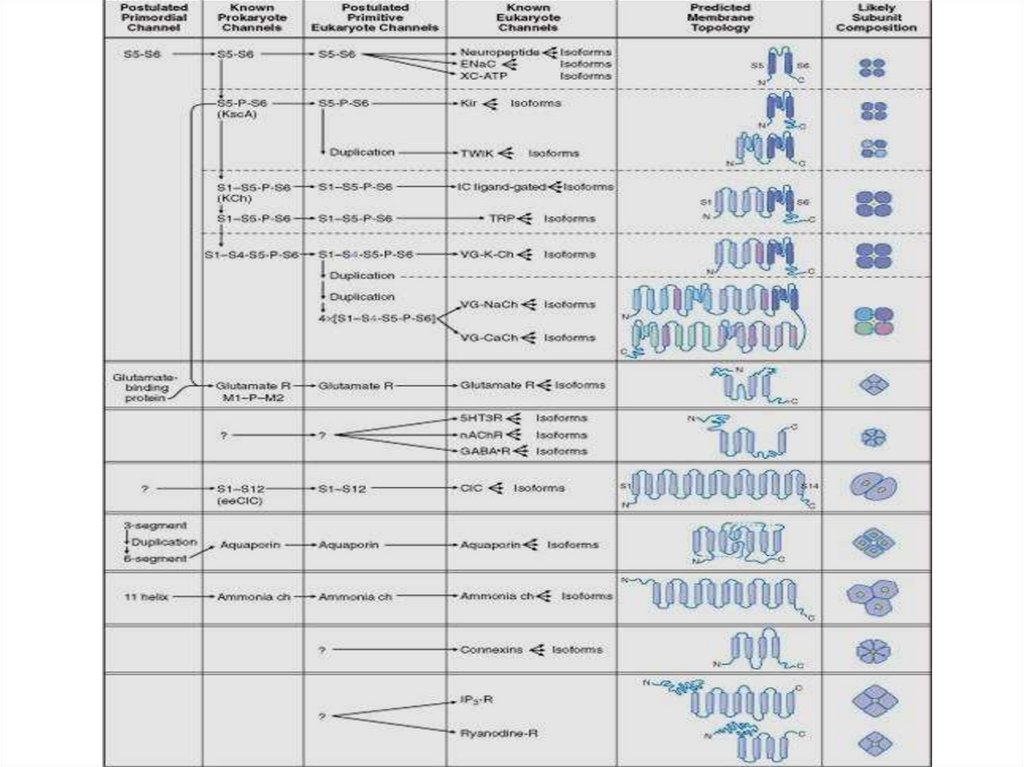
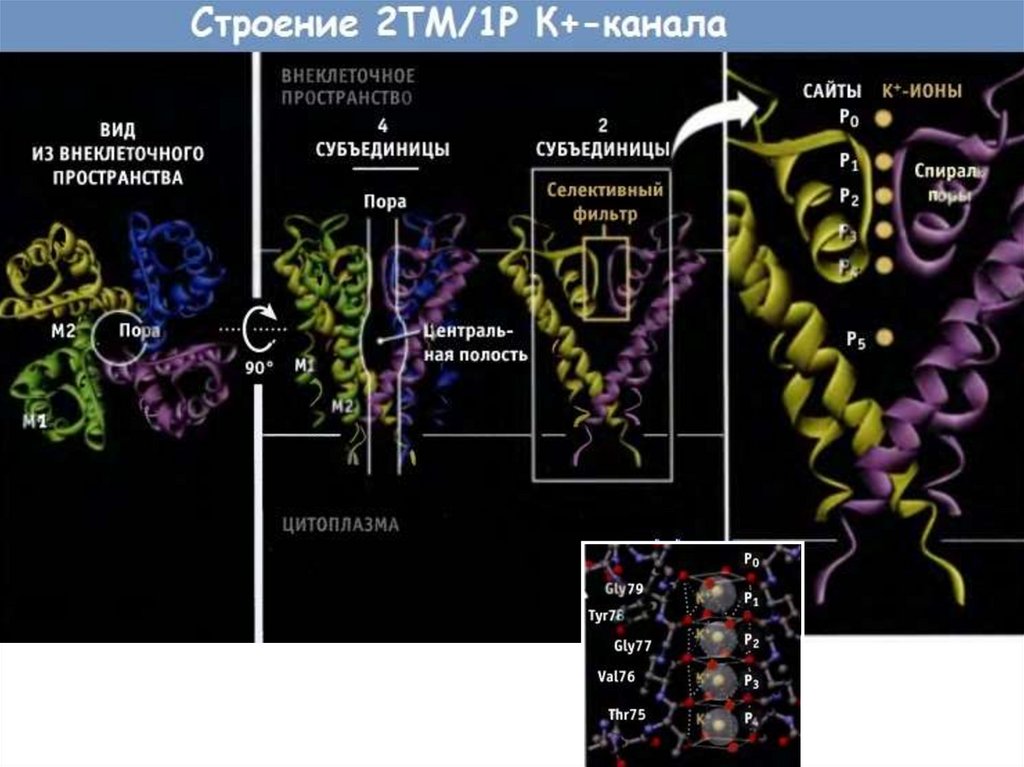
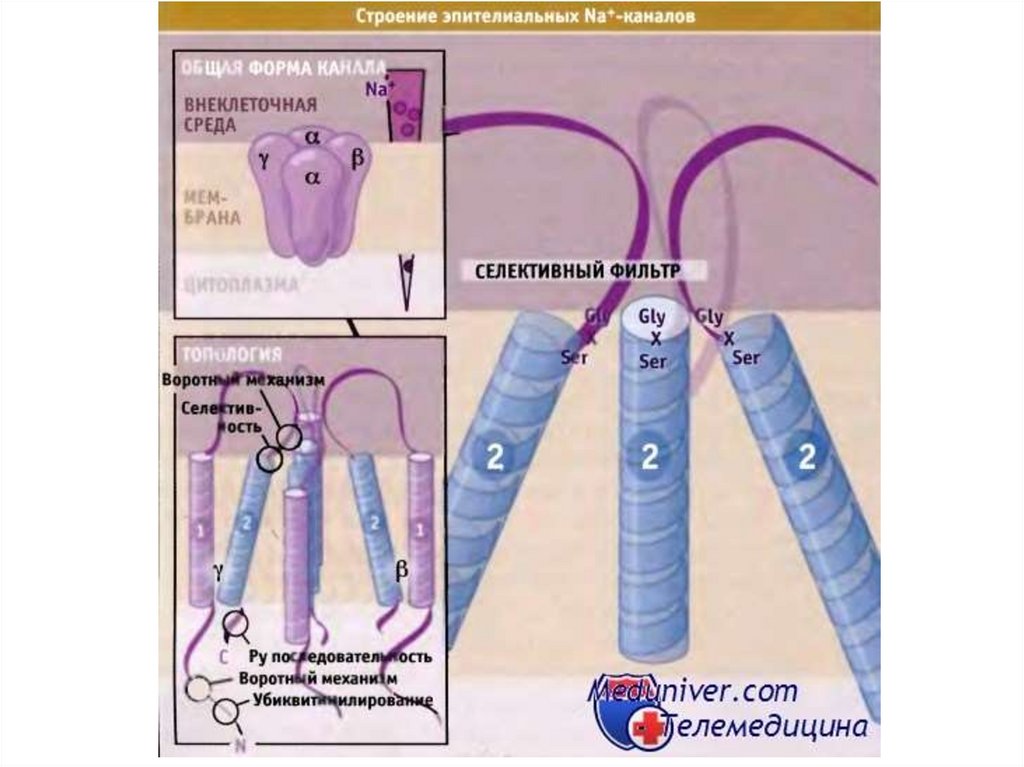
Строение канала.69.
70.
71.
72.
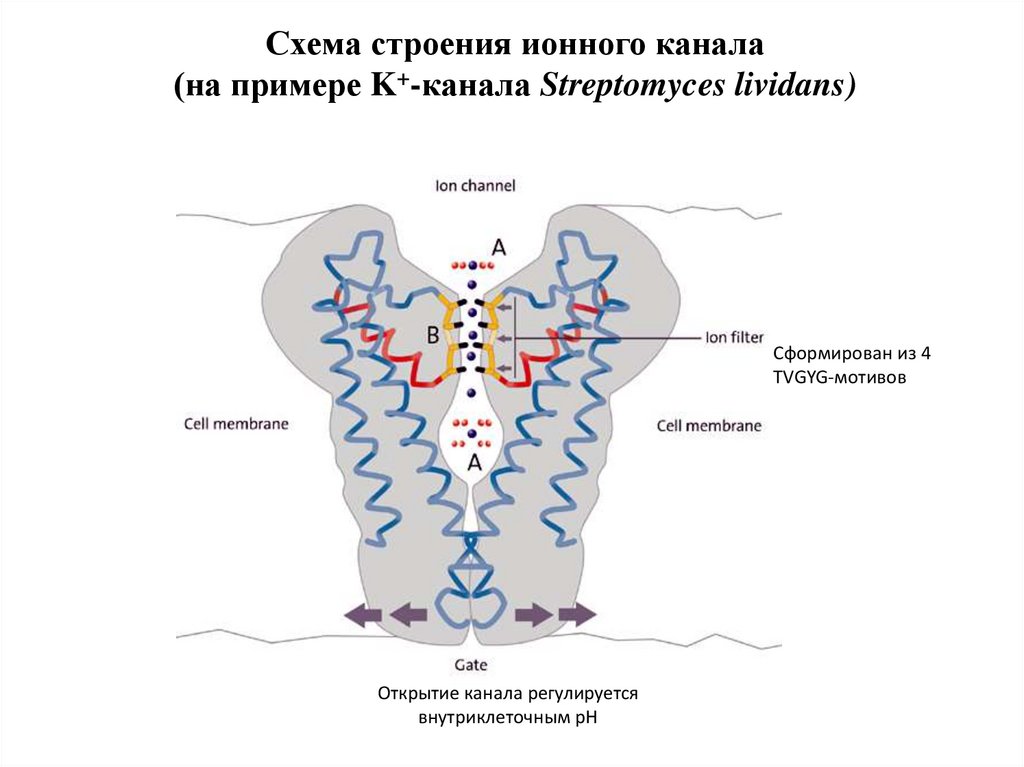
Схема строения ионного канала(на примере K+-канала Streptomyces lividans)
Сформирован из 4
TVGYG-мотивов
Открытие канала регулируется
внутриклеточным рН
73.
74.
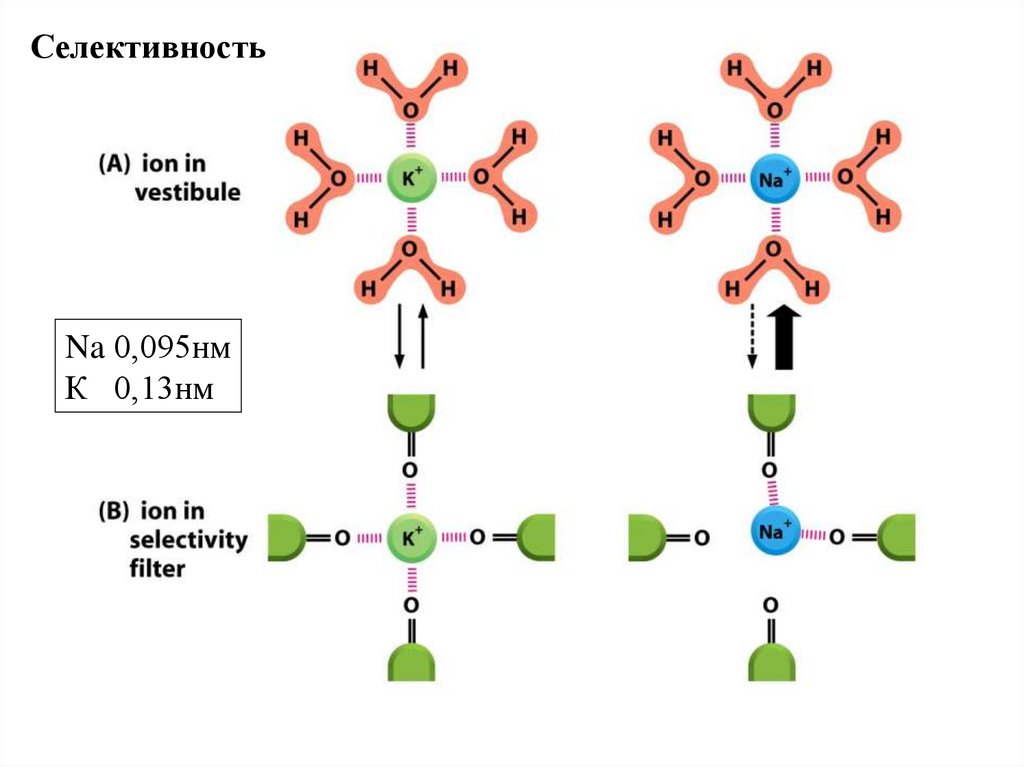
СелективностьNa 0,095нм
К 0,13нм
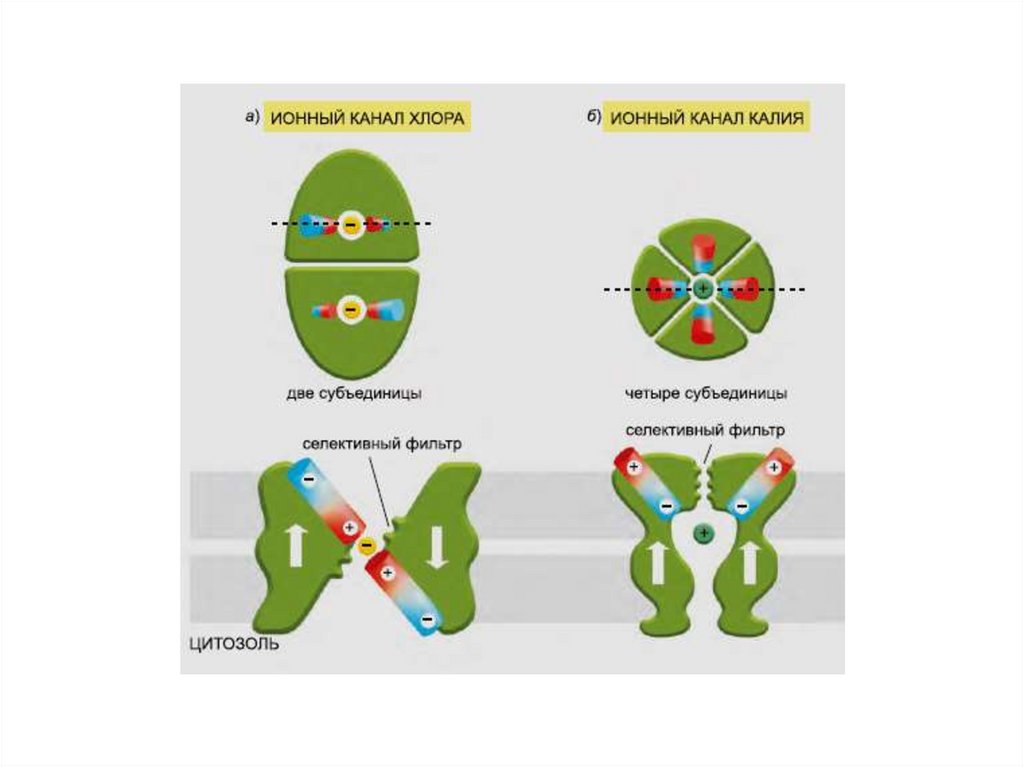
75.
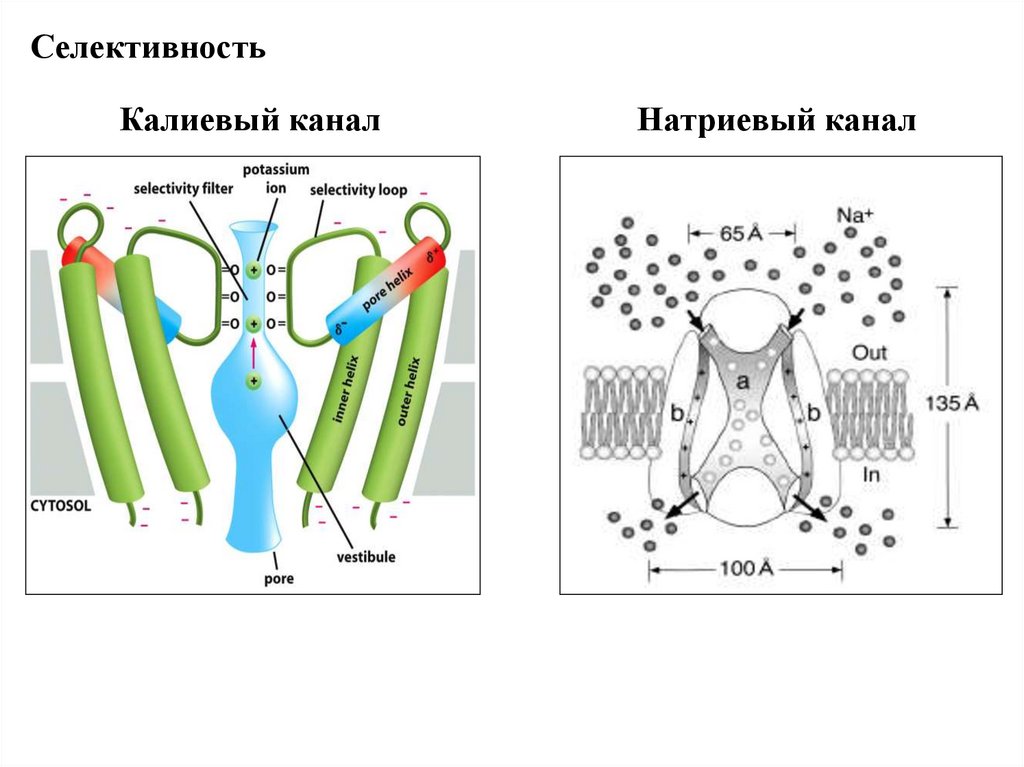
СелективностьКалиевый канал
Натриевый канал
76.
77.
78.
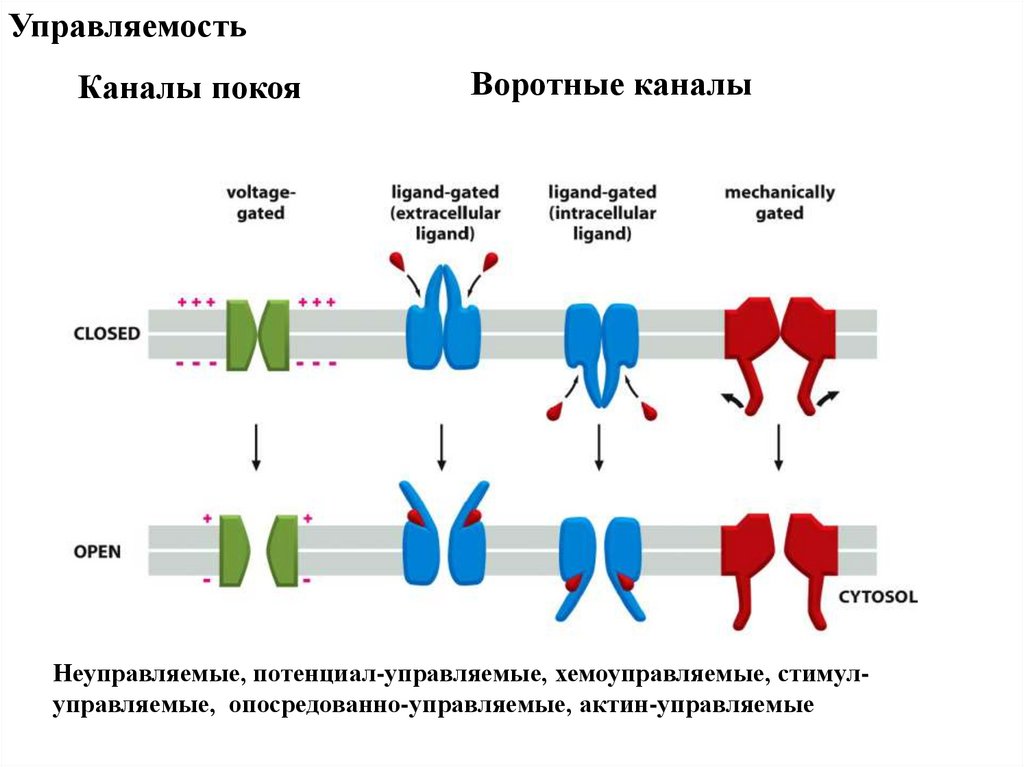
УправляемостьКаналы покоя
Воротные каналы
Неуправляемые, потенциал-управляемые, хемоуправляемые, стимулуправляемые, опосредованно-управляемые, актин-управляемые
79.
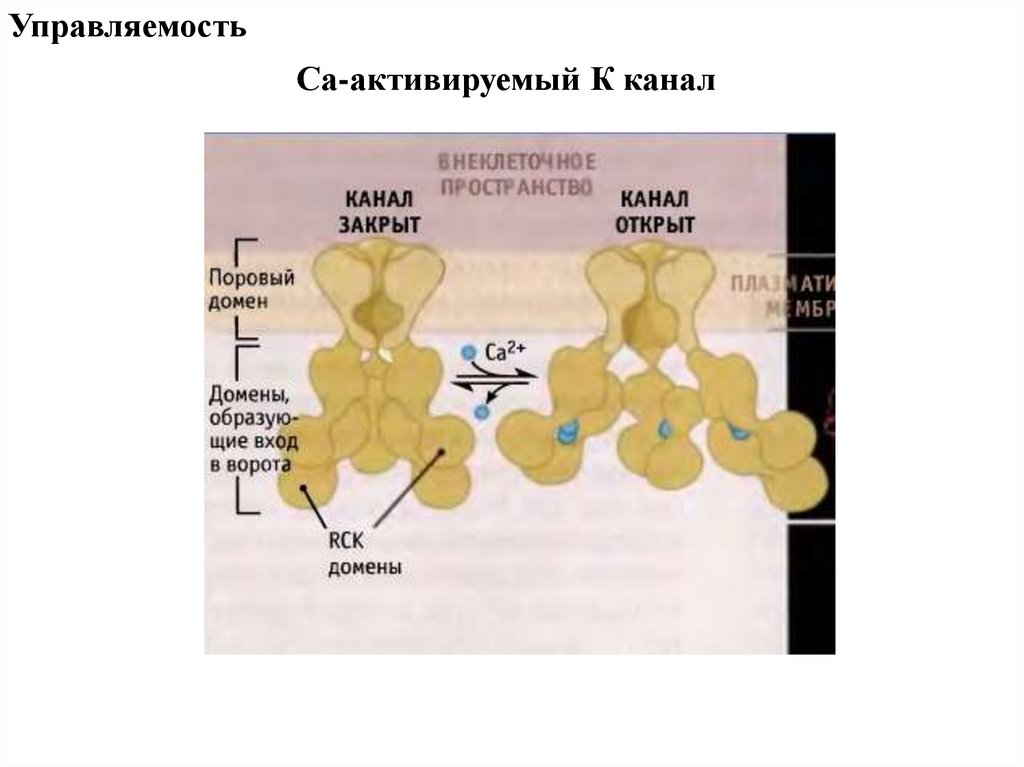
УправляемостьСа-активируемый К канал
80.
81.
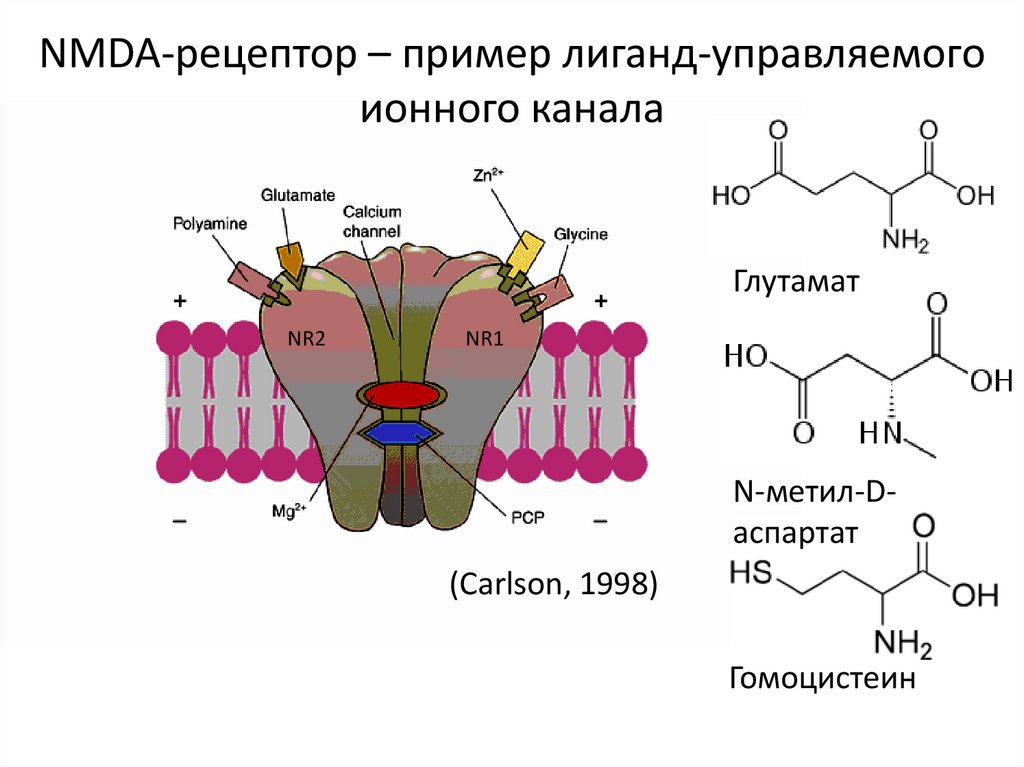
NMDA-рецептор – пример лиганд-управляемогоионного канала
Глутамат
NR2
NR1
N-метил-Dаспартат
(Carlson, 1998)
Гомоцистеин
82.
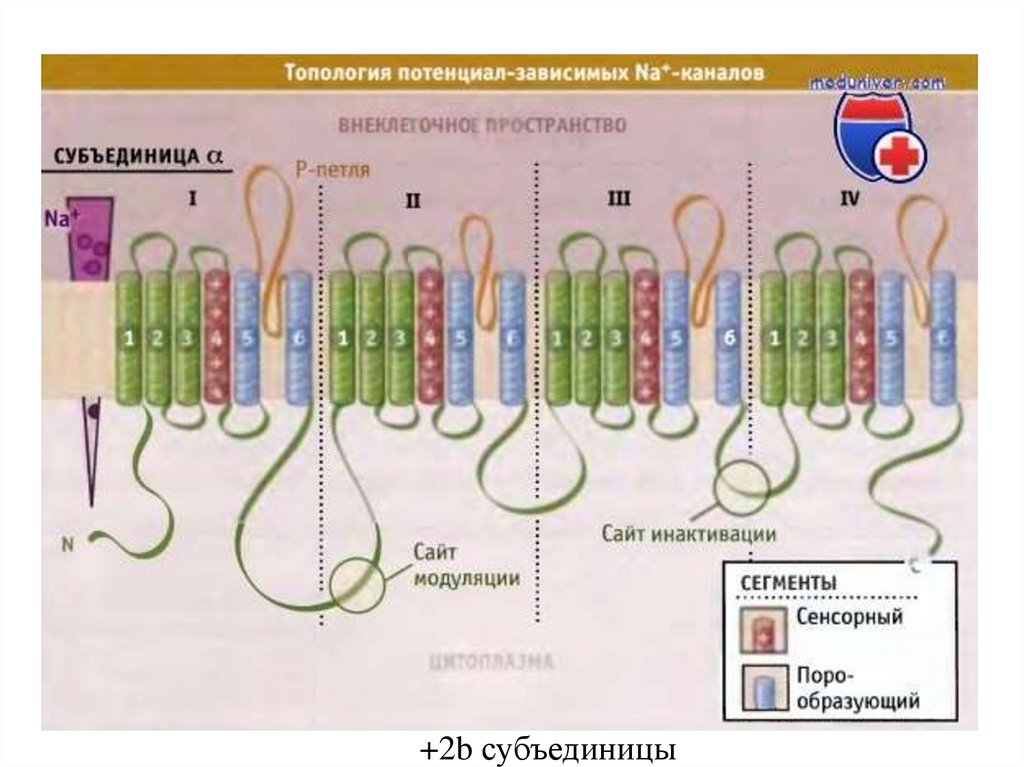
+2b субъединицы83.
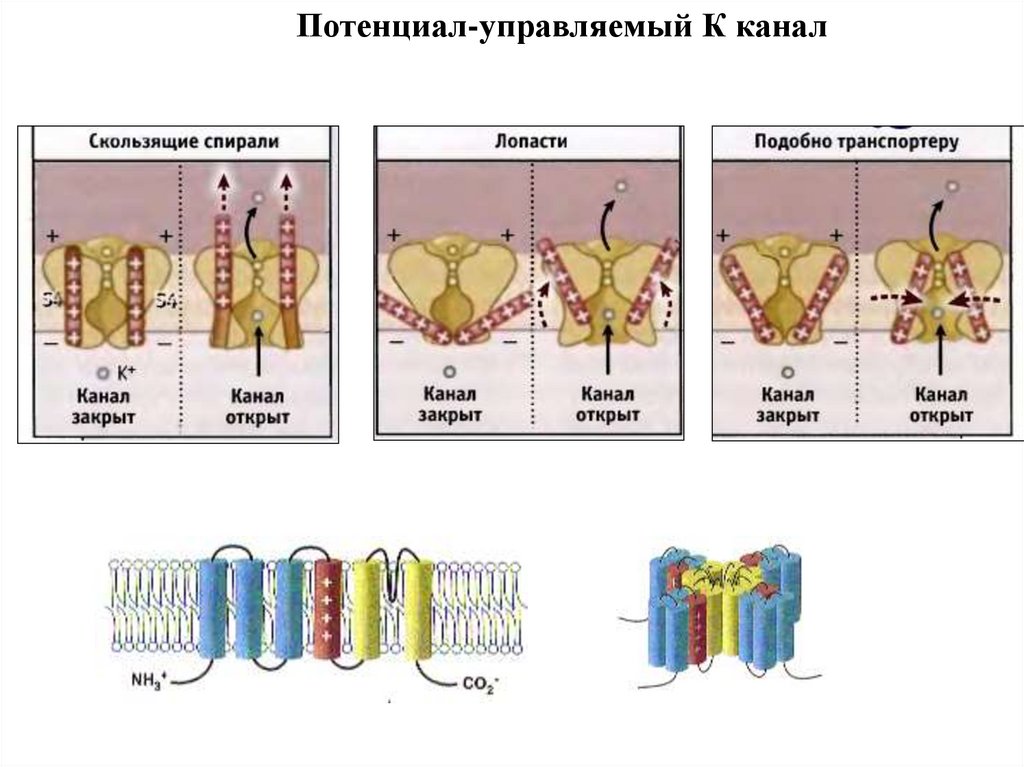
Потенциал-управляемый К канал84.
1. Открытое. Канал открыт и через него происходит перемещениеионов.
2. Закрытое. Канал закрыт и ионы не проходят через него.
3. Активированное. Канал может выполнять свои функции, т.е.
открываться и закрываться под действием его регуляторов
(управляющих веществ или электрических потенциалов).
4. Инактивированное. Канал не может выполнять свои функции, т.е.
открываться и закрываться, он "фиксируется" в каком-то одном
состоянии.
5. Блокированное. Канал перекрыт, инактивирован веществомантагонистом (блокатором), занявшем место управляющего вещества.
6. Модулированное . Канал изменяет свои обычные свойства под
действием фосфорилирования - присоединения к какому-то его
участку фосфатного остатка.
85.
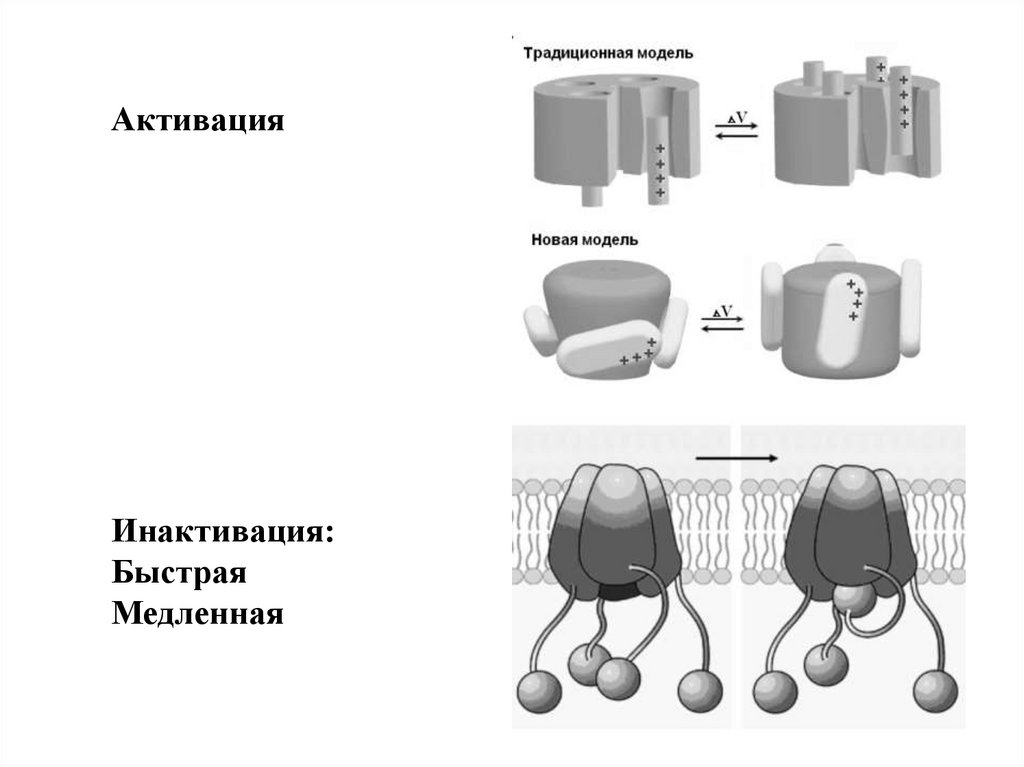
АктивацияИнактивация:
Быстрая
Медленная
86.
Тетродотоксин: токсин рыбы фугу.Блокатор Na-каналов
87.
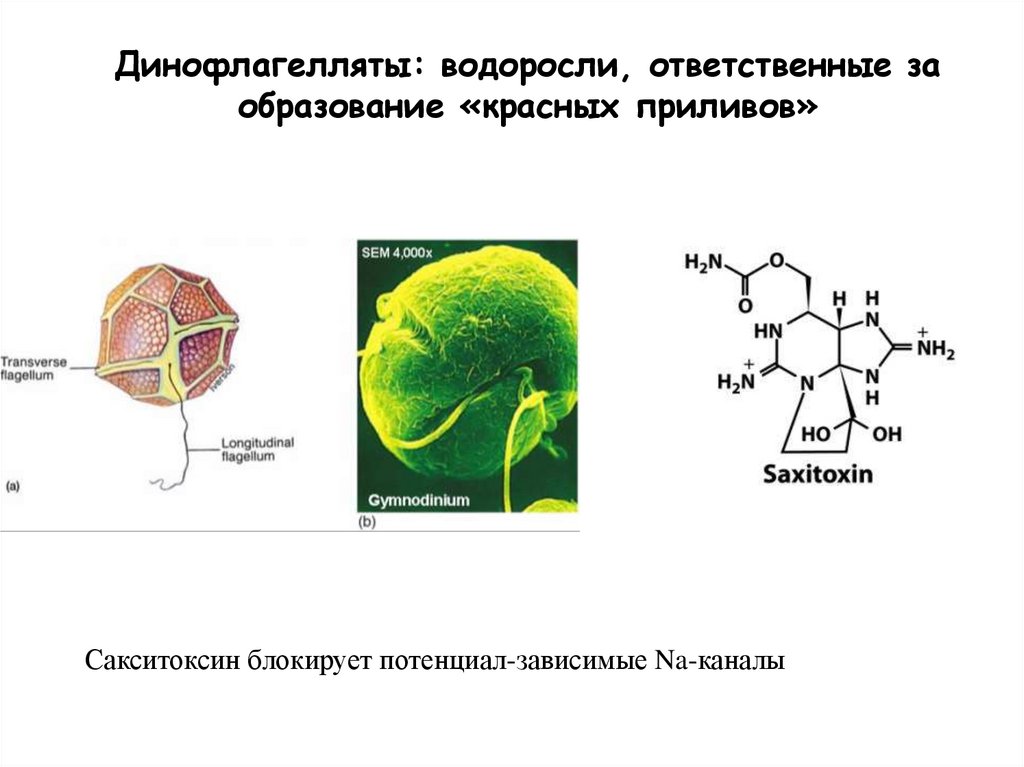
Динофлагелляты: водоросли, ответственные заобразование «красных приливов»
Сакситоксин блокирует потенциал-зависимые Na-каналы
88.
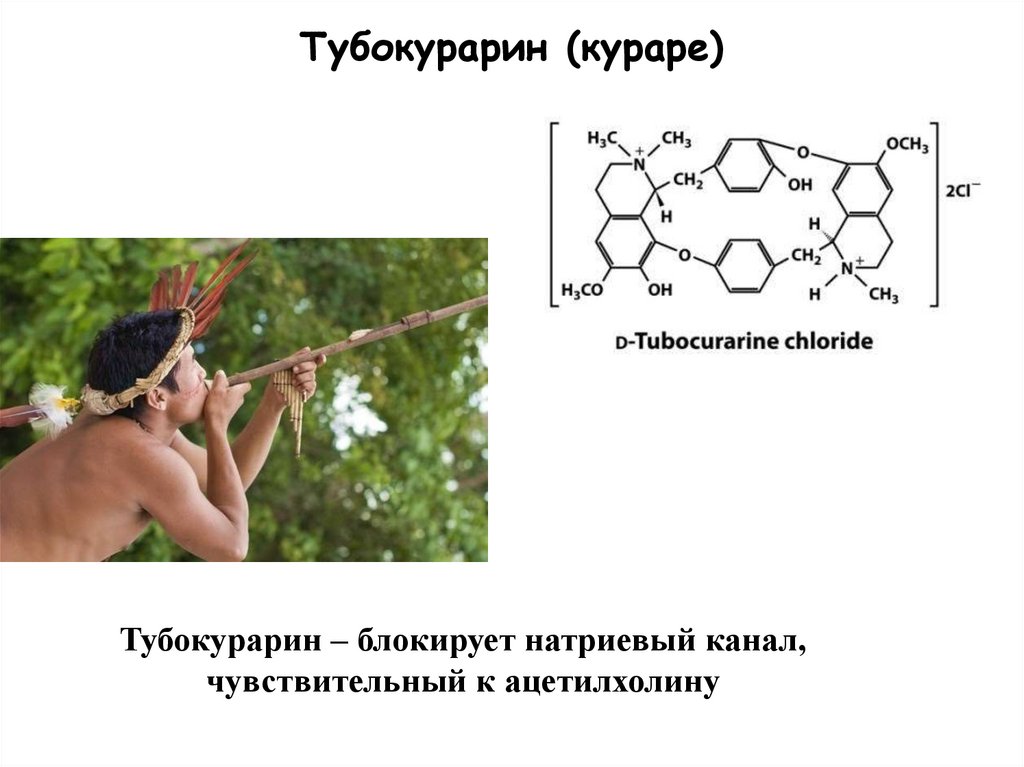
Тубокурарин (кураре)Тубокурарин – блокирует натриевый канал,
чувствительный к ацетилхолину
89.
Дендротоксин из яда черной мамбыДендротоксин – блокатор потенциал-зависимых
калиевых каналов
90.
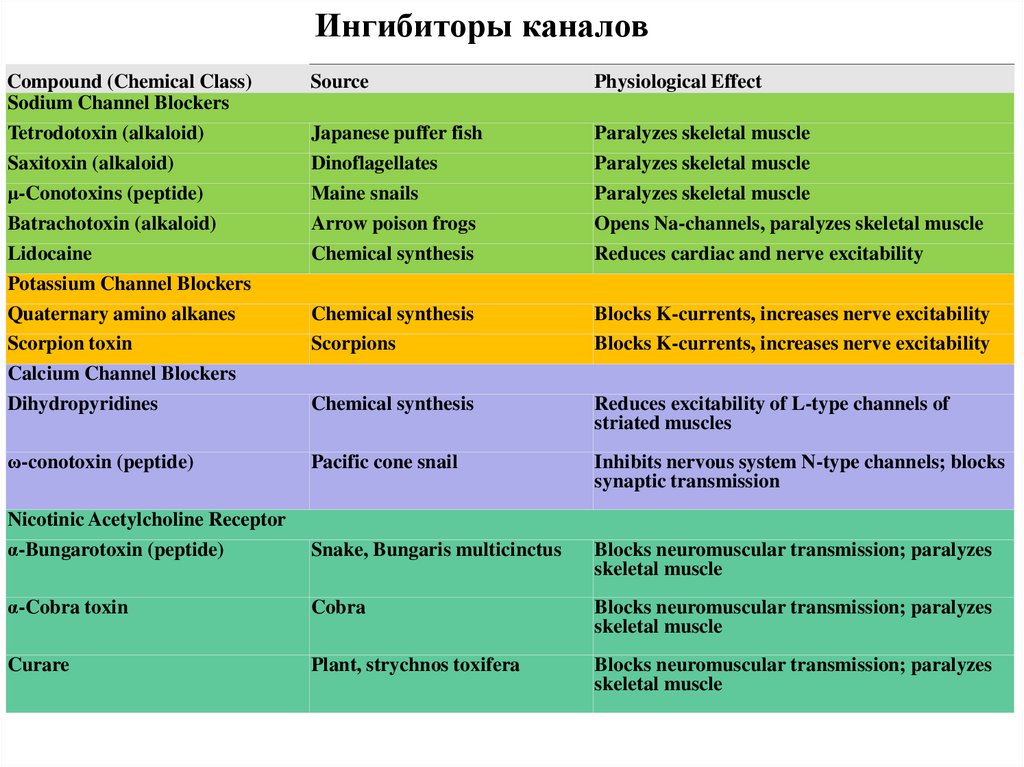
Ингибиторы каналовCompound (Chemical Class)
Sodium Channel Blockers
Source
Physiological Effect
Tetrodotoxin (alkaloid)
Japanese puffer fish
Paralyzes skeletal muscle
Saxitoxin (alkaloid)
Dinoflagellates
Paralyzes skeletal muscle
μ-Conotoxins (peptide)
Batrachotoxin (alkaloid)
Maine snails
Arrow poison frogs
Paralyzes skeletal muscle
Opens Na-channels, paralyzes skeletal muscle
Lidocaine
Chemical synthesis
Reduces cardiac and nerve excitability
Chemical synthesis
Scorpions
Blocks K-currents, increases nerve excitability
Blocks K-currents, increases nerve excitability
Dihydropyridines
Chemical synthesis
Reduces excitability of L-type channels of
striated muscles
ω-conotoxin (peptide)
Pacific cone snail
Inhibits nervous system N-type channels; blocks
synaptic transmission
Nicotinic Acetylcholine Receptor
α-Bungarotoxin (peptide)
Snake, Bungaris multicinctus
Blocks neuromuscular transmission; paralyzes
skeletal muscle
α-Cobra toxin
Cobra
Blocks neuromuscular transmission; paralyzes
skeletal muscle
Curare
Plant, strychnos toxifera
Blocks neuromuscular transmission; paralyzes
skeletal muscle
Potassium Channel Blockers
Quaternary amino alkanes
Scorpion toxin
Calcium Channel Blockers
91.
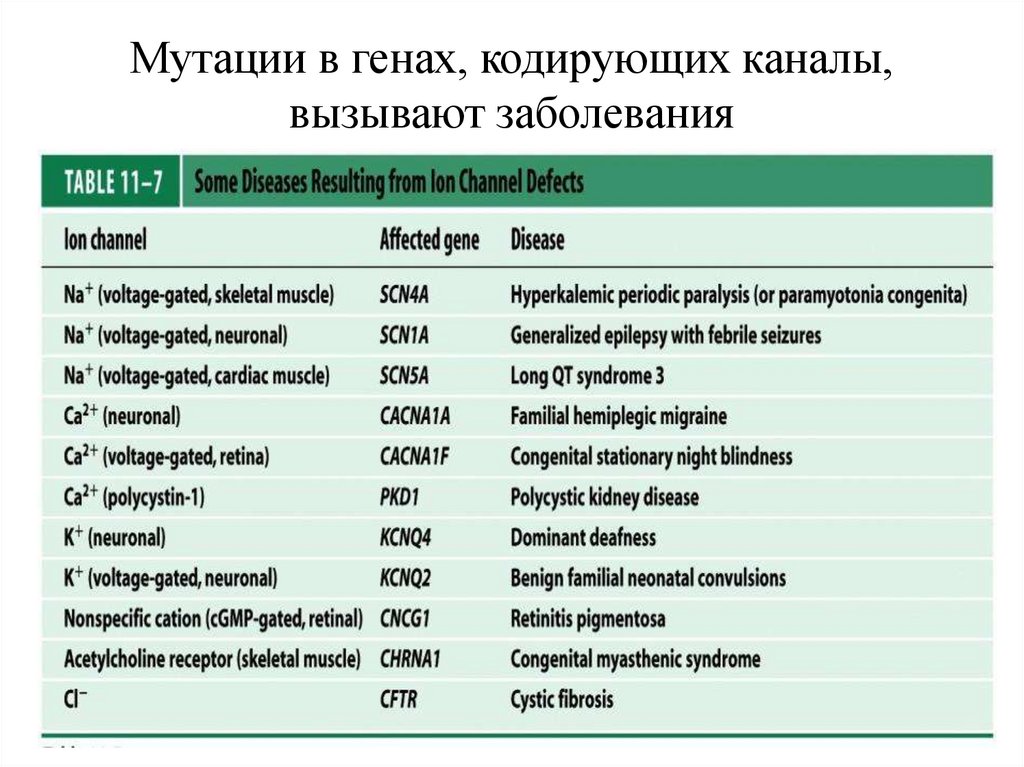
Мутации в генах, кодирующих каналы,вызывают заболевания
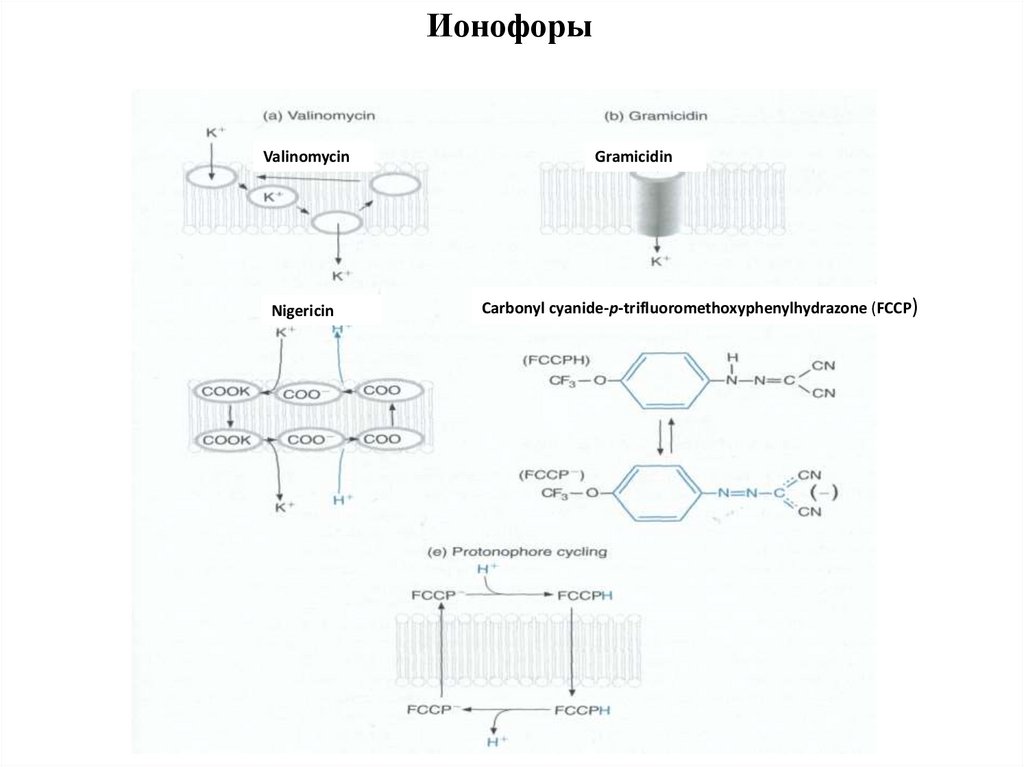
92.
ИонофорыValinomycin
Nigericin
Gramicidin
Carbonyl cyanide-p-trifluoromethoxyphenylhydrazone (FCCP)
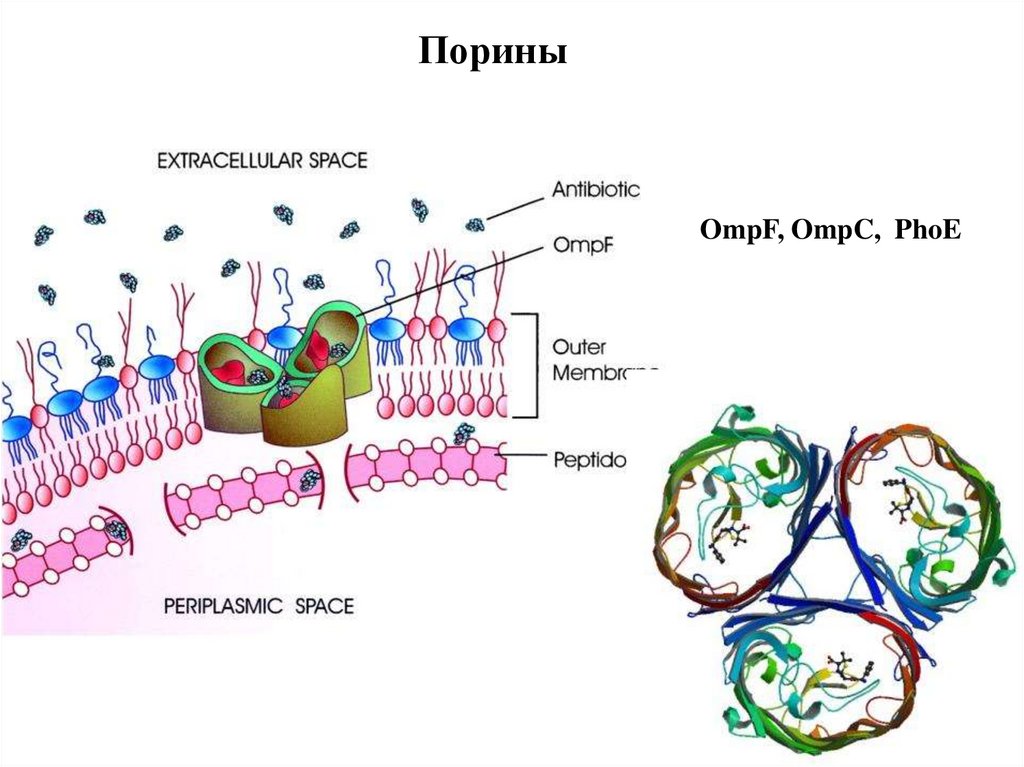
93.
ПориныOmpF, OmpC, PhoE
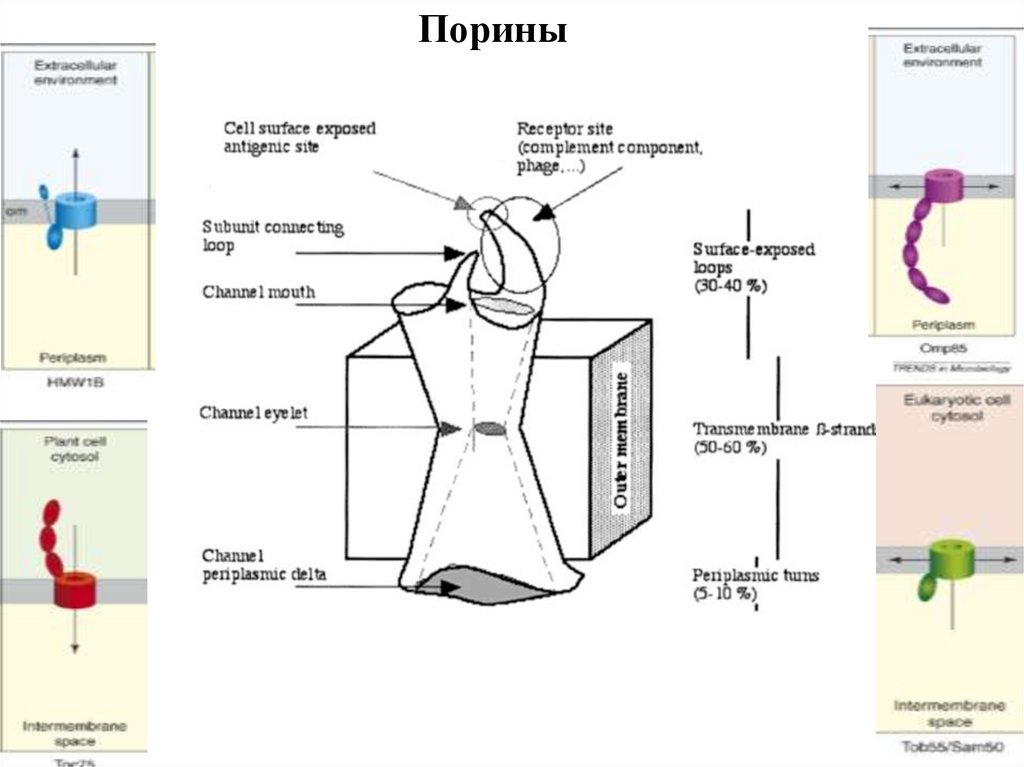
94.
Порины95.
ПориныРorin superfamily I
The mitochondrial and plastid porin (MPP)
Porin Superfamily II (MspA Superfamily)
1.B.24 - The Mycobacterial Porin (MBP) Family
1.B.58 - Nocardial Hetero-oligomeric Cell Wall Channel (NfpA/B) Family
Porin Superfamily III
1.B.28 - The Plastid Outer Envelope Porin of 24 kDa (OEP24) Family
1.B.47 - The Plastid Outer Envelope Porin of 37 kDa (OEP37) Family
Porin Superfamily IV
(Tim17/OEP16/PxMPL (TOP) Superfamily)
This superfamily includes protein that comprise pores in multicomponent protein translocases
as follows:
3.A.8 - [Tim17 Tim22 Tim23; 1.B.69 - PXMP4 PMP24 ; 3.D.9 - NDH 21.3 kDa component
1.B.30 - The Plastid Outer Envelope Porin of 16 kDa (OEP16) Family
1.B.69 - The Peroxysomal Membrane Porin 4 (PxMP4) Family
3.A.8 - The Mitochondrial Protein Translocase (MPT) Family
Porin Superfamily V (Corynebacterial PorA/PorH Superfamily)
1.B.34 - The Corynebacterial Porin A (PorA) Family 1.B.59 - The Outer Membrane Porin,
PorH (PorH) Family
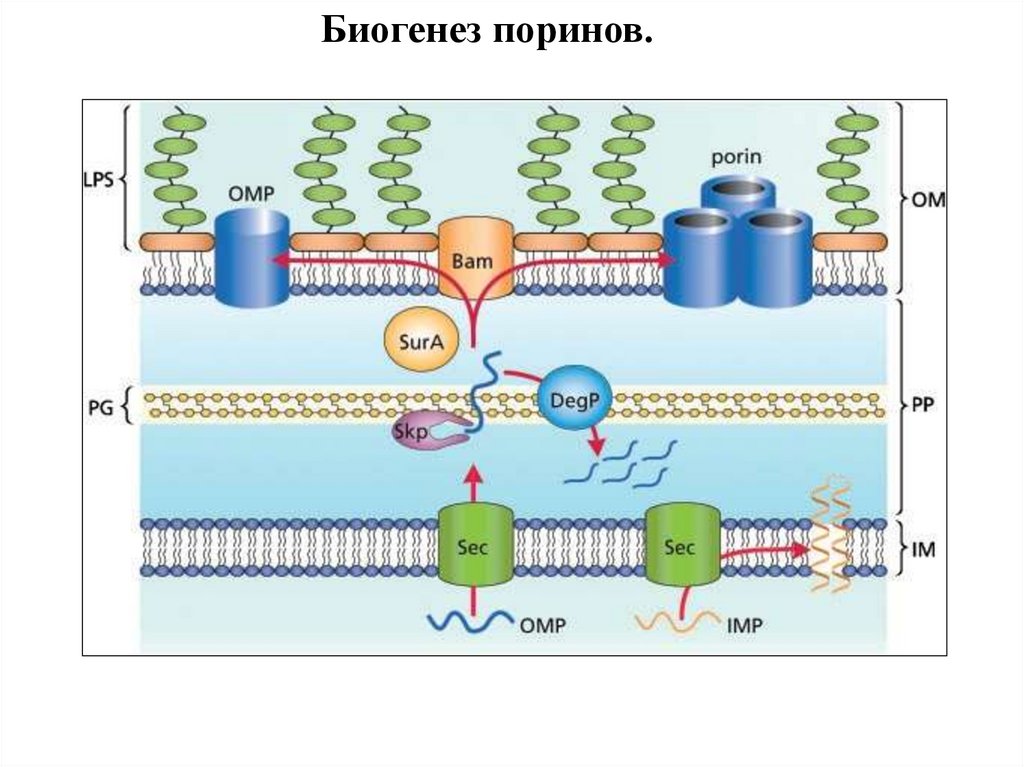
96.
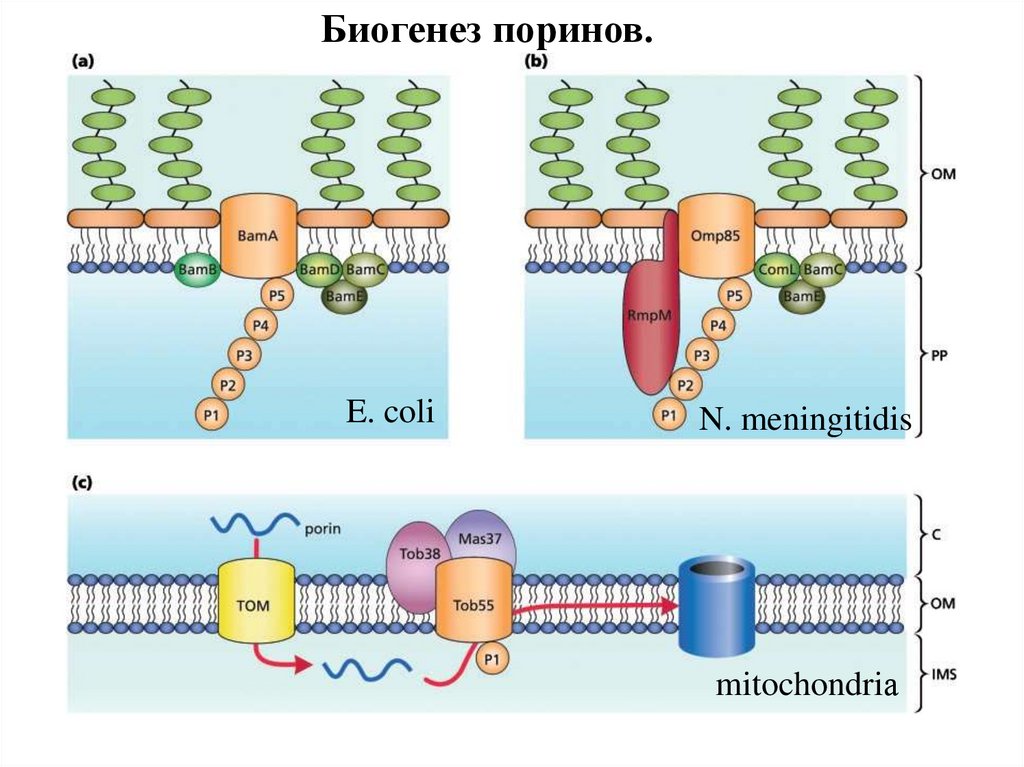
Биогенез поринов.97.
Биогенез поринов.E. coli
N. meningitidis
mitochondriа
98.
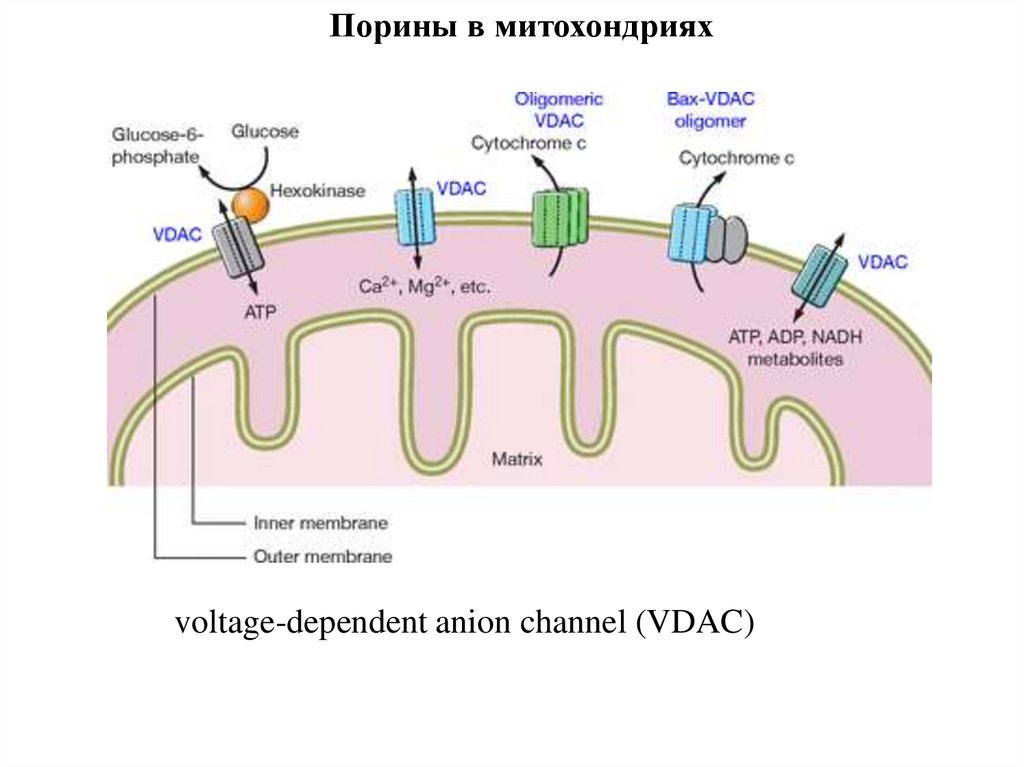
Порины в митохондрияхvoltage-dependent anion channel (VDAC)
99.
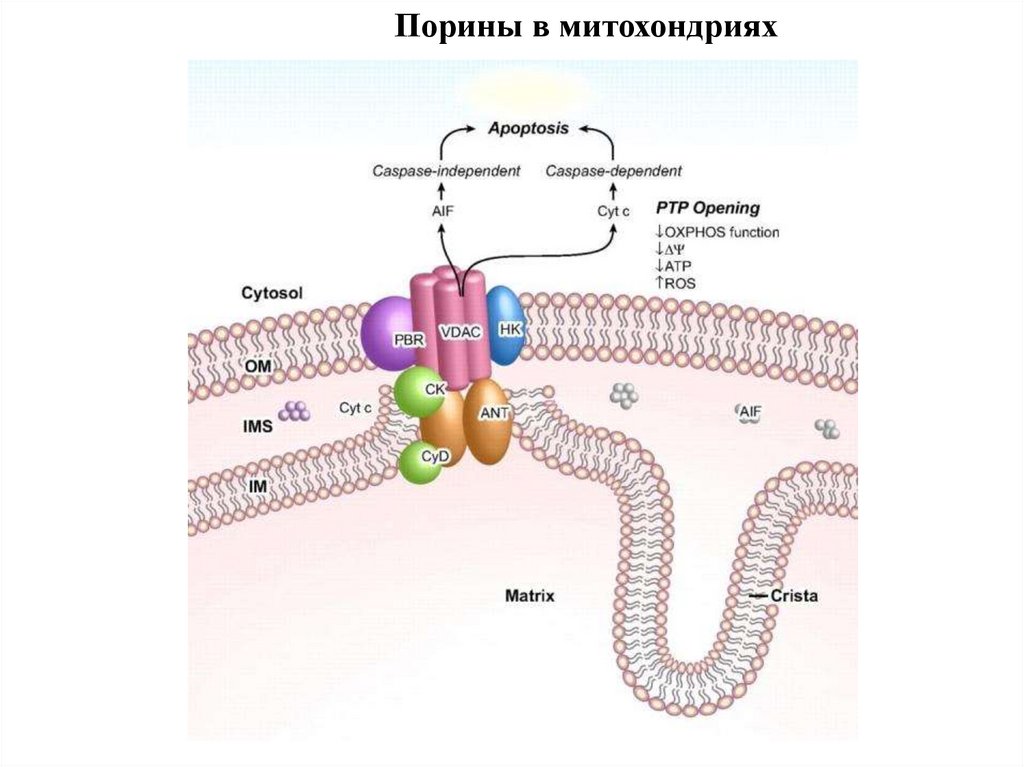
Порины в митохондриях100.
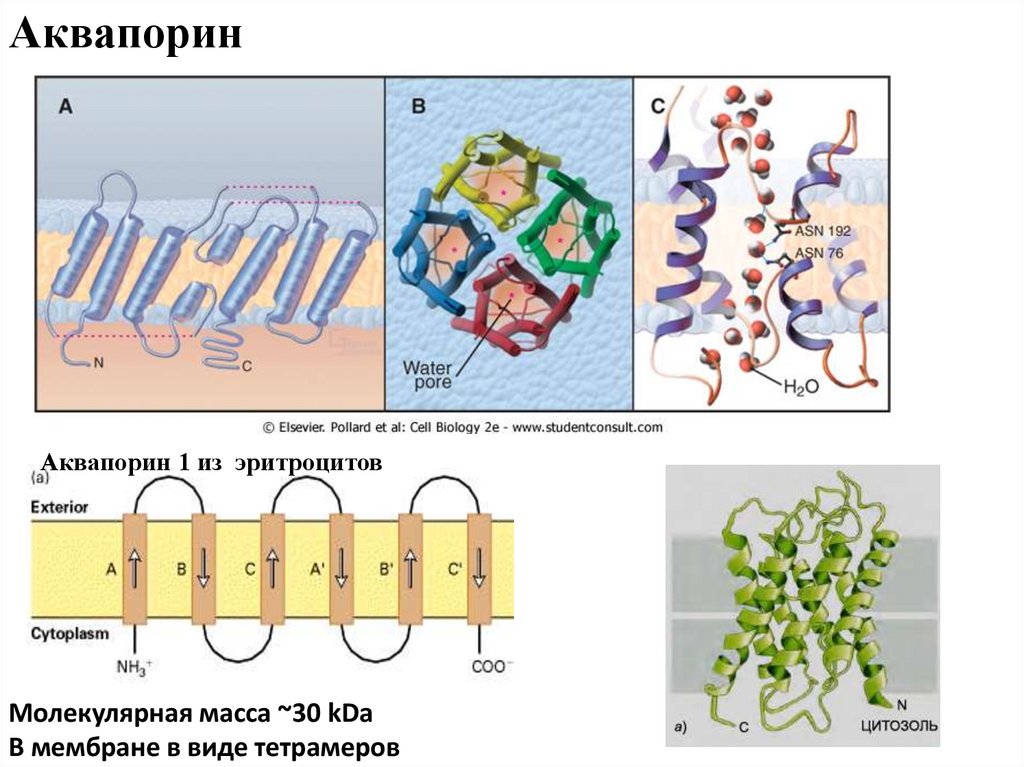
АквапоринАквапорин 1 из эритроцитов
Молекулярная масса ~30 kDa
В мембране в виде тетрамеров











 Биология
Биология