Похожие презентации:
Антуан Лоран Лавуазье 1743–1794 гг. Заложил основу анализа органических соединений
1.
Заложил основу анализаорганических соединений.
Антуан Лоран Лавуазье
1743–1794 гг.
2.
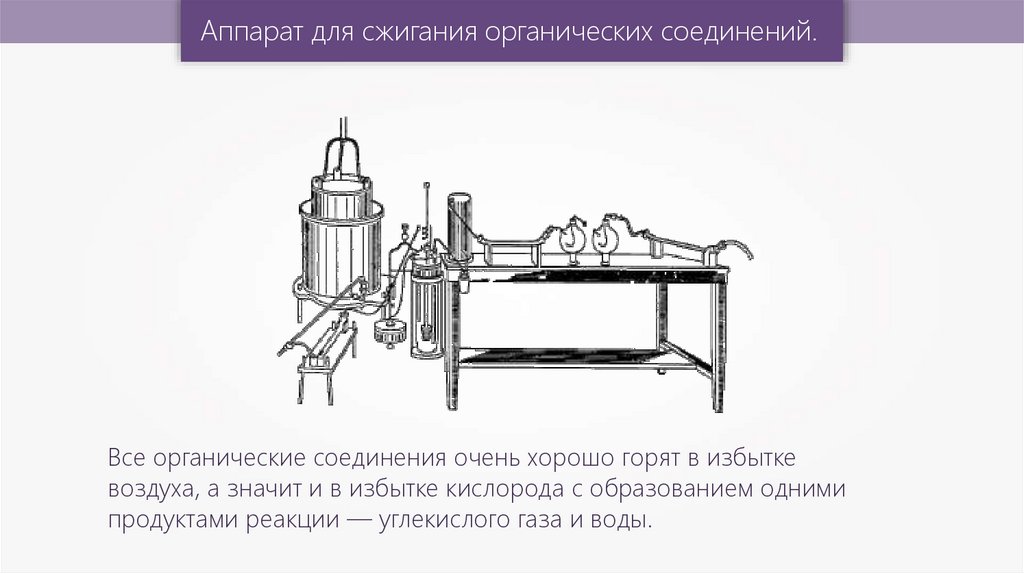
Аппарат для сжигания органических соединений.Все органические соединения очень хорошо горят в избытке
воздуха, а значит и в избытке кислорода с образованием одними
продуктами реакции — углекислого газа и воды.
3.
Жан Дюма1800–1884 гг.
Юстус фон Либих
1803–1873 гг.
4.
Одна из главных проблеморганической химии — определение
порядка расположения атомов
в молекулах.
5.
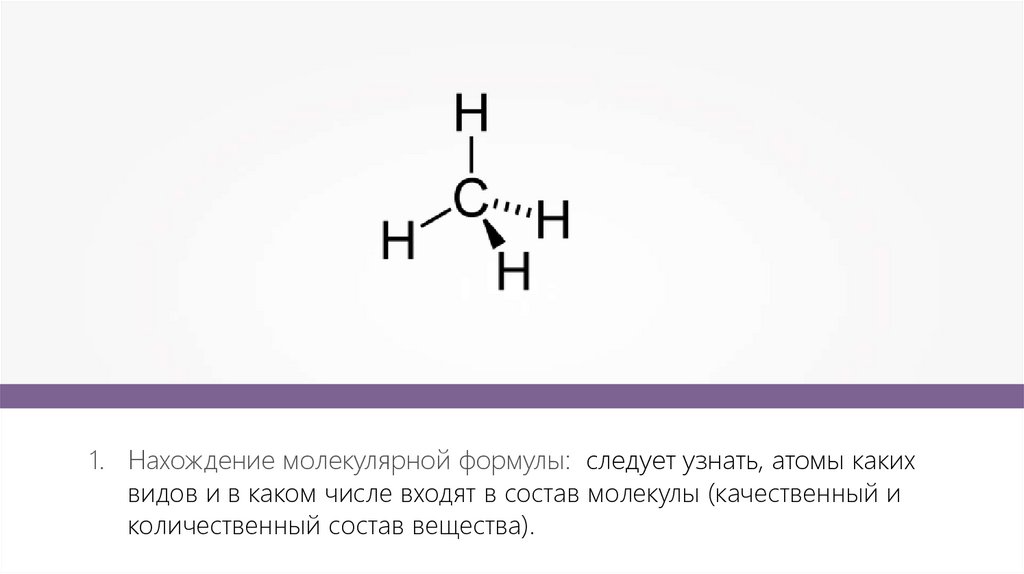
1. Нахождение молекулярной формулы: следует узнать, атомы какихвидов и в каком числе входят в состав молекулы (качественный и
количественный состав вещества).
6.
Качественный элементный анализУглерод и водород в
соединении определяют
сжиганием.
Нагревание углеводорода
в присутствии оксида
меди (II) сопровождается
превращением углерода в
диоксид углерода,
водорода — в воду.
7.
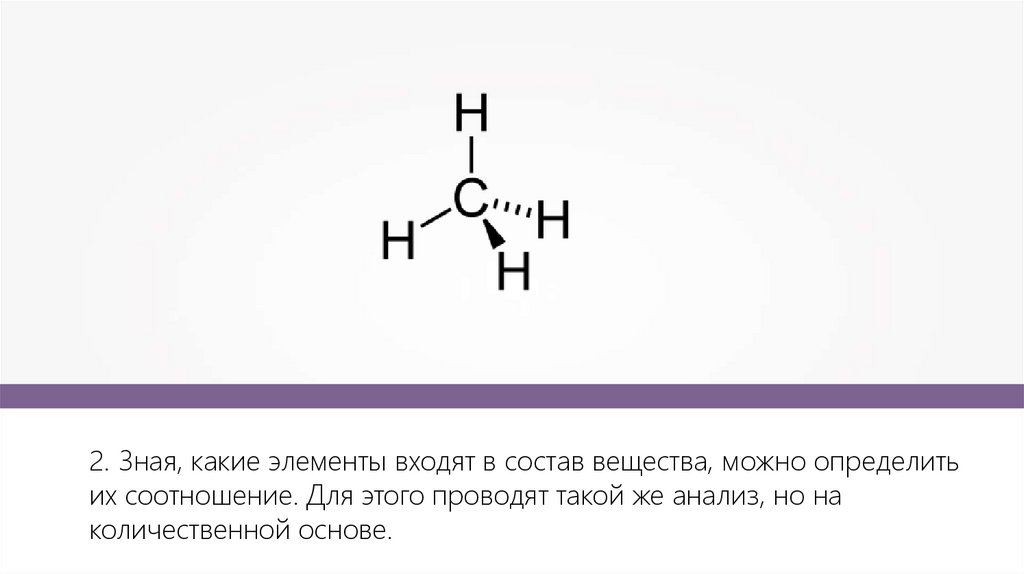
2. Зная, какие элементы входят в состав вещества, можно определитьих соотношение. Для этого проводят такой же анализ, но на
количественной основе.
8.
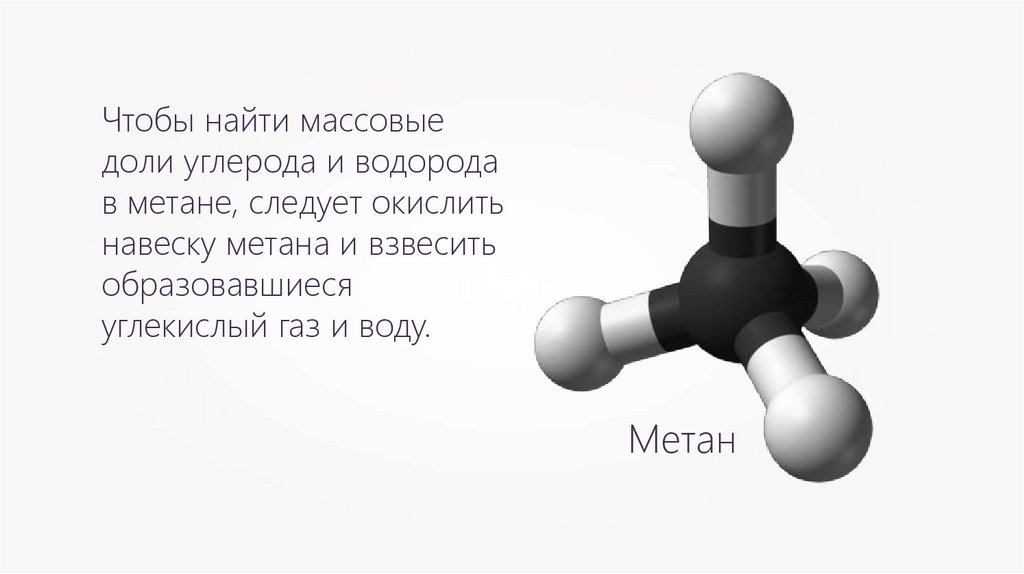
Чтобы найти массовыедоли углерода и водорода
в метане, следует окислить
навеску метана и взвесить
образовавшиеся
углекислый газ и воду.
Метан
9.
Задача: определить какое-либо веществона основе расчётов и анализа данных о его
свойствах.
10.
11.
12.
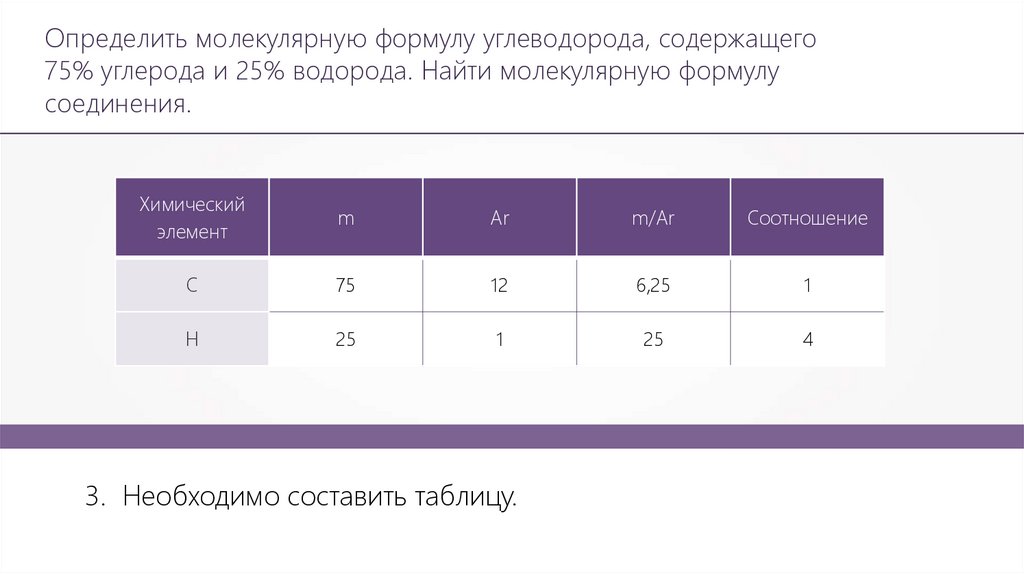
Определить молекулярную формулу углеводорода, содержащего75% углерода и 25% водорода. Найти молекулярную формулу
соединения.
75%+25%=100%
1. Сначала необходимо проверить входит ли в данное соединение
только углерод и водород.
13.
Определить молекулярную формулу углеводорода, содержащего75% углерода и 25% водорода. Найти молекулярную формулу
соединения.
Ведём расчёт на 100 г вещества.
75%+25%=100%
2. Необходимо разобрать более простой способ решения задачи,
который называется табличным.
14.
Определить молекулярную формулу углеводорода, содержащего75% углерода и 25% водорода. Найти молекулярную формулу
соединения.
Химический
элемент
m
Ar
m/Ar
Соотношение
С
75
12
6,25
1
Н
25
1
25
4
3. Необходимо составить таблицу.
15.
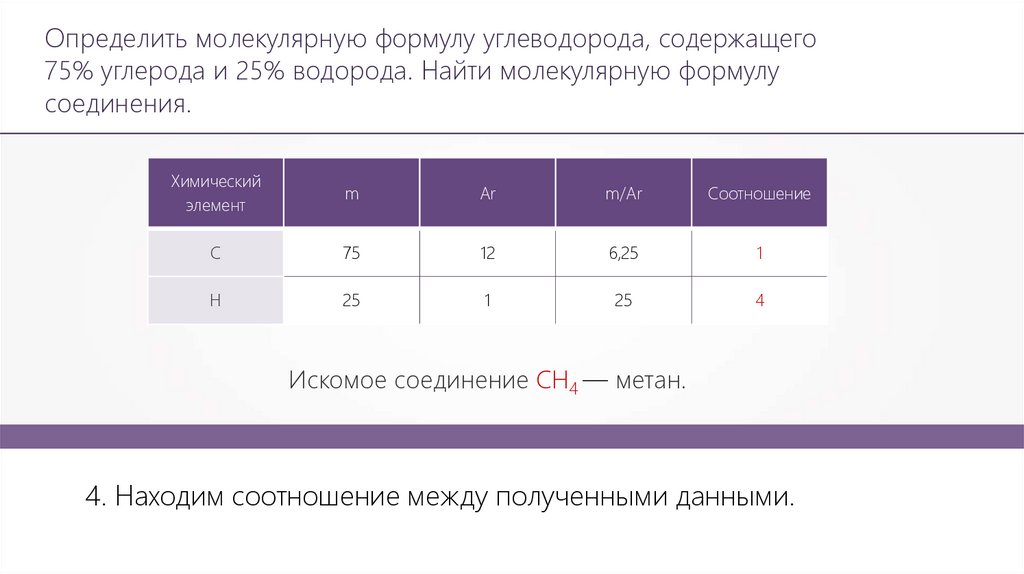
Определить молекулярную формулу углеводорода, содержащего75% углерода и 25% водорода. Найти молекулярную формулу
соединения.
Химический
элемент
m
Ar
m/Ar
Соотношение
С
75
12
6,25
1
Н
25
1
25
4
Искомое соединение СН4 — метан.
4. Находим соотношение между полученными данными.
16.
Масса атома углерода Аr(С) = 12 а.е.м. и водородаАr(Н) = 1 а.е.м. Найти молекулярную формулу соединения.
12х:1у = 75,0:25,0
Соотношение 75,0:25,0
1. Определяем относительные атомные массы
данных химических элементов.
17.
Масса атома углерода Аr(С) = 12 а.е.м. и водородаАr(Н) = 1 а.е.м. Найти молекулярную формулу соединения.
х:у =
= 6,25:25,0
2. Освободимся от коэффициентов при х и у путём деления первых
членов обоих отношений на коэффициент при х и вторых членов на
коэффициент при у.
18.
Масса атома углерода Аr(С) = 12 а.е.м. и водородаАr(Н) = 1 а.е.м. Найти молекулярную формулу соединения.
х:у =
= 1:4
Искомое соединение СН4 — метан.
3. Чтобы выразить отношение х:у целыми числами, разделим оба
члена правого отношения на меньший из них.
19.
Решение задач на вывод органической формулысоединения с помощью продуктов горения
M (вещества) = DH2 • M(H2)
20.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
СxНyОz + O2 → CO2 + H2O
1. Записываем схему реакции сгорания без расстановки
коэффициентов.
21.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
ν (CO2) = V/V m =
ν (H2O) = V/V m =
= 0,7 (моль)
= 0,7 (моль)
2. Находим количество веществ углекислого газа и воды и
определяем, сколько моль атомов углерода и водорода в них
содержится.
22.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
ν (H) = 0,7 • 2 = 1,4 (моль)
23.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
m (C) = 0,7 • 12 = 8,4 (моль)
m (Н) = 1,4 • 1 = 1,4 (моль)
m (всего соединения) = 8,4 + 1,4 = 9,8 (моль)
m (O) = 9,8 – 8,4 – 1,4 = 0 (г)
3. Проверяем наличие в веществе кислорода. Для этого из массы
всего исходного вещества надо вычесть массу углерода и водорода.
24.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
C : H = 0,7 : 1,4 = 1 : 2
То есть соотношение элементов 1:2
25.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
Простейшая формула СН2
4. Поиск простейшей и истинной формулы.
26.
Относительная плотность паров органического соединения по азотуравна 2. При сжигании 9,8 г этого соединения образуется 15,68 г углекислого
газа (н.у.) и 12,6 г воды. Выведите молекулярную формулу органического
соединения.
М = DN2 • M(N2) = 2 • 28 = 56
Истинная формула СН2 = 56 : 14 = 4
Истинная формула С4Н8
5. Истинную молярную массу ищем по относительной плотности газа
по азоту.


















 Химия
Химия








