Похожие презентации:
Скорость химической реакции
1. Скорость химической реакции
Тема:Скорость химической реакции
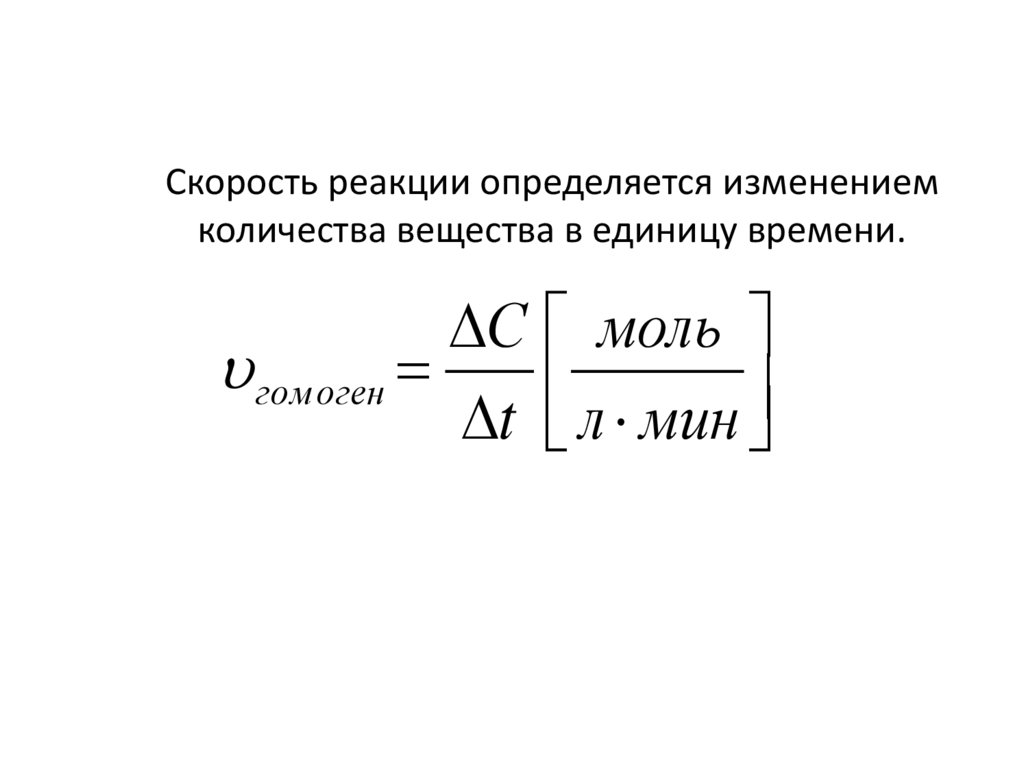
2. Скорость реакции определяется изменением количества вещества в единицу времени.
С мольгом оген
t л мин
3. Задача 1.
Исходные концентрации вещества А – 0,80 моль/л.Через 20 минут концентрация вещества А
снизилась до 0, 74 моль/л.
Определите среднюю скорость реакции за этот
промежуток времени
4.
Дано:С1 (А) = 0,80 моль/л
С2 (А) = 0,74 моль/л
Δ t = 20 мин
Найти:
U гомоген =?
Ответ:
Решение:
ΔC 0,80 0,74
υ гомоген
Δt
20
0,06
моль
0,003
20
л мин
Uгомоген. = 0,003 моль/л∙мин
5. Задача 2.
Исходные концентрации вещества А – 0,30 моль/лЧерез 10 минут концентрация вещества А
снизилась до 0,20 моль/л.
Определите среднюю скорость реакции за этот
промежуток времени.
6.
Скорость химической реакциизависит от температуры
При ↑ t° на каждые 10° С, скорость ↑ в 2-4 раза
(правило Вант-Гоффа)
7.
Задача 3Скорость некоторой реакции при 00С равна 1 моль/л ∙ ч,
температурный коэффициент реакции равен 3. Какой будет
скорость данной реакции при 300С?
Дано:
υ1 = 1 моль/л ∙ ч
Решение:
γ =3
υ2 = υ1 ∙ γ
t1 = 00С
t2 = 300С
Найти:
υ2 -?
Δt
10
30 0
10
υ2 =1∙3
= 1∙33 =1∙27= 27 моль/л∙ч
Ответ: Скорость данной реакции при 300С будет равна 27
моль/л∙ч
8.
Задача 4.Определите, как изменится скорость
некоторой реакции при повышении
температуры от 10° до 50° С. Температурный
коэффициент реакции равен 2, начальная
скорость 3 моль/л ∙ ч.
9.
Скорость химической реакциизависит от концентрации веществ
Чем ↑ С,
тем чаще происходят соударения и υ ↑
Закон действующих масс:
Скорость химической реакции (υх.р.) прямо
пропорциональна произведению концентраций
реагирующих веществ, взятых в степенях их
коэффициентов в уравнении реакции
10.
Для реакции mA + nB = Cпо закону действующих масс:
υ = k ∙ СAm ∙ CBn
где k – константа скорости;
С – концентрация (моль/л)
* З.д.м. не учитывает концентрации реагирующих веществ,
находящихся в твердом состоянии, т.к. они реагируют на поверхности и
их концентрации обычно остаются постоянными.
11.
Задача 6.Реакция идет по уравнению А +2В → С. Во сколько раз и как
изменится скорость реакции, при увеличении концентрации
вещества В в 3 раза?
Дано:
↑СВ в 3 раза
Найти:
Δυх.р. - ?
Решение:
А +2В → С
υ1 = k ∙ СA ∙ CB2
υ2 = k ∙ СA ∙ (3CB)2=9k ∙ СA ∙ CB2
υ 2 9kC C
9
υ1
kC C
2
A B
2
A B
Ответ: скорость реакции увеличится в 9 раз
12.
Задача 7.Как изменится скорость реакции
2А +3В → 5С, если концентрацию вещества А
увеличить в 5 раз?











 Химия
Химия








