Похожие презентации:
Скорость химических реакций
1.
Скоростьхимических реакций.
2.
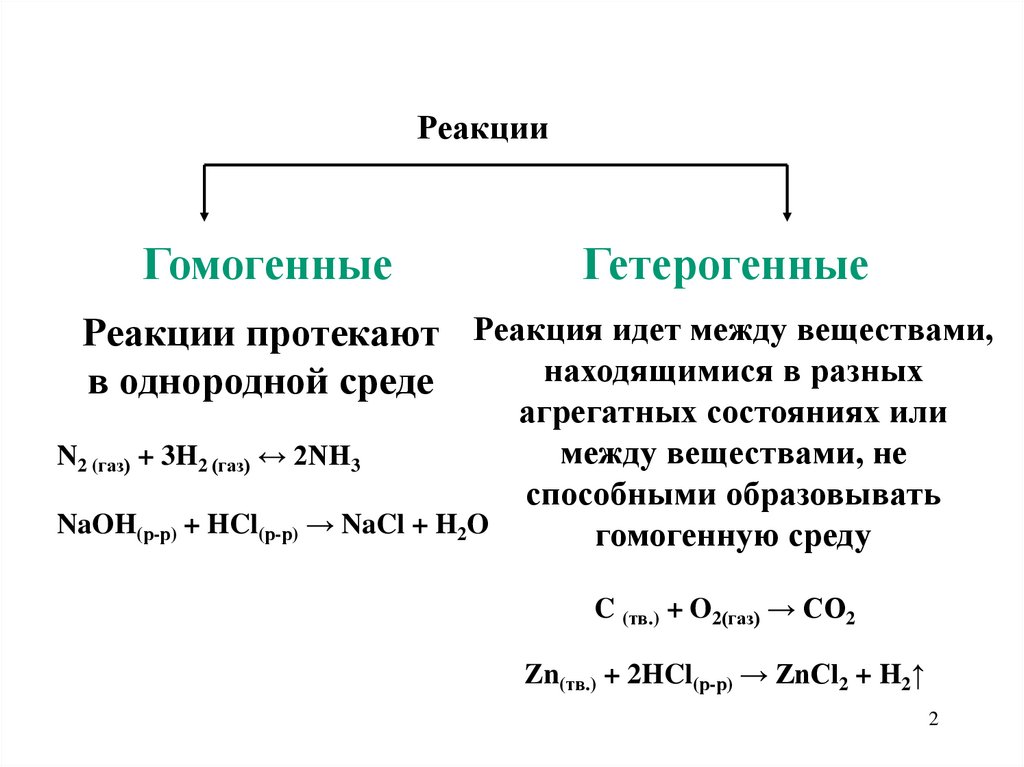
РеакцииГомогенные
Гетерогенные
Реакции протекают Реакция идет между веществами,
находящимися в разных
в однородной среде
агрегатных состояниях или
между веществами, не
N2 (газ) + 3H2 (газ) ↔ 2NH3
способными образовывать
NaOH(р-р) + HCl(р-р) → NaCl + H2O
гомогенную среду
C (тв.) + O2(газ) → CO2
Zn(тв.) + 2HCl(р-р) → ZnCl2 + H2↑
2
3.
Скорость гомогенной реакции (υгомог.) определяетсяизменением количества вещества в единицу
времени в единице объёма
υгомог. = Δ n
ΔC
Δt ∙V
где Δ n – изменение числа молей одного из веществ, (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
ΔC – изменение концентрации
3
4.
Скорость гомогенной реакции (υгомог.) определяетсяизменением концентрации одного из
веществ в единицу времени
υгомог. =
ΔC
моль
[
]
Δt
л·с
4
5.
Скорость гетерогенной реакции (υгетер.) определяетсяизменением количества вещества в единицу времени на
единице поверхности соприкосновения веществ
υгетер. = Δ n
Δt ∙ S
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
5
6.
Энергия активации Еакт - минимальныйизбыток энергии, который должна иметь частица (или
пара частиц), чтобы произошло эффективное соударение
6
7.
Факторы, влияющие на скорость химической реакцииЧем меньше Еакт, тем больше υ;
1. Если Еакт < 40 кДж/моль,
скорость такой реакции очень большая.
FeCl3 + K4[Fe(CN)6] →
Fe4[Fe(CN)6]3
берлинская лазурь
2. Если Еакт > 120 кДж/моль,
скорость таких реакций очень мала
4Fe + 2Н2О + ЗО2 = 2(Fe2O3 • Н2О)
7
8.
ЕслиЕакт имеют промежуточные значения
(40 – 120 кДж/моль),
то скорость таких реакций будет средней.
бромная вода
+ С2Н4 →
8
9.
Якоб Хендрик Вант-Гофф1852 – 1911г.г.
Голландский химик. Один из основателей физической химии
и стереохимии. Предложил классификацию химических
реакций. Установил, что повышении температуры на каждые
100С скорость реакции увеличивается в 2-4 раза.
Температура: при ↑ t на каждые 100 С, υ ↑ в 2-4 раза (правило ВантГоффа)
При ↑ t, ↑ количество активных частиц (с Еакт) и их активных
соударений.
9
10.
Факторы, влияющие на скорость химической реакцииЗадача 1.
Скорость некоторой реакции при 00С равна 1 моль/л ∙ ч,
температурный коэффициент реакции равен 3. Какой будет скорость
данной реакции при 300С?
Дано:
υt1 = 1 моль/л ∙ ч
γ =3
t1 = 00С
t2 = 300С
Решение:
υt2 = υt1 ∙ γ Δt/10
υt2 =1∙330 - 0/10 = 33 = 27 моль/л∙ч
Найти: υt2
Ответ: Скорость данной реакции при 300С будет равна 27 моль/л∙ч
10
11.
Концентрация: чем ↑ С, тем чащепроисходят соударения и υ ↑.
Закон действующих масс (з. д. м.):
Скорость химической реакции (υх.р.) прямо пропорциональна
произведению концентраций реагирующих веществ,
взятых в степенях их коэффициентов в уравнении реакции
Для реакции mA + nB = C по закону действующих масс:
υ = k ∙ СAm ∙ CBn
где k – константа скорости;
С – концентрация (моль/л)
Для газообразных веществ υ х.р. зависит от давления (что
аналогично изменению концентрации реагирующих веществ)
Чем ↑ р, тем ↑ υ
11
12.
Факторы, влияющие на скорость химической реакцииЗадача 2.
Реакция идет по уравнению А +2В → С. Во сколько раз и как
изменится скорость реакции, при увеличении концентрации
вещества В в 3 раза?
Дано:
Решение:
↑СВ в 3 раза
А +2В → С
По з.д.м. υ = k ∙ СA ∙ CB2
Пусть СА = а, СВ = в, тогда
υ1 = k ∙ а ∙ в2
υ2 = k ∙ а ∙ 3в2
υ1/ υ2 = а ∙ в2 / а ∙ 9в2 = 1/9
Найти:
Как измениться
υх.р.
Ответ: скорость реакции увеличится в 9 раз
12
13.
Катализаторы – вещества, которые изменяют механизм реакции,уменьшают Еакт => υ ↑.
▪ Катализаторы остаются неизменными по окончании
реакции
▪ Ферменты – биологические катализаторы, по природе
белки
▪ Ингибиторы – вещества, которые ↓ υ
Для гетерогенных реакций υ зависит:
от состояния поверхности
соприкосновения реагирующих веществ.
1. Железный гвоздь
2. Железные опилки
H2SO4 + Fe = FeSO4 + Cu
13
14.
Домашнее задание:Задача №4
Вычислите, во сколько раз увеличится скорость
реакции при повышении температуры от 30 до 70 ∘
С, если температурный коэффициент скорости равен
2.
Задача № 5
Определите скорость х.р., если концентрация
вещества изменилась за 10 минут с 4 моль/ л до 1,5
моль/л
14













 Химия
Химия








