Похожие презентации:
Фосфорная кислота и ее свойства
1. МБОУ СОШ №78 г. Санкт-Петербург урок ХИМИИ
Учитель:Скоробовенко А.В.
2.
Тема урока:Фосфорная кислота
и ее свойства.
3.
Сегодня на уроке мы должны:Образовательные:
Изучить физические и химические свойства
фосфорной кислоты через проведение химического
эксперимента;
На основе Интернет-ресурсов, специальной
литературы проиллюстрировать применение и
получение фосфорной кислоты.
развивающие:
Пробудить интерес к самостоятельному поиску
информации в Интернете, специальной литературе;
Выразить свое отношение к проблемам
экологии при промышленном получении фосфорной
кислоты и ее применение.
воспитательные:
На основе материала данной темы,
эксперимента умения обучающихся наблюдать,
сравнивать, делать выводы.
4.
Сегодня на уроке мы должны:План:
1. Молекулярная формула фосфорной кислоты.
2. Получение и физические свойства.
3. Химические свойства характерные для всех
кислот и специфические для фосфорной
кислоты.
4. Применение.
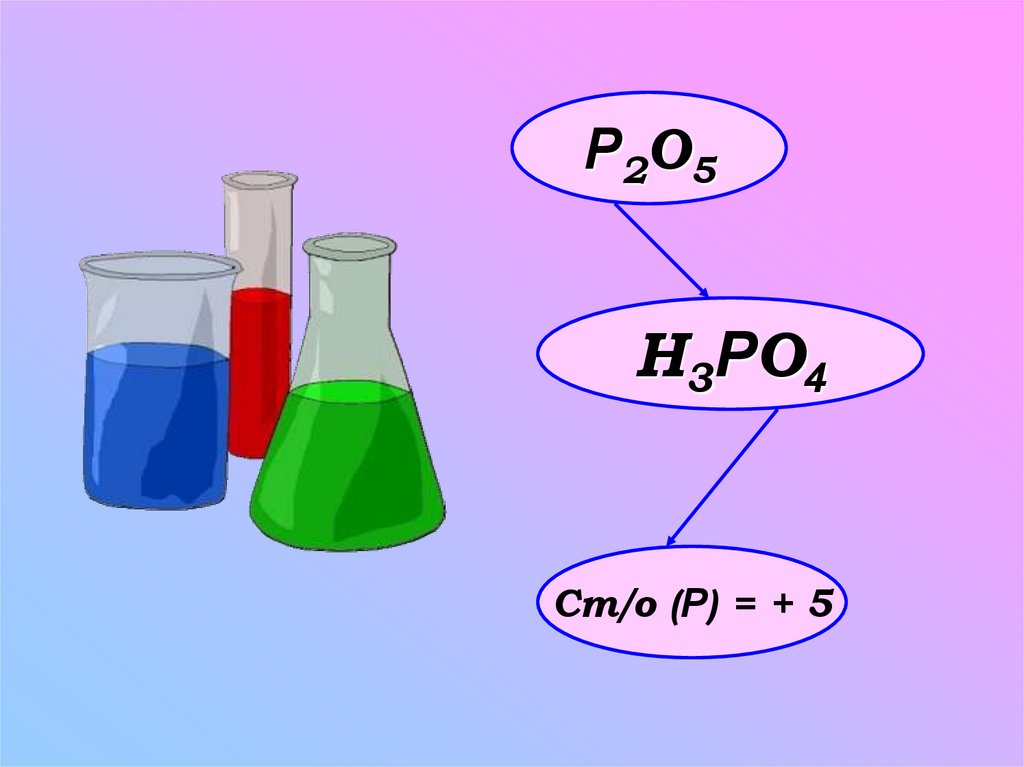
5.
Р2O5H3РO4
Ст/о (Р) = + 5
6.
Молекулярная формула фосфорнойкислоты и физические свойства:
• твердое бесцветное, кристаллическое
вещество, хорошо растворимое в воде в любых
соотношениях;
•Сильная кислота – сильный окислитель (ст/о
= +5)
• Mr(H3РO4) = 98
2H РO4
3
H2O +Н Р O7
4
2
7.
Производство фосфорной кислоты.а) Горение фосфора в ложечке, которую вносят в колбу.
2Р+5О2 = Р2О5
После заполнения колбы дымом частичек оксида
фосфора, приливают немного воды до полного
растворения Р2O5.
Р2O5 +3 Н2О = 2Н3РО4
Для доказательства образования кислоты в колбе,
добавляем несколько капель индикатора – лакмуса или
метилового оранжевого. Р2O5 является кислотным.
б) Взаимодействием природной соли с серной кислоты при
нагревании
Са3(РO4)2 +3 Н2SО4 = 2Н3РО4 + 3 СаSО4
8.
Химические свойства общие сдругими кислотами:
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени:
I) Н3РО4 = Н+ + Н2РО42II) Н2РО4- = Н+ + НРО42III) НРО42- = Н+ + РО4 3-
2. Взаимодействие с металлами, расположенными в вытеснительном ряду до водорода:
3 Nа + Н3РО4 = 3Н2 + Nа3РО4
3. Взаимодействие с оксидами металлов. Оксид фосфора растворяется. Напишите
уравнение реакции.
3 CaO + 2 Н3РО4 = 3 Н2O + Ca 3(РО4 )2
4. Взаимодействие с основаниями и аммиаком.
3 NaOH + Н3РО4 = 3Н2O + Na3РО4
5. Реагирует с солями:
3 Na2CO3 + 2Н3РО4 = 3Н2O + 3 CO2 + 2Na 3РО4
9.
Специфические свойствафосфорной кислоты:
а) При нагревании постепенно превращается в
метафосфорную кислоту
2Н3РО4 = Н4Р2О7 + Н2O
Н4Р2О7 =2НРО3 + Н2O
б) Качественная реакция на фосфорную кислоту нитрат
серебра – появляется желтый осадок
3 AgNO3 + Н3РО4 = 3НNO3 + Ag3РО4
в) Играет большую роль в жизнедеятельности животных и
растений. Входит в состав АТФ
6 при разложении которой
выделяется большое количество энергии
10.
H3РO411.
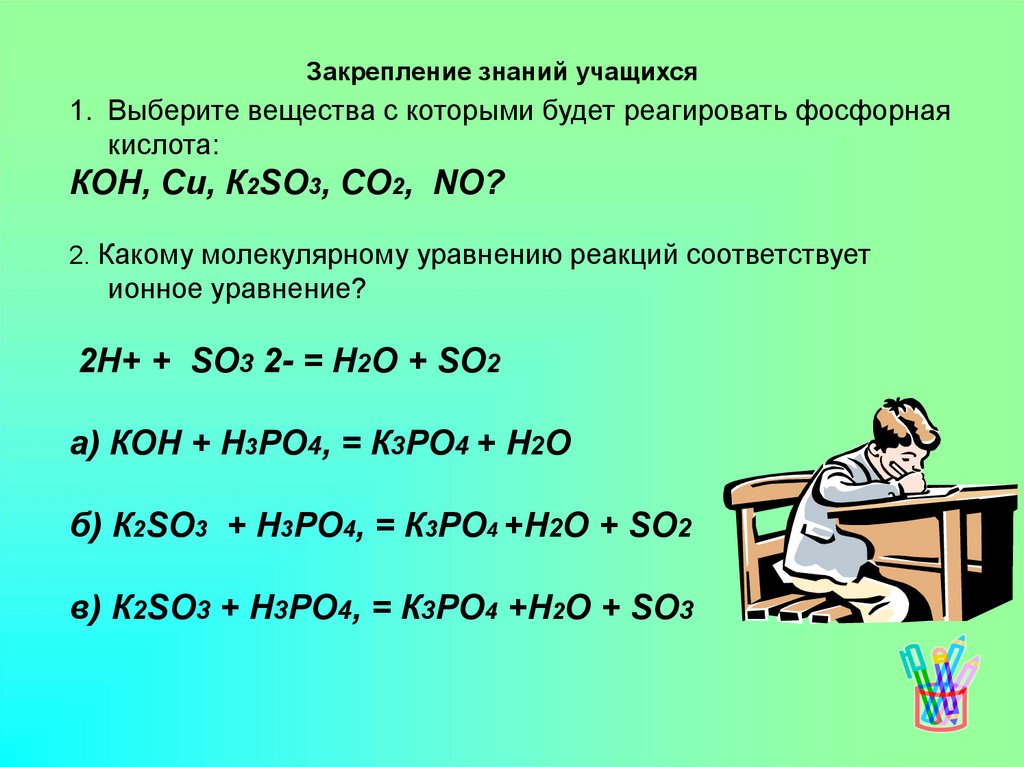
Закрепление знаний учащихся1. Выберите вещества с которыми будет реагировать фосфорная
кислота:
КОН, Си, К2SО3, СО2, NО?
2. Какому молекулярному уравнению реакций соответствует
ионное уравнение?
2Н+ + SО3 2- = Н2О + SО2
а) КОН + Н3РО4, = К3РО4 + Н2О
б) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО2
в) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО3
12.
Сегодня на уроке мы:1. Вспомнили молекулярная формула фосфорной
кислоты.
2. Рассмотрели получение и физические свойства.
3. Химические свойства характерные для всех
кислот и специфические для фосфорной кислоты.
4. Применение.
Урок закончен. Всем
огромное спасибо!
Задание на дом: 28, стр.159 – 163; з. 2,7.









 Химия
Химия








