Похожие презентации:
Химические свойства кислот
1. Химические свойства кислот
2.
Один опыт я ставлю выше, чем тысячумнений, рожденных только
воображением.
М.В.Ломоносов.
3. Цели:
1. обучающая-Исследовать физические и химические свойства
кислот,
-Познакомиться с электрохимическим рядом
напряжения металлов, показать принцип работы с ним.
--Совершенствовать знания о составе и номенклатуре кислот и солей,
-Совершенствовать умение пользоваться инструкцией и лабораторным
оборудованием,
-Наблюдать и фиксировать результаты эксперимента,
-Соблюдать правила техники безопасности.
2. развивающая
-Развивать навыки самостоятельной работы, коммуникативные
компетенции.
3. воспитательная.
-Воспитание аккуратности и последовательности в работе, бережного
отношения к школьному имуществу.
4. Цель урока:
• -Исследовать физические и химические свойства• кислот,
• -Познакомиться с электрохимическим рядом
напряжения металлов, показать принцип работы с ним.
• -Совершенствовать знания о составе и номенклатуре
кислот и солей,
• -Совершенствовать умение пользоваться инструкцией
и лабораторным оборудованием,
• -Наблюдать и фиксировать результаты эксперимента,
• -Соблюдать правила техники безопасности.
5. Задачи:
Закрепить умение наблюдать захимическими реакциями, описывать их и
делать выводы.
Продолжить формирование умений и
навыков по проведению химического
эксперимента.
Формировать умение общаться и работать
в группах.
6. Актуализация
• Дайте определение классу кислот.• Исходя из определения, выведите общую формулу
кислот.
• Кислот достаточно много, а можно ли их
классифицировать.
• На какие группы делятся кислоты по составу
( приведите примеры).
• На какие группы делятся кислоты по оснoвности
(приведите примеры).
• Существует ли общий принцип составления названий
кислот или у каждой кислоты свое индивидуальное
название.
7.
Что нас объединяет?8. Выберите и назовите формулы кислот
• 1) HCI,CO2 ,
NaOH ,
H2SO4
2) NaCI , H3PO4 , HNO3 ,
H2 S
3) СаО ,
H2CO3 , Н2О,
Н2SiO3
4) Al2O3,
H2SO3,
CuSO4
HBr ,
9. Физические свойства
жидкости (кроме кремниевой кислоты)
без цвета
без запаха
кислые на вкус
10. Химические свойства
«Кислоты – едкие вещества,вызывающие сильнейшие ожоги,
разрушают органические вещества» данное высказывание можно часто
услышать о кислотах. Так ли это?
11. Техника безопасности от строгой химички.
Ты в хим. кабинет пришелТак запомни кроха
Безопасность хорошо,
Быть безруким плохо.
Ты над брюками держал
С кислотой пробирку?
Круто, парень, ты попал –
На штанишки с дыркой!
12. Действие индикаторов
H2SO4 + лакмус красный+
ф.ф. бесцветный
+
м.о. красный
13. Электрохимический ряд напряжений
KNa Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Pt
Au
14. Взаимодействие с металлами ( до Н !)
H2SO4 + Zn ZnSO4 + H2H2SO4 + Cu реакция не идет
Кроме HNO3 + Ме
(NO2 , NO , NH3 , N2 )
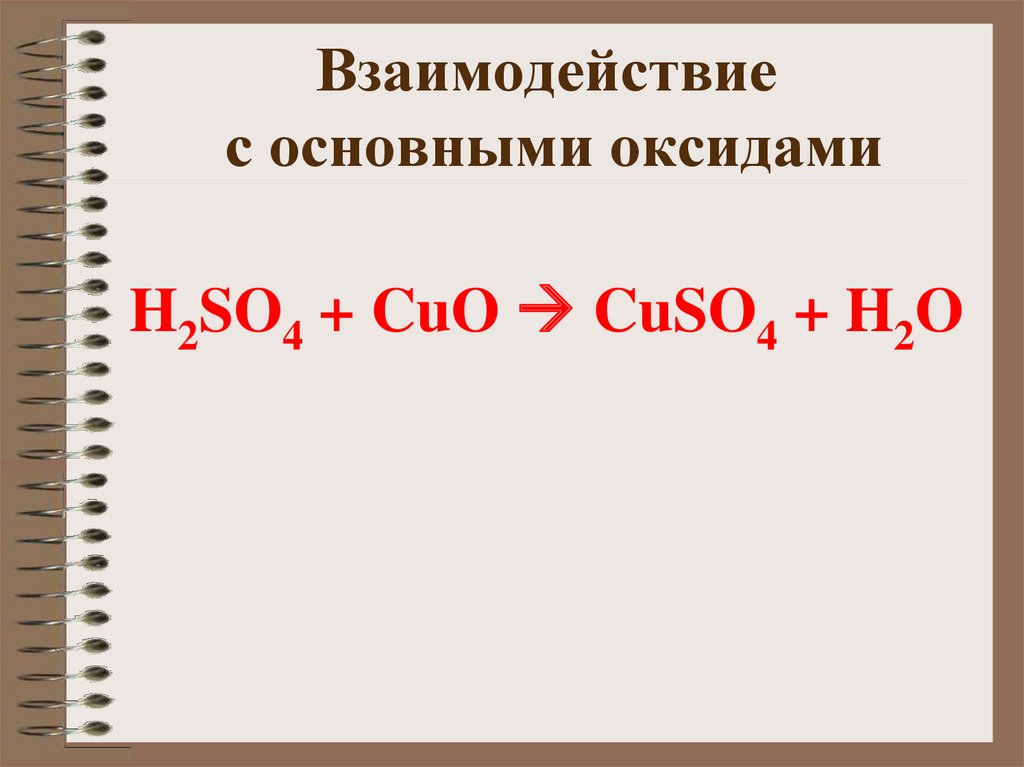
15. Взаимодействие с основными оксидами
H2SO4 + CuO CuSO4 + H2O16. Взаимодействие с растворимыми основаниями (щелочами)
H2SO4 + 2NaOH Na2SO4 + 2H2O17. Взаимодействие с нерастворимыми основаниями
H2SO4 + Cu(OH)2 CuSO4 + 2H2Осиний
18. Взаимодействие с солями
H2SO4 + ВаCL2 BaSO4 + 2 HCLбелый
19.
лакмус – красныйК
И
С
Л
О
Т
А
+
Индикатор метилоранж – красный
+
Основание
соль + Н2О
+
МехОу
соль + Н2О
+
Ме
фенолфталеин - бесцветный
соль + Н2
HNO3+Me H
/ 2 (NO2 , NO , NH3 , N2 )
20. Ответы на тестирование
1. В
2. В
3. В
4. В
5. -6. А
7. В
21.
• 5. Допишите возможные уравненияреакций:
• 6HCl + 2Al = 2AlCl3 + 3H2
• H2SO4 + Hg = реакция не идет
• 3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
• 3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 3H2O
• KOH + HNO3 = KNO3 + H2O
• Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
22. дополнительное задание
• С какими из перечисленных веществвступает в реакцию хлороводородная
(соляная) кислота: Na2О, Сu, SO3, Zn?
Составьте уравнения возможных
реакций.
23.
• 1. Определяем принадлежность заданных в условий веществ ксоответствующим классам и тут же проверяем, реагируют ли они
с кислотами. Получается:
•
Na2О — основный оксид — реагирует (получается соль и
вода);
•
Си — металл, находящийся в ряду активности после
водорода, — не реагирует;
•
SOз — кислотный оксид — не реагирует;
•
Zn — металл, находящийся в ряду активности до водорода,
— реагирует (получается соль и водород).
• 2. Чтобы составить уравнения реакций, определим валентность
метал-лов (натрий — I, цинк — II) и составим формулы солей
учитывая, что валентность кислотного остатка Сl составляет I.
Осталось записать уравнения реакций:
• Na2О + 2НСl = 2NaCl + Н2О;
• Zn + 2НСl= ZnCl2 + H2.

























 Химия
Химия








