Похожие презентации:
Водороды
1.
Эпиграф«Доводы, до которых человек
додумывается сам, обычно
убеждают его больше, нежели
те, которые пришли в голову
другим».
(Б. Паскаль)
2.
Вы со мною уже встречались Я космический скиталец,Элементов прародитель
И отважный предводитель.
Я любитель кислорода,
Вместе с ним даю я воду.
Водород
3.
1группа
Что вы знаете об атоме водорода?
2
группа
Что вы знаете о веществе водороде?
4.
Атом- схема
строения атома
- электронная формула: 1s1
-степень окисления:
+1 в соединениях с
неметаллами,
-1 в соединениях с
металлами
Вещество
простое вещество,
самый легкий газ,
легче воздуха,
без цвета,
без запаха,
ковалентная неполярная
химическая связь,
молекула водорода состоит
из 2 атомов
5.
Физические свойстваХимические свойства
Получение
Применение
Открытие
Название
6.
Открытие водородаКем?
Когда?
Как?
Кем?
Название водорода
Когда?
Как?
7.
Открытие водородаКем?
Английским
физиком и
химиком
Г. Кавендишем
Кем?
Французским
химиком
А. Лавуазье
Когда?
В 1766 году
Название водорода
Когда?
1784 году
Как?
Действием серной
и соляной кислот
на цинк, железо и
олово
Как?
Рождающий воду
8.
Почемуводород
записывают две резко
противоположные группы
химических элементов?
9.
Подобно атомам щелочныхметаллов атом водорода
содержит на единственном
энергетическом уровне один
электрон, поэтому легко
отдает его и проявляет
восстановительные свойства,
получая при этом степень
окисления +1.
Подобно атомам галогенов,
атому водорода до
завершения внешнего
энергетического уровня не
хватает одного электрона,
поэтому водород способен
проявлять окислительные
свойства в реакциях с
металлами, получая степень
окисления -1.
10.
Как Г. Кавендиш получилводород?
11.
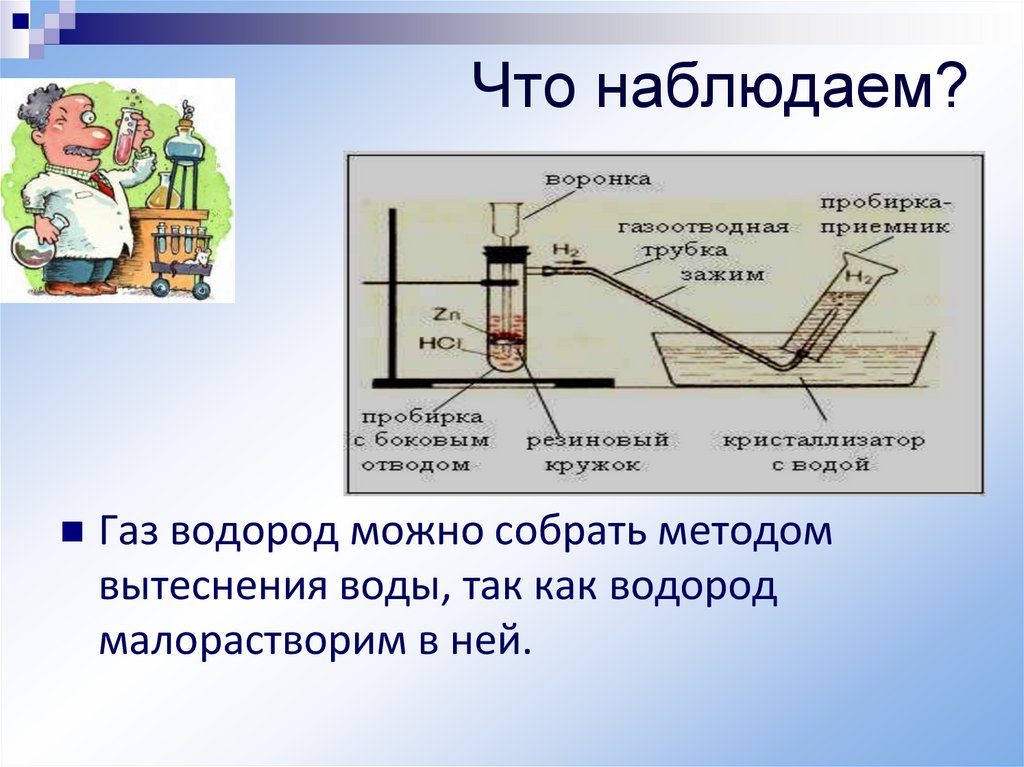
Действием кислот на металлы.12.
Что наблюдаем?Газ водород можно собрать методом
вытеснения воды, так как водород
малорастворим в ней.
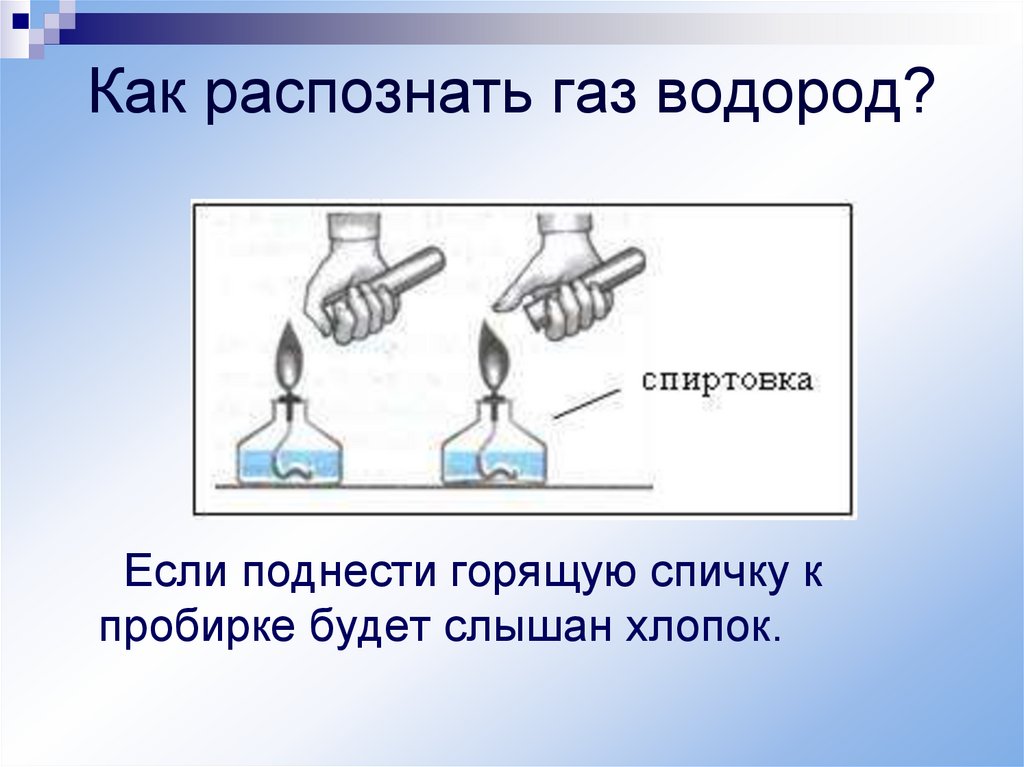
13.
Как распознать газ водород?Если поднести горящую спичку к
пробирке будет слышан хлопок.
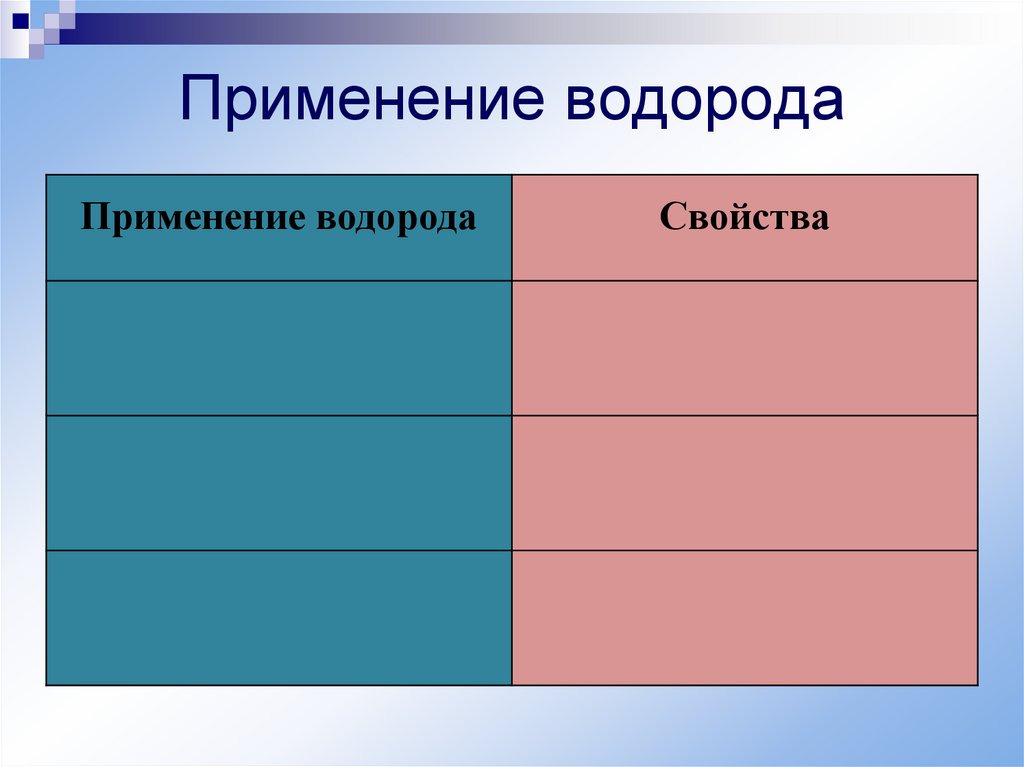
14.
Применение водородаПрименение водорода
Свойства
15.
Применение водородаСвойства
Производство металлов
CuO + H2 = Cu + H2O
Газовая горелка
2H2 + O2 = 2H2O
Получение различных
Cl2 + H2 = 2HCl
веществ
2Na + H2 = 2NaH
16.
Провести эксперимент исоставить уравнение реакции
взаимодействия металла (1
группа-медь, 2 группаалюминий, 3 группа-железо) с
соляной кислотой.
17.
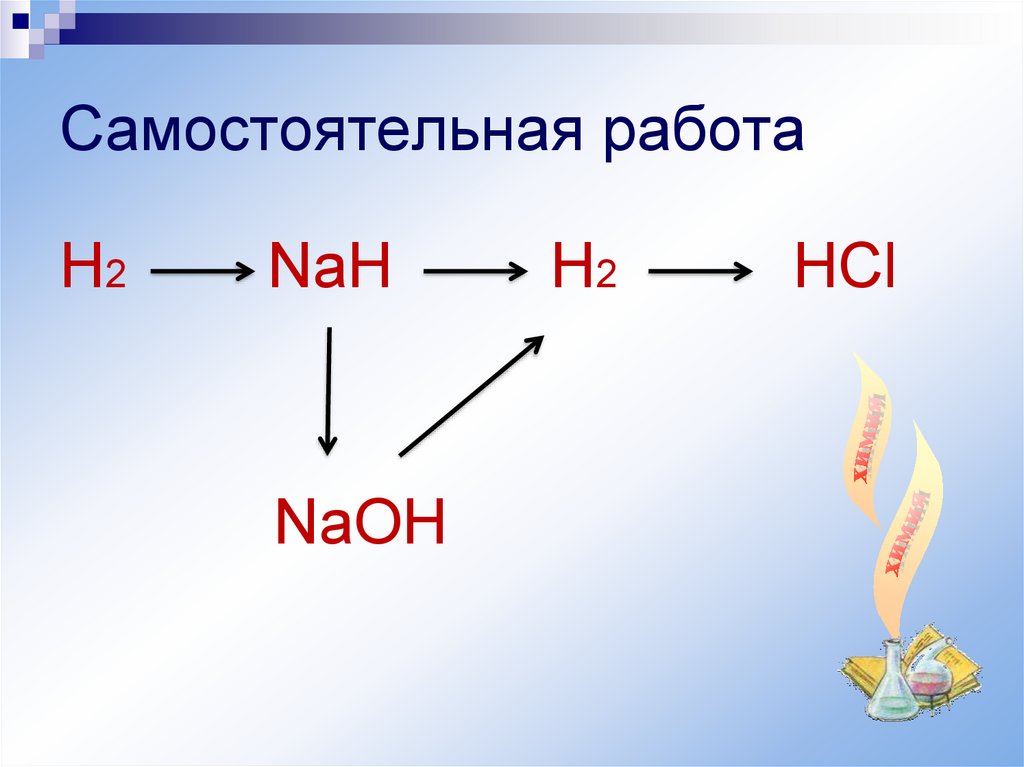
Самостоятельная работаН2
NaH
NaOH
H2
HCl
18.
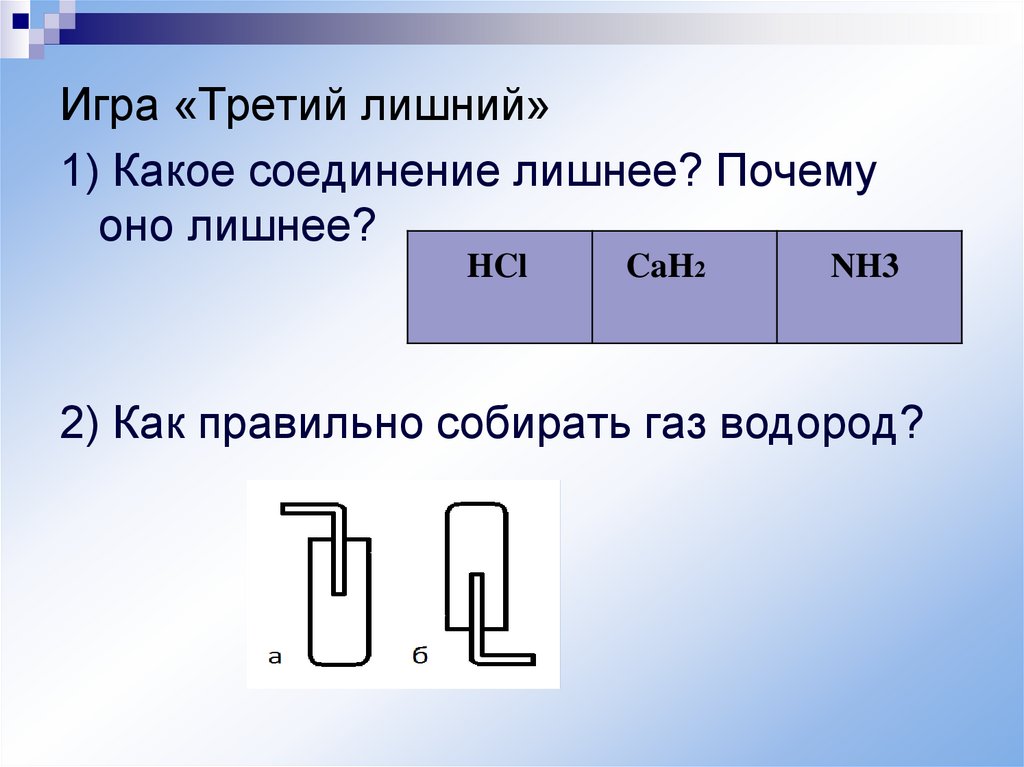
Игра «Третий лишний»1) Какое соединение лишнее? Почему
оно лишнее?
HCl
CaH2
NH3
2) Как правильно собирать газ водород?
19.
1) Лишний CaH2 потому что этогидрид, где водород обладает
окислительными свойствами имея
степень окисления -1, HCl и NH3 - это
летучие водородные соединения, где
водород обладает восстановительными
свойствами имея степень окисления +1.
2) Водород собирают в перевернутую
пробирку вверх дном, так как он легче
воздуха (рисунок б)
20.
Вспомните, какую цель мы поставили вначале урока?
Для этого давайте вернемся к эпиграфу
Как вы считаете, достигли ли мы
целей?
21.
«Шесть шляп мышления»выражение своих чувств без объяснения и причин
их возникновения
перечень фактов
выявление недостатков и их обоснование
позитивное мышление, что было хорошего и
почему
творческий позитив
философский вывод
22.
Алгоритм создания синквейнаназвание темы (одно существительное)
- описание темы (2 прилагательных)
- описание действия (2 глагола,
деепричастие)
- отношение к теме (4 слова)
- суть темы (два слова)
23.
СинквейнВодород
Легкий, гремучий
Восстанавливает, окисляет, помогает
Необходим для образования воды
Основа жизни!
24.
Домашнее заданиеОбязательное задание: учебник по
химии 9 класс О.С. Габриелян, п.17
«Водород», выполнить задания 1, 3 на
стр. 103.
Дополнительное творческое задание:
дать развернутый ответ на вопрос,
почему водород называют «Гремучий
газ», используя образовательные
ресурсы:
http://school-collection.edu.ru/
http://wikischool-ru.livejournal.com/


















 Химия
Химия








