Похожие презентации:
Водород
1.
водородI. История открытия водорода
II. Водород – химический элемент:
1. Положение водорода в ПСХЭ Д.И. Менделеева
2. Строение атома
3. Нахождение в природе
III. Водород – простое вещество:
1. Состав. Строение. Свойства
2. Получение водорода
3. Химические свойства
4. Применение водорода
IV. Соединения водорода
V. Тест
2.
История открытия водородаКавендиш Генри (1731 – 1810)
Английский физик и химик. Много
времени
Кавендиш
посвятил
исследованию газов – «видов
искусственного воздуха», как их
тогда
называли.
Действием
серной и соляной кислот на
железо, цинк и олово ученый
получил
«горючий»
или
воспламеняемый
воздух»
водород. Взвешивая колбу с
кислотой и металлом до и после
реакции и точно измеряя объем
выделившегося газа, Кавендиш
определил плотность водорода.
3.
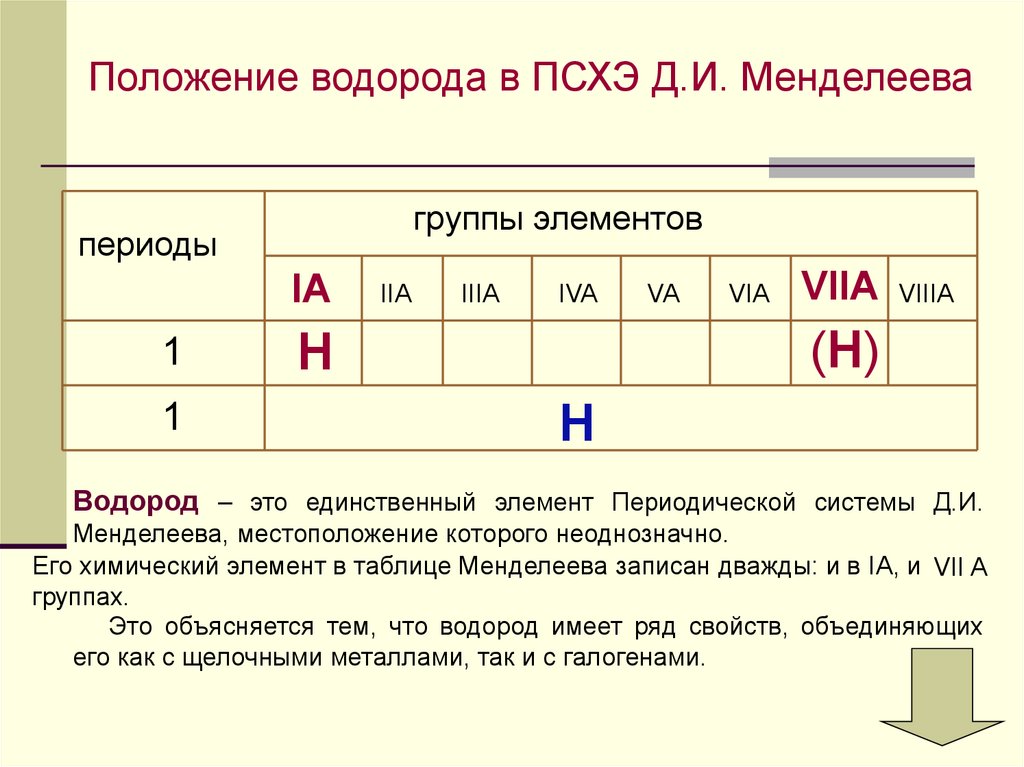
Положение водорода в ПСХЭ Д.И. Менделеевагруппы элементов
периоды
IA
1
1
IIA
IIIA
IVA
VA
VIA
VIIA
VIIIA
(H)
H
H
Водород – это единственный элемент Периодической системы Д.И.
Менделеева, местоположение которого неоднозначно.
Его химический элемент в таблице Менделеева записан дважды: и в IА, и VII A
группаx.
Это объясняется тем, что водород имеет ряд свойств, объединяющих
его как с щелочными металлами, так и с галогенами.
4.
Сравнение свойств водородасо свойствами щелочных металлов, галогенов
Сходство с щелочными металлами
На внешнем и единственном энергетическом уровне атомы водорода содержат один электрон.
Водород относится к s-элементам.
Водород, как и щелочные металлы в
соединениях с неметаллами имеет
степень окисления +1 (H+Cl)
Сходство с галогенами
До завершения внешнего и единственного уровня атомам водорода, как и
атомам галогенов, недостает одного
электрона.
Водород, как и галогены, в соединениях с щелочными и щелочноземельными металлами имеет степень окисления ─1 (NaH−)
Подобно фтору и хлору, водород при
обычных условиях является газом.
Его молекулы, как и молекулы галогенов, двухатомны и образованы за счет
ковалентной неполярной связи.
Водород, как и щелочные металлы
является сильным восстановителем.
Проявляет, как и галогены, окислительные свойства в реакциях с щелочными
и щелочноземельными металлами,
образуя при этом твердые соединениягидриды (NaH, CaH2), подобные галогенидам.
5.
Строение атомапериод
Каждый
энергетический
уровень
делится
Число валентных
электронов
равно
s-орбиталь
Заряд
Число
ядра
энергетических
имеет
атома
форму
численно
уровней
шара,равен
s-орбиталь,
равно
на
энергетические
подуровни,
которые
номеру
группы.
находящуюся
порядковому
номеру
периода
на
номеру
первом
элемента
энергетическом
в ПСХЭ
образованы
орбиталями,
имеющими
уровне
обозначают
одинаковую
форму1s.
и равную энергию
На первом уровне (n =1) есть только
1s-подуровень (одна 1s-орбиталь)
группа
1
1A
1 H
1
водород
+
1,00797
Изотопы водорода
Н
1
2
1
1
протий
D
дейтерий
3
1
T
тритий
)
1s1
6.
Нахождение в природеВо Вселенной водород является самым распространенным элементом
– на его долю приходится 75% массы Вселенной
Водород входит в состав гидросферы.
Водород образует наряду с углеродом, все органические вещества,
т.е. входит в состав биосферы.
В земной коре – литосфере – массовое содержание водорода составляет всего лишь 0,88%, т.е. он занимает 9-место среди всех элементов.
Воздушная оболочка Земли – атмосфера содержит менее миллионной
части общего объема, приходящейся на долю молекулярного
водорода.Он встречается только в верхних слоях атмосферы.
7.
Состав. Строение. Свойства.Н2
Н
Н Н
+
Химическая связь ковалентная неполярная
молекулярная
Кристаллическая решетка
Н─Н
Заполните таблицу:
агрегатное состояние при н.у. газ (самый легкий газ, плотность = 0,09 г/мл)
при t = ─253°С:
жидкость
запах:
без запаха
вкус:
без вкуса
цвет
без цвета
растворимость в воде:
плохо растворим в воде (2 V Н2 на 100 V H2O)
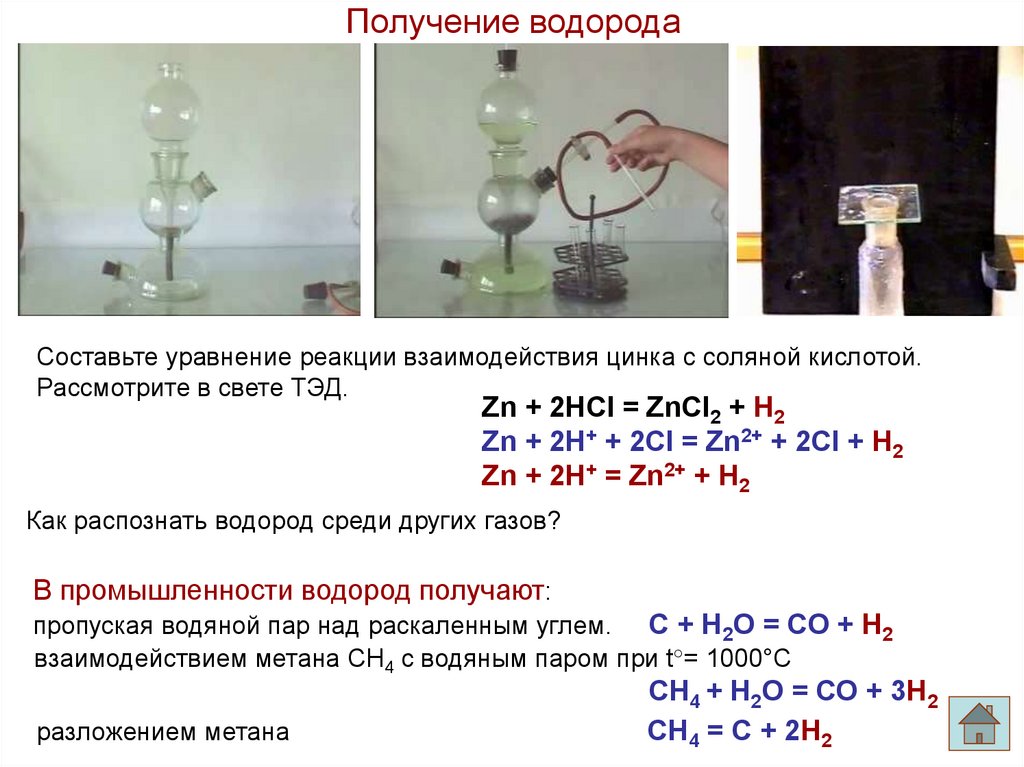
8.
Получение водородаСоставьте уравнение реакции взаимодействия цинка с соляной кислотой.
Рассмотрите в свете ТЭД.
Zn + 2HCl = ZnCl2 + H2
Zn + 2H+ + 2Cl = Zn2+ + 2Cl + H2
Zn + 2H+ = Zn2+ + H2
Как распознать водород среди других газов?
В промышленности водород получают:
пропуская водяной пар над раскаленным углем. С + Н2О = СО + Н2
взаимодействием метана СН4 с водяным паром при t°= 1000°С
разложением метана
СН4 + Н2О = СО + 3Н2
СН4 = С + 2Н2
9.
Химические свойства водорода1. Взаимодействие с неметаллами
2. Взаимодействие с металлами
3. Взаимодействие с оксидами металлов
10.
Взаимодействие с неметалламиПри обычных условиях водород реагирует только с фтором (со взрывом
даже в темноте). Взаимодействие водорода с хлором происходит на свету или
при нагревании, водород горит в хлоре.
опыт
Составьте уравнения реакций. Рассмотрите с т. зр. ОВР.
Н20 + F20 = 2H+F− + Q
Н20 + Cl20 = 2H+Cl− + Q
H20 ─2e → 2H+ 2 1
F20 + 2e → 2F− 2 1
Водород – восстановитель, фтор и хлор окислители.
Взаимодействие водорода с кислородом проходит при поджигании смеси
газов со взрывом, поэтому смесь водорода с кислородом (2:1 по объему)
называют «гремучим газом»
Допишите у─я реакций:
2Н20 + О20 = 2Н2+О−2 + Q
H2 + I2 →
H2 ─2e → 2H+ 2
H + Br →
О20 + 4e2→ 2О−22 2
H2 + N2 →
Водород
H2 +– S →
восстановитель
H2 +–C →
кислород
0
окислитель
1
1
11.
Взаимодействие водорода с хлором12.
Взаимодействие с металламиВставьте в предложения пропущенные слова:
при взаимодействии с активными металлами водород выступает в
роли окислителя , образующиеся гидриды металлов являются
типично ионными соединениями, степень окисления водорода в них −1
Составьте уравнение реакции образования гидрида натрия. Рассмотрите
реакцию как окислительно-восстановительную.
2Na0 + H20 = 2Na+H−
Na0 ─ 1e → Na+ 1 2
H20 + 2e → 2H+ 2 1
H2 – окислитель, процесс восстановления
Na – восстановитель, процесс окисления.
Образующиеся гидриды металлов разлагаются даже в присутствии следов
воды с образованием гидроксида и водорода.
Составьте уравнение реакции
разложения водой гидрида кальция
СаН2 + Н2О = Са(ОН)2 + Н2
13.
Взаимодействие водорода с оксидами металловЭтот метод применяют для
получения металлов высокой
чистоты.
Закончите уравнения реакций:
CuO + H2 →
Fe2O3 + H2 →
NiO
+ H2 →
WO3 + H2 →
W+6O
0
W0
+1O
++H
3H
=0Pb
+2+2
+2
+3
03H
020 =
3O
2+13H
Cu
Fe
Pb
Ni
++
Ni
=0 02Fe
+++H3H
H02+1
O 2+1O
2OO
3+H
2H
22==
2Cu
2+O
W+6
+ 6e → W
0
PbO + H2 →
Рассмотрите с т.зр. ОВР.
6 1
+2+3
+2
+2
Cu
Fe
Pb
Ni
++2e
+
2e
3e
2e
2e
→→
→Cu
Fe
Pb
Ni000 323 2322 1
+1
H200 0 ─
→
2H
0 ─2e
+ + +22 23
HH
2e
→→→
2H
2H
2H
31
2H
2 2──2e
WO3 (за счет W+6) ─ окислитель, процесс восстановления;
+2+2
+2
CuO
Fe
NiO
(за
(за
(за
счет
счет
счет
счет
Cu
Pb
Ni
Fe
) +3
)──
) окислитель,
─окислитель,
окислитель,
процесс
процесс
процесс
восстановления;
восстановления;
восстановления;
HPbO
восстановитель,
процесс
окисления.
2O
3(за
2 ─
HH
─
─восстановитель,
восстановитель,
процесс
процесс
процесс
окисления.
окисления.
окисления.
2H
2─
2восстановитель,
14.
Применение водородаВодород широко применяется:
для промышленного синтеза аммиака и хлороводорода;
1
для получения метанола синтетического жидкого топлива в
составе синтез-газа (2 объема Н2 и 1 объем СО);
2
для гидроочистки и гидрокрекинга нефтяных фракций;
3
для гидрогенизации жидких жиров;
4
для резки и сварки металлов;
5
для получения вольфрама, молибдена и рения из их оксидов;
для космических двигателей в качестве топлива;
в термоядерных реакторах в качестве топлива используются
изотопы водорода.
6
7
8
15.
12
3
4
5
6
7
8
16.
Соединения водородаI. Вода
1. Нахождение в природе
2. Строение молекулы. Физические свойства
II.Химические
Пероксид водорода
3.
свойства
17.
ВОДАНахождение в природе
Вода в природе представлена в первую очередь гидросферой, 96%
которой составляет Мировой океан, покрывающий ¾ поверхности земного
шара. На долю пресной воды приходится только 2,6% от общего содержания
ее на планете. Большая часть пресной воды сосредоточена в виде льда
Северного и Южного полюсов и недоступна для потребления. Доля жидкой
пресной воды, доступной к применению, равна 0,014% от общих запасов.
18.
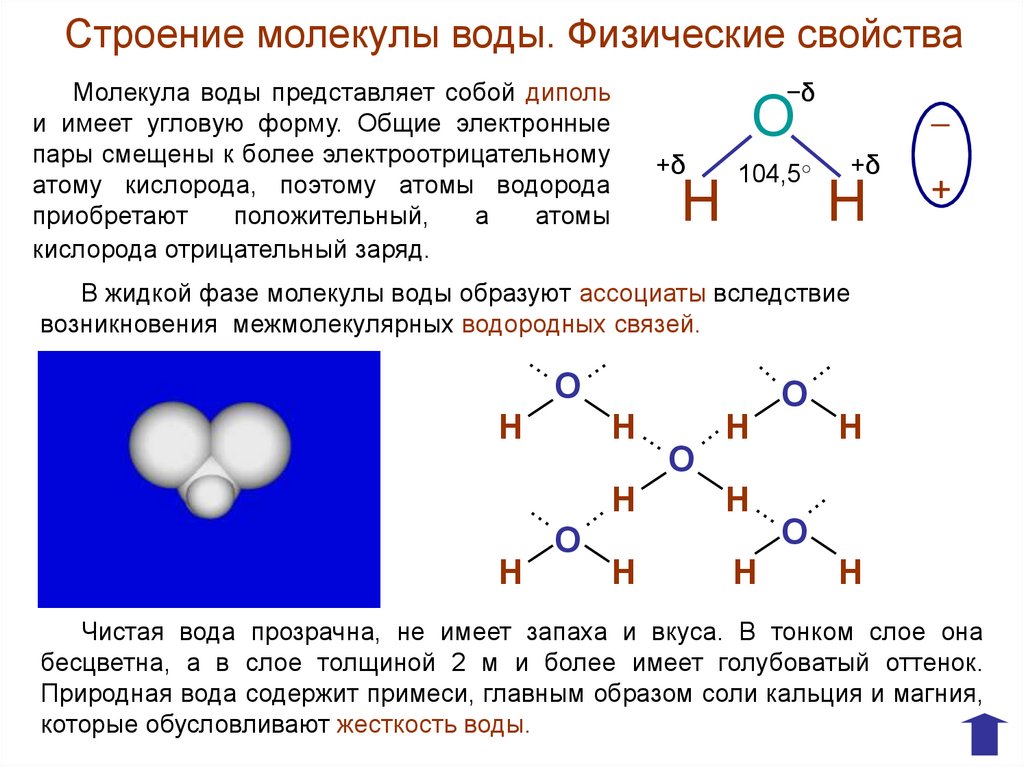
Строение молекулы воды. Физические свойстваМолекула воды представляет собой диполь
и имеет угловую форму. Общие электронные
пары смещены к более электроотрицательному
атому кислорода, поэтому атомы водорода
приобретают
положительный,
а
атомы
кислорода отрицательный заряд.
−δ
О
+δ
Н
104,5°
─
+δ
Н
+
В жидкой фазе молекулы воды образуют ассоциаты вследствие
возникновения межмолекулярных водородных связей.
О
Н
Н
Н
О
О
Н
Н
Н
Н
Н
О
Н
О
Н
Чистая вода прозрачна, не имеет запаха и вкуса. В тонком слое она
бесцветна, а в слое толщиной 2 м и более имеет голубоватый оттенок.
Природная вода содержит примеси, главным образом соли кальция и магния,
которые обусловливают жесткость воды.
19.
Химические свойства водыДля воды характеры как окислительно-восстановительные свойства, так и
реакции, протекающие без изменения степеней окисления водорода и
кислорода.
Взаимодействие с металлами
Щелочные металлы взаимодействуют с водой при обычных
условиях с образованием щелочи и
водорода.
Скорость реакции возрастает от
лития к калию.
Составьте уравнения реакций.
Рассмотрите с т. зр. ОВР.
опыт
2Li0 + 2H+2O = 2Li+OH + H20 2Na0 +2H+2O =2Na+OH +H20 2K0 + 2H+2O = 2K+OH + H20
K0 ─ 1e → K+ 1 2
Li0 ─ 1e → Li+ 1 2
Na0 ─ 1e → Na+ 1 2
2H+ + 2e → H20 2 1
2H+ + 2e → H20 2 1
2H+ + 2e → H20
2 1
K ─ восстановитель,
Li ─ восстановитель,
Na ─ восстановитель,
процесс окисления
процесс окисления
процесс окисления
H2O (за счет Н+) ─
H2O (за счет Н+) ─
H2O (за счет Н+) ─
окислитель, процесс
окислитель, процесс
окислитель, процесс
восстановления.
восстановления.
восстановления.
20.
Взаимодействие калия с водой21.
Взаимодействие воды с кальциемСоставьте уравнение реакции.
Рассмотрите с т.зр. ОВР.
Ca0 + 2H+2O = Ca+2(OH)2 + H20
Ca0 ─2e → Ca+2 2 1
2H+ + 2e → H20 2 1
Ca ─ восстановитель, пр. окисления
H2O (за счет H+) ─ окислитель,
пр. восстановления.
Алюминий вступает в реакцию с водой лишь при условии, что его
поверхность будет освобождена от оксидной пленки.
2Al + 6H2O = 2Al(OH)3 + 3H2
Остальные металлы, стоящие в электрохимическом ряду напряжений до
водорода, взаимодействуют с водой лишь при значительном нагревании с
образованием оксида металла и водорода:
Zn + H2O = ZnO + H2
3Fe + 4H2O = Fe3O4 + 4H2
22.
Пероксид водородаПероксид водорода – это бесцветная жидкость, представляет собой, так же
как и вода, соединение водорода с кислородом
Н2О2
Определите степень окисления и валентность кислорода, водорода:
Н+1 ─ О−1 ─ О−1 ─ Н+1
Степень окисления кислорода −1,
валентность II
Степень окисления водорода +1,
валентность I
Пероксид водорода нестоек и поэтому способен разлагаться на воду и
кислород:
2Н2О2 = 2Н2 + О2
В воде пероксид растворяется неограниченно, его водные растворы более
устойчивы. В виде таких растворов пероксиды поступают в продажу: аптечный 3%ный раствор. Для других целей используют пергидроль – 30%-ный раствор Н2О2.
Применяется пероксид водорода для отбеливания текстильных материалов
и бумаги, в парикмахерском деле, в медицине, как окислитель в ракетном
топливе, при получении глицерина.
23.
Тест1. Молекула водорода имеет:
А) ковалентную полярную связь;
В) ионную связь;
Б) ковалентную неполярную связь;
Г) водородную связь.
2. Водород образуется при действии:
А) раствора соляной кислоты на магний;
Б) раствора серной кислоты на медь;
В) раствора бромоводородной кислоты на ртуть;
Г) концентрированной серной кислоты на серебро.
3. Какие утверждения относятся к простому веществу водороду:
А) бинарные соединения водорода с металлами называются гидридами;
Б) водород входит в состав кислот;
В) водород не образует аллотропных модификаций;
Г) перед работой с водородом необходимо проверить его на чистоту.
4. Какое из приведенных утверждений верно:
А) водород имеет резкий запах;
В) водород тяжелее воздуха;
Б) водород хорошо растворим в воде;
Г) водород легче воздуха.
5. С какими веществами реагирует водород:
А) оксид серы (IV);
В) сероводород;
Б) оксид олова (II);
Г) серная кислота.
6. К гидридам относится вещество с молекулярной формулой:
А) Ca(OH)2;
Б) CaH2;
В) CaC2;
Г) CaO
7. В какой реакции образуется чистый металл:
А) CuО + Н2→
Б) CuO + O2 →
В) Cu + H2O→
Г) Cu + О2→
Б
А
Г
Г
Б
Б
А




















 Химия
Химия








