Похожие презентации:
Периодический закон и ПСХЭ Д.И. Менделеева
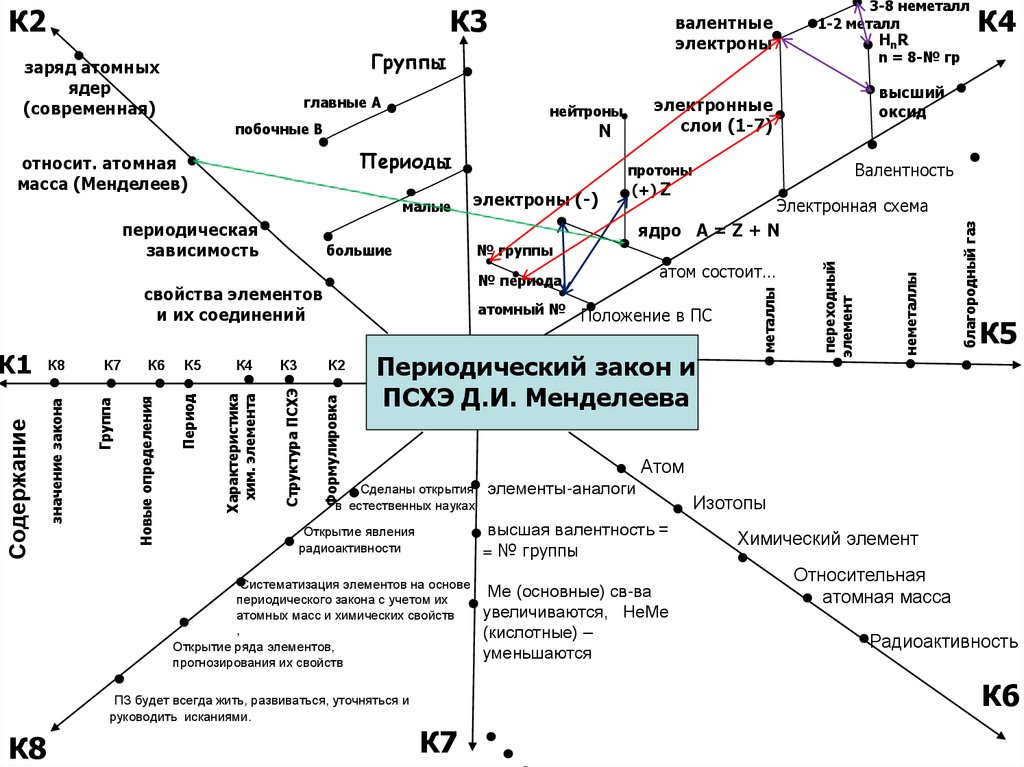
1.
К3валентные
электроны
Группы
главные А
побочные В
N
Периоды
малые
большие
К3
Структура ПСХЭ
атомный №
К2
Положение в ПС
Периодический закон и
ПСХЭ Д.И. Менделеева
элементы-аналоги
высшая валентность =
= № группы
Открытие явления
радиоактивности
ПЗ будет всегда жить, развиваться, уточняться и
руководить исканиями.
К5
Атом
Сделаны открытия
в естественных науках
Систематизация элементов на основе
периодического закона с учетом их
атомных масс и химических свойств
,
Открытие ряда элементов,
прогнозирования их свойств
К8
Электронная схема
ядро A = Z + N
атом состоит…
№ периода
Формулировка
К4
Характеристика
хим. элемента
К5
Период
К6
Новые определения
К7
Группа
значение закона
Содержание
К8
Валентность
протоны
(+) Z
№ группы
свойства элементов
и их соединений
К1
высший
оксид
неметаллы
периодическая
зависимость
электроны (-)
К4
n = 8-№ гр
переходный
элемент
относит. атомная
масса (Менделеев)
HnR
электронные
слои (1-7)
нейтроны
металлы
заряд атомных
ядер
(современная)
3-8 неметалл
1-2 металл
благородный газ
К2
Ме (основные) св-ва
увеличиваются, НеМе
(кислотные) –
уменьшаются
Изотопы
Химический элемент
Относительная
атомная масса
Радиоактивность
К6
К7
2.
Строение атомаНапишите электронную формулу атома
технеция. Сколько электронов находится на
d-подуровне предпоследнего электронного
слоя? К какому электронному семейству
относится элемент? Укажите квантовые
числа порядкового электрона.
3.
Строение атомаАтом Tc в таблице Менделеева имеет порядковый
номер 43. Следовательно, в его оболочке содержится
43 электрона. В электронной формуле распределяем их
по подуровням согласно порядку заполнения (в
соответствии с правилами Клечковского) и
учитывая емкость подуровней:
Tc: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5
Короткая запись:
Tc: [Kr]5s2 4d5
4.
При этом порядок заполнения подуровней следующий:1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d.
Последний электрон располагается на 4d-подуровне,
значит, технеций относится к семейству d-элементов.
На d-подуровне предпоследнего (4-го) слоя находится 5
электронов.
Квантовые числа порядкового электрона:
N = 4, L = 2, Ml = 2, Ms = ½
Ответ: 5, d.
5.
Строение атомаАтом какого элемента имеет
электронную конфигурацию
1s22s22p63s23p63d104s24p64d105s25p1?
Укажите квантовые числа порядкового
электрона.
6.
Строение атомаРешение.
Количество электронов в оболочке
нейтрального атома составляет 49.
Поэтому его заряд ядра и,
следовательно, порядковый номер,
также равны 49. В периодической
системе Д.И.Менделеева находим, что
этот элемент – индий.
Ответ: In.
7.
Квантовые числа определяются последним электрономв конфигурации, для атома In эти числа имеют значение
N = 5, L = 1, Ml = -1, Ms = ½
8.
Валентные возможностиатомов элементов
9.
Пример 1. Какую валентность, обусловленную неспареннымиэлектронами (спин-валентность), может проявлять фосфор в нормальном
и возбужденном (*) состояниях?
Решение. Распределение электронов внешнего энергетического уровня
фосфора, ...3s2 Зр3 (учитывая правило Хунда, 3s2ЗрхЗруЗрz) по квантовым
ячейкам имеет вид:
p
15P
s
d
3s23px3py3pz
Атомы фосфора имеют свободные d-орбитали, поэтому возможен
переход одного
3s-электрона в 3d-состояние:
15P*
s
p
d
3s 3px3py3pz3dxy
Отсюда валентность (спинвалентность) фосфора
состоянии равна трем, а в возбужденном – пяти.
в
нормальном
10.
Химическая связь ивалентность
Теоретические вопросы
Типы химической связи. Количественные характеристики химической
связи.
Метод валентных связей. Гибридизация атомных орбиталей и
строение молекул. Кратные связи ( - и -связи).
Основные положения метода молекулярных орбиталей. Связывающие
и разрыхляющие орбитали. Энергетические диаграммы двухатомных
молекул элементов второго периода. Порядок связи и магнитные
свойства.
Ионная связь. Ионные кристаллические решетки.
Металлическая связь.
Механизм образования водородной связи.
Типы межмолекулярного взаимодействия (ориентационное,
индукционное, дисперсное).
11.
Химическая связьПод химической связью понимают такое
взаимодействие атомов, которое связывает
их в молекулы, ионы, радикалы, кристаллы и
сопровождающееся уменьшением полной
энергии системы
При образовании химической связи атомы
стремятся приобрести устойчивую
восьмиэлектронную (или двухэлектронную)
внешнюю оболочку, соответствующую строению
атома ближайшего инертного газа.
12.
Химическая связьЯдерно-электронные взаимодействия
способствуют образованию химической связи
Межэлектронные
взаимодействия
а) притяжение электронов
с антипараллельными спинами
+
(положительный фактор
в образовании связи);
+
б) отталкивание электронов
с параллельными спинами
(отрицательный фактор)
Межъядерное
отталкивание не способствует
образованию химической связи
13.
Химическая связьВ 1927 году В. Гайтлер и Ф. Лондон
исследовали зависимость
потенциальной энергии системы (E)
из двух атомов водорода
от расстояния между их ядрами (r)
Fпр<Fот
Fпр>Fот
Fпр=Fот
r0 – расстояние между атомами в молекуле
E0 – энергия связи
Fпр<Fот
Fпр=Fот
Fпр>Fот
14.
К3Межмолекулярные
связи
Энергия
Уменьшение энергии
Длина
К3
Механизмы
образования
Постоянная
и переменная
Валентные
возможности
Связь с
положением
атома в ПС
Низшая,
промежуточная,
высшая
К5
Причина взаимодействия
Агрегатное
состояние
Летучесть
Растворимость
Температуры плавления и кипения
Молекулярная
Атомномолекулярная
Атомная
Металлическая
Ионная
Электро- и теплопроводность
К8
Свойство
атома
Кратность связи
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К4
Основные
параметры ХС
К5
Валентность и
степень окисления
Типы кристаллических решёток
Физических свойства веществ
Содержание
К6
Межмолекулярное
взаимодействие
Электростатическое
взаимодействие
Условная
величина….
Гибридизация атомных орбиталей
Валентность
Направленность
ковалентная
ионная
металлическая
К7
Угол связи, пространственное
строение молекул
Насыщенность
Межатомные связи
К8
Виды формул молекул
Поляризуемость
вандерваальсовые
водородная
донорноакцепторные
К1
К4
Степень окисления
К2
К7
Виды взаимодействия
Энергия взаимодействия
Агрегатное
состояние
К6
15.
Типы химической связиТип химической связи определяется
характером распределения электронной плотности
между взаимодействующими атомами
Электронная плотность
Электронная плотность Электронная плотность
смещена
сосредоточена
рассредоточена
к одному из атомов
в межатомном пространстве по всему кристаллу
ИОННАЯ
СВЯЗЬ
ПОЛЯРНАЯ
СВЯЗЬ
КОВАЛЕНТНАЯ
СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ
СВЯЗЬ
ДЕЛОКАЛИЗОВАННАЯ
СВЯЗЬ
При сближении молекул также возникает ХИМИЧЕСКАЯ СВЯЗЬ
Водородная химическая связь
Ван-дер-ваальсовы взаимодействия
Межмолекулярные связи отличаются значительно меньшей прочностью
16.
Полярность ковалентной связистепень смещённости общих электронных пар к одному
из связанных ими атомов
связь
неполярной
между атомами с одинаковой
электроотрицательностью
HH
полярной
образуется между атомами с разной
электроотрицательностью
электроотрицательность (ЭО)
— свойство оттягивать к себе
валентные электроны от других
атомов
H СL
17.
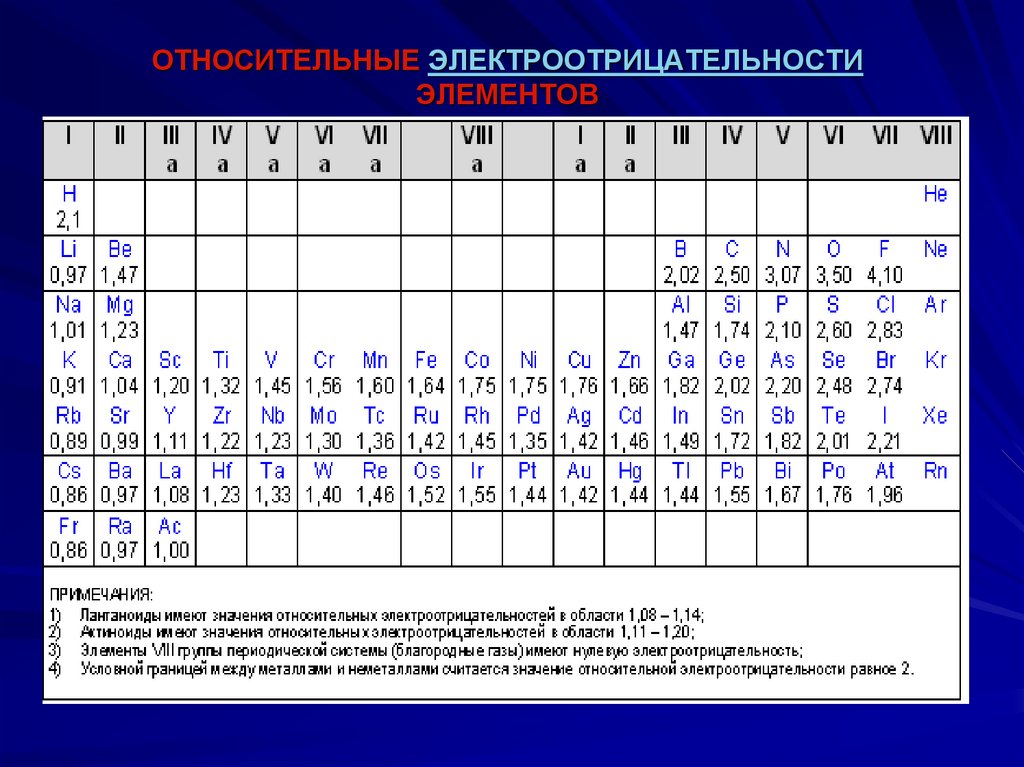
ОТНОСИТЕЛЬНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИЭЛЕМЕНТОВ
18.
Теории химической связиМетод
валентных связей
(ВС)
Представления о двухцентровых
локализованных связях
(Ф.Лондон, В.Гайтлер, Л.Полинг)
1927 г.
Метод
молекулярных орбиталей
(ММО)
Представления о многоцентровых
делокализованных связях
(Р.Малликен, Ф.Гунд, Э.Хюккель и др.)
40-е годы ХХ века
Обе теории дополняют друг друга
19.
Метод валентных связейОсновные положения
1. Химическая связь между атомами образуется в результате обобществления
валентных электронов, т.е. образования общих электронных пар
2. Общие электронные пары образуют лишь неспаренные электроны с
антипараллельными спинами
3. При образовании химической связи происходит частичное перекрывание
атомных орбиталей (АО), что приводит к увеличению электронной
плотности в межъядерном пространстве
4. Химическая связь тем прочнее, чем в большей степени перекрываются
взаимодействующие АО
5. В пространстве химическая связь располагается в том направлении, в
котором возможность перекрывания АО наибольшая
6. Связь, образованная перекрыванием АО по линии, соединяющей центры
атомов, называется – σ-связью, а по обе стороны от линии π-связью.
Еσ > Еπ
7. Если молекула образуется путём перекрывания двух АО, связь называется
одинарной, если более двух АО – кратной. Одинарная связь представлена
всегда σ-связью, а кратные связи включают σ- и π-связи.
8. Общая электронная пара соответствует единице химической связи
20.
Метод валентных связейКовалентность элемента или его спинвалентность определяется числом
неспаренных валентных электроновв основном и возбуждённом состояниях атома
Механизмы образования ковалентной связи
•Обменный
•Донорно-акцепторный
Каждый атом дает по одному
неспаренному электрону
в общую электронную пару
Объединенная
орбиталь молекулы
Один атом (донор)
предоставляет электронную пару,
а другой атом (акцептор)
предоставляет для этой пары
свободную орбиталь
21.
Механизмы образования ковалентнойсвязи
22.
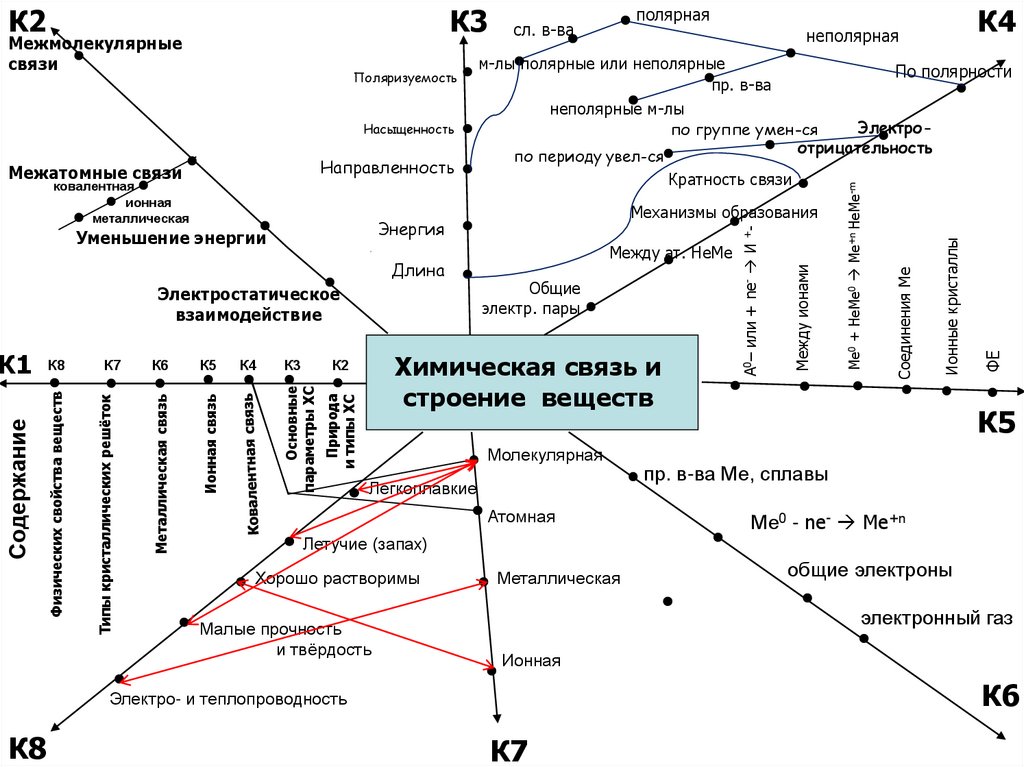
К3Уменьшение энергии
Длина
К4
К3
Между ат. НеМе
Общие
электр. пары
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К5
Основные
параметры ХС
К6
Ионная связь
К7
Типы кристаллических решёток
Физических свойства веществ
Содержание
К8
Металлическая связь
Электростатическое
взаимодействие
К1
Механизмы образования
Энергия
Молекулярная
Легкоплавкие
Атомная
К5
пр. в-ва Ме, сплавы
Ме0 - ne- Ме+n
Летучие (запах)
Хорошо растворимы
Малые прочность
и твёрдость
Металлическая
общие электроны
электронный газ
Ионная
К6
Электро- и теплопроводность
К8
ФЕ
ковалентная
ионная
металлическая
Ионные кристаллы
Направленность
Межатомные связи
Соединения Ме
Насыщенность
м-лы полярные или неполярные
По полярности
пр. в-ва
неполярные м-лы
Электропо группе умен-ся
отрицательность
по периоду увел-ся
Кратность связи
Me0 + НеМе0 Ме+n НеМе-m
Поляризуемость
неполярная
Между ионами
Межмолекулярные
связи
К4
полярная
сл. в-ва
А0– или + ne- И +-
К2
К7
23.
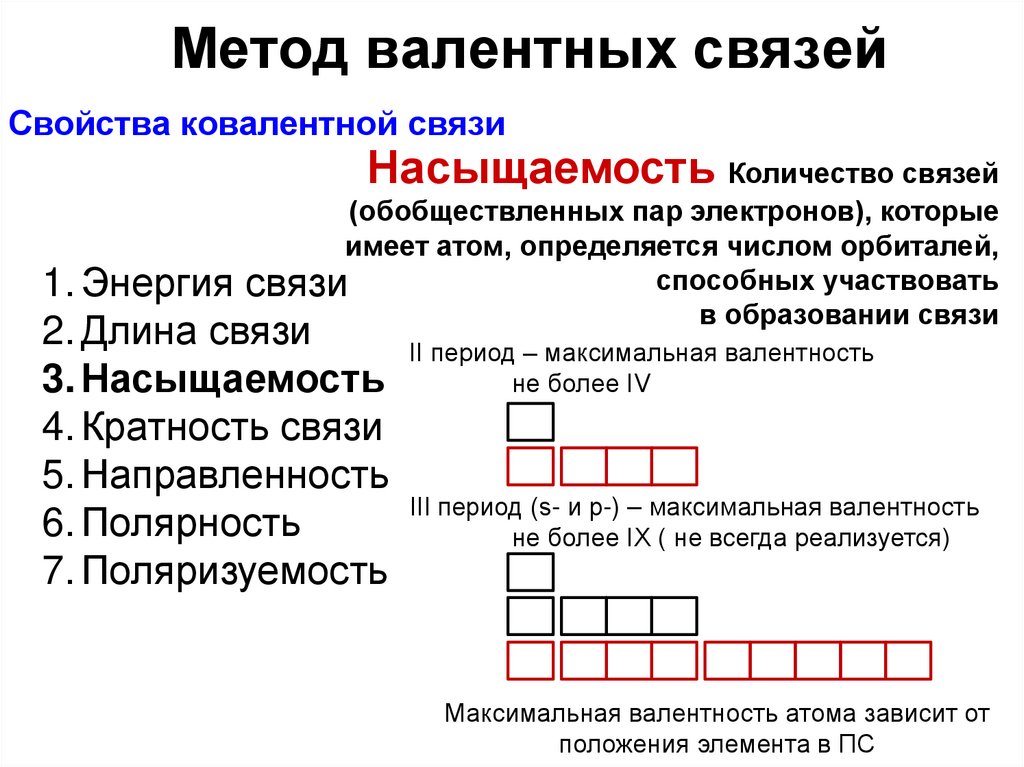
Метод валентных связейСвойства ковалентной связи
Насыщаемость Количество связей
(обобществленных пар электронов), которые
имеет атом, определяется числом орбиталей,
способных участвовать
связи
в образовании связи
1. Энергия
2. Длина связи
3. Насыщаемость
4. Кратность связи
5. Направленность
6. Полярность
7. Поляризуемость
II период – максимальная валентность
не более IV
III период (s- и p-) – максимальная валентность
не более IX ( не всегда реализуется)
Максимальная валентность атома зависит от
положения элемента в ПС
24.
Химическая связьДлина связи (r) – межъядерное расстояние
взаимодействующих атомов
Зависит от размеров электронных оболочек
и степени их перекрывания
С уменьшением длины связи обычно увеличивается энергия
связи и, соответственно, устойчивость молекул
Энергия химической связи (Есв) –
количество энергии,
выделяющееся при образовании химической связи
Чем больше энергия химической связи, тем устойчивее молекулы
25.
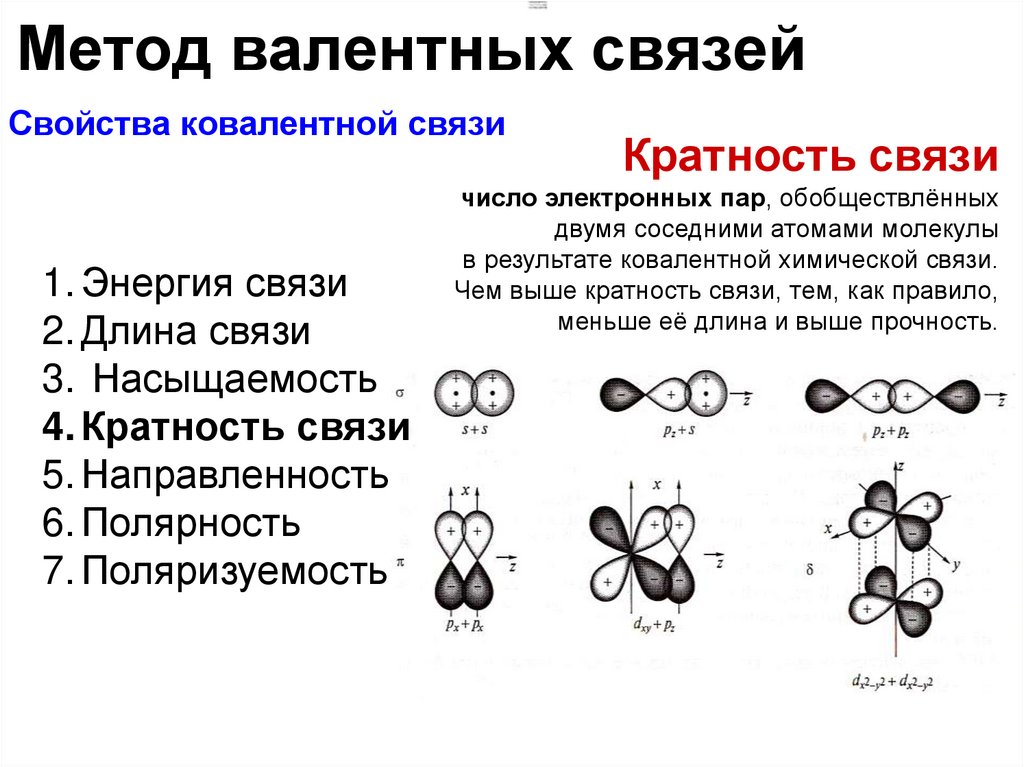
Метод валентных связейСвойства ковалентной связи
1. Энергия связи
2. Длина связи
3. Насыщаемость
4. Кратность связи
5. Направленность
6. Полярность
7. Поляризуемость
Кратность связи
число электронных пар, обобществлённых
двумя соседними атомами молекулы
в результате ковалентной химической связи.
Чем выше кратность связи, тем, как правило,
меньше её длина и выше прочность.
26.
Кратность ковалентной связи• число общих электронных пар, связывающих атомы
связи
одинарные
H2
водород
H-H
двойные
тройные
CO2
N2
оксид углерода(IV)
азот
о=с=о
27.
Метод валентных связейСвойства ковалентной связи
1. Энергия связи
2. Длина связи
3. Кратность связи
4. Насыщаемость
5. Направленность
6. Полярность
7. Поляризуемость
СH4
Направленность
H2S – нелинейная, так как связь
образована двумя p-орбиталями серы,
находящимися под углом 90°
Гибридизация смешение в процессе
образования химической связи разных по форме
и энергии АО (s-, p-, d- или f) с образованием новых,
но уже одинаковых по форме и энергии орбиталей
В гибридизации участвуют близкие по значению
энергии орбитали. Химические связи, образованные
гибридными орбиталями, прочнее, а полученная
молекула более устойчива
Гибридизация – не физическое явление, а модель
28.
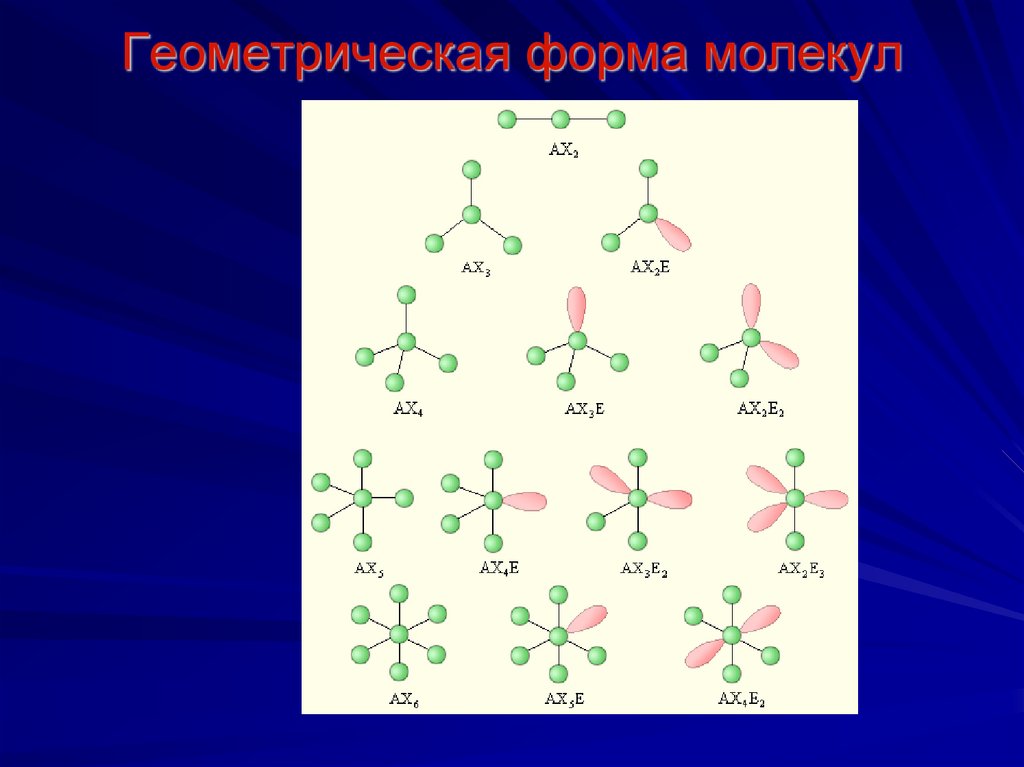
Свойства ковалентной связиНаправленность
Формул
Тип
а
гибриди
молеку
зации
лы
Геометрия
молекулы
Пример
AB2
sp
Линейная
BeH2
AB3
sp2
Треугольная
Угловая
Тетраэдр
Тригональная
пирамида
Угловая
Тригональная
бипирамида
Дисфеноид («качели»)
T-образная
Линейная
Октаэдр
Квадратная
пирамида
Квадрат
Пентагональная
бипирамида
BCl3
GeF2
AB4
AB5
AB6
sp3
sp3d
sp3d2
3 3
CH4
NH3
H2O
PF5
SCl4
ICl3
XeF2
SF6
IF5
XeF4
IF7
29.
Геометрическая форма молекул30.
Примеры молекулy
y
x
x
НСl
СН4
NН3
Н2О
31.
Типы гибридизации и форма молекулУкажите тип
гибридизации орбиталей бора в
молекуле BBr3.
32.
Типы гибридизации и форма молекулВ образовании трех ковалентных
связей между бором и атомами брома
участвуют одна s- и две p-орбитали атома
бора, свойства которых различаются.
Поскольку все химические связи в молекуле
BBr3 равноценны, атом бора
подвергается гибридизации. В ней
принимают участие указанные выше
три орбитали внешнего электронного слоя.
Следовательно, тип гибридизации – sp2.
Ответ: sp2.
33.
Пример. Предскажите геометрию следующих молекул и ионов:PCl3;PCl5; BF4–.
Решение.
У фосфора на внешнем слое пять электронов, поэтому для PCl3
запишем AB3E1;. Исходной моделью для рассмотрения геометрии
этой молекулы является тетраэдр, а молекула представляет собой
треугольную пирамиду, в одной из вершин которой находится
атом фосфора:
А вот молекула PCl5 будет симметричной в силу отсутствия у
атома фосфора свободных (неподелённых) электронных пар:. Для
неё запишем АВ5E0 и сделаем вывод, что указанная молекула
представляет собой тригональную бипирамиду, в которой
расстояния от атома фосфора до атомов хлора одинаковы:
У атома бора в анионе BF4– нет свободных электронных пар, n=4;
m=0. Ион имеет форму тетраэдра Анион имеет форму октаэдра.
В этих анионах по одной связи образовано по донорноакцепторному механизму: анион F– поставляет свободную
электронную пару на пустую орбиталь атома бора.
34.
Свойства ковалентной связи1. Энергия связи
2. Длина связи
3. Кратность связи
4. Насыщаемость
5. Направленность
6. Полярность
7. Поляризуемость
Под электроотрицательностью
атома понимают его способность
притягивать к себе
обобществленные электроны
Полярность определяется
степенью перекрывания орбиталей
Чем больше разница в относительной
электроотрицательности атомов (ОЭО),
тем выше полярность химической связи
Если связь образована двумя одинаковыми
атомами (т.е. ΔОЭО = 0), то электроны
в равной степени принадлежат обоим атомам
и молекула неполярна
Когда связь образована двумя разными
атомами, электронная плотность смещена
в сторону более электроотрицательного
атома. Такая связь называется полярной
Если ΔОЭО=2.5-3.2 связь условно считают ионной и рассматривают
как предельный случай ковалентной полярной связи
35.
Свойства ковалентной связиПолярность
Степень ионности связи
Смещение электронной плотности
к более электроотрицательному атому
Cl
+
H
δ +0.17
H
δ -0.17
Cl
Возникновение эффективных зарядов (δ)
Степень ионности
Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер
δ +0.83 δ -0.83
Na
Cl
т.е. степень ионности равна 83%
Полного перетягивания связующих пар электронов
от более электроположительного к более электроотрицательному атому
и образования 100%-ной ионной связи практически не бывает
36.
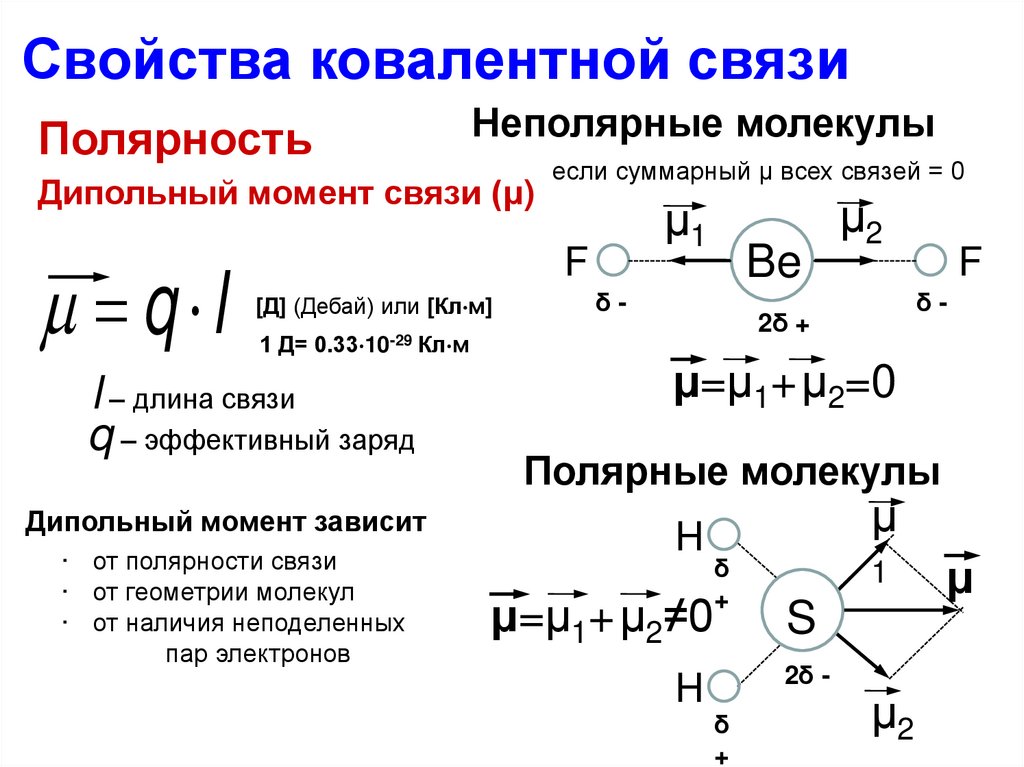
• Молекулы полярны, если их дипольныемоменты не равны нулю. В свою очередь
дипольный момент молекулы представляет
собой векторную сумму дипольных моментов
связей, при этом необходимо учитывать
вклад неподеленных электронных пар.
Таким образом, дипольный момент
молекулы определяется не только
полярностью отдельных связей, но и их
расположением в пространстве, т. е.
геометрией молекулы. Симметричные
молекулы, имеющие одинаковые связи,
неполярны и имеют μ=0.
37.
Свойства ковалентной связиНеполярные молекулы
Полярность
Дипольный момент связи (μ)
q l
если суммарный μ всех связей = 0
μ1
F
[Д] (Дебай) или [Кл м]
1 Д=
0.33 10-29
Кл м
l – длина связи
q – эффективный заряд
Дипольный момент зависит
• от полярности связи
• от геометрии молекул
• от наличия неподеленных
пар электронов
Be
δ-
μ2
F
δ-
2δ +
μ=μ1+μ2=0
Полярные молекулы
H
μ=μ1+μ2≠0
H
μ
δ
+
1
S
2δ -
δ
+
μ2
μ
38.
Пример. Какие из перечисленных молекул являютсяполярными: CO2; H2O; CHCl3; PF5?
Определим геометрию молекул (геометрию связей).
• Молекула CO2; n=2;; линейная молекула. Два вектора дипольных
моментов связей углерод–кислород одинаковы и противоположно
направлены. Следовательно, μ=0 и молекула неполярна.
• Молекула Н2O; n=2; исходная модель для рассмотрения геометрии –
тетраэдр; сама же молекула – угловая. Результат сложения векторов
дает положительный дипольный момент молекулы, кроме того в эту
величину вносят вклад и свободные электронные пары атома
кислорода. В результате приходим к выводу, что дипольный момент
молекулы воды не равен нулю μ≠0.
• Молекула хлороформа; n=4;m=0; тетраэдрическая молекула с
разными связями, имеющими различные дипольные моменты,
результатом сложения которых будет ненулевой дипольный момент
молекулы СНCl3.
• Молекула PF5 симметрична в силу симметрии и одинаковости связей
не будет полярной: PF5;n=5;m=0; тригональная бипирамида; μ=0
39.
Свойства ковалентной связиПоляризуемость или динамическая поляризация
– это способность электронной оболочки атома или молекулы
деформироваться под воздействием внешнего поля,
в качестве которого могут выступать ионы или полярные молекулы
Существует обратная зависимость между полярностью и
поляризуемостью ковалентной связи:
чем больше электроны в статической (нереагирующей) молекуле сдвинуты
под действием электроотрицательного атома (статическая поляризация),
тем меньше остается возможности для их дальнейшего смещения под
внешним воздействием (динамическая поляризация)
ΔЭО
HCl
0.9
НBr
0.7
HJ
0.5
Полярность связи уменьшается
Поляризуемость растет
40.
Пример. Объяснить с позиций метода валентныхсвязей образование молекулы СО2.
Решение:
Атомы углерода и кислорода обладают следующими электронными
конфигурациями: 1s22s22p2 и 1s22s22p4. Это означает, что атом углерода имеет
2 неспаренных p-электрона и одну пустую p-орбиталь, а атом кислорода - 2
неспаренных и 2 спаренных p-электрона. Во внешних слоях этих атомов
имеется соответственно по 4 и 6 электронов.
Образование молекулы СО2 возможно при «распаривании» 2s-электронов
атома углерода, который в возбужденном состоянии будет иметь 4
неспаренных электрона, один на 2s-орбитали и 3 на 2p-орбитали. Каждый из
атомов кислорода отдает по 2
p-электрона на образование ковалентных связей, в результате у возбужденного
атома углерода образуется по 2 обобщенных электронных пары с каждым из
атомов кислорода. В итоге кратность связи атома углерода будет равна 4, а у
атомов кислорода - 2. С учетом обобщенных электронов у атома углерода и у
каждого из атомов кислорода оказывается заполненная оболочка неона.
41.
Метод валентных связей (ВС) не можетобъяснить целый ряд свойств и строение
некоторых молекул (парамагнетизм
молекулы О2; большую прочность связей в
молекулярных ионах и , чем,
соответственно, в молекулах F2 и O2;
наоборот, меньшую прочность связи в ионе ,
чем а молекуле N2; существование
молекулярного иона и неустойчивость
молекулы Нe2 и т.п.).
Более плодотворным оказался другой подход к
объяснению ковалентной связи – метод
молекулярных орбита-лей (МО).
42.
Метод молекулярныхорбиталей
43.
Метод молекулярных орбиталей (МО) наиболеенагляден в его графической модели линейной
комбинации атомных орбиталей (ЛКАО).
Метод МО ЛКАО основан на следующих правилах.
1. При сближении атомов до расстояний
химических связей из атомных орбиталей
(АО) образуются молекулярные.
2. Число полученных молекулярных
орбиталей равно числу исходных атомных.
44.
3. Перекрываются атомные орбитали, близкиепо энергии. В результате перекрывания
двух атомных орбиталей образуются две
молекулярные. Одна из них имеет меньшую
энергию по сравнению с исходными
атомными и называется связывающей, а
вторая молекулярная орбиталь обладает
большей энергией, чем исходные атомные
орбитали, и называется разрыхляющей.
4. При перекрывании атомных орбиталей
возможно образование и σ-связи
(перекрывание по оси химической связи), и
π-связи (перекрывание по обе стороны от
оси химической связи).
45.
Молекулярной орбитали, возникающей от сложенияатомных орбиталей (АО), соответствует более низкая
энергия, чем исходным орбиталям. Такая МО имеет
повышенную электронную плотность в пространстве
между ядрами, способствует образованию химической
связи и называется связывающей. Молекулярной
орбитали, образовавшейся от вычитания атомных,
соответствует более высокая энергия, чем атомным
орбиталям. Электронная плотность в этом случае
сконцентрирована за ядрами атомов, а между ними равна
нулю. Подобные МО энергетически менее выгодны, чем
исходные АО, они приводят к ослаблению химической
связи и называются разрыхляющими. Электроны,
занимающие связывающие и разрыхляющие орбитали,
называют
соответственно
связывающими
(св)
и
разрыхляющими (разр) электронами.
46.
5. Молекулярная орбиталь, не участвующая вобразовании химической связи, носит
название несвязывающей. Ее энергия равна
энергии исходной АО.
6. На одной молекулярной орбитали (как,
впрочем, и атомной) возможно нахождение
не более двух электронов.
7. Электроны занимают молекулярную
орбиталь с наименьшей энергией (принцип
наименьшей энергии).
8. Заполнение вырожденных (с одинаковой
энергией) орбиталей происходит
последовательно по одному электрону на
каждую из них.
47.
Применим метод МО ЛКАО и разберем строениемолекулы водорода. Изобразим на двух
параллельных диаграммах энергетические уровни
атомных орбиталей исходных атомов водорода.
Энергетическая диаграмма несвязанных атомов водорода
48.
Далее мысленно перекроем две атомные орбитали,образовав две молекулярные, одна из которых
(связывающая) обладает меньшей энергией
(расположена ниже), а вторая (разрыхляющая) –
большей энергией (расположена выше).
Диаграмма уровней
энергии АО атомов
H и МО молекулы H2
49.
Видно, что имеетсявыигрыш в энергии по
сравнению с несвязанными
атомами. Свою энергию
понизили оба электрона,
что соответствует единице
валентности в методе
валентных связей (связь
образуется парой
электронов).
50.
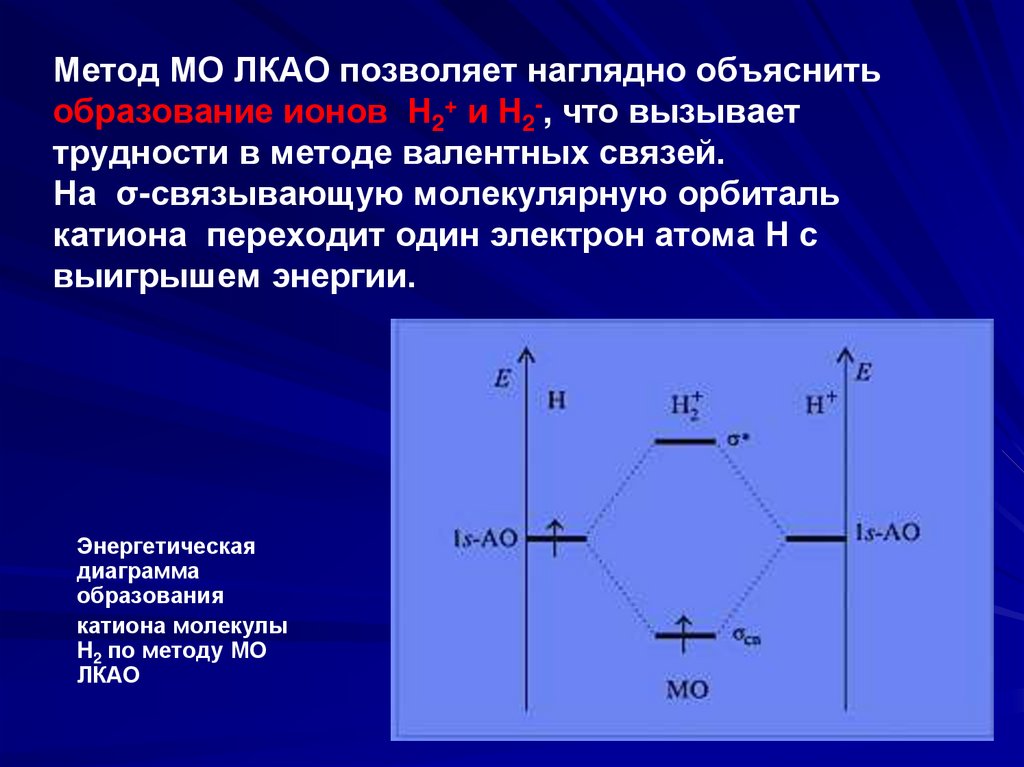
Метод МО ЛКАО позволяет наглядно объяснитьобразование ионов Н2+ и Н2-, что вызывает
трудности в методе валентных связей.
На σ-связывающую молекулярную орбиталь
катиона переходит один электрон атома H с
выигрышем энергии.
Энергетическая
диаграмма
образования
катиона молекулы
H2 по методу МО
ЛКАО
51.
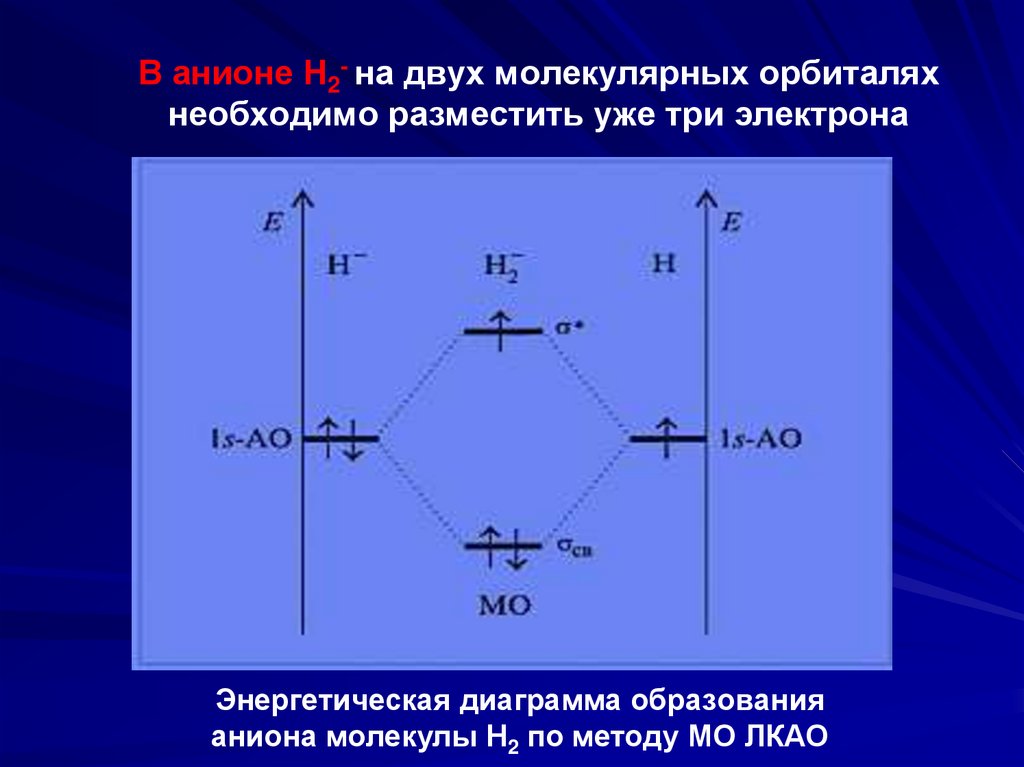
В анионе Н2- на двух молекулярных орбиталяхнеобходимо разместить уже три электрона
Энергетическая диаграмма образования
аниона молекулы H2 по методу МО ЛКАО
52.
Если два электрона, опустившись насвязывающую орбиталь, дают выигрыш в
энергии, то третьему электрону приходится
повысить свою энергию. Однако энергия,
выигранная двумя электронами, больше, чем
проигранная одним. Такая частица может
существовать.
53.
Энергетическая диаграмма образованиядвухатомной молекулы Li2 по методу
МО ЛКАО
Известно, что
щелочные металлы в
газообразном
состоянии
существуют в виде
двухатомных
молекул. Попробуем
убедиться в
возможности
существования
двухатомной
молекулы Li2,
используя метод МО
ЛКАО.
54.
Исходный атом лития содержитэлектроны на двух
энергетических уровнях –
первом и втором (1s и 2s).
Перекрывание валентных 2s-орбиталей атомов
лития приведет также к образованию одной σсвязывающей и одной разрыхляющей
молекулярных орбиталей. Два внешних электрона
займут связывающую орбиталь, обеспечивая общий
выигрыш в энергии (кратность связи равна 1).
55.
Перекрывание одинаковых 1s-орбиталей атомовлития
даст
две
молекулярные
орбитали
(связывающую и разрыхляющую), которые согласно
принципу минимума энергии будут полностью
заселены четырьмя электронами. Выигрыш в
энергии, получаемый в результате перехода двух
электронов
на
связывающую
молекулярную
орбиталь, не способен компенсировать ее потери
при
переходе
двух
других
электронов
на
разрыхляющую молекулярную орбиталь. Вот почему
вклад в образование химической связи между
атомами лития вносят лишь электроны внешнего
(валентного) электронного слоя.
56.
Используя метод МО ЛКАО, рассмотрим возможностьобразования молекулы He2 .
Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО
невозможность образования химической связи между атомами He
57.
В этом случае два электрона займутсвязывающую молекулярную
орбиталь, а два других –
разрыхляющую. Выигрыша в
энергии такое заселение двух
орбиталей электронами не принесет.
Следовательно, молекулы He2 не
существует.
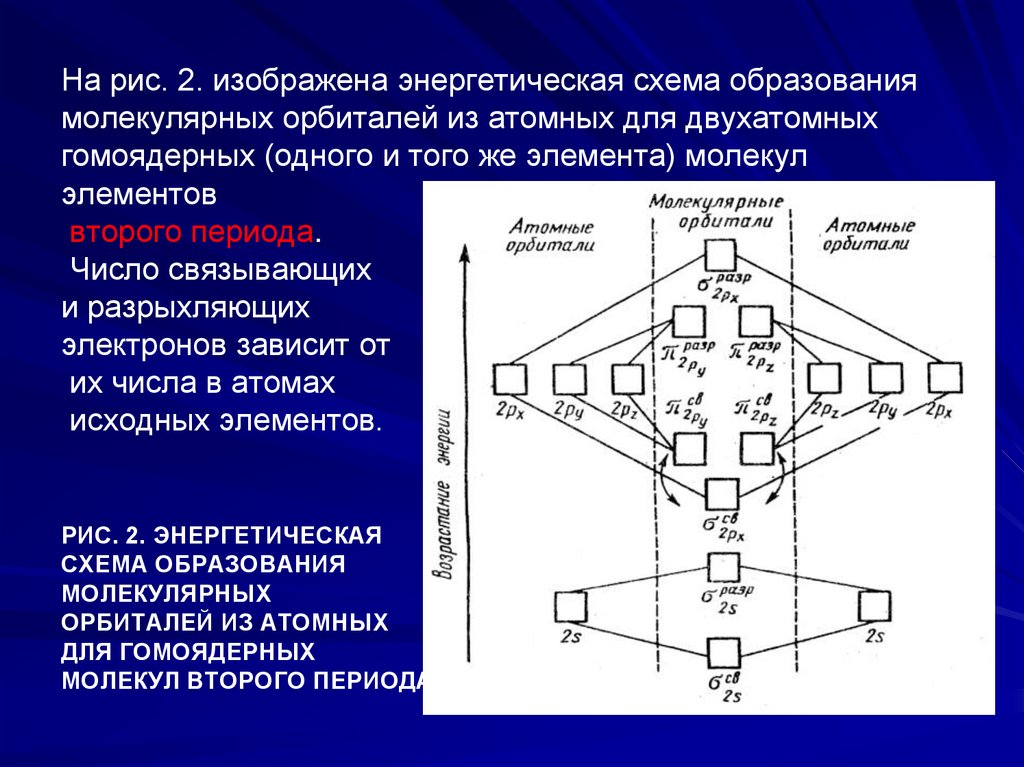
58.
На рис. 2. изображена энергетическая схема образованиямолекулярных орбиталей из атомных для двухатомных
гомоядерных (одного и того же элемента) молекул
элементов
второго периода.
Число связывающих
и разрыхляющих
электронов зависит от
их числа в атомах
исходных элементов.
РИС. 2. ЭНЕРГЕТИЧЕСКАЯ
СХЕМА ОБРАЗОВАНИЯ
МОЛЕКУЛЯРНЫХ
ОРБИТАЛЕЙ ИЗ АТОМНЫХ
ДЛЯ ГОМОЯДЕРНЫХ
МОЛЕКУЛ ВТОРОГО ПЕРИОДА
59.
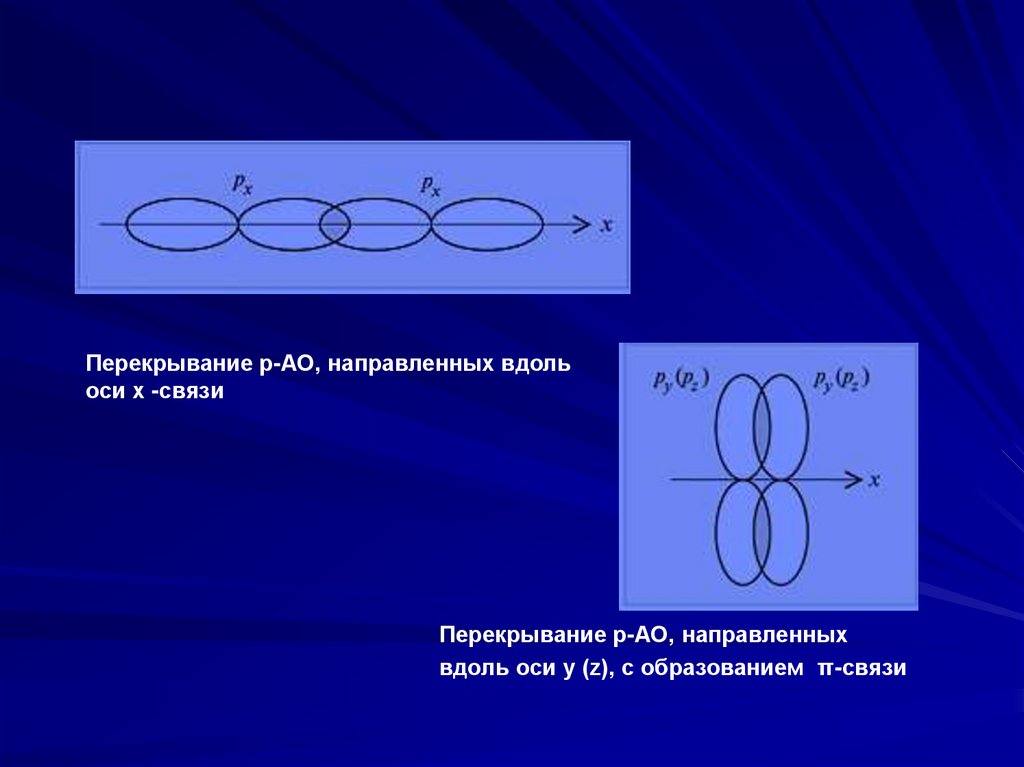
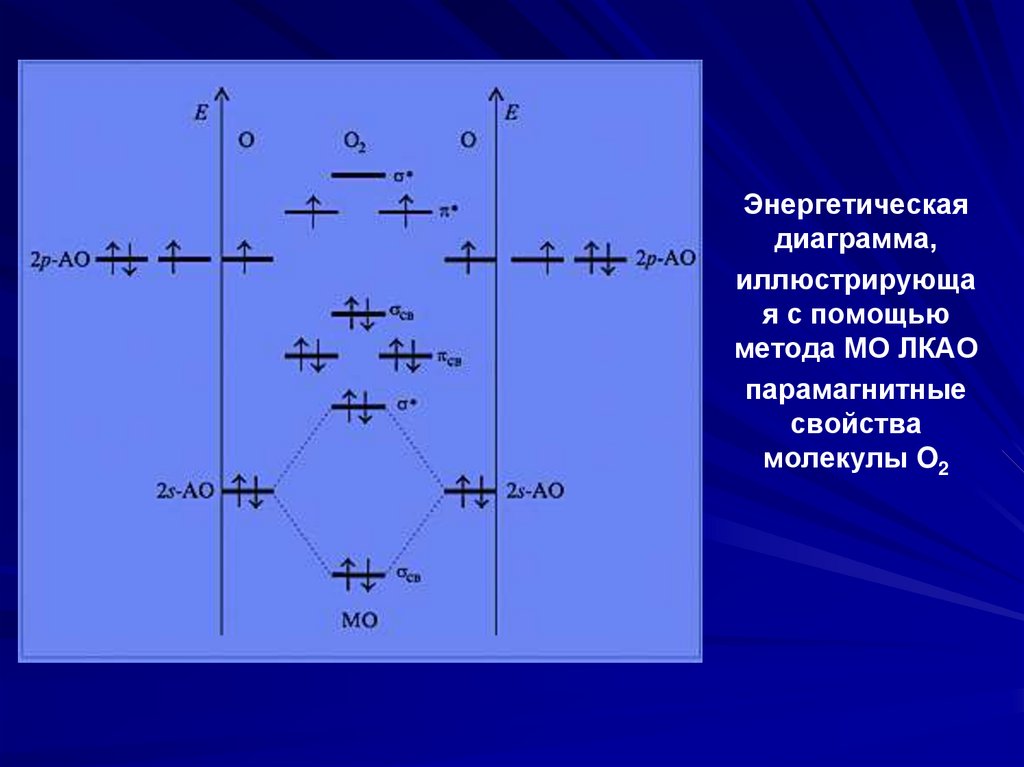
Методом МО ЛКАО легко продемонстрироватьпарамагнитные свойства молекулы кислорода.
С тем чтобы не загромождать рисунок, не будем
рассматривать перекрывание 1s-орбиталей
атомов кислорода первого (внутреннего)
электронного слоя. Учтем, что p-орбитали второго
(внешнего) электронного слоя могут
перекрываться двумя способами. Одна из них
перекроется с аналогичной с образованием
σ-связи. Две других p-АО перекроются по обе
стороны от оси x с образованием
двух π-связей.
60.
Перекрывание p-АО, направленных вдольоси x -связи
Перекрывание p-АО, направленных
вдоль оси y (z), с образованием π-связи
61.
Энергетическаядиаграмма,
иллюстрирующа
я с помощью
метода МО ЛКАО
парамагнитные
свойства
молекулы O2
62.
Среди молекулярных орбиталей молекулыкислорода, образовавшихся в результате
перекрывания p-АО, две π-связывающие
вырожденные (с одинаковой энергией) орбитали
обладают меньшей энергией, чем σсвязывающая, впрочем, как и π*-разрыхляющие
орбитали обладают меньшей энергией в
сравнении с
σ*-разрыхляющей
орбиталью.
63.
Средидвухатомных
молекул одной
из наиболее
прочных
является
молекула CO.
Метод МО ЛКАО
легко позволяет
объяснить этот
факт.
64.
Результатом перекрыванияp-орбиталей атомов O и C является
образование двух вырожденных
π-связывающих и одной
σ - связывающей орбитали.
Эти молекулярные орбитали займут шесть
электронов. Следовательно, кратность связи
равна трем.
65.
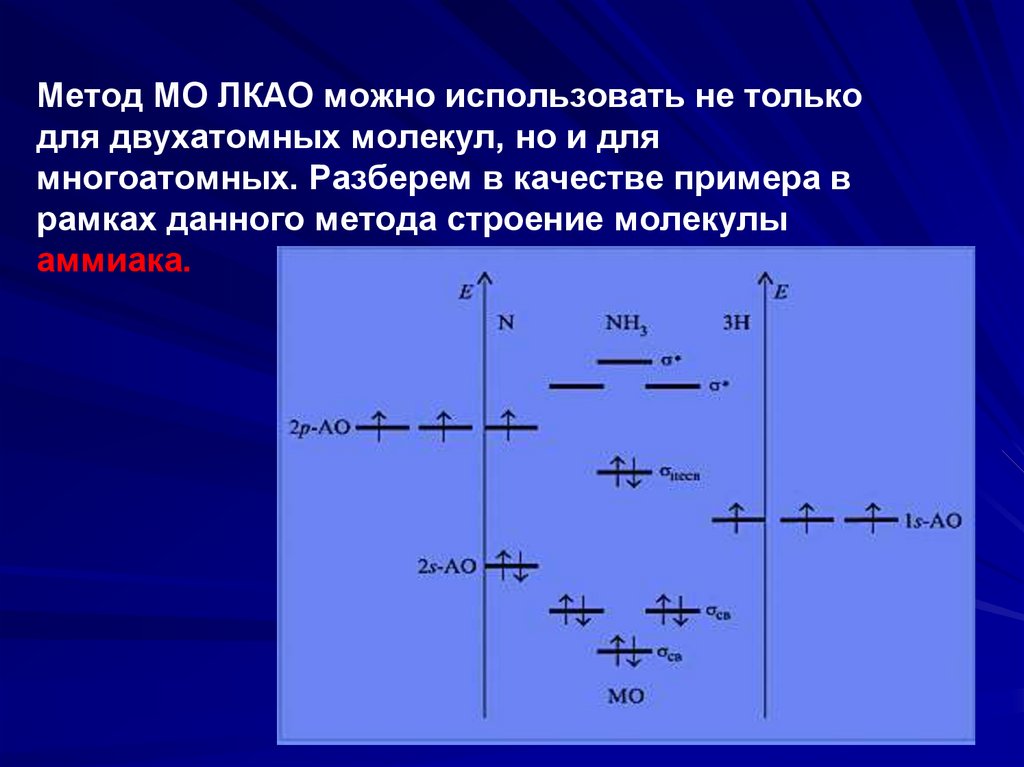
Метод МО ЛКАО можно использовать не толькодля двухатомных молекул, но и для
многоатомных. Разберем в качестве примера в
рамках данного метода строение молекулы
аммиака.
66.
Поскольку три атома водорода имеют толькотри 1s-орбитали, то суммарное число
образованных молекулярных орбиталей будет
равно шести (три связывающих и три
разрыхляющих). Два электрона атома азота
окажутся на несвязывающей молекулярной
орбитали (неподеленная электронная пара).
67.
Метод молекулярных орбиталейДвухатомные гомоядерные
молекулы
Энергетические диаграммы
МО молекул F2 (а), N2 (б)
и фотоэлектронный спектр молекулы N2
(в)
68.
ИОННАЯ СВЯЗЬЕсли разность электроотрицательностей атомов велика,
то электронная пара, осуществляющая связь, переходит
к одному из атомов, и оба атома превращаются в ионы.
Na
+ S
Na
+
2-
+
Na [ S ] Na
Ионная связь образуется только между атомами таких элементов, которые
значительно отличаются по своей электроотрицательности (разность >1,7).
Однако полного перехода электронов от одних атомов к другим не
происходит.
69.
Ионная связь70.
Ионная химическая связьэто связь, образовавшаяся за счет
электростатического притяжения
катионов к анионам
Задание:
Выпишите формулы веществ с ионной связью.
РСl3; С2Н2; Na3P; ССl4, MgCl2; СН4; K3N; NaBr.
71.
Пример. Объяснить образование из атомов калия икислорода соединения с ионной связью К2О.
Решение:
При взаимодействии кислорода с калием два атома калия
отдают по своему одному внешнему электрону, превращаясь в
ионы К+ с оболочкой Аг:
2К0 - 2е- = 2К+.
В свою очередь атом кислорода захватывает эти два электрона на
2р-орбиталь, результатом чего является образование иона О2-,
имеющего оболочку Ne:
О + 2е- = О2-.
Взаимное электростатическое притяжение возникших ионов
противоположных знаков имеет следствием образование
ионного соединения К2О.
72.
Металлическая связьсвязь в металлах и сплавах, которую
выполняют относительно свободные
электроны между ионами металлов в
металлической кристаллической решетке
Схема образования металлической связи:
о
М — пе
п+
М
Задание:
Выпишите формулы веществ, в которых присутствует металлическая связь
Na, KF, NH3, C2H2, CH3-COOH, H2S, AL, NaCl.
73.
Кристаллическое строениеКристаллические решётки веществ – это
упорядоченное расположение частиц
(атомов, молекул, ионов) в строго
определённых точках пространства
Точки размещения частиц называют
узлами кристаллической решётки
В зависимости от типа частиц,
расположенных в узлах кристаллической
решётки, и характера связи между ними
различают 4 типа кристаллических
решёток: ионные, атомные, молекулярные,
металлические
74.
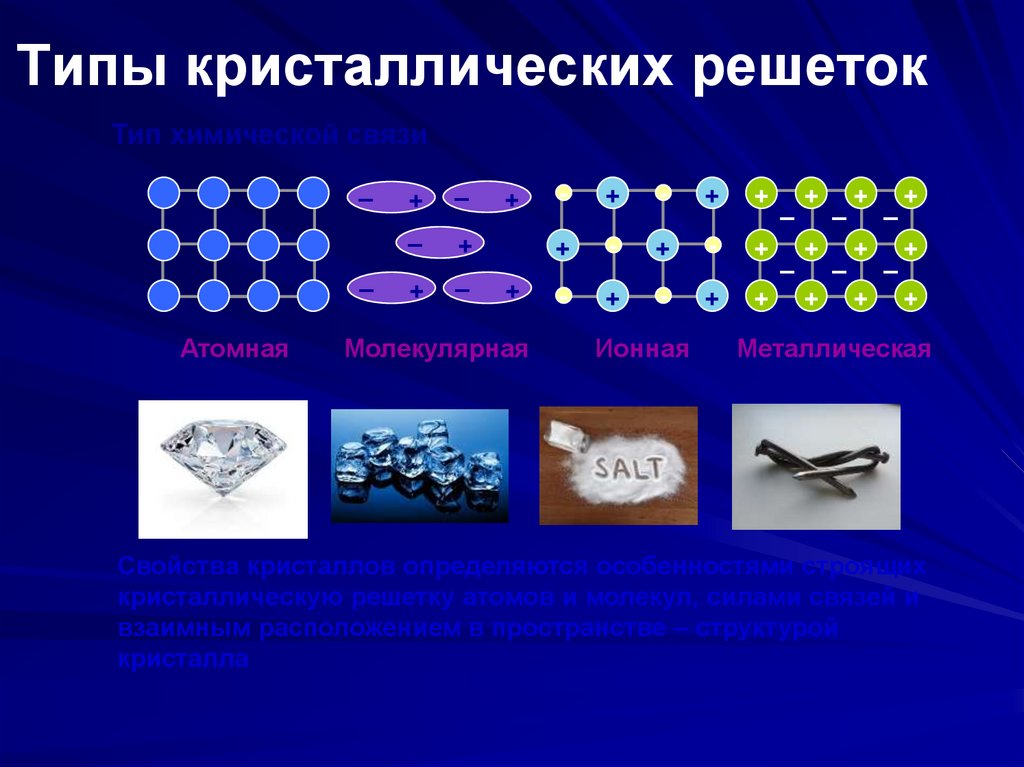
Типы кристаллических решетокТип химической связи
–
–
Атомная
+
–
–
+
+
–
+
+
Молекулярная
-
+
-
+
+
+
-
+
-
+
-
+
-
+
+
Ионная
–
–
+
+
+
–
–
+
+
+
–
–
+
+
+
Металлическая
Свойства кристаллов определяются особенностями строящих
кристаллическую решетку атомов и молекул, силами связей и
взаимным расположением в пространстве – структурой
кристалла
75.
Зависимость свойств веществ от типакристаллической решёток
Тип решетки
Виды частиц в
узлах решетки
Вид связи
между частицами
Примеры веществ
Физические свойства
веществ
Ионная
Ионы
Ионная – связь прочная
Соли, галогениды (IA,
IIA),оксиды и гидроксиды
типичных металлов
Твердые, прочные,
нелетучие, хрупкие,
тугоплавкие, многие
растворимы в воде,
расплавы проводят
электрический ток
Атомная
Атомы
1. Ковалентная не
Простые вещества:
Очень твердые, очень
полярная – связь очень алмаз (C), графит (C) , бор
тугоплавкие, прочные,
прочная
(B), кремний (Si).
нелетучие, не растворимы
2. Ковалентная полярная –
Сложные вещества:
в воде
связь очень прочная
оксид алюминия (Al2O3),
оксид кремния (IV) – SiO2
Молекулярная
Молекулы
Между молекулами –
Твердые вещества при
Непрочные, летучие,
слабые силы
особых условиях, которые легкоплавкие, способны к
межмолекулярного
при обычных – газы или
возгонке, имеют
притяжения, а вот
жидкости (О2, Н2, Cl2, N2,
небольшую твердость
внутри молекул – прочная
Br2, H2O, CO2, HCl);
ковалентная связь
сера, белый фосфор, йод;
органические вещества
Металлическая
Атом-ионы
Металлическая – разной
прочности
Металлы и сплавы
Ковкие, обладают блеском,
пластичностью, тепло- и
электропроводны
76.
Межмолекулярное взаимодействиеОриентационное
Индукционное
Дисперсионное
Водородная связь
Эσ- — Нσ+ …Эσ- — Нσ+ …Эσ– — Нσ+ …
77.
Водородная связь• Это связь между положительно заряженным атомом водорода
одной молекулы и отрицательно заряженным атомом другой
молекулы. Водородная связь имеет частично
электростатический, частично донорно-акцепторный характер.
Наличие водородных связей объясняет высокие температуры
кипения воды, спиртов, карбоновых кислот.
78.
К3Уменьшение энергии
Длина
К4
К3
Между ат. НеМе
Общие
электр. пары
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К5
Основные
параметры ХС
К6
Ионная связь
К7
Типы кристаллических решёток
Физических свойства веществ
Содержание
К8
Металлическая связь
Электростатическое
взаимодействие
К1
Механизмы образования
Энергия
Молекулярная
Легкоплавкие
Атомная
К5
пр. в-ва Ме, сплавы
Ме0 - ne- Ме+n
Летучие (запах)
Хорошо растворимы
Малые прочность
и твёрдость
Металлическая
общие электроны
электронный газ
Ионная
К6
Электро- и теплопроводность
К8
ФЕ
ковалентная
ионная
металлическая
Ионные кристаллы
Направленность
Межатомные связи
Соединения Ме
Насыщенность
м-лы полярные или неполярные
По полярности
пр. в-ва
неполярные м-лы
Электропо группе умен-ся
отрицательность
по периоду увел-ся
Кратность связи
Me0 + НеМе0 Ме+n НеМе-m
Поляризуемость
неполярная
Между ионами
Межмолекулярные
связи
К4
полярная
сл. в-ва
А0– или + ne- И +-
К2
К7
79.
К3Межмолекулярные
связи
Энергия
Уменьшение энергии
Длина
К3
Механизмы
образования
Постоянная
и переменная
Валентные
возможности
Связь с
положением
атома в ПС
Низшая,
промежуточная,
высшая
К5
Причина взаимодействия
Агрегатное
состояние
Летучесть
Растворимость
Температуры плавления и кипения
Молекулярная
Атомномолекулярная
Атомная
Металлическая
Ионная
Электро- и теплопроводность
К8
Свойство
атома
Кратность связи
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К4
Основные
параметры ХС
К5
Валентность и
степень окисления
Типы кристаллических решёток
Физических свойства веществ
Содержание
К6
Межмолекулярное
взаимодействие
Электростатическое
взаимодействие
Условная
величина….
Гибридизация атомных орбиталей
Валентность
Направленность
ковалентная
ионная
металлическая
К7
Угол связи, пространственное
строение молекул
Насыщенность
Межатомные связи
К8
Виды формул молекул
Поляризуемость
вандерваальсовые
водородная
донорноакцепторные
К1
К4
Степень окисления
К2
К7
Виды взаимодействия
Энергия взаимодействия
Агрегатное
состояние
К6
80.
Вопросы изадания
81.
Самостоятельная работа1) Выпишите отдельно структурные формулы
веществ с ковалентной полярной и неполярной
связью. Укажите при помощи стрелки
полярность.
Вг2; НСl; КВг; H2SO4; Ba; SO3; Li3N; P4; C2H4.
2) Определите типы химических связей между
атомами в веществах.
CaВг2; НСl; К; H2SO3; BaO; SO2; LiNО3;
S2; C2H2; Na; HCОOК.
82.
Виды химической связиКакие виды химической связи имеются
в молекуле NH4I ?
83.
Виды химической связиМолекула NH4I состоит из ионов NH4+ и
I–, между которыми имеется ионная
связь. В ионе NH4+ четыре связи
являются ковалентными полярными,
причем одна из них образована
по донорно-акцепторному типу.
Ответ: ионная, ковалентная полярная,
донорно-акцепторная.
84.
1. Какие виды связей можноотнести к химическим?
2. Какие два основных подхода к
рассмотрению химической связи
вам известны? В чем состоит их
отличие?
3. Дайте определение валентности и
степени окисления.
4. В чем состоят отличия простой
ковалентной, донорно-акцепторной,
металлической, ионной связей?
85.
5. Что такое электроотрицательность?О чем электроотрицательности атомов,
образующих химическую связь,
позволяют судить? Как изменяется
электроотрицательность атомов
элементов при продвижении в
периодической таблице Д.И.Менделеева
сверху вниз и слева направо?
6. Какими правилами необходимо
руководствоваться при рассмотрении
строения молекул методом МО ЛКАО?
86.
7. Используя метод валентных связей,объясните строение водородных соединений
элементов 2-го периода.
8. Почему при обычных условиях CO2 – газ, а
SiO2 – твердое вещество, H2O – жидкость,
а H2S – газ? Попробуйте объяснить агрегатное
состояние веществ.
9. Используя метод МО ЛКАО, объясните
возникновение и особенности химической связи
в молекулах B2, C2, N2, F2, LiH, CH4.
10. Используя теорию отталкивания валентных
электронных пар, определите формы молекул
кислородных соединений элементов 2-го
периода.









































































 Химия
Химия








