Похожие презентации:
Периодический закон и Периодическая система элементов Д.И. Менделеева
1.
Тема: Периодический закон иПериодическая система элементов
Д.И. Менделеева
2.
3.
Электронные конфигурации атомов и Периодическая системаПериодическая таблица элементов — графическое изображение
правил заполнения электронами энергетических уровней.
Схема периодической таблицы, показывающая блочное
расположение элементов по типу орбиталей,
заполняемых в каждом блоке
4.
Правила заполнения электронных оболочек атомов1. Принцип последовательного заполнения атомных орбиталей с
наименьшей энергией; орбитали заполняются, начиная с имеющих
самую низкую энергию.
Правило Клечковского - заполнение электронами орбиталей в
атоме происходит в порядке возрастания суммы главного и
орбитального квантовых чисел (n + l). При одинаковой сумме раньше
заполняется орбиталь с меньшим значением n.
2. Принцип Паули – два электрона в атоме не могут иметь
одинаковый набор четырех квантовых чисел, т. е. каждая орбиталь
может содержать максимум два электрона с различными спинами;
орбиталь, содержащая два электрона полностью занята.
3. Правило Хунда – спаривание электронов на орбиталях, имеющих
одинаковую энергию, невозможно до тех пор, пока каждая орбиталь не
будет иметь один электрон, т. е. суммарный спин электронов в атоме
должен быть максимальным. .
4. Максимальное число электронов для данного квантового числа n
равно N = 2n2
5.
Электронные конфигурации химических элементов№
Символ
n
l
ms
s
n+l
Электронная конфигурация
1
H
1
0
0
+½
1
1s1
2
He
1
0
0
-½
1
1s2
3
Li
2
0
0
+½
2
1s22s1
4
Be
2
0
0
-½
2
1s22s2
5
B
2
1
-1
+½
3
1s22s22p1
6
C
2
1
0
+½
3
1s22s22p2
7
N
2
1
+1
+½
3
1s22s22p3
8
O
2
1
-1
-½
3
1s22s22p4
9
F
2
1
0
-½
3
1s22s22p5
10
Ne
2
1
+1
-½
3
1s22s22p6
11
Na
3
0
0
+½
3
1s22s22p63s1
12
Mg
3
0
0
-½
3
1s22s22p63s2
13
Al
3
1
-1
+½
4
1s22s22p63s23p1
6.
№ Символn
l
ms
s
n+l
Электронная конфигурация
14
Si
3
1
0
+½
4
1s22s22p63s23p2
15
P
3
1
+1
+½
4
1s22s22p63s23p3
16
S
3
1
-1
-½
4
1s22s22p63s23p4
17
Cl
3
1
0
-½
4
1s22s22p63s23p5
18
Ne
3
1
+1
-½
4
1s22s22p63s23p6
19
K
4
0
0
+½
4
1s22s22p63s23p64s1
20
Ca
4
0
0
-½
4
1s22s22p63s23p64s2
21
Sc
3
2
-2
+½
5
1s22s22p63s23p64s23d1
22
Ti
3
2
-1
+½
5
1s22s22p63s23p64s23d2
23
V
3
2
0
+½
5
1s22s22p63s23p64s23d3
24
Cr
3
2
+1
+½
5
1s22s22p63s23p64s23d4
25
Mn
3
2
+2
+½
5
1s22s22p63s23p64s23d5
26
Fe
3
2
-2
-½
5
1s22s22p63s23p64s23d6
27
Co
3
2
-1
-½
5
1s22s22p63s23p64s23d7
7.
8.
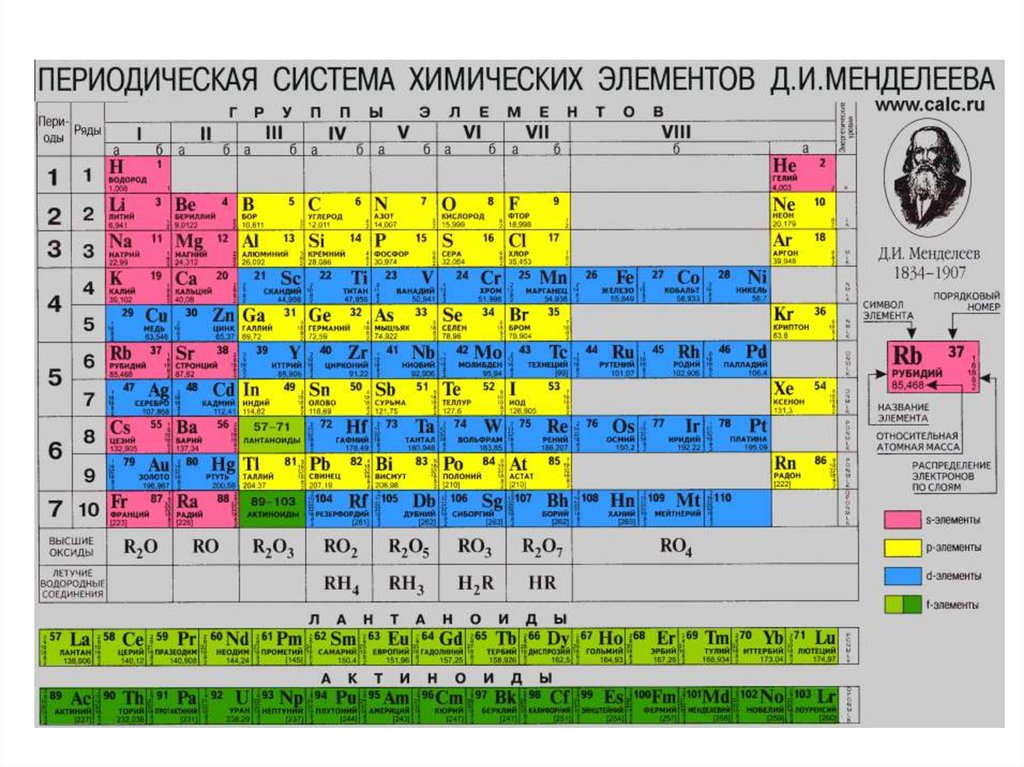
Современная Периодическая система, в которой элементы расположены в порядкеувеличения зарядов ядер. В вертикальных столбцах – группах – расположены элементы с
одинаковым числом валентных электронов. По рекомендации ИЮПАК группы обозначены
номерами от 1 до 18. Горизонтальные строки называют периодами.
9.
10.
Конфигурации валентных электронов элементовглавных подгрупп
Элементы одной подгруппы имеют подобные электронные
конфигурации, являются электронными аналогами.
Число валентных электронов совпадает с номером группы.
Элементы – аналоги, расположенные в одной подгруппе, имеют
сходное строение внешних электронных оболочек атомов при
различных значениях n и поэтому проявляют сходные химические
свойства
11.
Конфигурации валентных электронов элементовглавных подгрупп
В периоде с ростом заряда ядра (Z) происходит
закономерное изменение конфигураций валентных
электронов.
С увеличением зарядов ядер атомов элементов
Периодической системы конфигурации валентных
электронов периодически повторяются.
Это явление лежит в основе Периодического закона.
12.
Периодический закон Д.И. Менделеева.Открыт в 1869 г. великим русским ученым
Д.И. Менделеевым.
“Свойства элементов и свойства образуемых ими
простых и сложных соединений стоят в
периодической зависимости от их атомного веса”.
Современная формулировка Периодического Закона гласит:
Свойства химических элементов, а также формы и свойства
их соединений находятся в периодической зависимости от
величины заряда атомных ядер в результате
периодического повторения электронных конфигураций
атомов.
Графическим отображением Периодического Закона
является Периодическая система
13.
Схожесть в химических свойствах элементов однойподгруппы определяется подобием электронных
конфигураций их внешнего валентного слоя
Вертикальная периодичность изменения свойств
В каждом периоде происходит закономерное изменение
электронных конфигураций валентных электронов с
ростом заряда ядра Z
Горизонтальная периодичность изменения свойств
Элементы 2 периода отличаются от элементов-аналогов тех же групп
следующих периодов, так как :
-внутренний слой содержит только 2 электрона (1s2)
-электроны 2-го валентного слоя имеют более низкую энергию, чем
электроны последующих слоев.
В больших периодах d- и f–элементы, у которых заполняются внутренние
d- и f-подуровни значительно меньше отличаются по свойствам, чем
элементы главных подгрупп, у которых заполняются внешние слои. В
главных подгруппах происходит более резкое изменение свойств
14.
Периодически изменяющиесясвойства атомов
1. Атомные и ионные радиусы R
2. Энергия ионизации Еион
3. Сродство атома к электрону Есрод к е
4. Электроотрицательность ЭО
15.
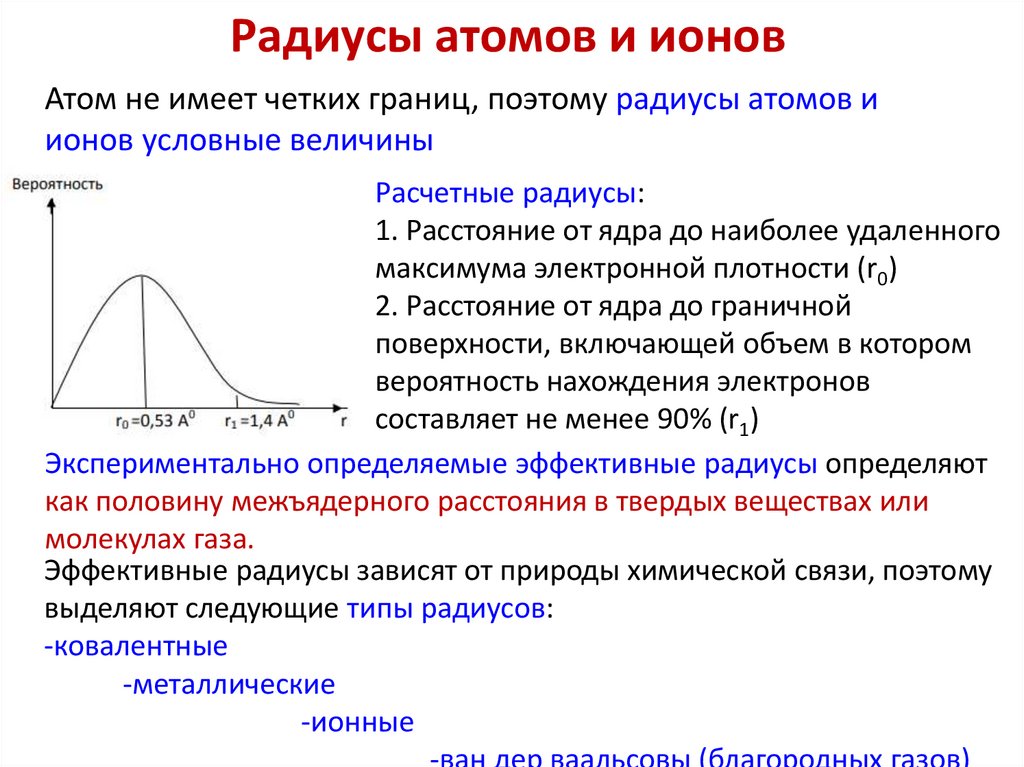
Радиусы атомов и ионовАтом не имеет четких границ, поэтому радиусы атомов и
ионов условные величины
Расчетные радиусы:
1. Расстояние от ядра до наиболее удаленного
максимума электронной плотности (r0)
2. Расстояние от ядра до граничной
поверхности, включающей объем в котором
вероятность нахождения электронов
составляет не менее 90% (r1)
Экспериментально определяемые эффективные радиусы определяют
как половину межъядерного расстояния в твердых веществах или
молекулах газа.
Эффективные радиусы зависят от природы химической связи, поэтому
выделяют следующие типы радиусов:
-ковалентные
-металлические
-ионные
-ван дер ваальсовы (благородных газов)
16.
Металлический радиус (дляметаллов) – половина
расстояния между ядрами
соседних атомов в
металлическом кристалле
Ионный радиус – для ионных соединений
Ковалентный радиус (для
неметаллов) – половина
расстояния между ядрами
соседних атомов в простых
веществах неметаллов
17.
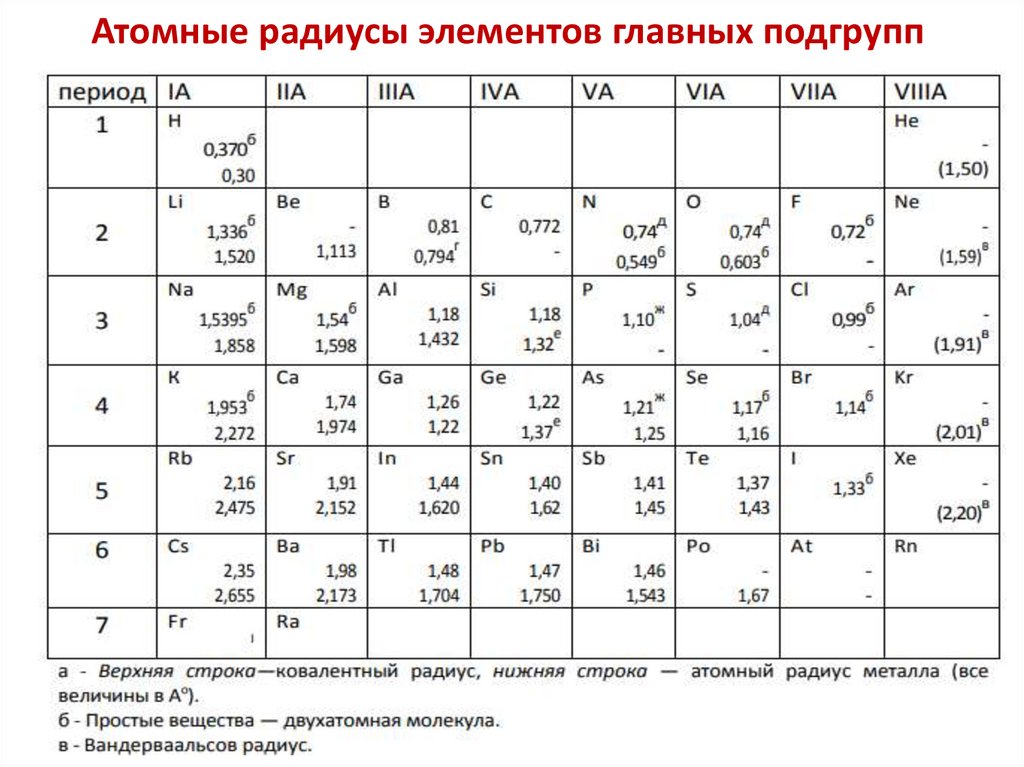
Атомные радиусы элементов главных подгрупп18.
Атомные радиусы элементов побочных подгрупп19.
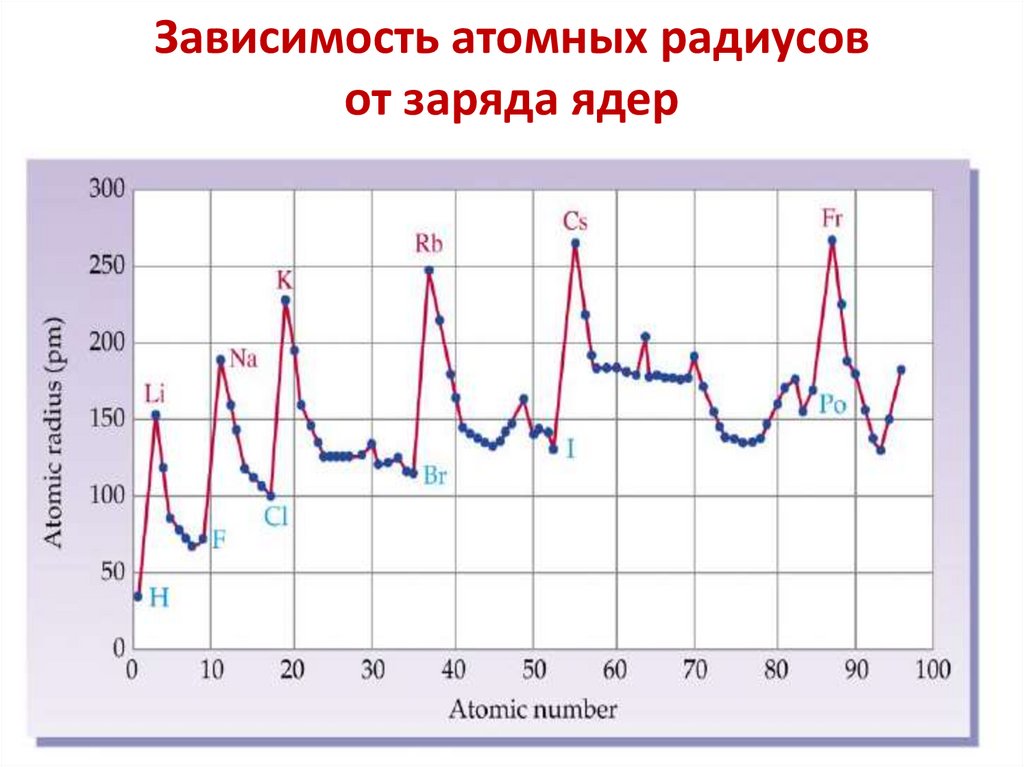
Зависимость атомных радиусовот заряда ядер
20.
Зависимость атомных радиусовот заряда ядер
21.
Атомные радиусы элементов главных подгрупп22.
Атомные радиусы элементов побочных подгрупп23.
Атомные радиусы элементовс увеличением заряда ядра периодически
изменяются в Периодической системе
эффективные атомные радиусы
Увеличение
в подгруппе
Уменьшение в периоде
В главных подгруппах увеличение
радиуса происходит в большей
степени, чем в побочных подгруппах.
24.
Электронные конфигурации ионовПоложительно заряженные ионы (катионы) образуются
при отрыве электронов от атома
А – ne → An+
Легче всего отрываются электроны внешнего подуровня
внешнего уровня (правила Клечковского не соблюдаются)
[Ar]4s23d104p4
4+
2
10
0
34Se [Ar]4s 3d 4p
6+
10 0
0
34Se [Ar]3d 4s 4p
34Se
5 2
25Mn [Ar]3d 4s
2+
5
25Mn [Ar]3d
5 1
24Cr [Ar] 3d 4s
24Cr
3+ [Ar] 3d34s0
Отрицательно заряженные ионы (анионы) образуются в
результате присоединения электронов к атому (по правилам
Клечковского)
А + ne → An2- [Ar]3d104s24p6
Se
34
Изоэлектронные частицы имеют одинаковое число электронов
и совпадающие (по формуле) электронные конфигурации.
2 2
6 2
6
18Ar 1s 2s 2p 3s 3p
2 2
6 2
6
17Cl 1s 2s 2p 3s 3p
+ 1s22s22p63s23p6
19K
25.
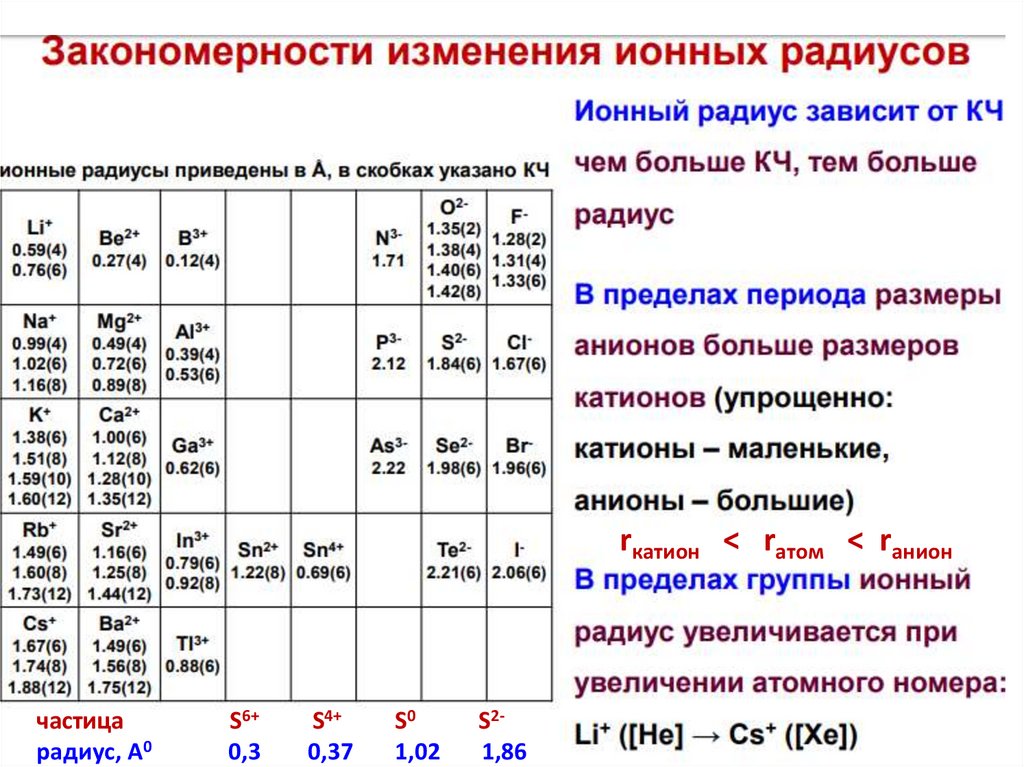
rкатион < rатом < rаниончастица
радиус, А0
S6+
0,3
S4+
0,37
S0
1,02
S21,86
26.
27.
Закономерности изменения ионных радиусов28.
29.
Энергия ионизацииЭнергия ионизации это энергия, необходимая для отрыва
наименее прочно связанного электрона от атома в
основном состоянии
А - е → А+ ; Еион > 0 (энергия затрачивается)
Энергии ионизации атомов
30.
Первая энергия ионизации, кДж/моль31.
Первый потенциал ионизации и сродство атомов к электронуa Верхняя строка —первый потенциал ионизации Еион, эВ (все величины соответствуют поглощению
энергии); нижняя строка — энергия сродства атома к электрону (первая ступень) Есрод ат к е эВ
(отрицательные величины — поглощение энергии, положительные — выделение энергии).
32.
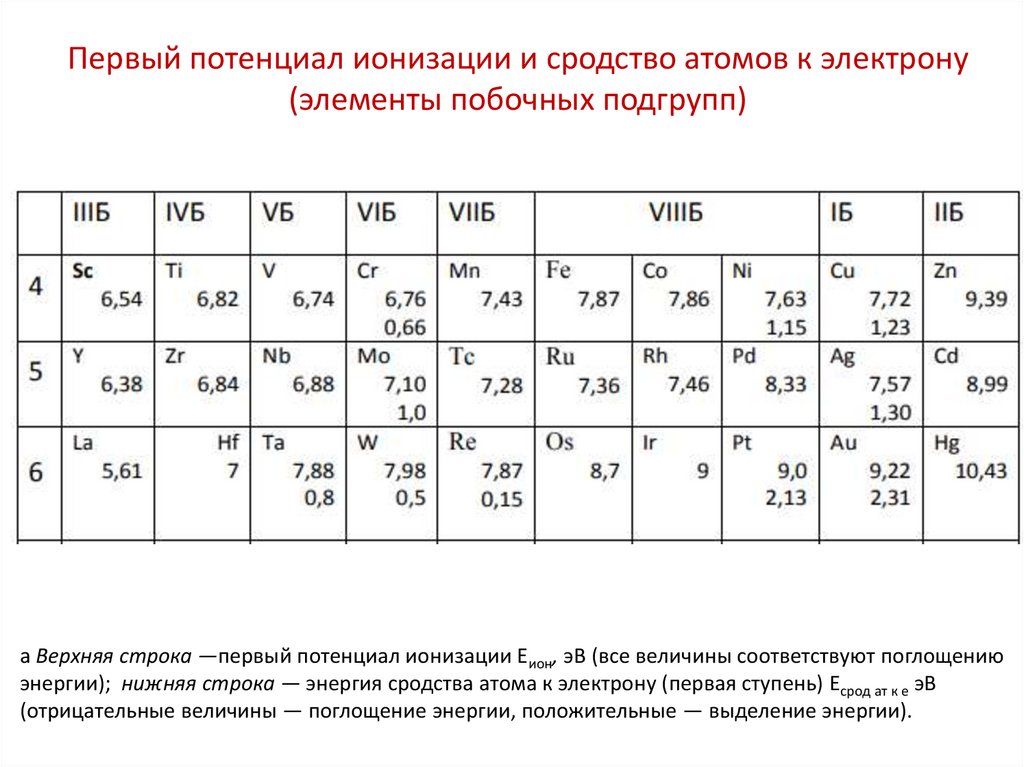
Первый потенциал ионизации и сродство атомов к электрону(элементы побочных подгрупп)
a Верхняя строка —первый потенциал ионизации Еион, эВ (все величины соответствуют поглощению
энергии); нижняя строка — энергия сродства атома к электрону (первая ступень) Есрод ат к е эВ
(отрицательные величины — поглощение энергии, положительные — выделение энергии).
33.
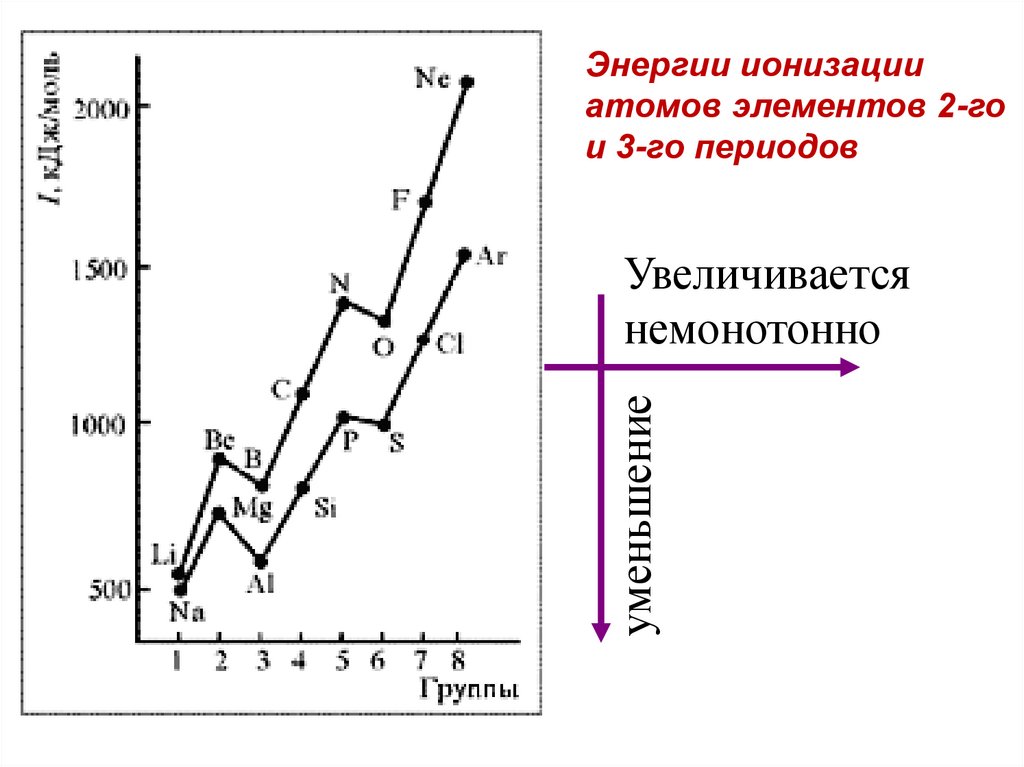
Энергии ионизацииатомов элементов 2-го
и 3-го периодов
уменьшение
Увеличивается
немонотонно
34.
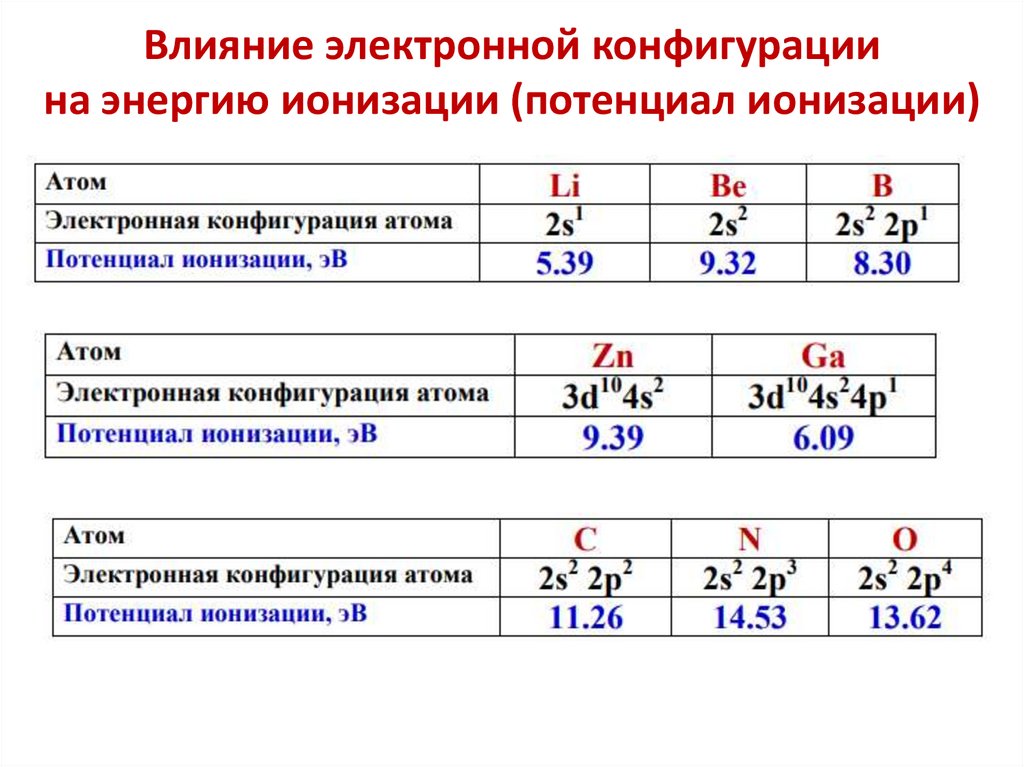
Влияние электронной конфигурациина энергию ионизации (потенциал ионизации)
35.
Анализ изменения энергии ионизациипозволяет сделать выводы:
1. С ростом заряда ядра в периодах Еион увеличивается,
что вызвано сжатием электронной оболочки вследствие
увеличения эффективного заряда ядра
2. Неравномерность в изменении Еион определяется
электронными конфигурациями атомов
… Еион (В 2s22p1) < Еион (Ве 2s2) и
Еион (О 2s22p4) < Еион (N 2s22p3)
3. Атомы щелочных Ме (ns1) имеют самые низкие Еион
4. Атомы благородных газов (ns2np6) имеют max Еион
36.
Последовательный ряд энергий ионизацииА
2
2
2
6C 1s 2s 2p
- е →
А+ ;
Еион 1
А+ - е → А2+ ; Еион 2
А2+ - е → А3+ ; Еион 3
А3+ - е → А4+ ; Еион 4
А4+ - е → А5+ ; Еион 5
Еион 1 < Еион 2 < Еион 3 < Еион 4 < Еион 5
Последовательный ряд энергий ионизации атома углерода.
Резкое увеличение Еион при отрыве пятого электрона с
внутреннего 1-го уровня
37.
Первая, вторая и третья энергия ионизации элементов, кДж/мольПоследовательный ряд энергий ионизации
38.
Сродство атомов к электронуЭнергия сродства атома к электрону — энергия, которая
выделяется или поглощается при присоединении
электрона к атому:
А + е → А-; Есродства ат к е
Есродства ат к е < 0; — энергия выделяется; ион устойчивее,
чем атом; «высокое сродство атома к электрону»
Есродства ат к е > 0; — энергия поглощается; атом устойчивее,
чем ион; «низкое сродство атома к электрону»
39.
Сродство атомов к электрону40.
Сродство к электрону некоторых элементовЗависимость сродства к электрону
(Есрод ат к е, эВ) атомов химических
элементов 1 и 2 периодов от заряда
ядра
Низкое сродство к электрону у
элементов групп с конфигурациями:
IIA
ns2
VA
ns2np3
VIIIA ns2np6
41.
Анализ изменения Еср. позволяет сделатьвыводы:
1. Минимальное «низкое сродство» к электрону
наблюдается у атомов, имеющих завершенные ns2
и ns2np6 подуровни.
2. «Низкое сродство» к электрону у атомов с
конфигурацией np3 (устойчивый наполовину
заполненный подуровень)
3. Максимальным сродством к электрону обладают
атомы VIIА-подгруппы с конфигурацией – ns2np5
42.
43.
Электроотрицательность (ЭО или )[кДж/моль] или [эВ/атом] – характеризует способность
атома удерживать свои электроны и притягивать
электроны соседних атомов.
Электроотрицательность по Малликену
1
ЭО Еион Еср
2
ЭО Li = ½ (500+60) = 280 кДж/моль
ЭО F = ½ (1700+310) = 1005 кДж/моль
Относительная электроотрицательность по Полингу
По Полингу ЭО Li условно принята за 1,
тогда ЭО F = 1005 /280 = 3,6 .
Относительная электроотрицательность (ОЭО) безразмерная величина
44.
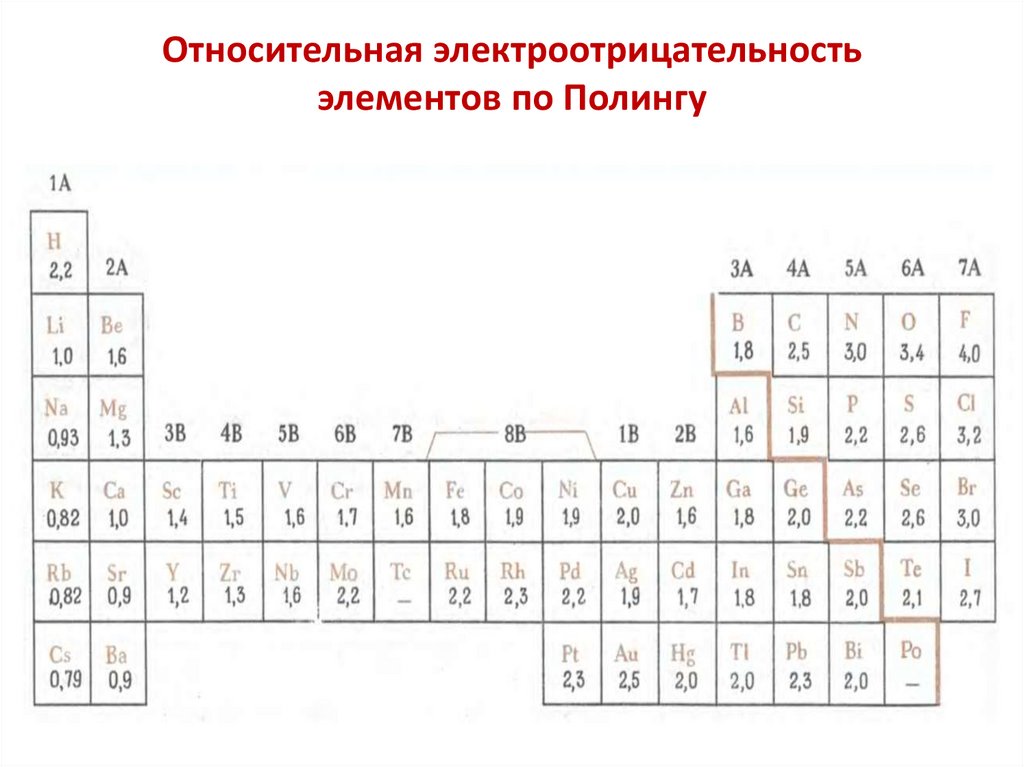
Относительная электроотрицательностьэлементов по Полингу
45.
Относительная электроотрицательностьэлементов по Полингу
Электроотрицательность элементов — периодическая
функция зарядов ядер
46.
Электроотрицательность по Полингу, Малликену, Олред-Рохау47.
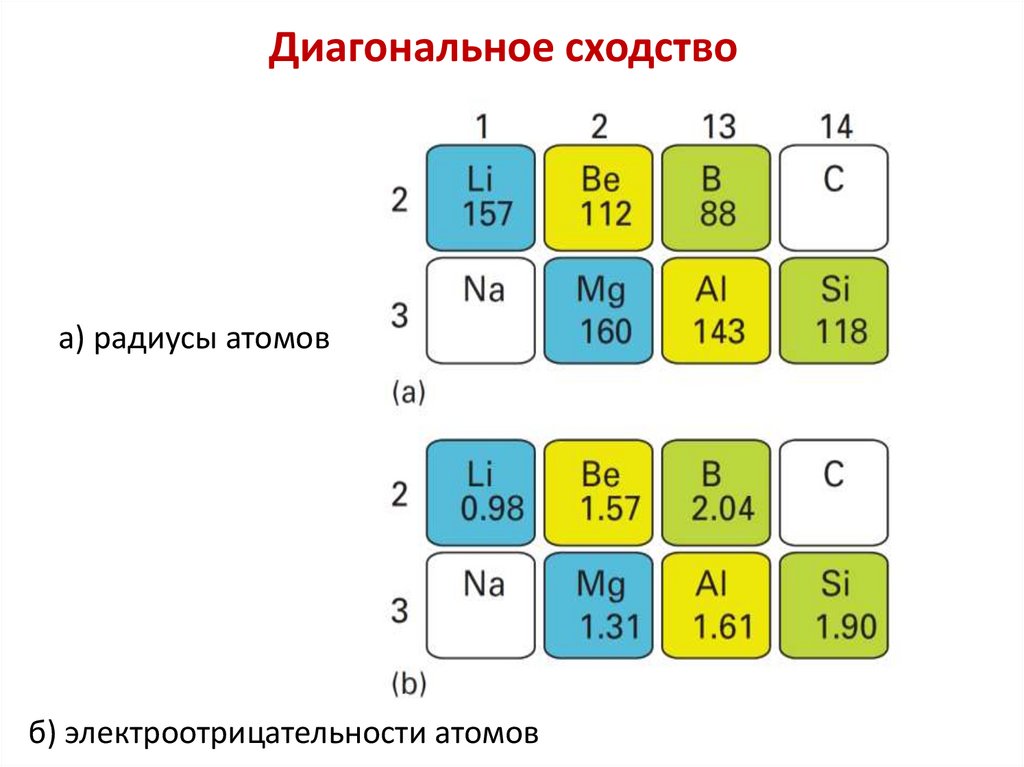
а) радиусы атомовб) электроотрицательности
атомов
Период
Горизонтальная периодичность
Подгруппа
Вертикальная периодичность
— радиусы атомов увеличиваются
— энергии ионизации уменьшаются
— «сродство атомов к электрону» уменьшается
— электроотрицательность уменьшается
— восстановительные свойства усиливаются
— «металличность» усиливается
48.
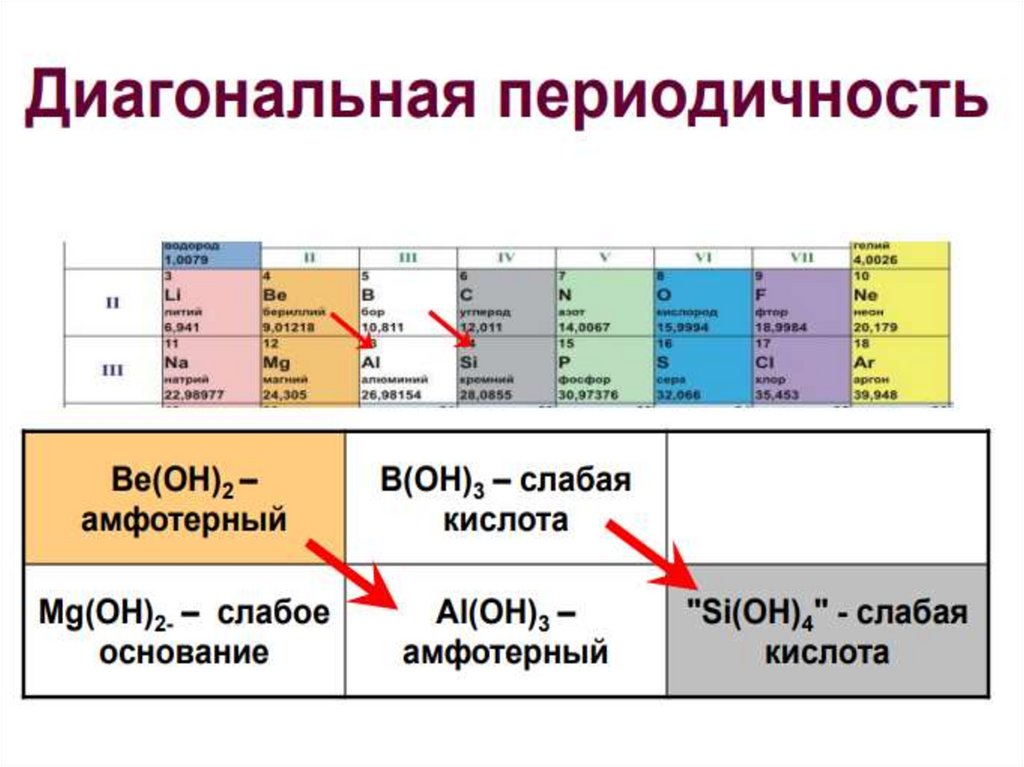
Диагональное сходствоа) радиусы атомов
б) электроотрицательности атомов








































 Химия
Химия








