Похожие презентации:
Химическое равновесие
1. Химическое равновесие
2.
Химическое равновесие — состояниеобратимого процесса, при котором скорости
прямой и обратной реакции равны.
!!! Кинетическое условие равновесия:
пр. обр.
Концентрации веществ или парциальные
давления для газов, установившиеся к
моменту наступления равновесия, называют
равновесными, они остаются постоянными
до нарушения химического равновесия.
3.
Численно химическоеравновесие характеризуется
величиной константы
равновесия KС или KР .
4.
Вывод константы равновесия: KС (KР)Запишем ЗДМ для обратимой реакции
(прямой и обратной реакции):
k пр .
2 HI
H 2 г I 2 г
г
k обр .
В состоянии равновесия скорость
прямой реакции равна скорости
обратной:
k прCH2 CI2 k обрC
2
HI
5.
KC =k пр
k обр
C2HI
=
=const или
CH2 CI2
KР =
k пр
k обр
2
Р HI
=
=const
Р H2 Р I 2
Примечание: Т.к. при Т=const молярные
концентрации газов пропорциональны их
парциальным давлениям, то KС ≠ KР .
K P K C (RT)
n
где n — изменение числа молей газов,
n = n (прод.) – n (исх.)
Если отсутствует газовая фаза, то n = 0.
6.
Константа равновесия KС или KР равнаотношению произведения равновесных
концентраций
(парциальных
давлений)
продуктов реакции в степенях, равных
стехиометрическим
коэффициентам
в
уравнении
реакции,
к
произведению
равновесных концентраций (парциальных
давлений) исходных веществ в степенях,
равных стехиометрическим коэффициентам
в уравнении реакции.
7.
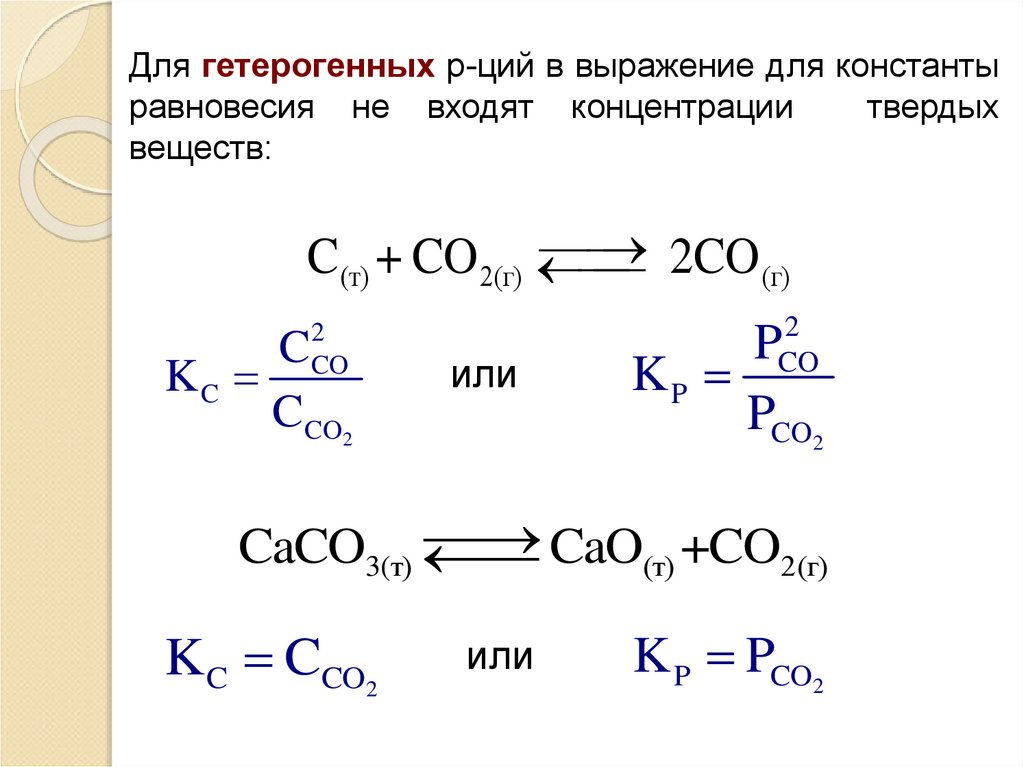
Для гетерогенных р-ций в выражение для константыравновесия не входят концентрации
твердых
веществ:
2CO(г)
C(т) + CO 2(г)
2
CO
C
KC
CCO2
или
2
CO
P
KP
PCO2
CaO(т) +CO2(г)
CaCO3(т)
K C CCO2
или
K P PCO2
8.
!!!Константа равновесия зависит от:
природы реагирующих веществ;
температуры.
Константа равновесия не зависит от:
концентрации (С);
давления (Р);
наличия в системе катализатора.
9.
!!!Физический смысл KС (KР ):
Константа равновесия определяет
глубину протекания процесса к
моменту
достижения
системой
равновесного состояния.
Чем больше значение K, тем с
большей скоростью до достижения
равновесия идет прямая реакция.
10.
Смещение химического равновесияСмещение химического равновесия – переход
системы из одного равновесного состояния в другое,
вызванный неодинаковым изменением скорости
прямой и обратной реакции вследствие изменений
одного из условий (С, Р, Т).
!!!
Если
пр . обр .
– равновесие смещается
→
Если
пр . обр .
– равновесие смещается
←
С течением времени в системе устанавливается
новое
химическое
равновесие,
которое
характеризуется новыми равновесными концентрациями всех веществ в системе.
11.
Направление смещенияравновесия определяется
принципом Ле Шателье:
Если на систему, находящуюся в
равновесии, оказывается внешнее
воздействие,
то
равновесие
смещается в направлении
той
реакции, которая ослабляет это
воздействие.
12.
Принцип Ле Шателье. Частные случаи1. Влияние концентрации на положение равновесия
ЛР 1,
опыт
№4
FeCl3 + 3KCNS ⇄ Fe(CNS)3 + 3KCl
3
пр . kпрС FeCl C KCNS
;
3
С FeCl3 пр .
kпр , C KCNS
соnst
Увеличение скорости прямой реакции приводит к нарушению кинетического условия
равновесия и
равновесие смещается в
направлении реакции, идущей с бо́льшей
скоростью, т.е.
.
13.
!!! При ↑ С исходных веществравновесие
смещается
в
направлении прямой реакции,
и наоборот.
исх. в-ва
⇄
прод. р-ции
Cисх. ↑ →
Cпрод. ↑ ←
Cисх. ↓ ←
Cпрод. ↓ →
14. 2. Влияние давления на положение равновесия
Приувеличении
внешнего
давления
равновесие смещается в сторону реакции,
идущей с уменьшением числа молекул газа
(т.е. в сторону понижения давления), и
наоборот.
N2(г) 3H2(г)
2 NH3(г)
Р↑ : равновесие смещается 1 + 3 → 2
Если в ходе реакции число молекул газа не
изменяется, то давление не влияет на положение
равновесия .
Считаем только моль газа!
15.
3. Влияние температуры на положениеравновесия
При изменении температуры в разной степени
изменяется скорость прямой и обратной реакции.
Для выяснения направления смещения равновесия
необходимо
знать
знак теплового эффекта
реакции.
!!!
При ↑Т равновесие смещается
в направлении
эндотермической реакции (ΔН>O, Q<O),
при ↓ Т равновесие смещается
в направлении
экзотермической реакции (ΔН<O, Q>O).
16. Пример:
1. Как будет влиять увеличение температуры насостояние равновесия в реакции:
2СО2(г)
2СО(г) О 2(г) Q
Как изменится численное значение константы
равновесия реакции при увеличении температуры?
Решение:
Прямая реакция – эндотермическая и при ↑Т в
соответствии с принципом Ле Шателье равновесие
сместится в сторону прямой реакции →.
↑Т смещает равновесие в сторону прямой реакции,
поэтому увеличивается отношение kпр / kобр ,
следовательно, численное значение константы
равновесия увеличится.
17.
Для эндотермической реакции (∆Н > 0) приповышении температуры равновесие смещается
в
сторону
прямой
реакции,
поэтому
увеличивается отношение kпр/ kобр. Следовательно, численное значение константы равновесия
увеличивается.
ЛР 1,
опыт
№5
Для экзотермической реакции (∆Н < 0) при
повышении температуры равновесие смещается
в
сторону
обратной
реакции,
поэтому
уменьшается отношение kпр / kобр. Следовательно, численное значение константы равновесия
уменьшается.
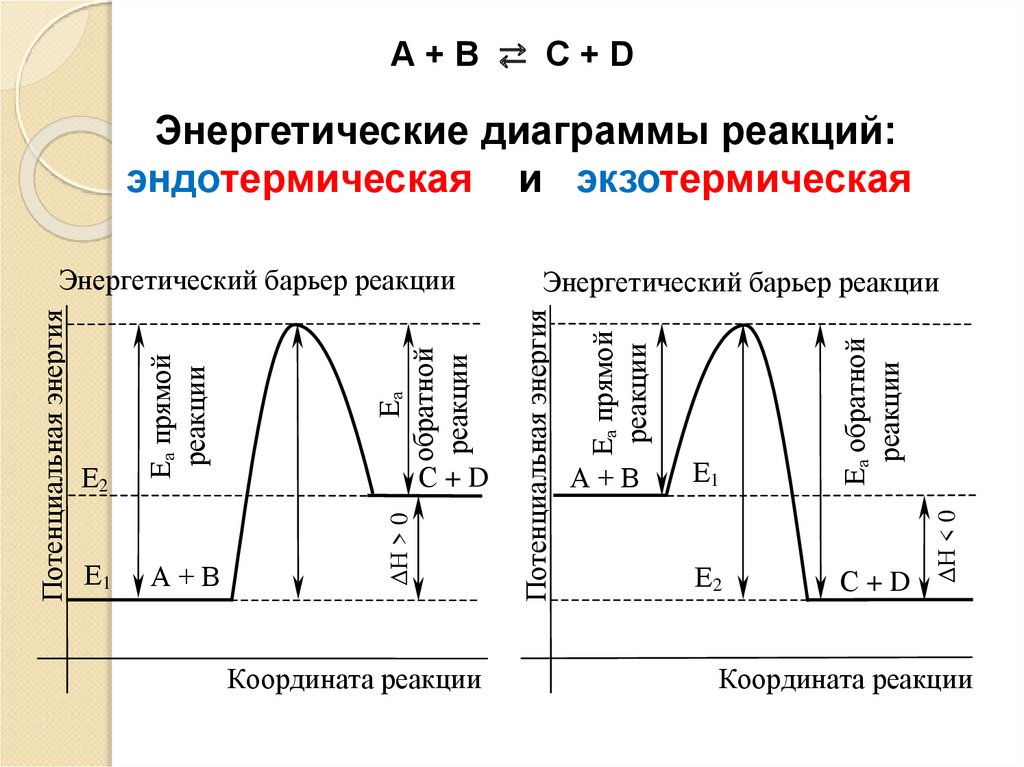
18. Энергетические диаграммы реакций: эндотермическая и экзотермическая
А+В ⇄ С+DЭнергетические диаграммы реакций:
эндотермическая и экзотермическая
Е1
Е2
С+D
ΔH < 0
Еа прямой
реакции
Еа
обратной
реакции
Координата реакции
А+В
Еа обратной
реакции
А+В
Энергетический барьер реакции
Потенциальная энергия
Е1
С+D
ΔH > 0
Е2
Еа прямой
реакции
Потенциальная энергия
Энергетический барьер реакции
Координата реакции
19. Анализ энергетической диаграммы обратимой эндотермической реакции
∆Н = Еапр. – Еаобр.Для эндотермической реакции ∆Н > 0 (Q < 0),
следовательно, Еа пр. > Еа обр. и с увеличением
температуры скорость прямой реакции увеличится
больше, чем скорость обратной (↑kпр > ↑kобр), что
следует из следствия из уравнения Аррениуса (с
увеличением температуры в большей степени
возрастает скорость тех реакций, энергия
активации которых больше). Следовательно,
равновесие смещается в направлении реакции,
идущей с бо́льшей скоростью, т.е.
20. Анализ энергетической диаграммы обратимой экзотермической реакции
ЛР 1,опыт
№5
Анализ энергетической диаграммы обратимой
экзотермической реакции
∆Н = Еапр. – Еаобр.
Для экзотермической реакции ∆Н < 0 (Q > 0),
следовательно, Еа пр. < Еа обр. и с увеличением
температуры скорость обратной реакции увеличится
больше, чем скорость прямой (↑kобр > ↑kпр), что
следует из следствия из уравнения Аррениуса.
Следовательно,
равновесие
смещается
в
направлении реакции, идущей с бо́льшей
скоростью, т.е.
21.
!!!Шпаргалка
Влияние С – см. ЗДМ (руки :)
Влияние Р – см. моль газа
Влияние Т – см. ΔН
22.
Пример:При каком воздействии равновесие
реакции смещается вправо:
1) повышение температуры;
2) уменьшение концентрации водорода;
3) увеличение давления?
2H2(г) + O2(г)
2H2O(г) ,
H <0
23.
Пример:Вычислите константу равновесия реакции, если известны
начальные концентрации реагентов C0(NO) = 4 моль/л,
C0(O2) = 2 моль/л, а к моменту наступления равновесия в
реакцию вступило 80% первоначального количества NO.
2 NO2(г)
2NO(г) О 2(г)
Обозначения:
С0 – исходные концентрации веществ;
С – изменения концентраций исходных веществ
к моменту наступления равновесия;
С – равновесные концентрации веществ.
C0, C и С для исходных веществ реакции связаны
соотношением:
С0 = С + С.
С исходных веществ и равновесные концентрации
продуктов
реакции
пропорциональны
стехиометрическим коэффициентам соответствующих
веществ в уравнении реакции.





















 Химия
Химия








