Похожие презентации:
Химическое равновесие. Термодинамика химического равновесия
1. Химическое равновесие
Термодинамикахимического равновесия
2. Химическое равновесие - состояние системы, при котором прямая и обратная реакции протекают с одинаковыми скоростями, и тенденции к изменен
Химическое равновесие - состояние системы, прикотором прямая и обратная реакции протекают с
одинаковыми скоростями, и тенденции к изменению
концентраций всех участников реакции не наблюдается.
Термодинамически
равновесный
процесс
предполагает бесконечно медленное изменение
всех свойств системы и не оставляет изменений в
окружающей среде.
При химическом равновесии прямая и обратная
реакции протекают с определенными конечными
скоростями и сопровождаются изменениями как
внутри системы, так и в окружающей среде.
3.
В момент равенства скоростей прямой и обратной реакцийсуммарная скорость процесса в целом близка к нулю, то
есть он протекает бесконечно медленно, и для его описания
правомерно
применять
законы
термодинамического
равновесия.
Самопроизвольный
процесс
сопровождается
убылью
свободной энергии, поэтому условием химического
равновесия является её минимум:
GР ,Т i ni 0
i
FV ,Т i ni 0
i
4.
A A B B CC D DV k C A A CB B
V k CC C CD D
C
D
k CC C D
K
k C A A CB B
KС
Ci
i
Сi
i
KР
i
Р
i
i
прод.
i
исх.
прод.
i
i
Р
X
i i прод.
i
(1)
(2)
исх .
i
i
KX
Xi
i
i
исх.
(3)
5.
Константа равновесия химической реакции независит от абсолютных величин Сi , Рi или хi , а только
от их соотношения. В идеальных системах является
истинной термодинамической константой при Т=const.
Ka
ai
i
прод.
Kf
i
a
i
i
исх.
fi
i
прод.
i
fi
i
исх.
i
i
ni
Pi
RT Ci RT
V
(4)
CC CD RT
C D A B
KР A B
A B К С RT
C A CB RT
C
D
C D
K P KC RT
n
(5)
6.
n i прод. i исх.i
i
(6)
Pi Pxi
C
D
( C D )
хC хD Р
C D A B
K Р A B ( A B ) К Х Р
х A хB Р
KP K X P
n
(7)
В отличие от КР и КС константа КХ зависит не только
от температуры, но и от общего давления газовой
смеси.
7.
n 0 K P KC K XОбщее давление газовой смеси не влияет на смещение
равновесия и выход продукта в обратимых реакциях,
протекающих без изменения числа молей газообразных
веществ.
В случае реакции, сопровождающейся увеличением
объема реакционной газовой смеси
(∆n>0),
возрастание давления приводит к смещению равновесия
в сторону обратной реакции и уменьшению выхода
продукта.
Для реакций, протекающих с уменьшением объема
реакционной смеси (∆n<0), возрастание давления
приведет к сдвигу равновесия в сторону образования
продуктов реакции.
8. Уравнение изотермы химической реакции
A A B B C C D Dпри (P,Т)=const:ni i G i i
(8)
i
G С C D D ( A A B B )
i RT ln Pi
0
i
C
(9)
D
PC PD
G C D A B RT ln A B
PA PB
0
C
0
D
0
A
0
B
G C D A B
0
0
C
0
D
0
A
0
B
(10)
(11)
9.
(12)C
D
P
P
G G 0 RT ln C A D B
PA PB
Уравнение изотермы для неравновесного состояния системы:
i
GТ GТ0 RT ln
Pi
i
прод.
i
Pi
i
(13)
исх.
GТ0 – стандартная энергия Гиббса реакции при температуре Т;
Рi – неравновесные парциальные давления реагирующих газов
Уравнение изотермы для равновесного состояния GТ 0 :
i
GТ0 RT ln
i Pi
прод.
i
i Pi
исх.
RT ln K P 2,3RT lg K P (14)
10.
iGТ RT ln K P RT ln
FТ FТ0 RT ln
Ci
i
Pi
i
i
Pi
i
i
Ci
i
i
прод.
(15)
исх.
прод.
(16)
исх.
FТ0 RT ln K C 2,3RT lg K C
(17)
Уравнения изотермы химической реакции (13)-(15) или
(16), (17) позволяют рассчитать константу равновесия по
известной величине ТДП (или наоборот), установить
направление самопроизвольного протекания процесса,
определить состав реакционной смеси в равновесном и
неравновесном состоянии.
11. Зависимость константы равновесия от температуры. Уравнения изобары и изохоры химической реакции.
GТ0 RT ln K PG 0
T
(14)
ln K P
Т
R ln K P Т RT T
Р
P
P
G 0
ln K P
R ln K P RT
T P
T P
0
G
G 0
R ln K P
S 0
T
T P
(18)
(19)
12.
Gln K P
S
RT
T
T P
o
0
G o T S 0 ln K P
2
RT
T P
(20)
(21)
0
ln
K
H
P
2
T
RT
P
d ln K P H 0
dT
RT 2
(22)
0
ln
K
U
C
2
T
RT
V
d ln K C U 0
dt
RT 2
(23)
13. Интегрирование уравнения изобары (изохоры)
При интегрировании уравнения изобарынеобходимо
знать
температурную
0
зависимость энтальпии H f (T ) .
Если расчеты равновесий проводятся на
небольшом температурном интервале,
0
можно принять H const .
14. Интегрирование уравнения изобары
1)2)
H dT
1 d ln К Р
1 2 , H f Т
R
T
0
K Р2
H 1
1
ln
(24)
K p1
R T1 T2
0 2
2
H dT
d ln К Р
2 , H f Т
R T
0
(25)
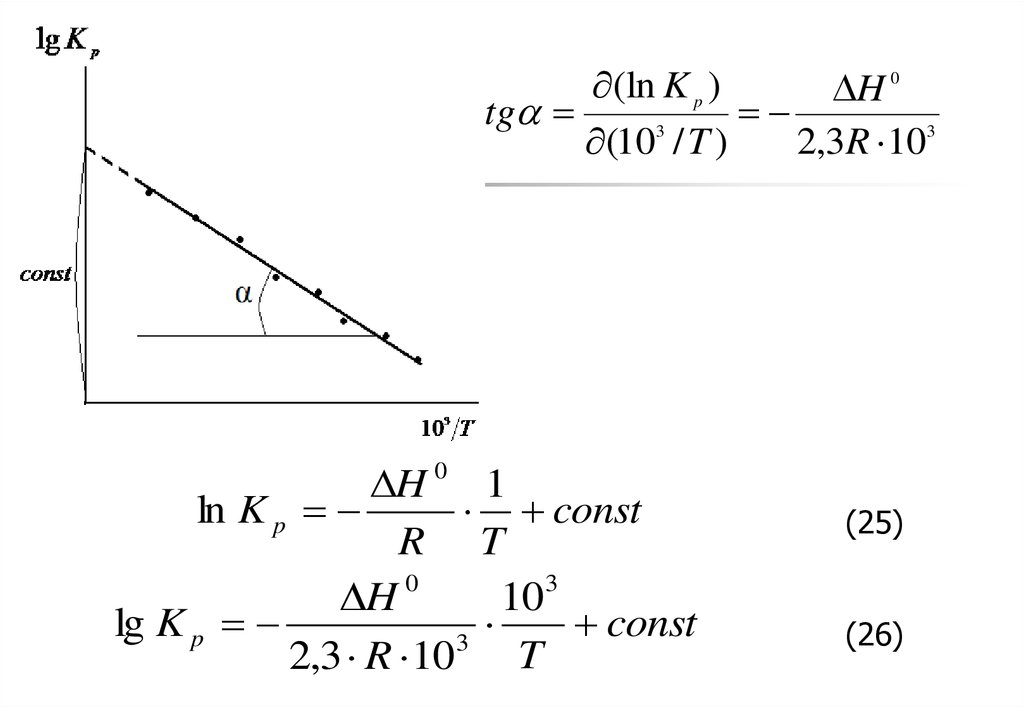
15.
(ln K p )H 0
tg
3
(10 / T )
2,3R 103
H 0 1
ln K p
const
R T
H 0
10 3
lg K p
const
3
T
2,3 R 10
(25)
(26)
16. Уравнения изобары и изохоры как количественная интерпретация принципа Ле Шателье – Брауна.
0d ln K P
H
2
dT
RT
Эндотермическая реакция
Экзотермическая реакция
ln K P
0
ln K P
0
H 0
0 H 0
T P
T P
0
С повышением температуры
величина КР увеличивается,
равновесие
смещается
в
сторону прямой реакции,
выход продукта возрастает.
С повышением температуры
величина
КР
уменьшается,
равновесие
смещается
в
сторону обратной реакции,
выход продукта снижается.
17. Расчет состава равновесной реакционной смеси и равновесного выхода продукта
РАСЧЕТ СОСТАВА РАВНОВЕСНОЙРЕАКЦИОННОЙ СМЕСИ И РАВНОВЕСНОГО
ВЫХОДА ПРОДУКТА
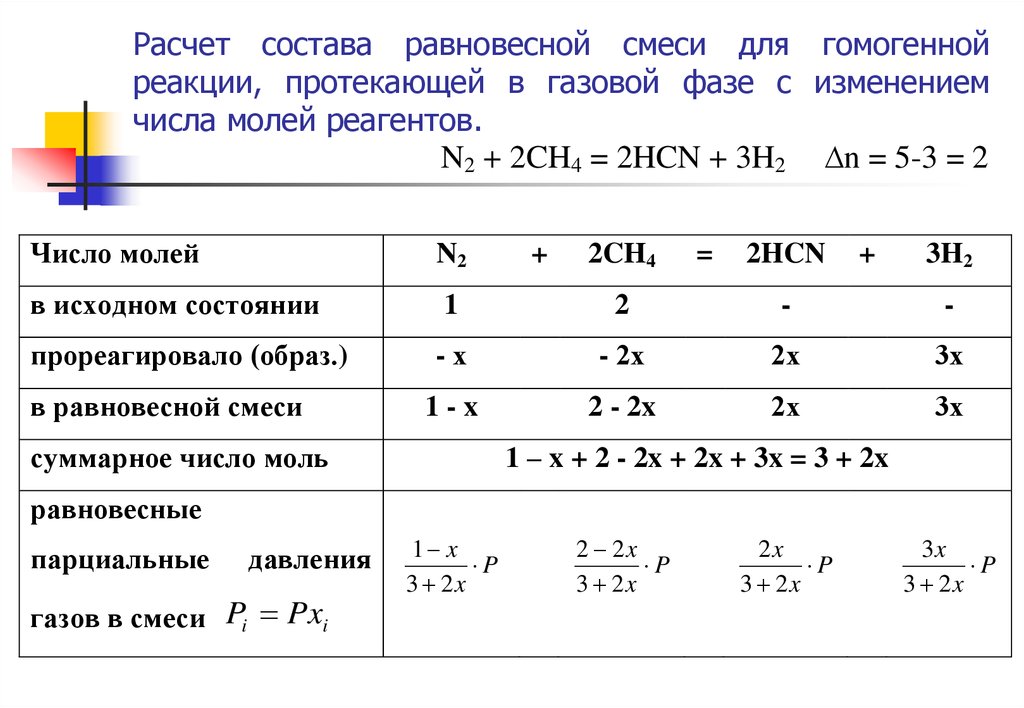
18. Расчет состава равновесной смеси для гомогенной реакции, протекающей в газовой фазе (∆n = 0).
H2 + I2 = 2 HI ,Число молей веществ
H2
в исходном состоянии
1
1
-
прореагировало (образовалось)
-x
-x
2x
1-х
1-х
2x
в равновесной смеси
Дальтона Pi Pxi
I2
=
2 HI
(1 – х) + (1 – х) + 2х = 2
суммарное число моль nΣ
равновесное
парциальное
давление каждого компонента
в соответствии с законом
+
Р
1 х
2
Р
1 х
2
2х
Р
2
19.
22
PHJ
4x
KP
2
PJ 2 PH 2 (1 x)
0
0
0
0
∆




















 Химия
Химия








