Похожие презентации:
Процессы и аппараты нефтегазопереработки и нефтехимии
1. Процессы и аппараты нефтегазопереработки и нефтехимии
Для студентов профиля подготовки«Оборудование нефтегазопереработки»
Часть 1.
2. Содержание
Лекция 1. Введение
Лекция 2. Массообменные процессы.
Лекция 3. Движущая сила. Число единиц переноса. ЧТТ.
Лекция 4. Способы расчета ЧЕП. Равновесные системы.
Лекция 5. Равновесие идеальных растворов
Лекция 6. Равновесие бинарных систем
Лекция 7. Равновесие бинарных систем (продолжение)
Лекция 8. Равновесие взаимно нерастворимых жидкостей
Лекция 9. Основы перегонки
Лекция 10. Ректификация
Лекция 11. Материальный баланс колонны
Лекция 12. Тепловой баланс колонны
Лекция 13. Тепловой баланс колонны (продолжение)
Лекция 14. Способы отвода и подвода тепла
Лекция 15. Ректификация многокомпонентных смесей
Лекция 16. Ректификация МКС (продолжение)
Лекция 17. Азеотропная и экстрактивная ректификация
2
3. Основной учебник
А.И. Скобло, Ю.К. Молоканов,А.И. Владимиров, В.А. Щелкунов
ПРОЦЕССЫ И АППАРАТЫ
НЕФТЕГАЗОПЕРЕРАБОТКИ
И НЕФТЕХИМИИ
ИЦ РГУ нефти и газа имени И.М. Губкина 2012
Москва,Недра (2000, 2002)
УДК 60.011.665.6/7(075.8)
ББК 33.36
3
4. Дополнительная литература
1. Касаткин А.Г. Основные процессы иаппараты химической технологии. – Изд-во
«Альянс», 2006.
2. А.И.Владимиров, В.А.Щелкунов,
С.А.Круглов. Основные процессы и
аппараты нефтегазопереработки. – М.: ООО
«Недра-Бизнесцентр», 2002.
3. Расчеты основных процессов и аппаратов
нефтепереработки. – Справочник под ред.
Судакова Е.Н. – М.: Химия, 1979.
4
5. Введение в курс «Процессы и аппараты»
Лекция 1.ВВЕДЕНИЕ В КУРС
«ПРОЦЕССЫ И АППАРАТЫ»
5
6. Основные понятия и определения
Цель курса:1) Изучение физико-химических основ процессов
нефтегазопереработки и нефтехимии;
2) Ознакомление с принципами устройства
оборудования для осуществления этих
процессов;
3) Изучение основных методов расчета типовых
процессов и аппаратов нефтегазопереработки и
нефтехимии.
6
7. Основные понятия и определения
Процесс - всякое естественное илиискусственное
изменение
положения,
формы или состояния вещества
Движущая сила процесса - стремление
системы к состоянию равновесия
Чем больше система отклоняется от равновесия,
тем выше скорость процесса.
Как правило, скорость процесса пропорциональна
движущей силе.
7
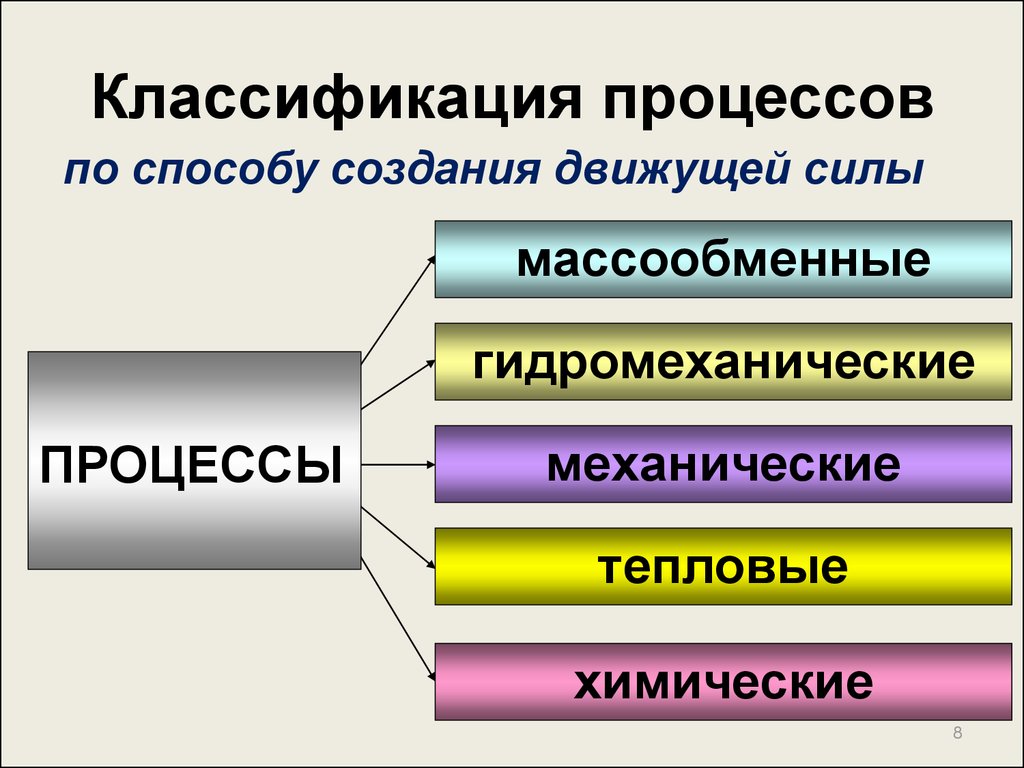
8. Классификация процессов
по способу создания движущей силымассообменные
гидромеханические
ПРОЦЕССЫ
механические
тепловые
химические
8
9. Массообменные процессы
- переход вещества из одной фазы вдругую за счет диффузии
Движущая сила: разность
концентраций вещества между
соответствующими фазами системы
Скорость определяется законами
массопередачи
9
10. Массообменные процессы
1)2)
3)
4)
5)
6)
7)
8)
тв→ж
ж →тв
ж →ж
ж →г
г→ж
ж↔ п
тв→г
г →тв
растворение твердых веществ;
кристаллизация;
экстракция;
испарение жидкости, десорбция;
конденсация паров, абсорбция;
ректификация;
возгонка, десорбция;
адсорбция.
10
11. Гидромеханические процессы
- связаны с переработкой суспензийСуспензия – неоднородная система,
состоящая из жидкости или газов и
взвешенных в них твердых или жидких
частиц
Движущая сила: разность давлений,
обусловленная разностью плотностей.
Скорость определяется законами
гидромеханики
11
12. Гидромеханические процессы
1) перемещение жидкости или газа;2) перемешивание в жидкой среде;
3) разделение жидких
неоднородных систем
(осаждение, фильтрование,
центрифугирование);
4) очистка газов от пыли.
12
13. Механические процессы
- связаны с обработкой твердых тели их перемещением
Движущая сила: разность сил,
давлений, градиент напряжений
(сдвиг, растяжение)
Скорость определяется законами
механики твердых тел
13
14. Механические процессы
1) измельчение;2) рассев;
3) транспортирование;
4) дозирование;
5) смешение.
14
15. Тепловые процессы
- связаны с теплообменомДвижущая сила: разность температур
Скорость определяется законами
теплопередачи
15
16. Тепловые процессы
1)2)
3)
4)
нагревание;
охлаждение;
испарение;
конденсация;
5) плавление;
6) затвердевание;
7) выпаривание;
8) кристаллизация.
16
17. Химические процессы
- связаны с химическимипревращениями участвующих в
процессе веществ и получением
новых соединений
Движущая сила: разность
концентраций реагирующих веществ
Скорость определяется законами
химической кинетики
17
18. Химические процессы
1) каталитический крекинг;2) гидроочистка;
3) риформинг;
4) пиролиз;
5) полимеризация и т.д.
18
19. Классификация аппаратов
.19
с перемешивающими устройствами
с движущимся слоем катализатора;
с фонтанирующим слоем катализатора;
Тепловые
с псевдоожиженным слоем катализатора;
с неподвижным слоем катализатора;
аппараты воздушного охлаждения (АВО).
плавильные печи;
конденсаторы;
испарители;
Механические
холодильники;
теплообменники;
трубчатые печи;
смесители.
дозаторы;
транспортеры;
Гидромеханические
сита;
дробилки;
мешалки
фильтры;
электрофильтры;
циклоны;
центрифуги;
отстойники;
Массообменные
электродегидраторы;
адсорберы
сушилки;
ректификационные колонны;
конденсаторы, абсорберы;
испарители, десорберы;
экстракторы;
кристаллизаторы;
перегонные кубы;
Классификация аппаратов
В основу классификации положен основной процесс, определяющий
назначение аппарата
Аппараты и машины
Химические
(реакторы)
20. Классификация процессов
• по способу осуществления во временипериодические
ПРОЦЕССЫ
непрерывные
20
21. Периодические процессы
• Характеризуются единствомместа проведения и
неустановившимся состоянием во
времени
• Работа делится на определенные
циклы, в течение которых
осуществляются все стадии
процесса
21
22. Непрерывные процессы
• Характеризуются единствомвремени проведения всех стадий
процесса и установившимся
режимом, не зависящим от времени
• Обеспечивается непрерывный
подвод сырья и вывод продуктов
• Установившееся состояние –
среднестатическое
22
23. Расчет процессов и аппаратов
Цель расчета:• определение расходов,
• выбор оптимального режима
работы,
• обоснование размеров,
• выбор конструкции аппарата, узлов,
материала
23
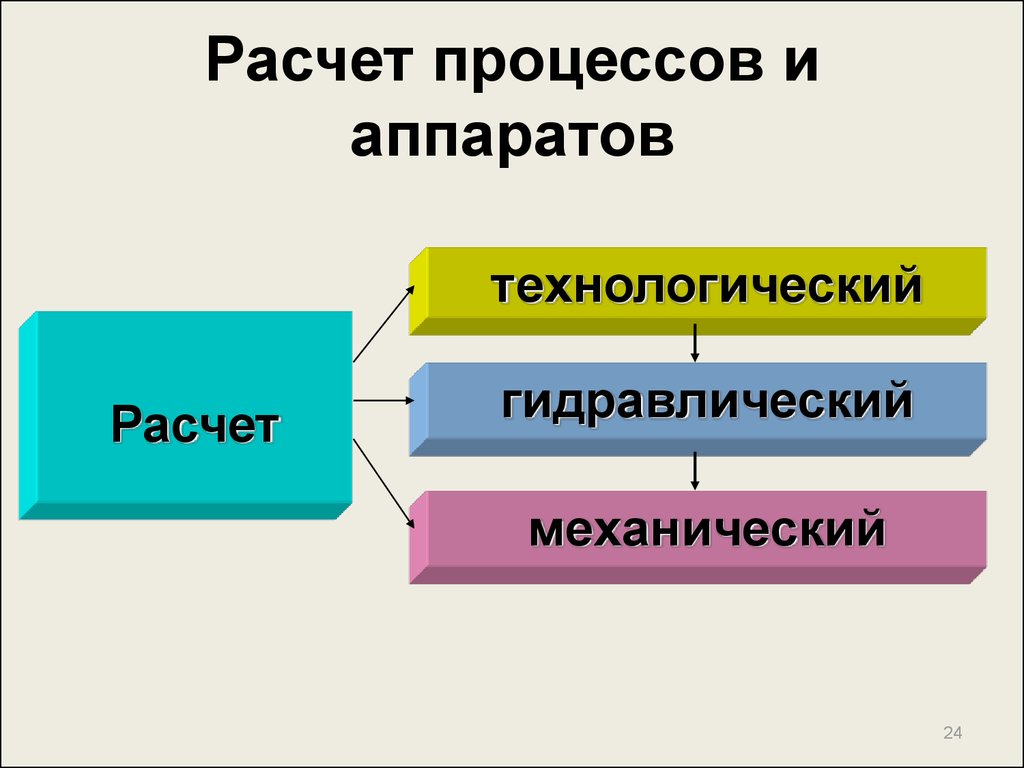
24. Расчет процессов и аппаратов
технологическийРасчет
гидравлический
механический
24
25.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ• обоснование рабочих параметров процесса
(температура, давление),
• определение материальных и тепловых
потоков
ГИДРАВЛИЧЕСКИЙ РАСЧЕТ
• определение размеров рабочих сечений
аппаратов и перепадов давлений,
обеспечивающих работу
МЕХАНИЧЕСКИЙ РАСЧЕТ
• обоснование выбора материала, конструкции
основных элементов, толщины стенки и т.д.,
обеспечивающих безопасную, надежную,
длительную эксплуатацию аппарата
25
26.
проектный1. Проектное задание
2. Технический проект
3. Рабочие чертежи
Расчет
проверочный
- обоснование производительности
аппарата и режима его работы
на основе имеющихся размеров,
проверка возможности
использования аппарата
при заданных рабочих условиях
26
27. Теоретические основы курса
– основные физические законы:– 2-й закон термодинамики,
– законы,
характеризующие
соотношение
между
концентрациями
компонента
в
различных фазах
– основные уравнения, описывающие
процесс:
– материальный баланс;
– энергетический (тепловой) баланс;
– условия равновесия.
27
28. Материальный баланс
По закону сохранения массы:количество веществ, поступающих на
переработку, равно количеству веществ,
получаемых в результате переработки
G нач G кон Gпот
Для периодических процессов баланс составляют
на одну операцию, для непрерывных – за
единицу времени.
Баланс можно составить для всего аппарата или
для отдельной его части, по всем компонентам
или по одному.
28
29. Энергетический баланс
По закону сохранения энергии:количество энергии, введенной в процесс, равно
количеству энергии, получаемой в результате
проведения процесса
Qнач Qкон Qпот
В балансе учитывают энергию:
• поступающую и уходящую вместе с веществами;
• изменения агрегатного состояния веществ;
• отдельно от веществ (обогрев, потери тепла,
работа насосов или компрессоров)
29
30. Материальные и тепловые балансы
1) Внешние:2) Внутренние:
для завода
для установки
для аппарата
для части аппарата
30
31. Условия равновесия
характеризуют статику процесса и показываютпределы, до которых может протекать данный
процесс
31
32. Понятие о концентрации
Концентрация – относительноесодержание отдельного
компонента в смеси или доля
данного компонента в смеси
32
33. Способы выражения состава фаз
в массовых концентрациях:gi
gi
xi
n
g
gi
i 1
n
n
gi
xi 1
i 1
i 1 g
Gi
Gi
yi
n
G
Gi
i 1
n
n
Gi
yi 1
i 1
i 1 G
33
34. Способы выражения состава фаз
в мольных концентрациях:Ni
Ni
xi
n
N
Ni
i 1
n
n
Ni
xi
1
i 1
i 1 N
Ni
Ni
yi
n
N
Ni
i 1
n
n
Ni
yi
1
i 1
i 1 N
34
35. Способы выражения состава фаз
в объёмных концентрациях;Vi
Vi
vi n
V
Vi
i 1
n
n
Vi
vi 1
i 1
i 1 V
35
36. Взаимный пересчет массовых и мольных концентраций
xiN i M i
N i M i
g
N
n
n N M
g
i
i
N i M i
i 1
i 1 N
i
n
i 1
i
xi M i
n
x M
i 1
i
i
36
37. Взаимный пересчет массовых и мольных концентраций
gigi
M
g
M
N
i
i
x
n gi
n gi
N
i 1M i i 1 g M i
i
i
n
i 1
i
xi
Mi
n
xi
i 1 M i
37
38. Средняя мольная масса смеси
nM cp xi M i
i 1
1
n
xi
i 1 M i
38
39. Массообменные процессы
Лекция 2.МАССООБМЕННЫЕ
ПРОЦЕССЫ
39
40. Основные признаки массообменных процессов
1) применяют для разделения смесей,2) участвуют две фазы,
3) вещество переходит из одной фазы в другую за
счет диффузии,
4) движущей силой является разность концентраций,
y – yp
или
х - хр
40
41. Основные признаки массообменных процессов
5) перенос вещества происходит через границураздела фаз;
6) все массообменные процессы обратимы,
направление процесса определяется законами
фазового равновесия, фактическими
концентрациями компонента в фазах и внешними
условиями (t, p);
7) переход вещества из одной фазы в другую
заканчивается при достижении динамического
равновесия.
41
42. Основное уравнение массопередачи
Скорость любого процесса определяетсяколичеством вещества М (кг), перешедшего из
одной фазы в другую через поверхность контакта
фаз площадью F (м2) за время τ (час).
• Движущая сила – разность между рабочей (y,
х) и
равновесной (yр, хр) концентрациями компонента,
переходящего из одной фазы в другую.
• Сопротивление процессу массопереноса R
обусловлено сопротивлением пограничной пленки
переходу компонента из одной фазы в другую
42
43. Основное уравнение массопередачи
Скорость массопередачи по газовой фазе:y y p y
M
R
R
F
1
Ky
R
Ky – коэффициент массопередачи или скорости
массобменного процесса,
характеризует массу вещества, переданную из фазы
в фазу через единицу поверхности в единицу
времени при движущей силе, равной единице
43
44. Основное уравнение массопередачи
Разность концентраций изменяется во времени,поэтому используем среднюю величину движущей
силы (индекс m):
или
M
K y y m
F
M
KyF
y
m
, кг
44
45. Основное уравнение массопередачи
Размерность коэффициента массопередачи:кг
M
2
Ky
F y m м ед.дв.с. ч
Размерность движущей силы для газовой и жидкой фаз:
кг/м3, кг/кг, м3/м3, моль/моль, моль/м3;
и только для газовых фаз:
кГ/см2, Па, мм рт.ст. и т.д.
45
46. Основное уравнение массопередачи
по жидкой фазе:M K x F xm
K y
xm x p x
y
m
K x xm
За 1 час:
M
KyF
y
m
KxF
x
m
, кг/ч
46
47. Материальный баланс массообменного процесса
Переход вещества изгазовой фазы в жидкую
G – расход газовой фазы
L – расход жидкой фазы
y, x – содержание
переходящего компонента
в газовой и жидкой фазах
yн>yк
x н< x к
Gyн Lxн Gyк Lxк
47
48. Материальный баланс массообменного процесса
Количество переданной массы по всему аппарату:M G yн yк L xк xн
L
G
- уравнение материального баланса
- относительный расход
yн yк
жидкой фазы на единицу массы
l
xк xн
(объёма) газовой фазы
G L
xк xн
y y
н
к
y y
L G
н
к
xк xн
- уравнения расхода фаз
48
49. Материальный баланс массообменного процесса
Материальный баланс нижней части аппарата досечения а-а:
G
y
н
y L x x
к
L
L
y x y н xк
G
G
- уравнение рабочей линии
(линии концентраций, оперативной линии)
- показывает изменение концентраций переходящего
компонента в парах и в жидкости по высоте аппарата
49
50. Материальный баланс массообменного процесса
LA
G
L
B y н xк
G
С( x; y )
y
С
- характеризует
концентрации
переходящего
компонента во
встречных потоках пара
и жидкости в сечении а-а
x
50
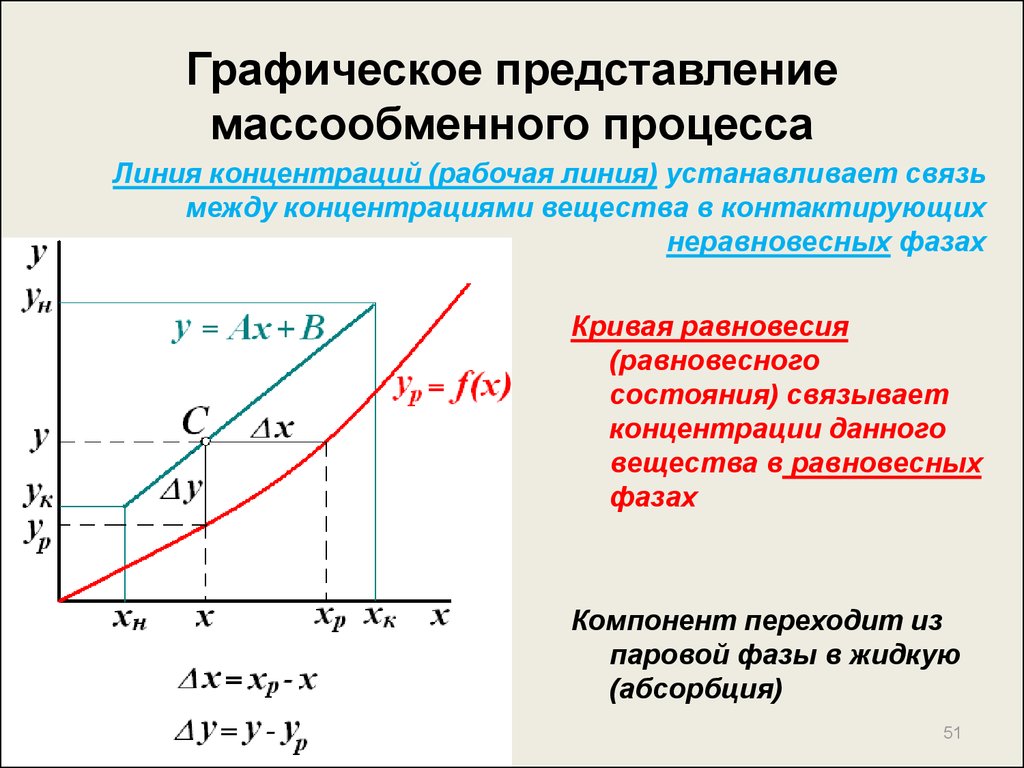
51. Графическое представление массообменного процесса
Линия концентраций (рабочая линия) устанавливает связьмежду концентрациями вещества в контактирующих
неравновесных фазах
Кривая равновесия
(равновесного
состояния) связывает
концентрации данного
вещества в равновесных
фазах
Компонент переходит из
паровой фазы в жидкую
(абсорбция)
51
52. Графическое представление массообменного процесса
Компонент переходит изжидкой фазы в паровую
(десорбция)
52
53. Средняя движущая сила массообменного процесса. А. Средняя интегральная движущая сила
Дифференциальное уравнение материальногобаланса:
dM Gdy
Дифференциальное уравнение массопередачи:
dM K y y y p dF
G dy
dF
K y y y p
y dy
G
F
K y y y
н
y
к
p
53
54. Средняя движущая сила массообменного процесса. А. Средняя интегральная движущая сила
GS
F
Ky
M G yн yк
yн
dy
y y
y
M
F
K y y
к
y
н
p
к
54
55. Средняя движущая сила массообменного процесса. А. Средняя интегральная движущая сила
yy
M K F y
dy
y y
y
н
к
y
н
к
p
M K F y
y
y
cp
y y
y dy
y y
y
н
x
x
x x
dx
x xp x
к
к
cp
н
к
cp
p
н
к
н
55
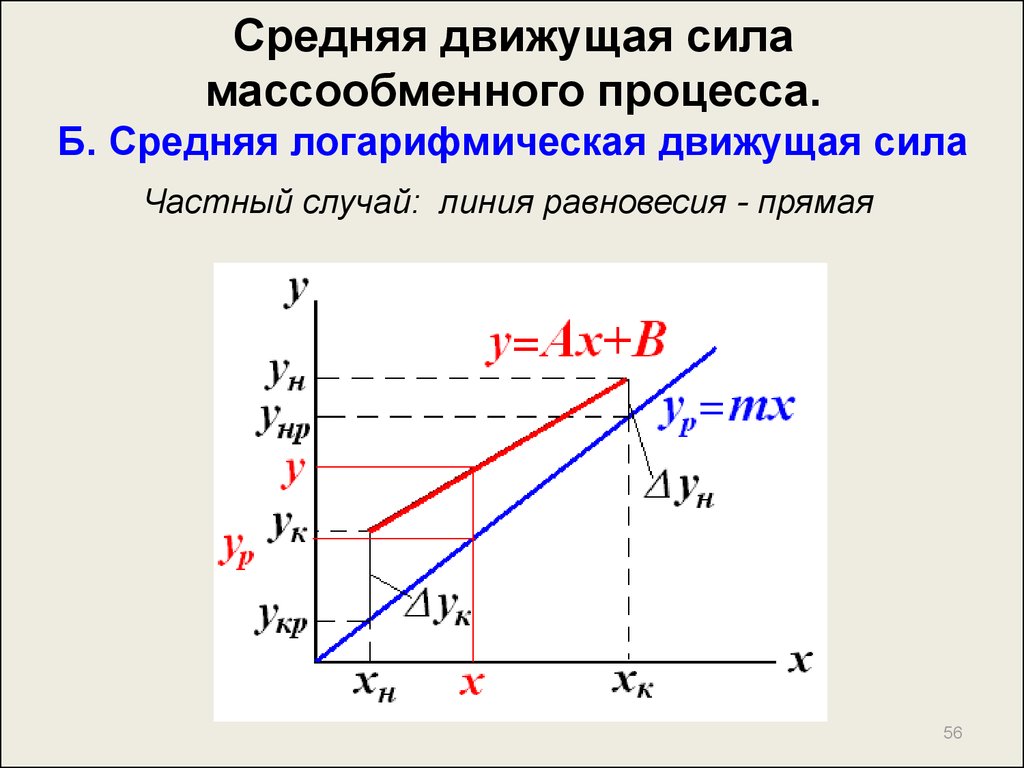
56. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
Частный случай: линия равновесия - прямая56
57. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
dM Gdy LdxdM
dy
G
y p mx
dM
dx
L
dM
dy p mdx m
L
1 m
dM
dM
m
dM
d y y p dy dy p
G
L
G L
57
58. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
d y y pK y dF y y p
dM
m
1
G
L
d y y p
1
dF
1 m y y p
Ky
G L
58
59. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
F1
1
K y
G
y н
ln
m y к
L
M G y y L xк x
н
M
G
yн yк
н
к
xк
y нp
m
xн
y кp
m
59
60. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
ML
xк
1
xн
m
y
нp
y кp
1 m
M y н y к y нp y кp y н y к
G L
y н
M
ln
F
K y y н y к y к
60
61. Средняя движущая сила массообменного процесса. Б. Средняя логарифмическая движущая сила
y н y кM KyF
y н
ln
y к
y н y к
y cp
y н
ln
y к
x к x н
x cp
x к
ln
x н
61
62. Лекция 3
ЛЕКЦИЯ 362
63. Число единиц переноса. Число теоретических тарелок
.ЧИСЛО ЕДИНИЦ ПЕРЕНОСА.
ЧИСЛО ТЕОРЕТИЧЕСКИХ
ТАРЕЛОК
63
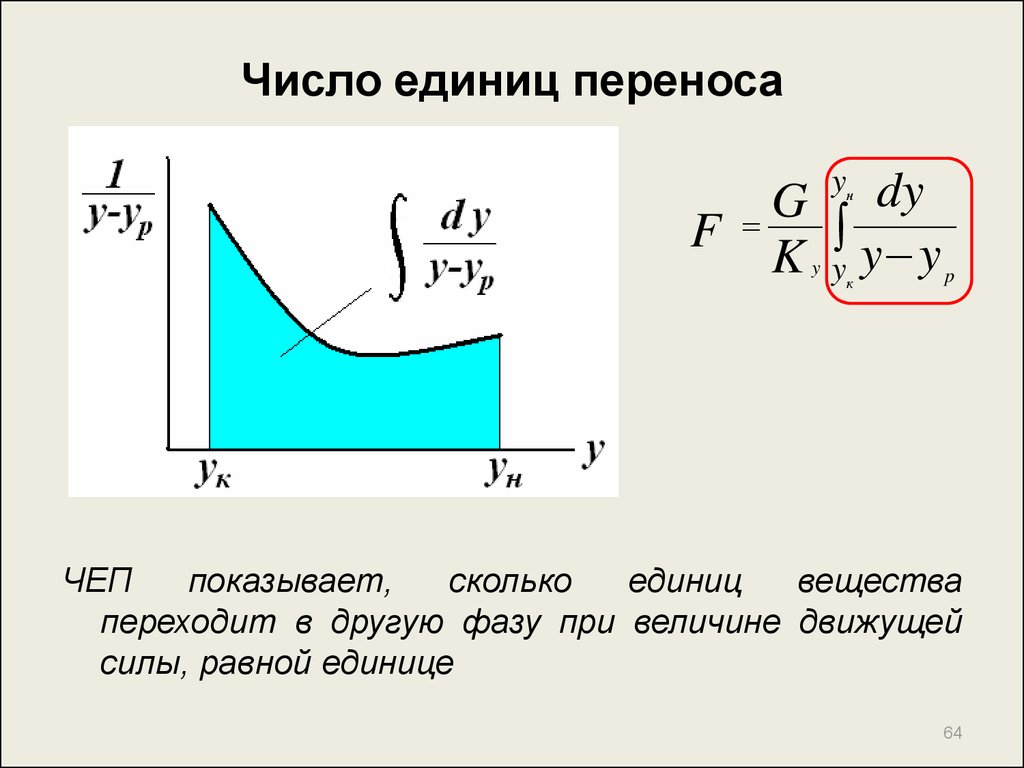
64. Число единиц переноса
yнdy
G
F y y
K y
y
к
p
ЧЕП
показывает,
сколько
единиц
вещества
переходит в другую фазу при величине движущей
силы, равной единице
64
65.
Число единиц переносаy н dy
my
yк y y p
yн yк
x к dx
mx
xp x
xн
yн yк
KyF
G yн yк
M KyF
y н dy
my
yк y y p
G
m y f Vнас f San H нас
F
Ky
- f, м2/м3 – удельная поверхность фазового контакта (насадки)
65
66.
Число единиц переносаH нас
h эy
h эx
G
f S an K y
Gg
f Ky
Lg
f Kx
my
Gg
G
S an
H hэy m y
H hэx m x
66
67.
Число единиц переносаyн yк
my
ycp
yн yк
m y y y
н
к
y н
ln
y к
x
к xн
mx
xcp
xн
x
к
mx
xк xн
xк
ln
xн
67
68. Число теоретических тарелок
Теоретическая тарелка – контактное устройство, котороеобеспечивает получение равновесных потоков фаз,
покидающих контактную зону (т.е. приводит систему в
состояние равновесия).
Число теоретических ступеней контакта, или ЧТТ, может быть
рассчитано аналитическим или графическим методом при
совместном решении уравнений равновесия и рабочей линии
процесса.
Одна теоретическая тарелка выражает одно изменение
движущей силы по газовой Δy и одно изменение по
жидкой Δx фазам.
68
69. Число теоретических тарелок
6970. Коэффициент полезного действия
1) локальный или точечный к.п.д.2) к.п.д. тарелки
3) к.п.д. колонны
70
71. Коэффициент полезного действия
Локальный к.п.д. представляет собой отношение изменениясостава пара или жидкости в данной точке тарелки к
изменению состава при достижении равновесной
концентрации
y
y* K x x*
K
y y n 1
oy
y* y n 1
x n 1 x
ox
xn 1 x*
71
72. Коэффициент полезного действия
К.п.д. тарелки или к.п.д. Мерфри, представляет собойотношение изменения среднего состава паров или
жидкости на тарелке к изменению состава при
достижении равновесной концентрации
my
y n 1 y n
y* n 1 y n
EG
x
n 1 x n
EL
mx
xn 1 x* n
- эффективность (к.п.д.) по
парам
- эффективность (к.п.д.) по
жидкости
72
73. Коэффициент полезного действия
BK yn 1( K ) ynТу
BA y*n 1 ( A ) yn
По значению локального к.п.д. и к.п.д. тарелки Мерфри оценивается
эффективность тарелки.
Соотношение между ними определяет степень смешения жидкости на
тарелке, при полном перемешивании жидкости и пара их значения
совпадают для каждой фазы.
73
74. Коэффициент полезного действия
К.п.д. колонны представляет собой отношение числатеоретических тарелок к действительному числу
тарелок, необходимых для разделения смеси.
N теор
N факт
Эффективность колонны как кинетическая характеристика
зависит от соотношения потоков жидкости и пара, плотностей,
вязкостей, и др.
К.п.д. колонны η является усредненным для всей колонны.
74
75. Коэффициент полезного действия
• Для насадочных колонн отношение полной высоты слоянасадки к числу теоретических тарелок (ЧТТ) на этой
высоте называется высотой, эквивалентной
теоретической тарелке (ВЭТТ)
Нэ
H H э N теор
H hТ N факт
75
76. Способы расчета числа единиц переноса
Лекция 4.СПОСОБЫ РАСЧЕТА ЧИСЛА
ЕДИНИЦ ПЕРЕНОСА
76
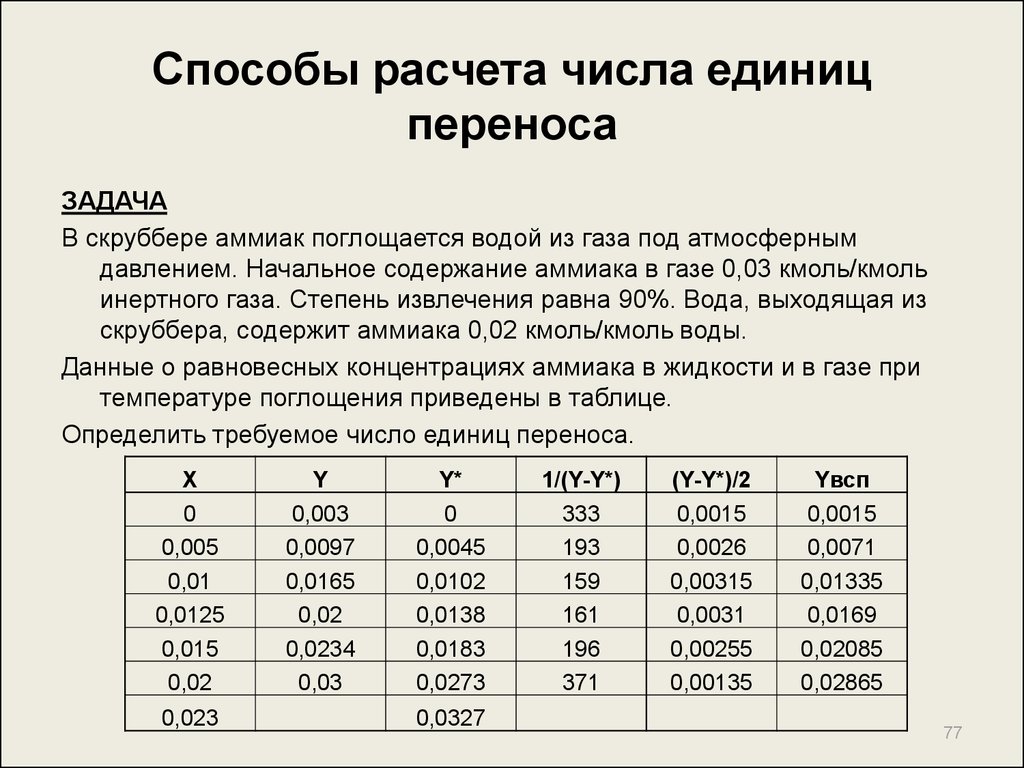
77. Способы расчета числа единиц переноса
ЗАДАЧАВ скруббере аммиак поглощается водой из газа под атмосферным
давлением. Начальное содержание аммиака в газе 0,03 кмоль/кмоль
инертного газа. Степень извлечения равна 90%. Вода, выходящая из
скруббера, содержит аммиака 0,02 кмоль/кмоль воды.
Данные о равновесных концентрациях аммиака в жидкости и в газе при
температуре поглощения приведены в таблице.
Определить требуемое число единиц переноса.
X
0
0,005
0,01
0,0125
0,015
0,02
0,023
Y
0,003
0,0097
0,0165
0,02
0,0234
0,03
Y*
0
0,0045
0,0102
0,0138
0,0183
0,0273
0,0327
1/(Y-Y*)
333
193
159
161
196
371
(Y-Y*)/2
0,0015
0,0026
0,00315
0,0031
0,00255
0,00135
Yвсп
0,0015
0,0071
0,01335
0,0169
0,02085
0,02865
77
78. Первый способ расчета ЧЕП – графическим построением
1) По данным таблицы строим рабочую линию и кривуюравновесия.
2) Отрезки ординат между рабочей и равновесной линиями
разделим пополам; через их середины проведем
вспомогательную пунктирную линию.
3) Начиная от т.С строим ступенчатую линию таким образом,
чтобы горизонтальные отрезки этой линии также делились
вспомогательной линией пополам (ab=bc).
4) Каждая из полученных ступеней будет равна одной единице
переноса, т.е каждой ступени соответствует такой участок
аппарата, на котором изменение рабочей концентрации равно
средней движущей силе на этом участке.
78
79. Первый способ расчета ЧЕП – графическим построением
m y ,iYn 1 Yn Yn 1 Yn
1
Ycp
Yn 1 Yn
n
m y m y ,i
i 1
m y 5 ,82
79
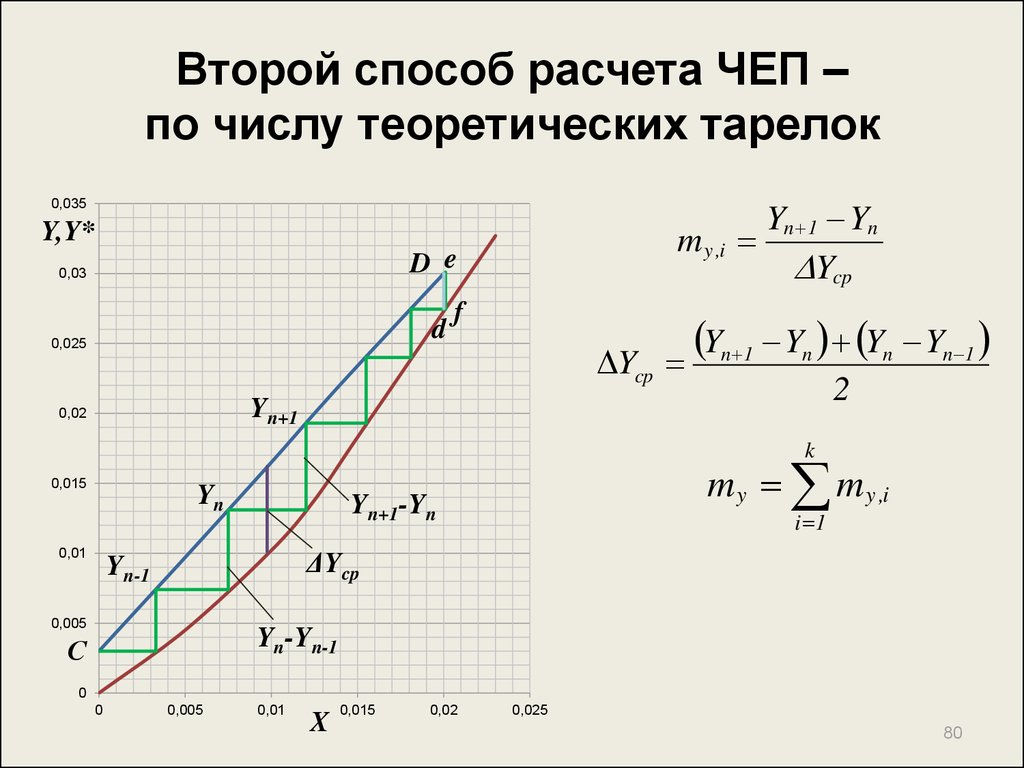
80. Второй способ расчета ЧЕП – по числу теоретических тарелок
0,035Y,Y*
m y ,i
D e
0,03
d
0,025
f
Ycp
Yn 1 Yn
Ycp
Yn 1 Yn Yn Yn 1
2
Yn+1
0,02
k
0,015
Yn
0,01
m y m y ,i
Yn+1-Yn
i 1
ΔYcp
Yn-1
0,005
Yn-Yn-1
С
0
0
0,005
0,01
X
0,015
0,02
0,025
80
81. Третий способ расчета ЧЕП – графическим интегрированием
400350
Yн
dY
my ,i S
Yк Y Y *
300
1/(Y-Y*)
250
200
150
S
100
50
0
0
0,005
0,01
0,015
0,02
0,025
0,03
0,035
Y
81
82. РАВНОВЕСНЫЕ СИСТЕМЫ. РАВНОВЕСИЕ ИДЕАЛЬНЫХ РАСТВОРОВ
Лекция 5.РАВНОВЕСНЫЕ СИСТЕМЫ.
РАВНОВЕСИЕ ИДЕАЛЬНЫХ
РАСТВОРОВ
82
83. Равновесные системы
При взаимодействии фаз системы через поверхность разделапроисходит обмен веществом и энергией.
В том случае, когда скорость перехода молекул жидкости в паровую
фазу равна скорости их возвращения в жидкость, система находится
в динамическом равновесии.
Равновесной системой называется такая система, которая может
существовать неограниченно долго без каких-либо качественных или
количественных изменений.
Условия существования равновесия:
1) постоянство температуры и давления во всех точках системы;
2) сосуществование фаз, т.е. их контакт.
83
84. Применение правила фаз к процессам перегонки
Компонентами системы называются тесоставные части, концентрация
которых может претерпевать изменения
в различных фазах.
Состояние равновесия подчиняется
правилу фаз Гиббса:
L=n+2–N
84
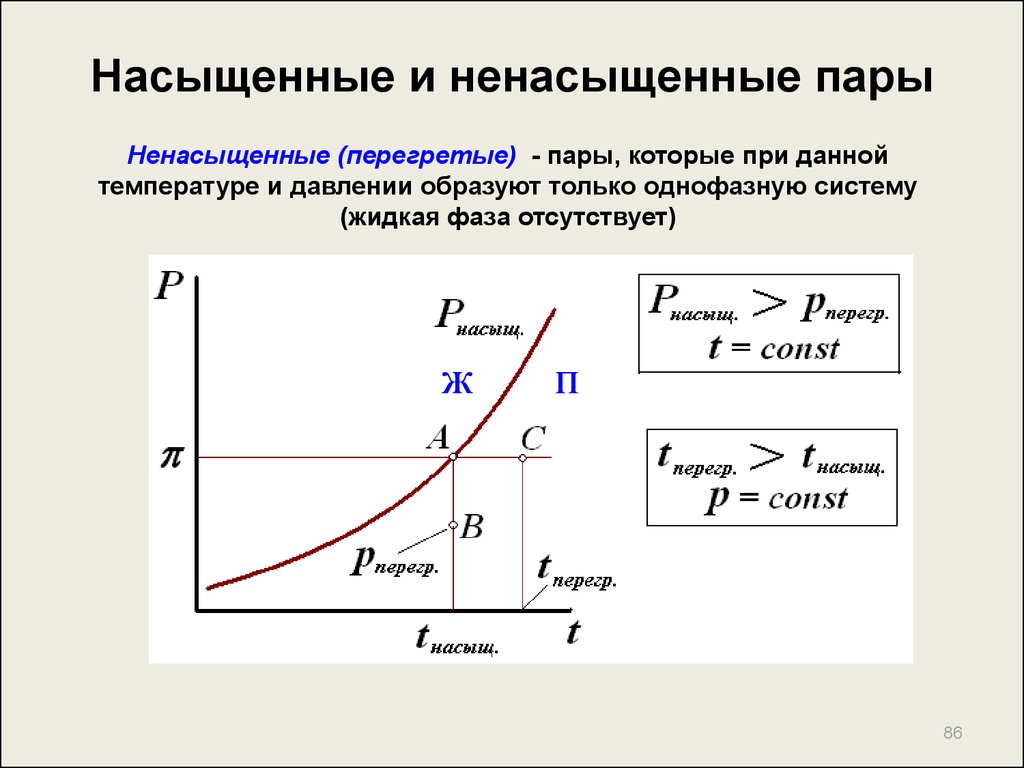
85. Насыщенные и ненасыщенные пары
Насыщенный – пар, находящийся в равновесии
(сосуществующий) с жидкостью
Давление насыщенных паров – давление, производимое паровой
фазой, находящейся в равновесии с жидкостью при
определенной температуре
Давление Р, производимое
молекулами над жидкостью на
стенки сосуда, принято
называть
упругостью пара
или
давлением насыщенных
паров
85
86. Насыщенные и ненасыщенные пары
Ненасыщенные (перегретые) - пары, которые при даннойтемпературе и давлении образуют только однофазную систему
(жидкая фаза отсутствует)
ж
п
86
87. Насыщенные и ненасыщенные пары
Уравнение АнтуанаB
lg P A
C t
А, В, С – константы, зависящие от свойств веществ
B
t
C
A lg P
87
88. Классификация бинарных смесей жидкостей
8889. Равновесие идеальных растворов
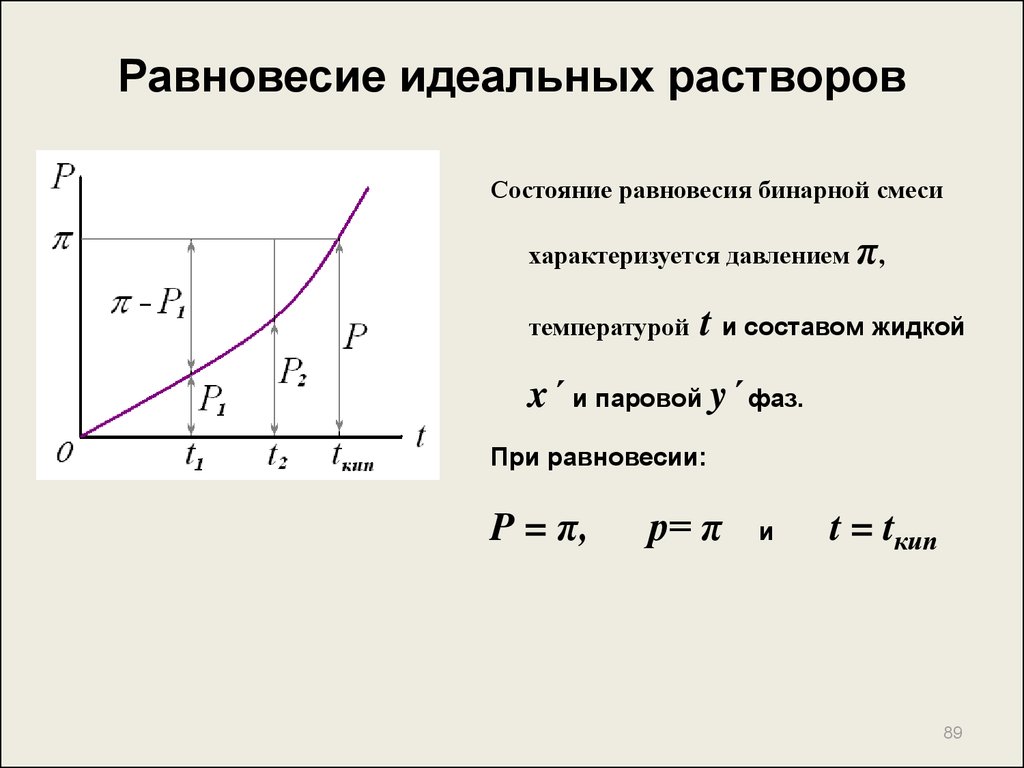
Состояние равновесия бинарной смесихарактеризуется давлением π,
температурой
t и составом жидкой
x´ и паровой y´ фаз.
При равновесии:
P = π,
р= π
и
t = tкип
89
90. Равновесие идеальных растворов
Закон ДальтонаДавление смеси газов равно сумме парциальных давлений
pa pw
Парциальное давление – давление отдельных газов, которое они
имели бы, если каждый газ занимал бы при данной температуре
объем всей смеси.
p a y'
p w 1 y'
90
91. Равновесие идеальных растворов
Закон РауляПарциальное давление одного из компонентов, входящих в состав
раствора, равно произведению упругости пара чистого компонента
при данной температуре на его мольную долю в жидкой фазе
p a P1 x'
p w P 2 1 x'
p aw pa pw P1 x' P2 1 x'
уравнение изотермы идеального раствора
91
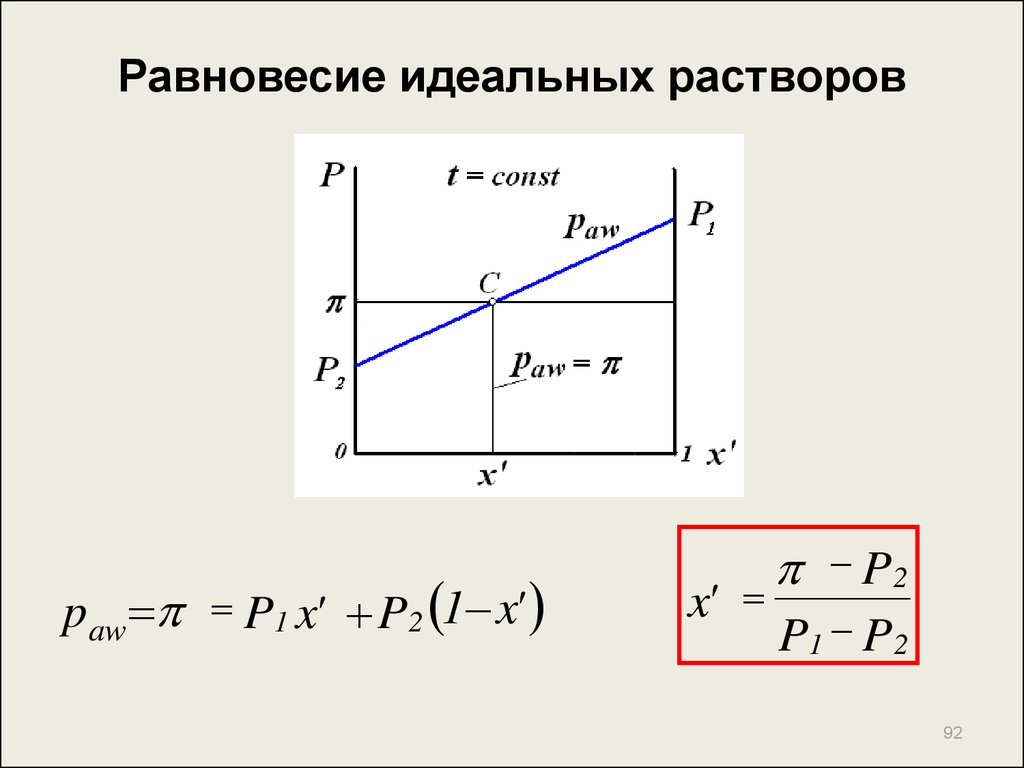
92. Равновесие идеальных растворов
paw P1 x' P2 1 x'x'
P2
P1 P 2
92
93. Равновесие идеальных растворов
При равновесии:p a P1 x' y'
p w P2 1 x' 1 y'
y'
P1
x'
1 y' P2 1 x'
93
94. Равновесие идеальных растворов
y' 1 y'1
paw P1
P2
- уравнение изотермы паровой фазы
Для точки С´:
1
1 y' 1 y'
paw P1
P2
Константы фазового равновесия:
y'
x'
P
1
1 y'
K1
1 x'
P
2
K2
94
95. Равновесие идеальных растворов Графический метод расчета равновесных составов фаз
P1P
P
P1
paw, ж
P2
paw, п
C
pa, n
K
K´
P2
pa, ж
0
D
C´
ta
t
tw
pa
0
pa
x´
pa, ж =P1x´
1 x´,y´
y´
pa, n = y´
95
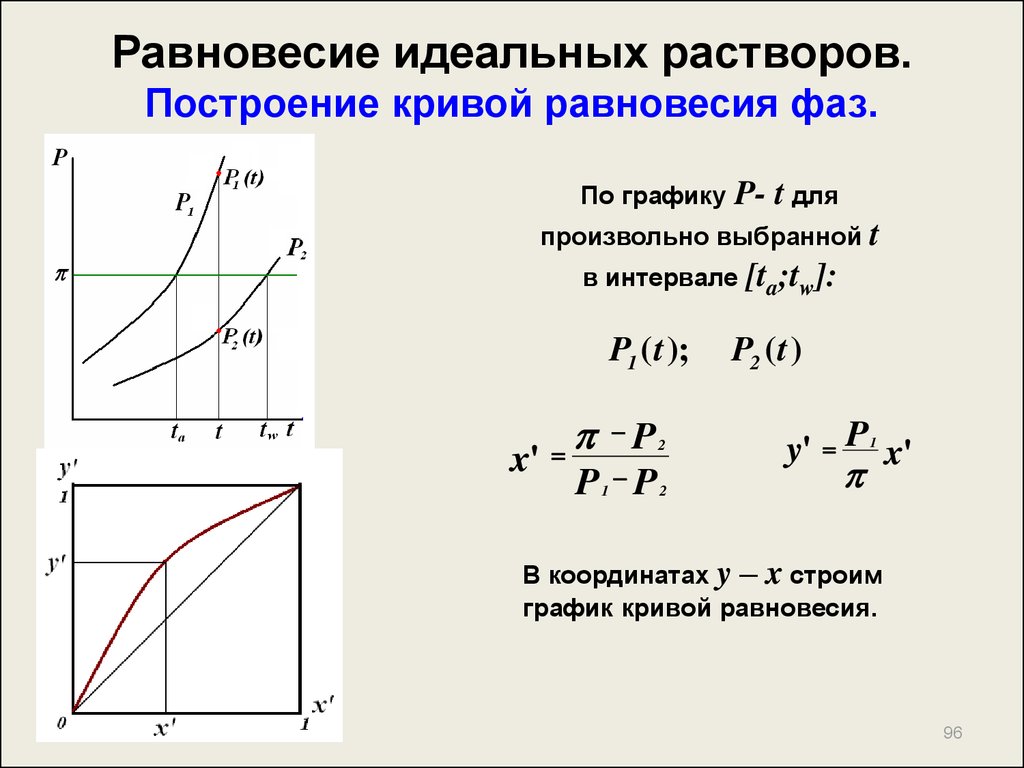
96. Равновесие идеальных растворов. Построение кривой равновесия фаз.
По графикуP- t для
произвольно выбранной t
в интервале
P1 ( t );
x'
P
P P
1
2
2
[ta;tw]:
P2 ( t )
y' P x'
1
В координатах y – x строим
график кривой равновесия.
96
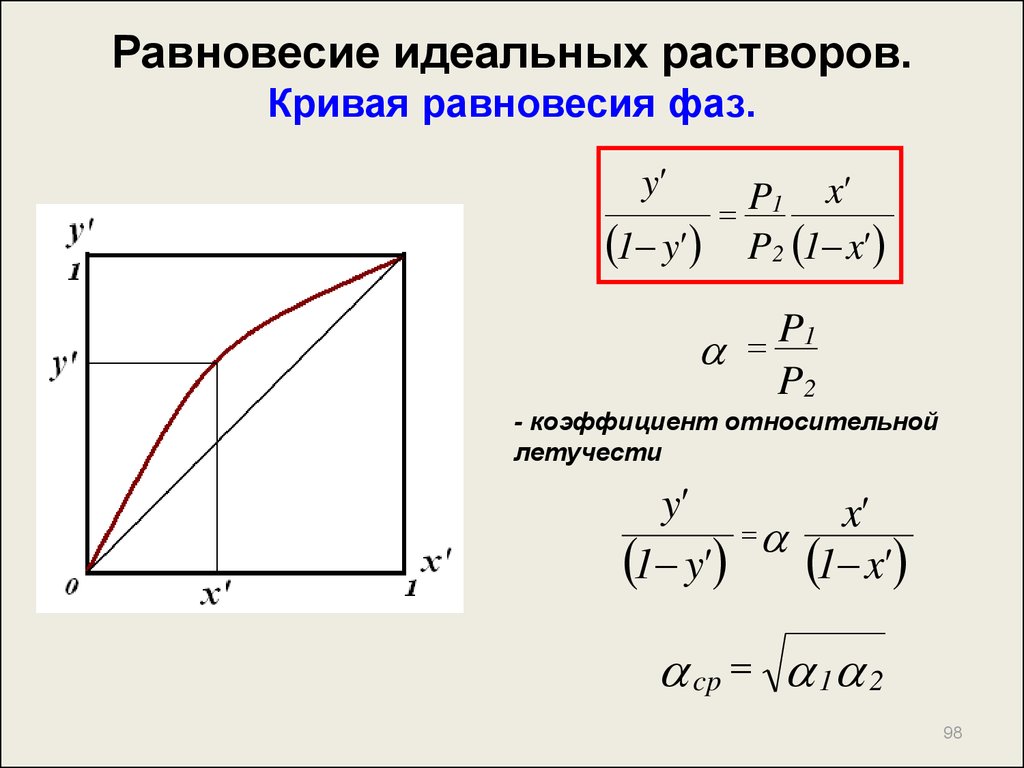
97. Равновесие идеальных растворов. Кривая равновесия фаз.
При равновесииy' P1 x'
1 y'
P2 1 x'
y'
x'
P
1
1 y' P2 1 x'
- уравнение кривой равновесия фаз
97
98. Равновесие идеальных растворов. Кривая равновесия фаз.
y'x'
P
1
1 y' P2 1 x'
P1
P2
- коэффициент относительной
летучести
y'
x'
1 y' 1 x'
cp 1 2
98
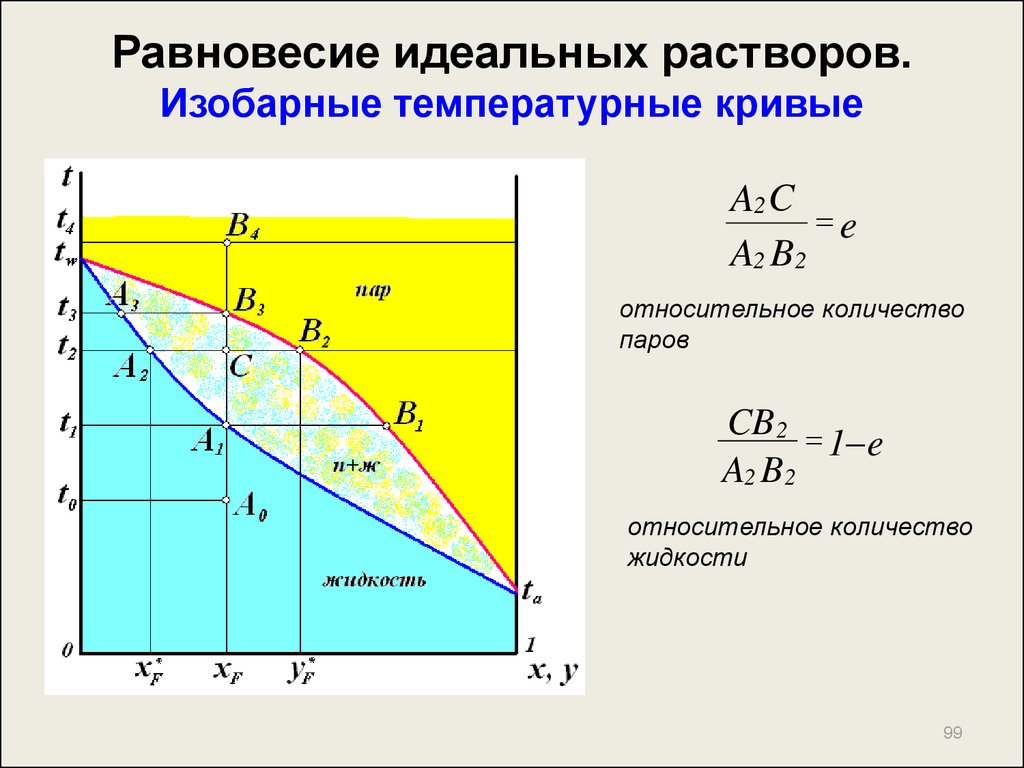
99. Равновесие идеальных растворов. Изобарные температурные кривые
A2 Ce
A2 B2
относительное количество
паров
CB2
1 e
A2 B2
относительное количество
жидкости
99
100. Равновесие идеальных растворов. Построение изобарных температурных кривых.
По графикуP- t для
произвольно выбранной t
в интервале
P1 ( t );
x'
P
P P
1
2
2
[ta;tw]:
P2 ( t )
y' P x'
1
В координатах t – x,y строим
изобарные температурные
кривые.
100
101. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ (продолжение)
Лекция 6.РАВНОВЕСИЕ БИНАРНЫХ
СИСТЕМ (ПРОДОЛЖЕНИЕ)
101
102. Равновесие идеальных растворов. Энтальпийная (тепловая) диаграмма
ht ha x hw 1 xH t H a y H w 1 y
102
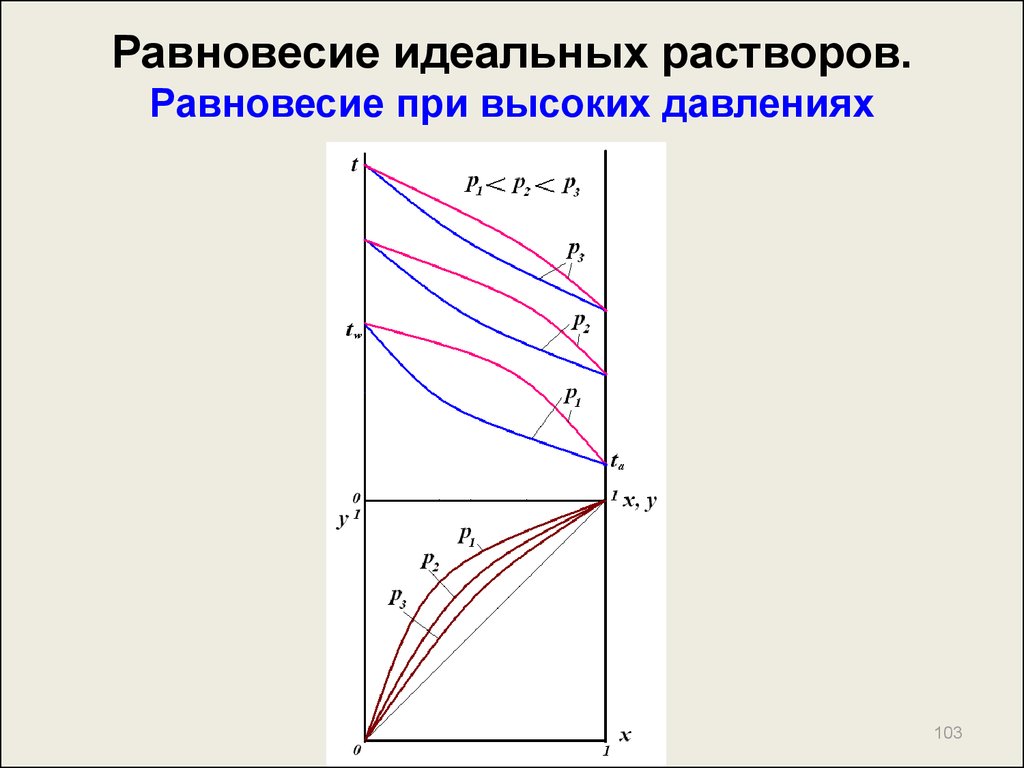
103. Равновесие идеальных растворов. Равновесие при высоких давлениях
103104. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ЧАСТИЧНО ОТКЛОНЯЮЩИХСЯ ОТ ЗАКОНА РАУЛЯ
бензол + четыреххлористыйуглерод
хлороформ + бензол
104
105. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ЧАСТИЧНО ОТКЛОНЯЮЩИХСЯ ОТ ЗАКОНА РАУЛЯ
p w w P 2 1 x'p a a P1 x'
γ
Коэффициент активности
характеризует степень отклонения системы от
идеальной:
γ >1
γ <1
- положительное отклонение;
- отрицательное отклонение.
f T прив , P прив
105
106. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ЧАСТИЧНО ОТКЛОНЯЮЩИХСЯ ОТ ЗАКОНА РАУЛЯ
p aw p a p w a P1 x' w P 2 1 x'- уравнение изотермы
x'
2 P2
1 P1
y'
x'
1 P1 2 P 2
1 P1
2 P2
106
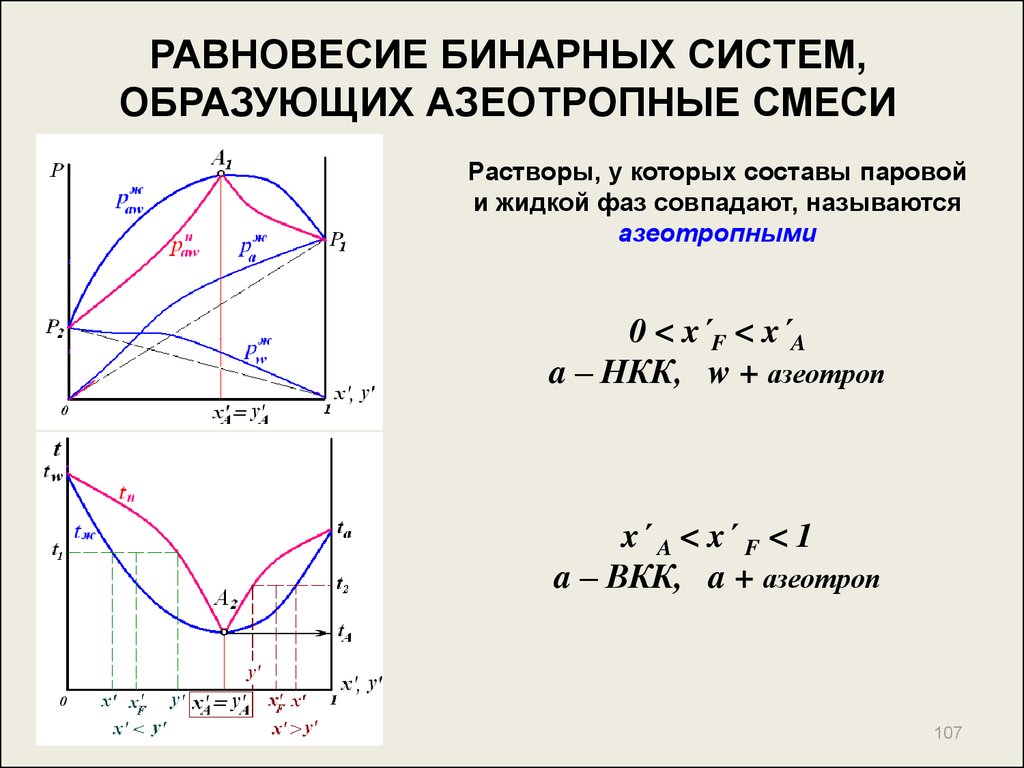
107. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ОБРАЗУЮЩИХ АЗЕОТРОПНЫЕ СМЕСИ
Растворы, у которых составы паровойи жидкой фаз совпадают, называются
азеотропными
0 < x´F < x´A
a – НКК, w + азеотроп
x´ A < x´ F < 1
a – ВКК, a + азеотроп
107
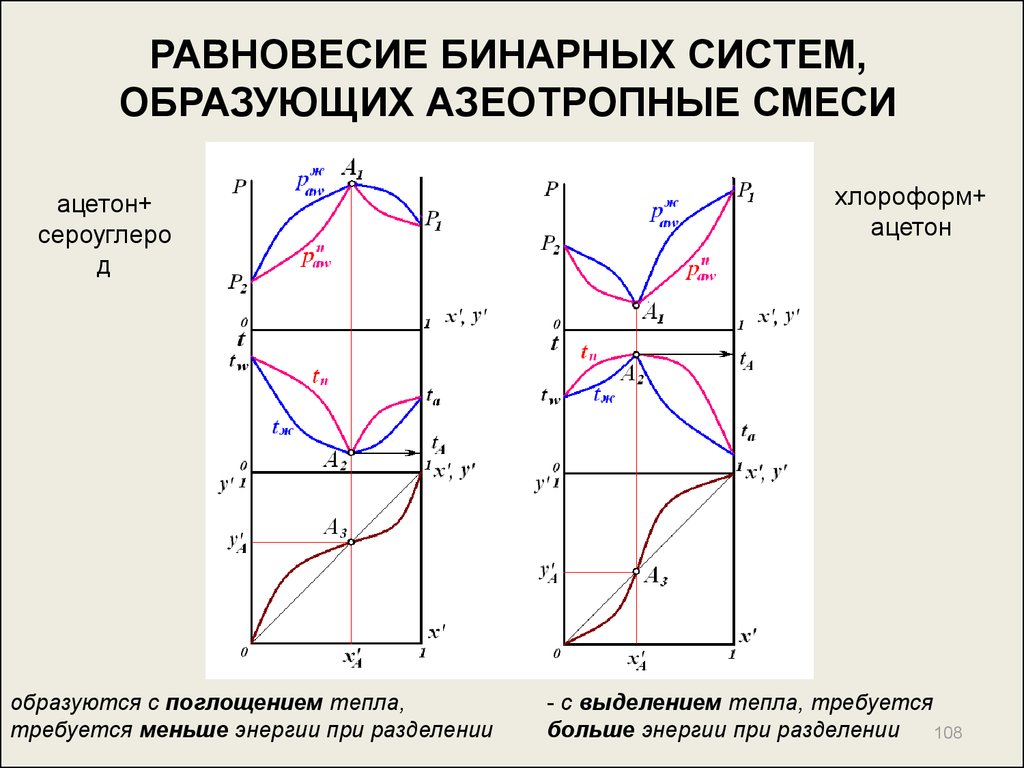
108. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ОБРАЗУЮЩИХ АЗЕОТРОПНЫЕ СМЕСИ
ацетон+сероуглеро
д
образуются с поглощением тепла,
требуется меньше энергии при разделении
хлороформ+
ацетон
- с выделением тепла, требуется
больше энергии при разделении 108
109. РАВНОВЕСИЕ БИНАРНЫХ СИСТЕМ, ОБРАЗУЮЩИХ АЗЕОТРОПНЫЕ СМЕСИ Особенности гомогенных в жидкой фазе азеотропов (гомоазеотропов)
1) имеют tmax или tmin по сравнению с ta и2) испаряются при
tw ;
tА=const;
3) испаряются без изменения состава;
4) не являются химическими соединениями, их состав зависит
от давления
109
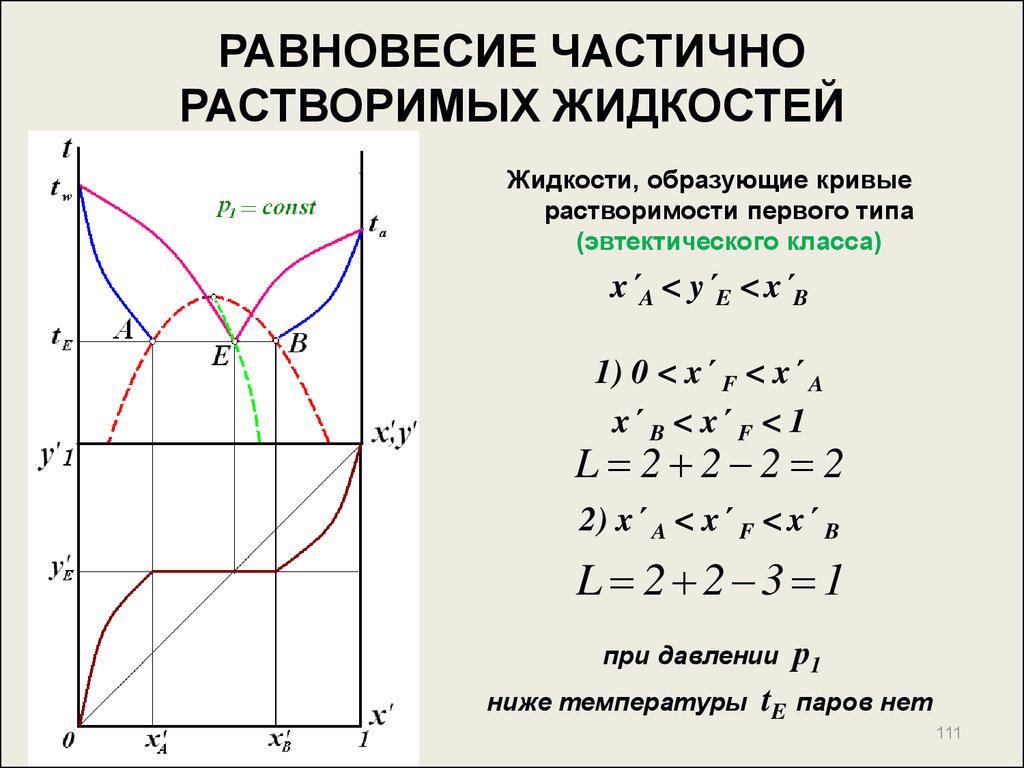
110. РАВНОВЕСИЕ ЧАСТИЧНО РАСТВОРИМЫХ ЖИДКОСТЕЙ
Системы, компоненты которых растворимы друг в друге в строгоопределенных для каждой температуры пределах концентраций, вне
этих пределов образуют два несмешивающихся жидких слоя
1) 0 < x´F < x´A
и
x´B < x´F < 1
полная растворимость
(1 жидкая фаза),
пары равновесны с жидкостью
2) x´A < x´F < x´B
2 жидкие фазы, состава x´A и x´B
110
111. РАВНОВЕСИЕ ЧАСТИЧНО РАСТВОРИМЫХ ЖИДКОСТЕЙ
Жидкости, образующие кривыерастворимости первого типа
(эвтектического класса)
x´A < y´E < x´B
1) 0 < x´ F < x´ A
x´ B < x´ F < 1
L 2 2 2 2
2) x´ A < x´ F < x´ B
L 2 2 3 1
при давлении
р1
ниже температуры tE паров нет
111
112. РАВНОВЕСИЕ ЧАСТИЧНО РАСТВОРИМЫХ ЖИДКОСТЕЙ
При повышении давления до р2гетероазеотроп превращается
в гомоазеотроп
112
113. РАВНОВЕСИЕ ЧАСТИЧНО РАСТВОРИМЫХ ЖИДКОСТЕЙ
Жидкости, образующие кривыерастворимости второго типа
(неэвтектического класса)
x´A < x´B< y´E
1) 0 < x´ F < x´ A - полная
растворимость (1 ж.ф. и 1 п.ф.),
пары равновесны с жидкостью
2) x´ A < x´ F < x´ B - 2 ж.ф., состава xA
и xB и 1 п.ф.
3) x´ B < x´ F < 1 - 1 ж.ф. и 1 п.ф.
Везде
a – НКК,
w – ВКК
113
114. РАВНОВЕСИЕ ЧАСТИЧНО РАСТВОРИМЫХ ЖИДКОСТЕЙ
При повышении давления до р2компоненты растворимы
полностью
114
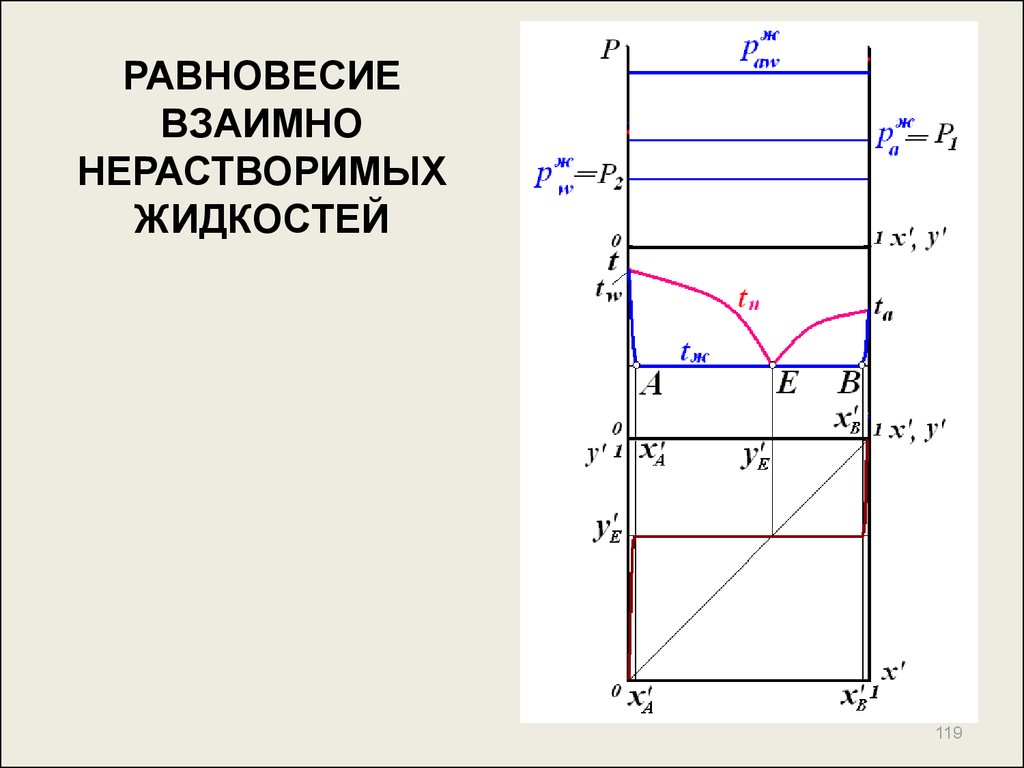
115. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
Лекция 7.РАВНОВЕСИЕ ВЗАИМНО
НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
115
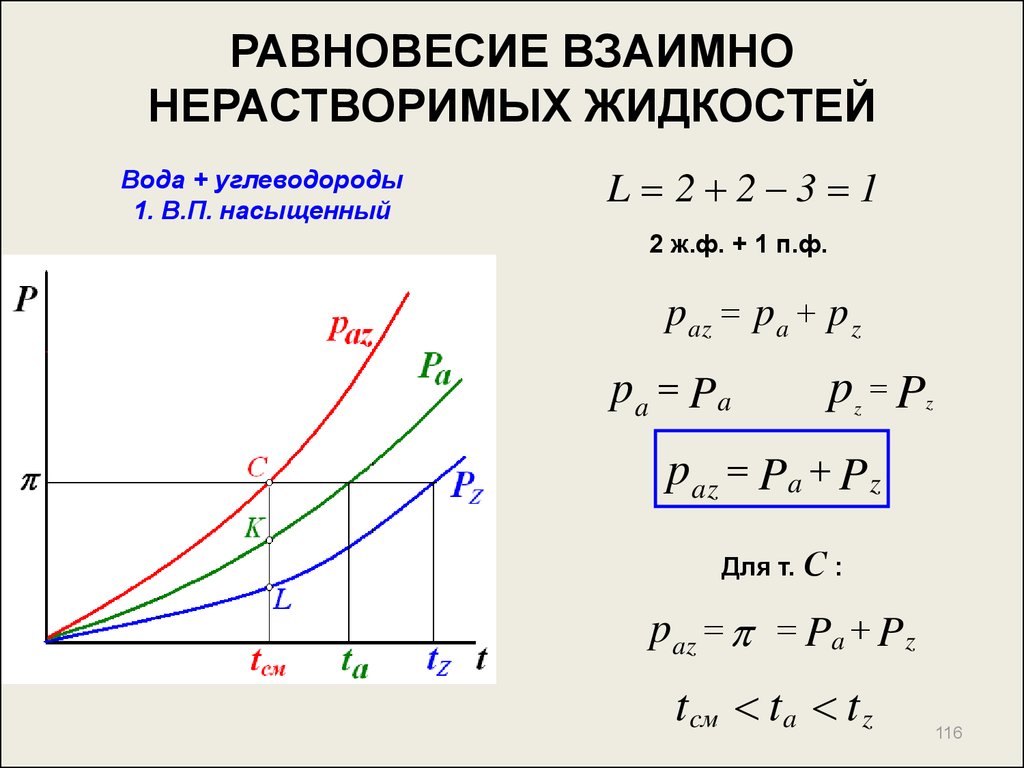
116. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
Вода + углеводороды1. В.П. насыщенный
L 2 2 3 1
2 ж.ф. + 1 п.ф.
paz pa p z
pa Pa
p P
z
z
paz Pa P z
Для т. С :
paz Pa Pz
tcм t a t z
116
117. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
Вода + углеводороды1. В.П. насыщенный
pa
Pa
y' a
paz Pa P z
pz
P
z
y' z
paz Pa P z
Z y z M z y' z M z P z
G y a M a y' a M a Pa
Z' P z
G' P a
117
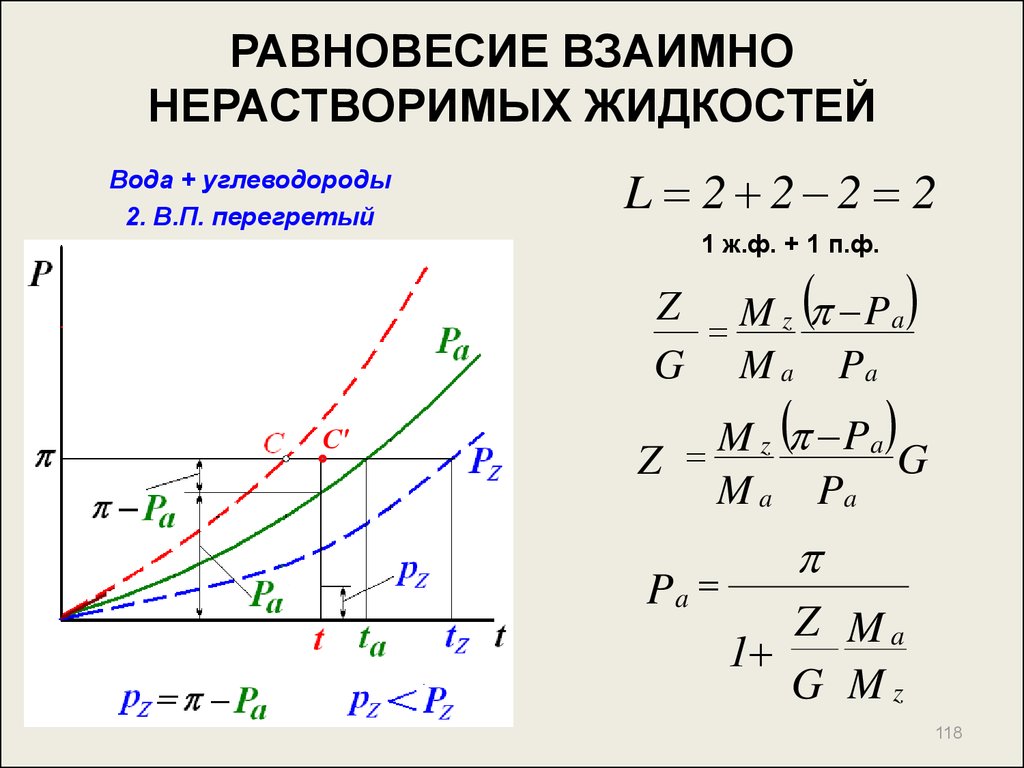
118. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
Вода + углеводороды2. В.П. перегретый
L 2 2 2 2
1 ж.ф. + 1 п.ф.
Z M z P a
G M a Pa
С'
P
M
a
z
G
Z
M a Pa
Pa
Z Ma
1
G Mz
118
119. РАВНОВЕСИЕ ВЗАИМНО НЕРАСТВОРИМЫХ ЖИДКОСТЕЙ
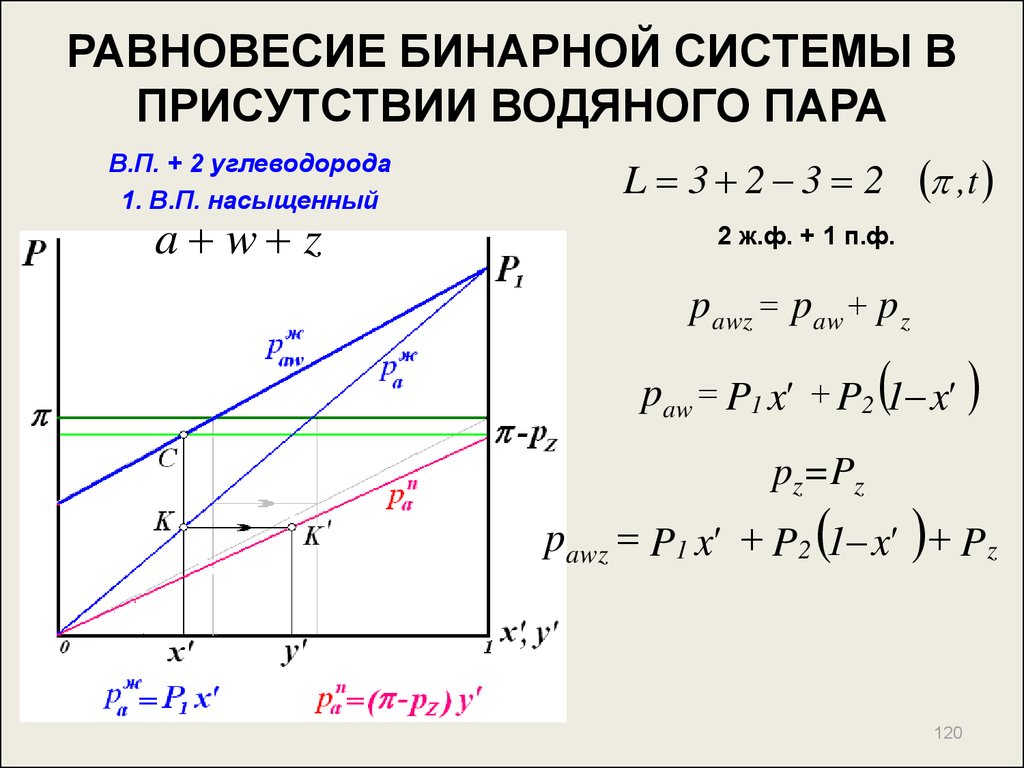
119120. РАВНОВЕСИЕ БИНАРНОЙ СИСТЕМЫ В ПРИСУТСТВИИ ВОДЯНОГО ПАРА
В.П. + 2 углеводорода1. В.П. насыщенный
a w z
L 3 2 3 2 , t
2 ж.ф. + 1 п.ф.
pawz paw p z
paw P1 x' P2 1 x'
pz=Pz
pawz P1 x' P2 1 x' P z
120
121. РАВНОВЕСИЕ БИНАРНОЙ СИСТЕМЫ В ПРИСУТСТВИИ ВОДЯНОГО ПАРА
В.П. + 2 углеводорода1. В.П. насыщенный
a w z
Для т. С :
pawz P1 x' P2 1 x' P z
p z P1 x' P2 1 x'
x'
P z P2
y'
P1 P2
P1
x'
Pz
121
122. РАВНОВЕСИЕ БИНАРНОЙ СИСТЕМЫ В ПРИСУТСТВИИ ВОДЯНОГО ПАРА
В.П. + 2 углеводородаa w z
2. В.П. перегретый
1 ж.ф. + 1 п.ф.
L 3 2 2 3 ,t , Z
Температура системы не определяет pz
pz < Pz
в.п. способствует испарению углеводородов,
но затрудняет их конденсацию
122
123. Основы перегонки
ОСНОВЫ ПЕРЕГОНКИ123
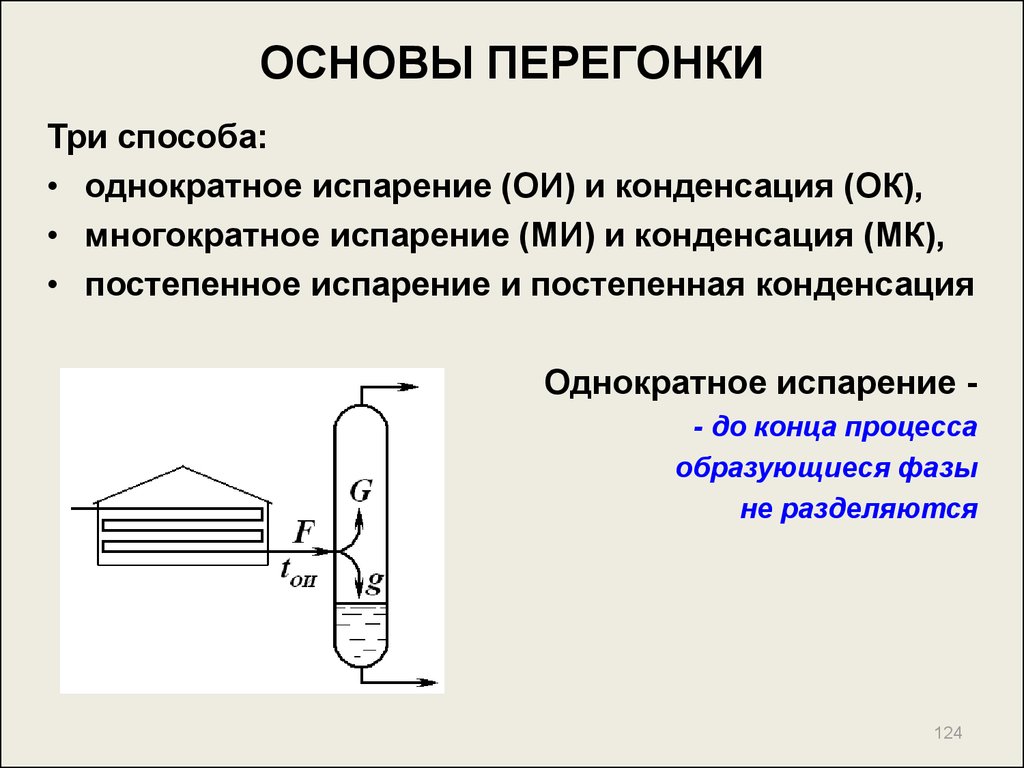
124. ОСНОВЫ ПЕРЕГОНКИ
Три способа:• однократное испарение (ОИ) и конденсация (ОК),
• многократное испарение (МИ) и конденсация (МК),
• постепенное испарение и постепенная конденсация
Однократное испарение - до конца процесса
образующиеся фазы
не разделяются
124
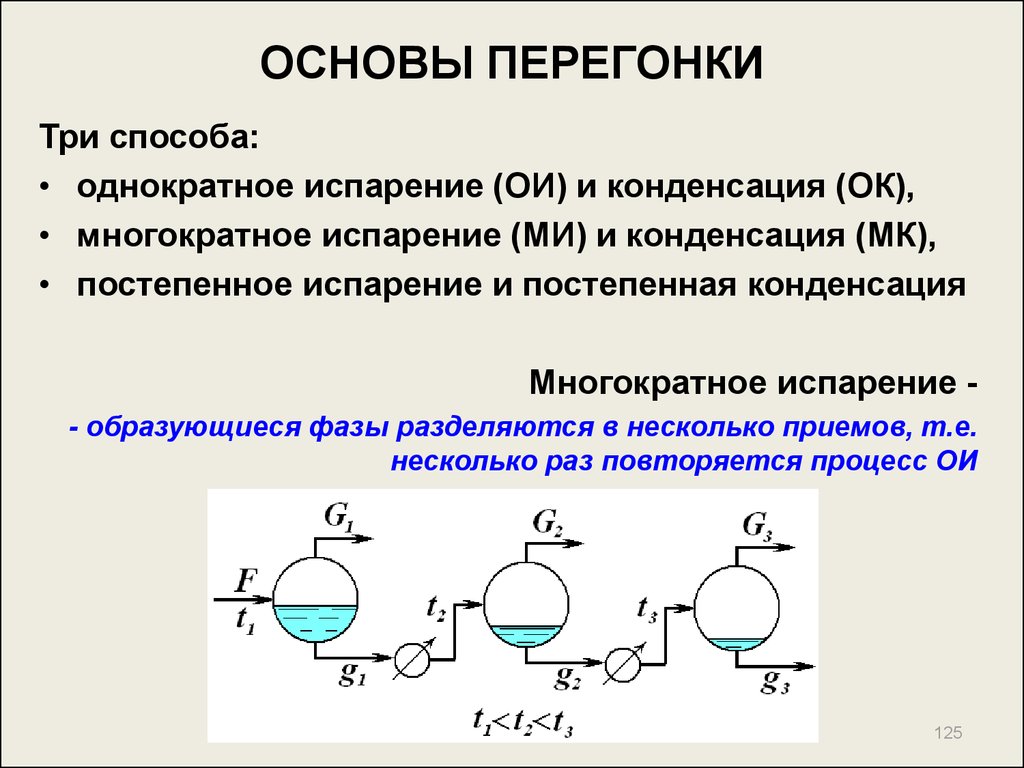
125. ОСНОВЫ ПЕРЕГОНКИ
Три способа:• однократное испарение (ОИ) и конденсация (ОК),
• многократное испарение (МИ) и конденсация (МК),
• постепенное испарение и постепенная конденсация
Многократное испарение - образующиеся фазы разделяются в несколько приемов, т.е.
несколько раз повторяется процесс ОИ
125
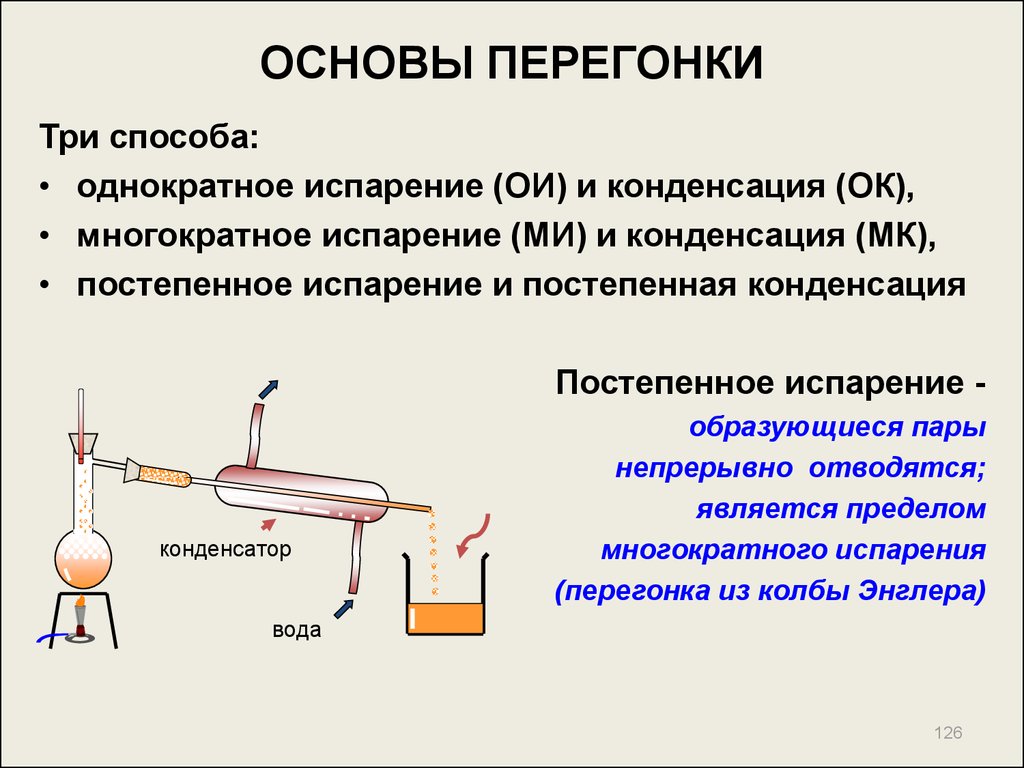
126. ОСНОВЫ ПЕРЕГОНКИ
Три способа:• однократное испарение (ОИ) и конденсация (ОК),
• многократное испарение (МИ) и конденсация (МК),
• постепенное испарение и постепенная конденсация
Постепенное испарение -
конденсатор
образующиеся пары
непрерывно отводятся;
является пределом
многократного испарения
(перегонка из колбы Энглера)
вода
126
127. Основы перегонки
Лекция 9ОСНОВЫ ПЕРЕГОНКИ
127
128. Обозначения
F – расход сырья, поступающего на перегонкуG – расход потока паров
g – расход потока жидкости
xF – доля низкокипящего компонента в сырье
xF*, yF* – доли низкокипящего компонента в
равновесных потоках жидкости и пара, образующихся в
результате однократного испарения сырья
e – доля отгона, или доля паров в потоке сырья
ht – энтальпия потока жидкости при температуре t
Ht – энтальпия потока паров при температуре t
128
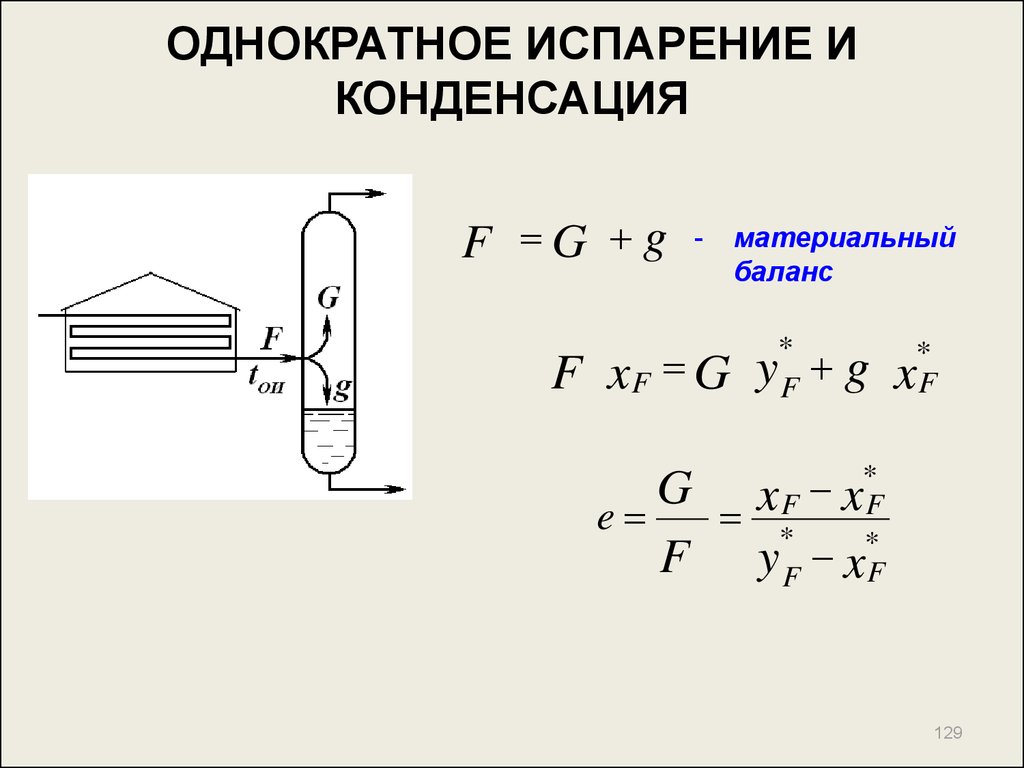
129. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
F G g-
материальный
баланс
*
F
*
F xF G y g xF
G x F x*F
e
*
*
F y F xF
129
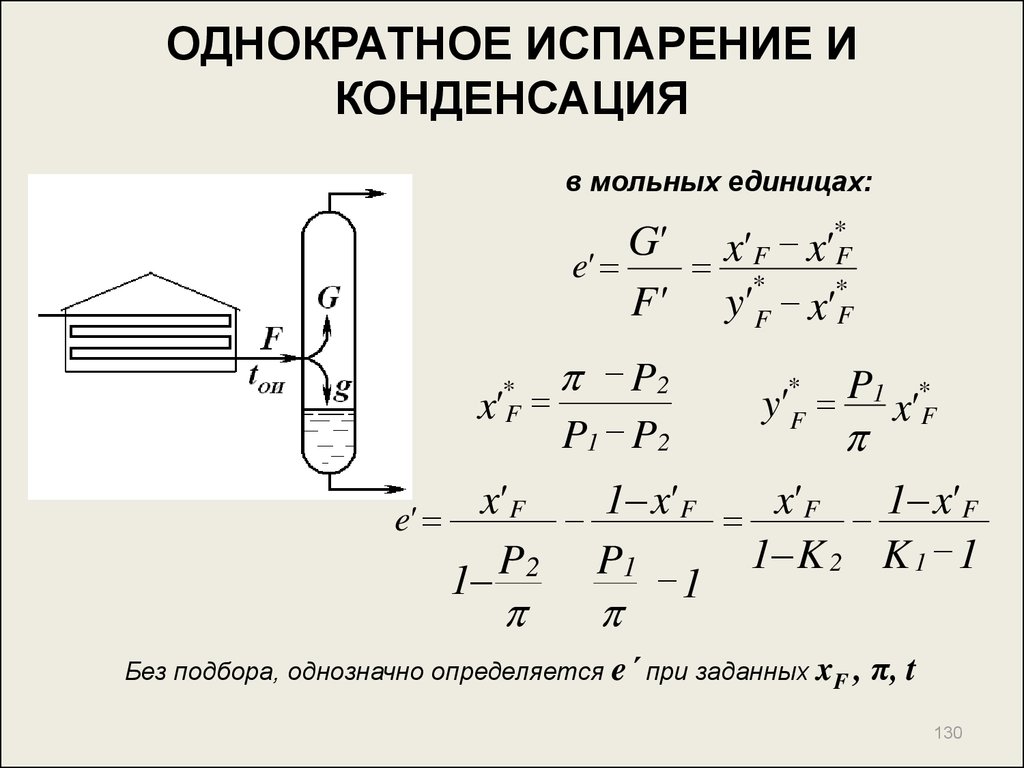
130. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
в мольных единицах:G' x' F x'*F
e'
*
F' y' F x'*F
x'
*
F
e'
P2
P1 P2
y' P1 x'*F
*
F
x' F 1 x' F x' F 1 x' F
1 K 2 K 1 1
P
P
2
1
1
1
Без подбора, однозначно определяется
e´ при заданных xF , π, t
130
131. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Пересчет мольной доли отгонав массовую
G F e
G
F e F e'
G' F' e'
My My
MF
e
e'
My MF
M
e e'
M
y
F
131
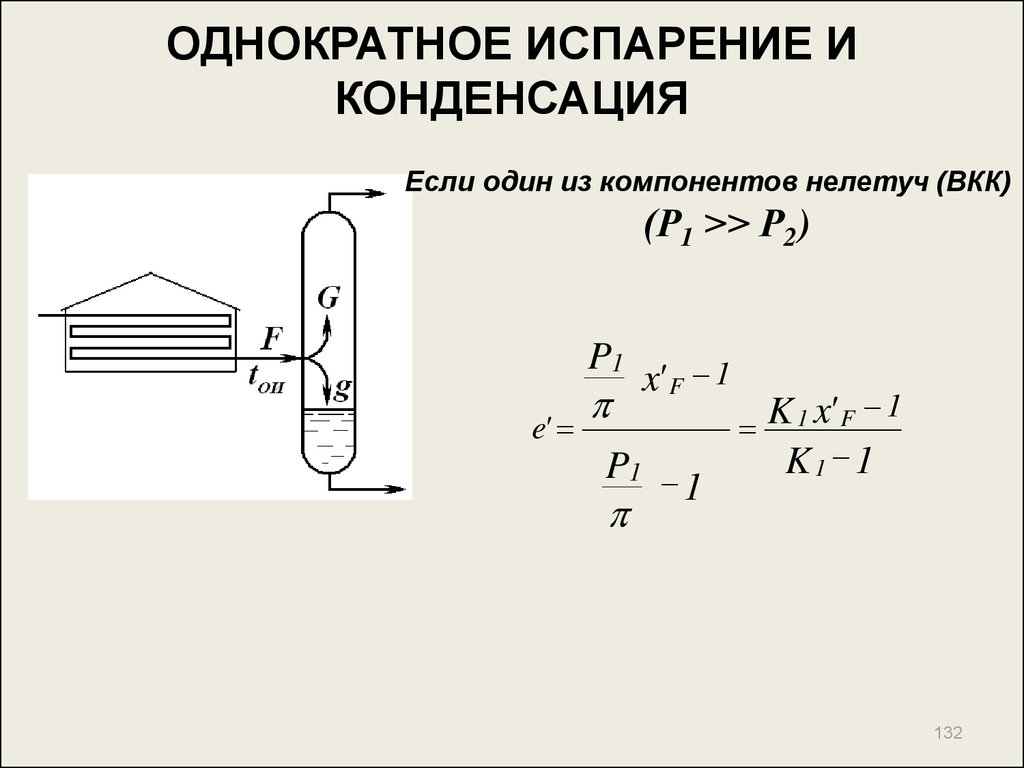
132. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Если один из компонентов нелетуч (ВКК)(Р1 >> Р2)
P1
e'
x' F 1
P1
1
K
1 x' F 1
K1 1
132
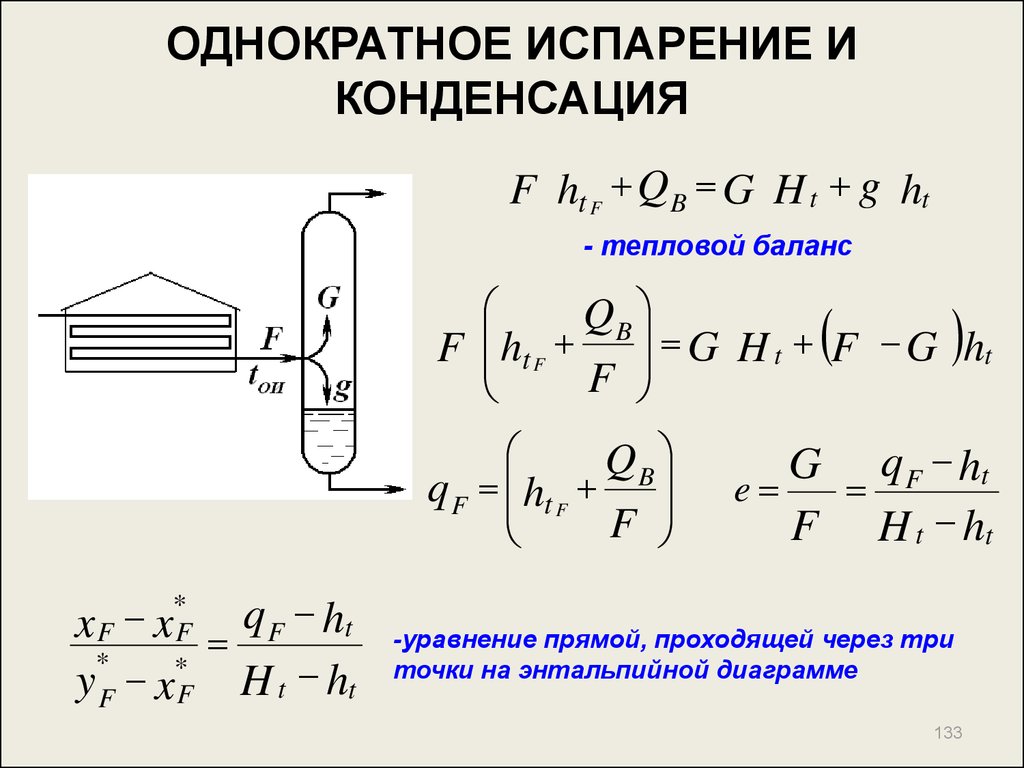
133. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
F ht F QB G H t g ht- тепловой баланс
Q
B
G H t F G ht
F ht F
F
Q
q F ht F B
F
q F ht
*
*
y F x F H t ht
*
xF xF
G q F ht
e
F H t ht
-уравнение прямой, проходящей через три
точки на энтальпийной диаграмме
133
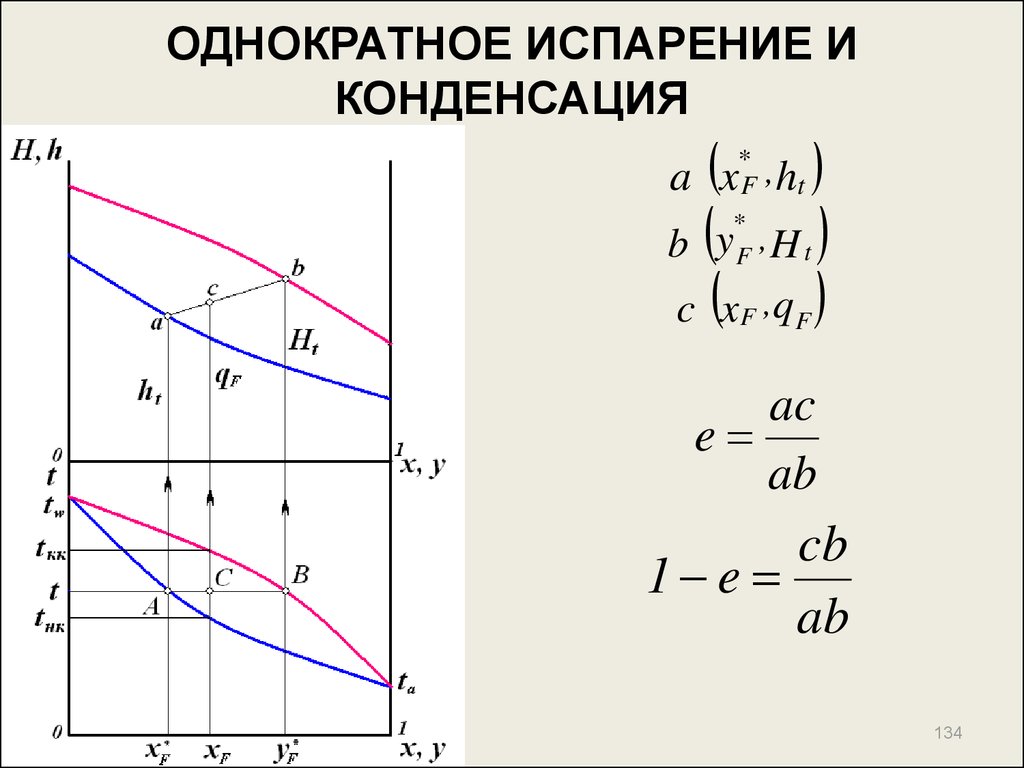
134. ОДНОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
*a x F , ht
b y , H
c x ,q
*
F
t
F
F
ac
e
ab
cb
1 e
ab
134
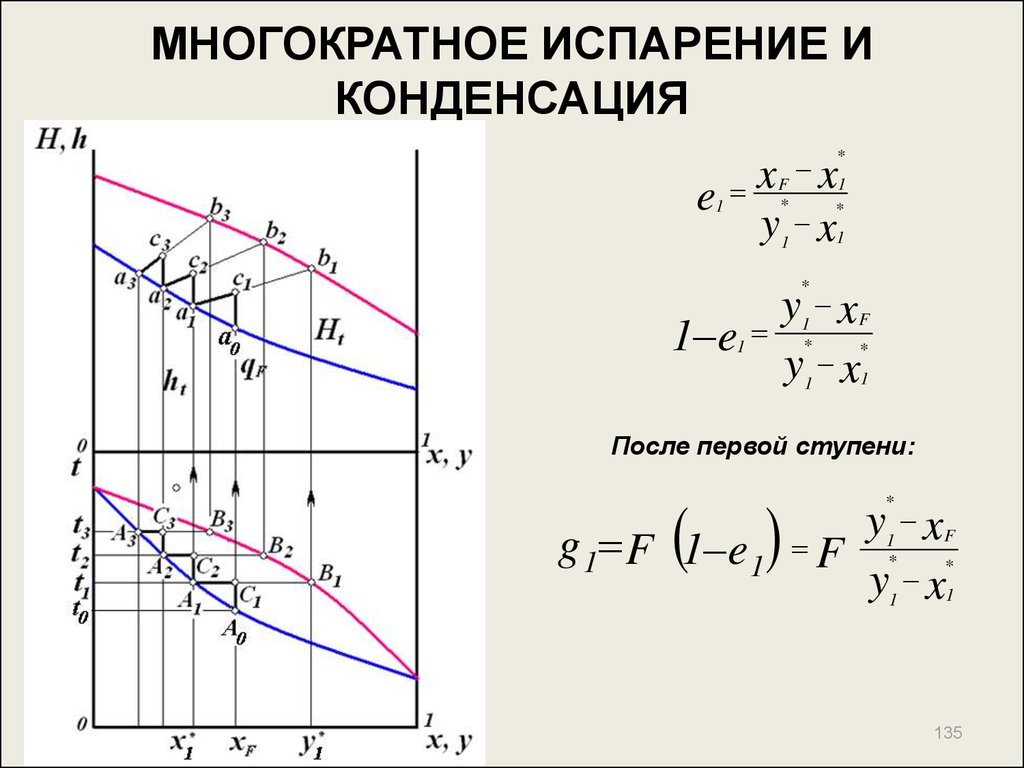
135. МНОГОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
xF x1*
e
1
*
y
1
x1
*
*
x
y
1 e
y x
1
1
*
F
1
1
*
После первой ступени:
*
x
y
g 1 F 1 e 1 F
y x
1
*
F
1
1
*
135
136. МНОГОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
*x2
x
1
e2 *
y 2 x2
x
y
1 e
y x
g 2 g 1 1 e 2 F 1 e 1 e
2
1
2
2
2
1
2
и т.д.
ОИ обеспечивает больший
отгон, но жидкая фаза
содержит больше НКК, т.е.
разделение при МИ лучше.
136
137. МНОГОКРАТНОЕ ИСПАРЕНИЕ
конденсаторконденсатор
конденсатор
КОНДЕНСАТ
КОНДЕНСАТ
КОНДЕНСАТ
ПАРОВ
ПАРОВ
ПАРОВ
63% ПЕНТАНА
49% ПЕНТАНА
35% ПЕНТАНА
37% ГЕКСАНА
51% ГЕКСАНА
65% ГЕКСАНА
ПЕРЕГОННЫЙ КУБ 1
ПАРЫ
ПАРЫ
52 °С
СЫРЬЁ
НАГРЕВ
ПЕРЕГОННЫЙ КУБ 2
ПАРЫ
57 °С
ЖИДКОСТЬ
НАГРЕВ
ПЕРЕГОННЫЙ КУБ 3
62 °С
ЖИДКОСТЬ
НАГРЕВ
ЖИДКОСТЬ
50% ПЕНТАНА
37% ПЕНТАНА
25% ПЕНТАНА
15% ПЕНТАНА
50% ГЕКСАНА
63% ГЕКСАНА
75% ГЕКСАНА
85% ГЕКСАНА
137
138. МНОГОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
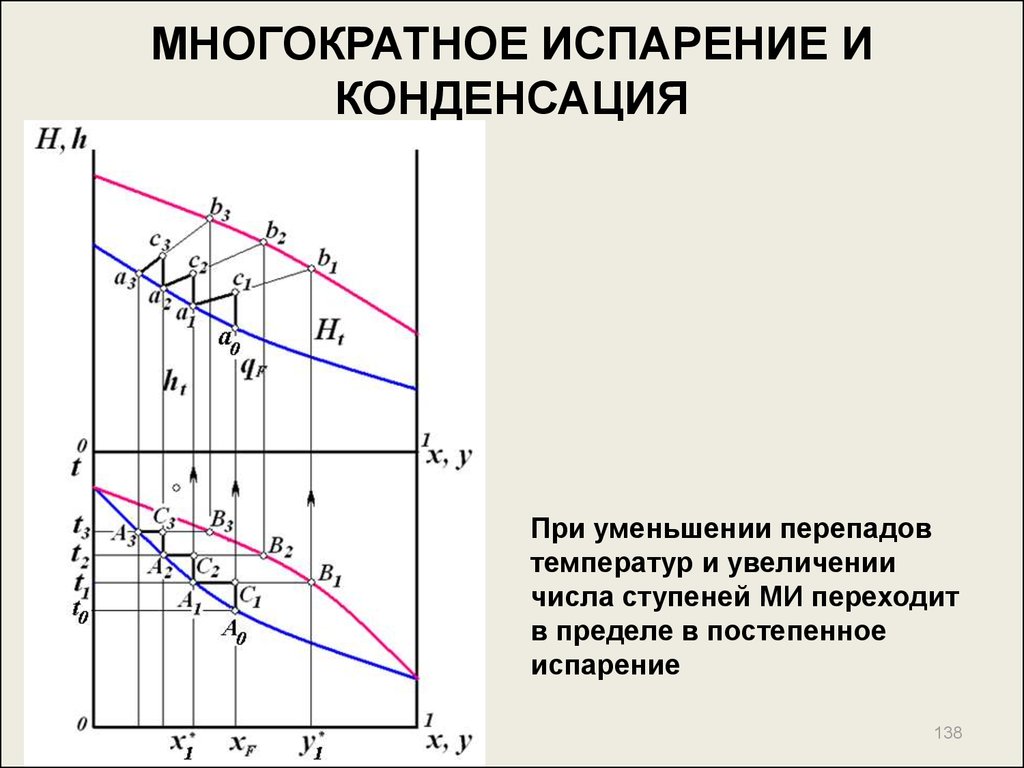
При уменьшении перепадовтемператур и увеличении
числа ступеней МИ переходит
в пределе в постепенное
испарение
138
139. ПОСТЕПЕННОЕ ИСПАРЕНИЕ
Начало перегонки:g0, x0
В рассматриваемый момент:
g, x
После увеличения температуры:
dg – испаряется, состав y,
g-dg - неиспарившаяся жидкость,
состава x-dx.
Материальный баланс:
g x y dg g dg x dx
139
140. ПОСТЕПЕННОЕ ИСПАРЕНИЕ
dgdx
g y x
g
dg
g0
g
x
x0 y
dx
x
x0 dx
g
ln
g0 x y x
- уравнение Рейлея
140
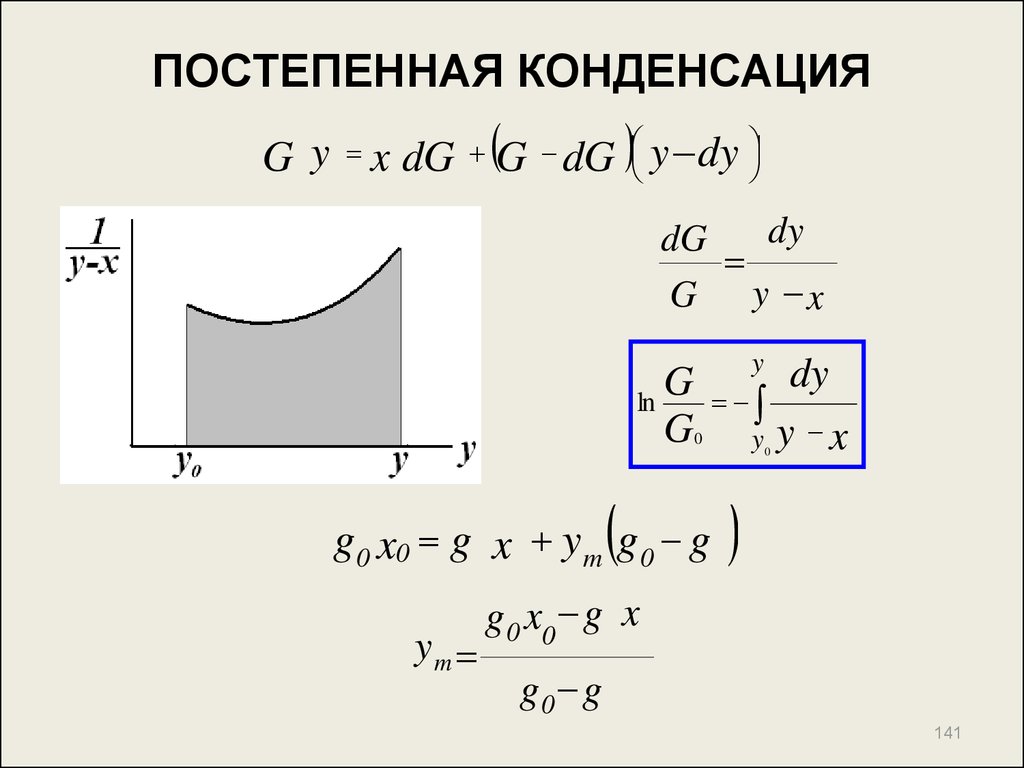
141. ПОСТЕПЕННАЯ КОНДЕНСАЦИЯ
G y x dG G dG y dydy
dG
G y x
G
ln
G
y
0
g 0 x0 g x y m g 0 g
ym
dy
y y x
0
g 0 x0 g x
g0 g
141
142. Сущность процесса ректификации
диффузионный процесс разделения жидкостей,различающихся по температурам кипения,
который осуществляется путем
противоточного многократно ступенчатого
или непрерывного контактирования паров и
жидкости
142
143. Ректификация
• Учебный фильм143
144. ректификация
Лекция 10РЕКТИФИКАЦИЯ
144
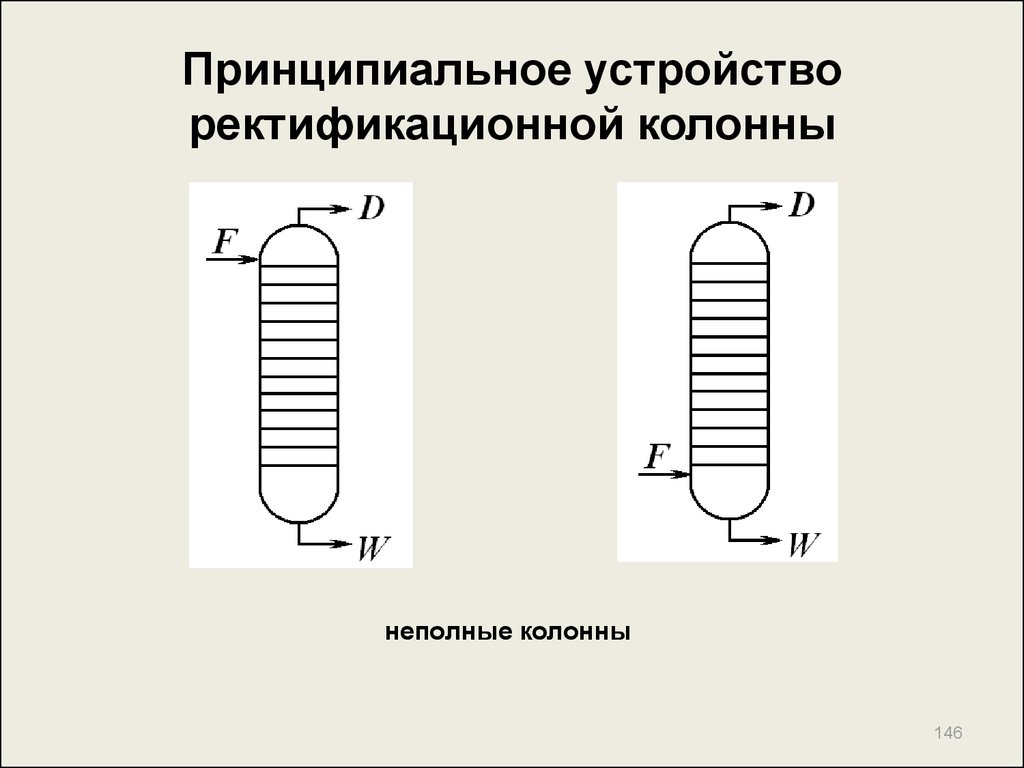
145. Принципиальное устройство ректификационной колонны
145146. Принципиальное устройство ректификационной колонны
неполные колонны146
147. Материальный баланс колонны
для всей колонны по всем компонентам:F D W
по НКК:
F xF D y D W xW
1
W
F
D
F
xF xW
y D xW
1
D
F
y D xF
y D xW
147
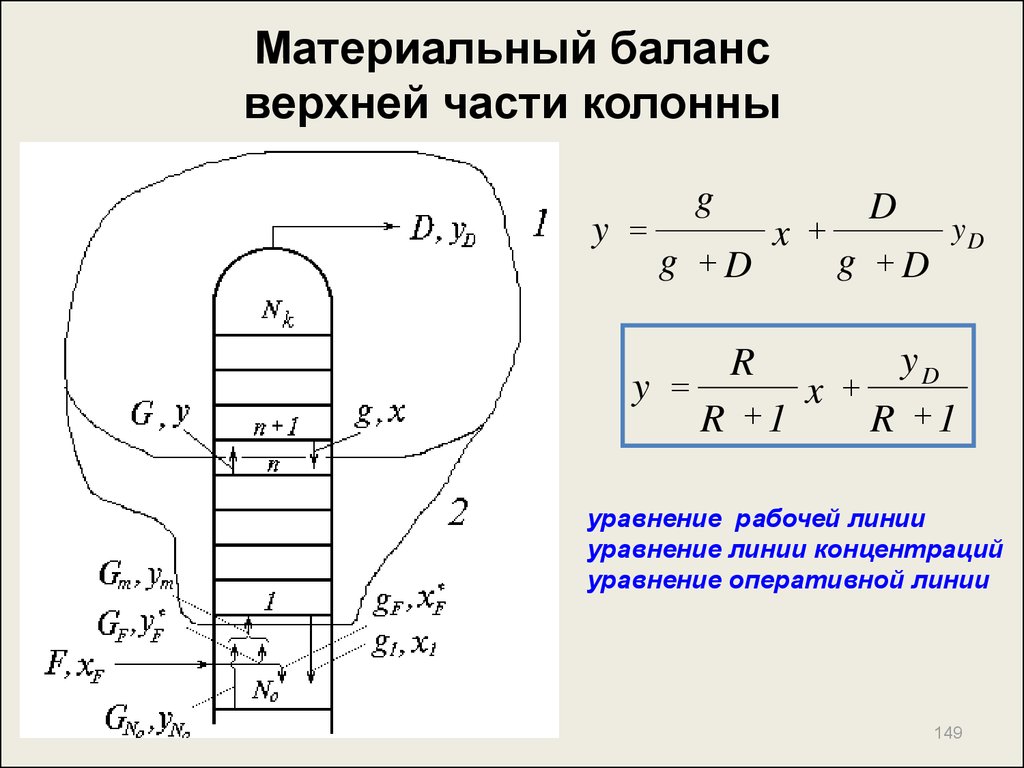
148. Материальный баланс верхней части колонны
По контуру 1:G g D
или
G g D
G y g x D yD
R
g
D
yD y
y x
- флегмовое число
148
149. Материальный баланс верхней части колонны
yg
g D
x
D
g D
yD
yD
y
x
R 1
R 1
R
уравнение рабочей линии
уравнение линии концентраций
уравнение оперативной линии
149
150. Материальный баланс верхней части колонны
По контуру 2 – для всей верхней части колонны:G
F
G
No
g D
1
GF y*F GN0 y N0 g1 x1 D yD
ym
GF y*F GN y N
0
GF G N
0
g D g g1 const
0
GF y*F GN y N
0
0
Gm
R
R 1
const
150
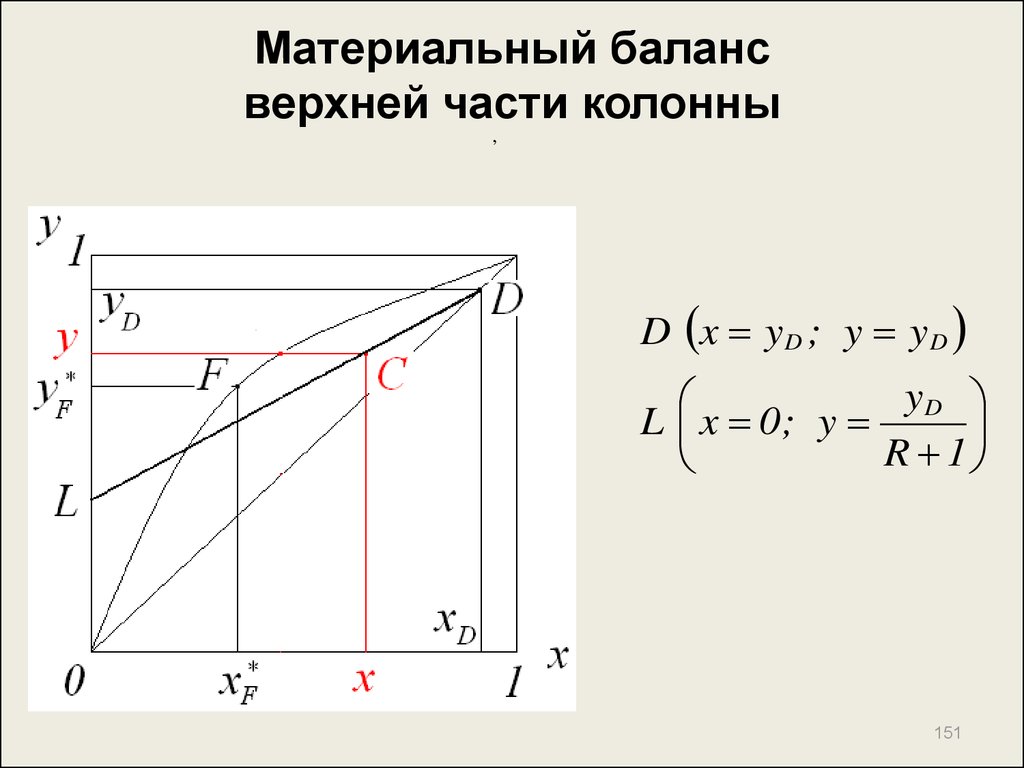
151. Материальный баланс верхней части колонны
,D x y D ; y y D
yD
L x 0; y
R 1
151
152. Материальный баланс верхней части колонны Режим минимального орошения
*yD yF
*
R мин
D мин y F x*F
g
152
153. Материальный и тепловой баланс колонны
Лекция 11.МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ
БАЛАНС КОЛОННЫ
153
154. Материальный баланс нижней части колонны
По контуру 1:g G W
или
g G W
g x G y W xW
G x xW
П
W
y x
- паровое число
154
155. Материальный баланс нижней части колонны
G WW xW
y
x
G
G
xW
П 1
y
x
П
П
155
156. Материальный баланс нижней части колонны
По контуру 2 – для всей нижней части колонны:g F x*F g1 x1 GN y N0 W xW
0
xm
*
g F xF
g1 x1
g F g1
*
g F xF
g1 x1
gm
156
157. Материальный баланс нижней части колонны
W x xW ; y xWП xW
M x
; y 1
П 1
157
158. Материальный баланс нижней части колонны Режим минимальных паров
GП
W
м ин
x x
y x
*
мин
F
*
F
W
*
F
158
159. Общий вид уравнения рабочей линии
Ф g G• для верхней части колонны
Ф 1
G g
g
G g
y
G
x
G
- внутреннее флегмовое число
• для нижней части колонны
Ф 1
yD
y Ф x 1 Ф y D
G g
g
g G
y x
xW
G
G
y Ф x 1 Ф xW
159
160. Общий вид уравнения рабочей линии
Ф g Gy Ф x 1 Ф y D
x p yD
- внутреннее флегмовое число
y Ф x 1 Ф xW
x p xW
y Ф x 1 Ф x p
Ф
R
R 1
1
П 1
1
Ф
П
160
161. Связь между основными параметрами ректификации
G GN g DF
o
1
Fe ПW RD D
Fe ПF 1 RF D
R
e
П
1
161
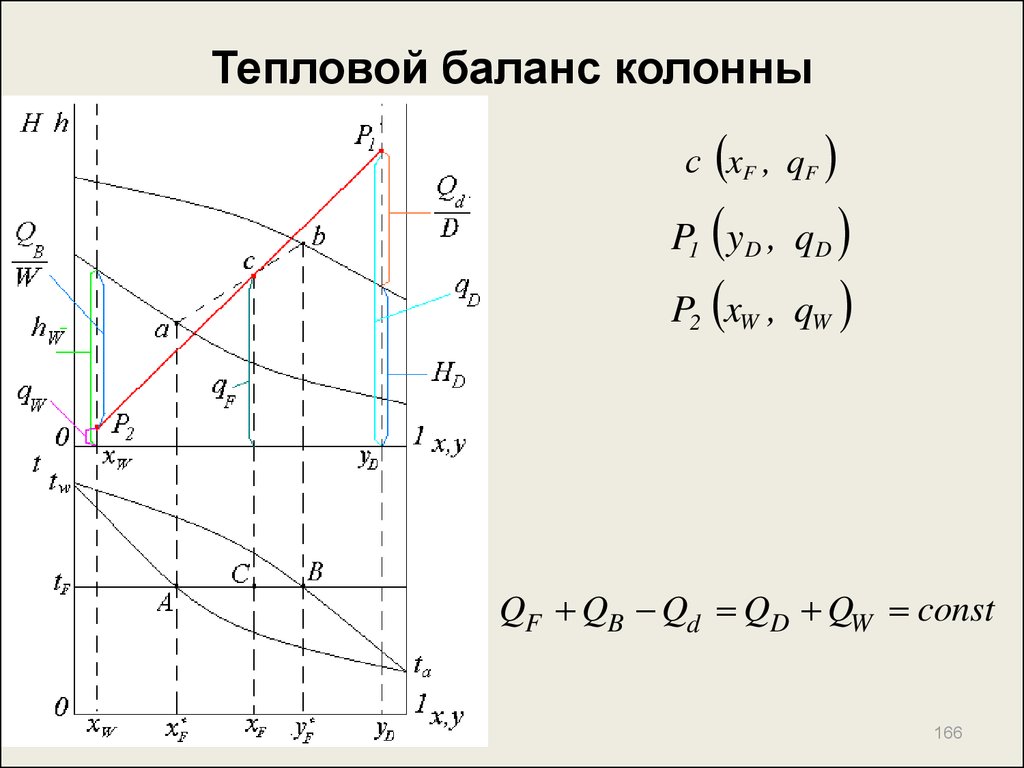
162. Тепловой баланс колонны
QF QB QD QW QdQF F 1 e ht F e Ht F qF
F
F
QB GW ( H tW htW ) GW qисп
QD D H t
D
QW W ht
W
Qd g D ( H t D ht D ) g D q конд
QF QB Qd QD QW const
162
163. Тепловой баланс колонны
QF D H t Qd W ht QBD
Q
d
QF D H t
W
D
D
W
Q
B
h
t
W
Qd
qD H t D
D
QB
qW ht
W
W
W
F qF D qD W qW
163
164. Тепловой баланс колонны
F qF D qD W qWD
F
D
F
qF qW
qD qW
xF xW
y D xW
qF qW
qD qW
164
165. Тепловой баланс колонны
с xF , qFP1 y D , qD
P2 xW , qW
165
166. Тепловой баланс колонны
с xF , qFP1 y D , qD
P2 xW , qW
QF QB Qd QD QW const
166
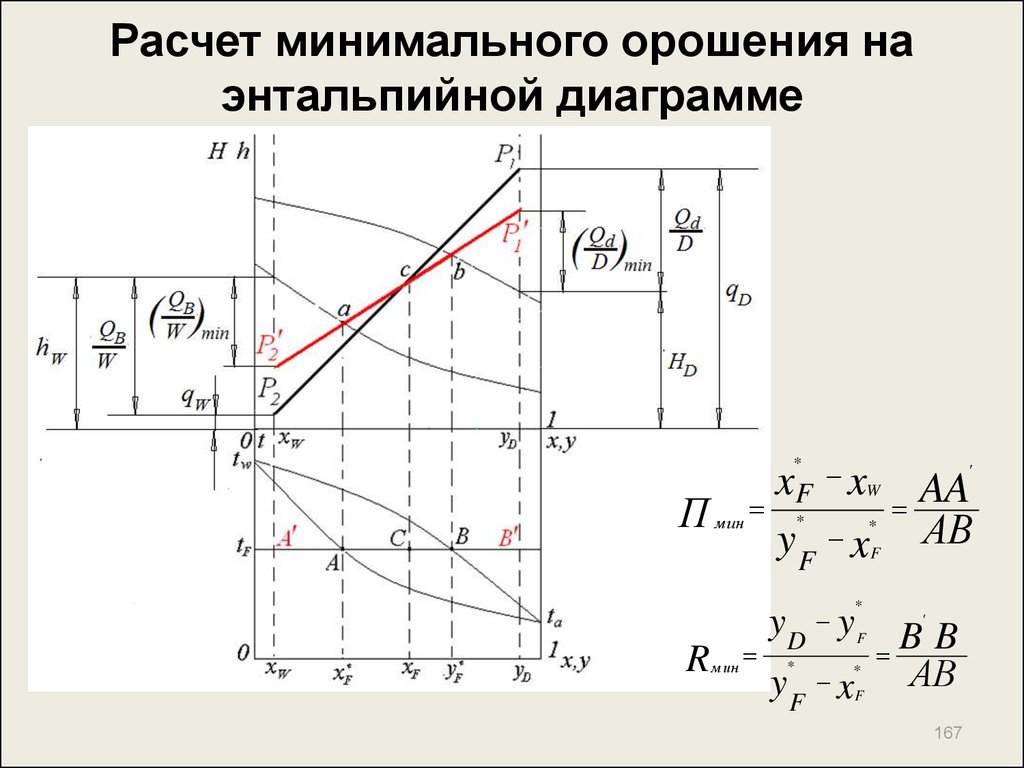
167. Расчет минимального орошения на энтальпийной диаграмме
xF xП
yF x
*
'
W
м ин
*
*
R м ин
yF
AA
АВ
*
yD y
*
F
'
F
xF
*
BB
АВ
167
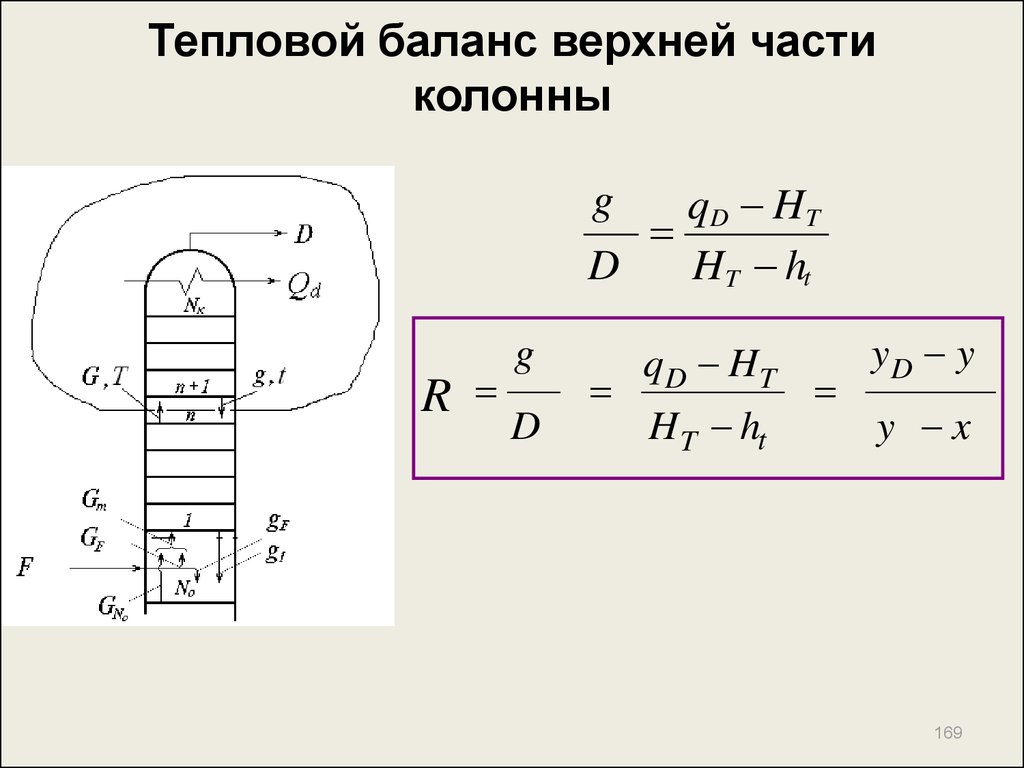
168. Тепловой баланс верхней части колонны
G H T D H t g ht QdD
G g D
g
D H T D H t g ht Qd
D
Q
d
g ht
g D HT D H t
D
g
D
D HT D qD g ht
168
169. Тепловой баланс верхней части колонны
qD H TD
HT ht
g
R
g
D
qD HT
HT ht
yD y
y x
169
170. Тепловой баланс колонны (продолжение)
Лекция 11.ТЕПЛОВОЙ БАЛАНС
КОЛОННЫ (ПРОДОЛЖЕНИЕ)
170
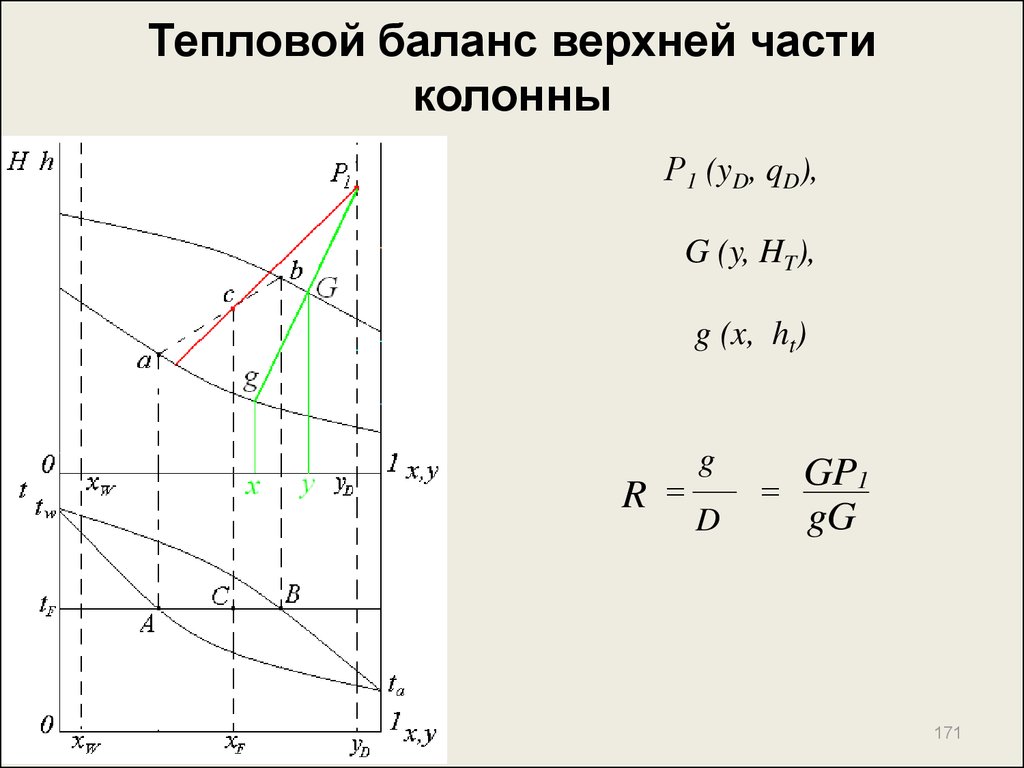
171. Тепловой баланс верхней части колонны
Р1 (yD, qD),G (y, HT),
g (x, ht)
R
g
D
GP1
gG
171
172. Тепловой баланс нижней части колонны
g ht QB G H T W htW
g G W
Q
B
G W ht G H T W htW
W
G
W ht G HT W qW
П
G
W
ht qW
H T ht
x xW
y x
172
173. Тепловой баланс нижней части колонны
P2 (xW, qW )G (y, HT )
g (x, ht )
П
G
W
gP2
Gg
173
174. Построение рабочей линии с использованием энтальпийной диаграммы
H,hP1
P1’
b
c
(Qd /D)min
1.
Задано: xF, yD, xW, F(xF*;yF*), КИФ.
2.
Тт. D, W, O, F;
a, b, c
a
3.
Находим положение тт. Р1 и Р2.
(Qd /D) = (Qd /D)min * КИФ
y
yD
1 x,y
P2
3.
проходящие через полюс Р1 и
D
полюс Р2.
F
y*F
5.
O
W
0 xW
x*F
Строим рабочие линии,
xF
x
x=yD 1
Точки пересечения РЛ с
энтальпийными кривыми
определяют соответствующие
концентрации НКК,
принадлежащие РЛ на диаграмме
x-y.
174
175. Расчет числа теоретических тарелок графическим методом (Метод Мак-Кэба и Тиле)
175176. Расчет числа теоретических тарелок графическим методом (Метод Мак-Кэба и Тиле)
x F x*Fe *
y F x*F
176
177. Оптимальный режим работы колонны
yD constxW const
R опт 1,35 R мин 0 ,35
N
опт
1,7 N мин 0,7
177
178. Расчет числа теоретических тарелок с использованием энтальпийной диаграммы
1.Задано: xF, yD, xW, е, КИФ.
2.
Тт. А, В, С;
a, b, c
3.
Находим положение тт. Р1
и Р2.
4.
ИТК: 1(yD) - 2(xD*)
5.
ЭД: 2(xD*) - 3(htD) - 4(y1)
178
179. Расчет числа теоретических тарелок с использованием энтальпийной диаграммы
6. ИТК: 5 (y1) – 6 (x1*)7. ЭД: 7 (x1*) – 8 (y2)
8. ИТК : 9 (y2) – 10(x2*)
9. КЧ колонны: 3 ТТ
ПК (1-2) + 2ТТ (5-6; 9-10)
179
180. Расчет числа теоретических тарелок с использованием энтальпийной диаграммы
1.ИТК: 1’(xW) – 2’(yW*)
2.
ЭД: 3’(yW*) – 4’(x1’)
180
181. Расчет числа теоретических тарелок с использованием энтальпийной диаграммы
3. ИТК: 5’ (x1) – 6’ (y1*)4. ЭД: 7’ (y1*) – 8’ (x2)
5. ИТК : 9’ (x2) – 10’(y2*)
6. OЧ колонны: 3 ТТ
К (1’-2’) + 2ТТ (5’-6’; 9’-10’)
181
182. Способы отвода и подвода тепла
Лекция 12.СПОСОБЫ ОТВОДА И
ПОДВОДА ТЕПЛА
182
183. Расчет температур верха и низа колонны
Температура верхаТемпература низа
в эв p N к
н эв p N о
y' D ,i n
x' D ,i 1
i 1 K i
i 1
n
n
K x'
i
i 1
n
W ,i
y'
i 1
W ,i
1
Для бинарной смеси:
y 1 y
1
K1 K 2
'
D
'
D
K i Pi в
'
K x K 2 1 xW 1
'
1 W
K i Pi н
183
184. Расчет температуры ввода сырья в колонну
Прие 1
При
xi ,F
i 1 e ( Ki 1 ) 1
е 0
K i xi ,F
i 1 e ( Ki 1 ) 1
Для бинарной смеси:
x F
1 x F
1
1 e ( K1 1 ) 1 e ( K 2 1 )
Ki
K1 x F
K 2 ( 1 x F )
1
1 e ( K1 1 ) 1 e ( K 2 1 )
Pi
э
184
185. Способы создания орошения в колонне
• Парциальный конденсатор• Холодное испаряющееся орошение
• Циркуляционное неиспаряющееся орошение
Выбор способа отвода тепла определяется условиями
эксплуатации, свойствами перерабатываемого сырья и
экономической эффективностью
185
186. Способы создания орошения в колонне
Парциальный конденсаторg
G N к HТ N к g горhtD D HТ D Qd
гор
D HТ
g горht D HТ Qd
Nк
Qd g гор H Т
D
Nк
ht D H Т
D HТ
D
Nк
Ht
D
D
Nк
Ht
0
Qd g гор H t Nк ht D
Qd g горqконд
186
D
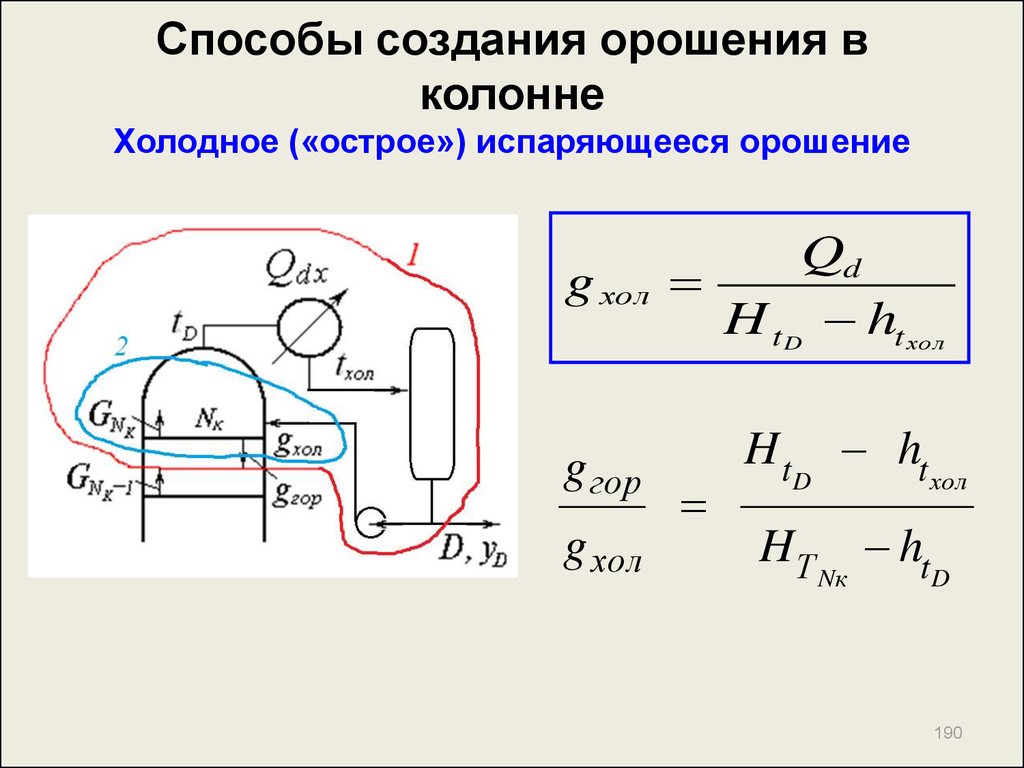
187. Способы создания орошения в колонне Холодное («острое») испаряющееся орошение
tN tDк
187
188. Способы создания орошения в колонне Холодное («острое») испаряющееся орошение
Контур 1G N к 1 HТ Nк 1 D ht хол g гор ht Nк Qdх
g
гор
D HТ Nк 1 D ht хол g гор ht Nк Qdх
Qdх g гор HТ Nк 1 ht Nк D HTNк 1 ht хол
Qdх g гор HТ Nк 1 ht Nк D HТ Nк 1 HТ Nк D HTNк ht хол
Qdх Qd D H Т
Nк
ht
хол
188
189. Способы создания орошения в колонне Холодное («острое») испаряющееся орошение
Контур 2g
GN K 1 HTNK 1 g хол ht хол g горht NK GN K HTNK
гор
D H Т Nк 1 g хол ht хол g гор ht N D g хол H Т Nк
к
g хол H Т Nк ht хол g гор H Т Nк 1 ht Nк D H Т Nк 1 H Т Nк
Qd g хол H t D ht хол
189
190. Способы создания орошения в колонне Холодное («острое») испаряющееся орошение
g холg гор
g хол
Qd
H t D ht хо л
D
ht
HТ
ht
Ht
Nк
хол
D
190
191. Способы создания орошения в колонне Верхнее циркуляционное неиспаряющееся орошение
G Nк 1 HТ N к 1 gцоhtцоg гор ht gцоht D H T
g
tD T D
D
гор
D HТ
D
N к 1
D
gцоht
цо
g гор ht gцоht D H t
D
D
D
191
192. Способы создания орошения в колонне Верхнее циркуляционное неиспаряющееся орошение
g цо ht D htцо g гор H Т Nк 1 ht D D H t Nк 1 H t Dg цо ht ht
gцо
Qd
ht ht
D
D
цо
Q
d
g цо
цо
g хол
HТ
D
ht
ht ht
D
хол
цо
192
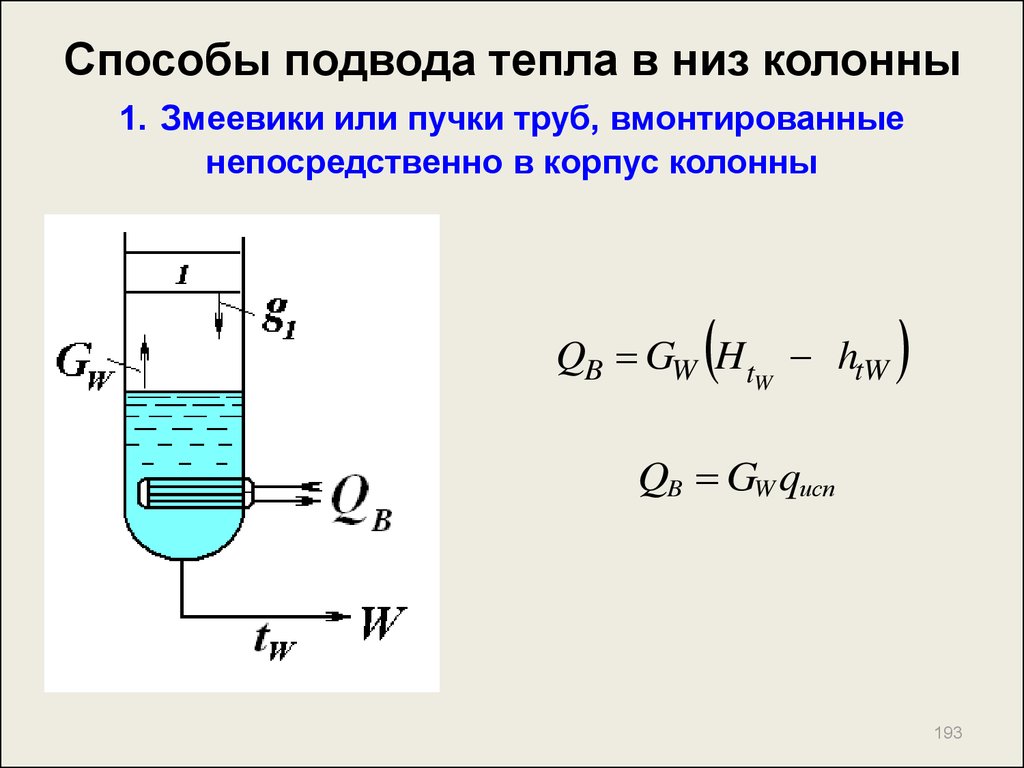
193. Способы подвода тепла в низ колонны 1. Змеевики или пучки труб, вмонтированные непосредственно в корпус колонны
QB GW Ht htWW
QB GW qисп
193
194. Способы подвода тепла в низ колонны 2а. Подогреватель с паровым пространством - рибойлер
Способы подвода тепла в низ колонны2а. Подогреватель с паровым пространством рибойлер
G
W
W ht QB GW Ht W ht
1
W
W
QB GW Ht ht W ht ht
W
1
W
1
t1 tW
QB GW Ht ht
W
1
QB GW Ht ht
W
W
QB GW qисп
194
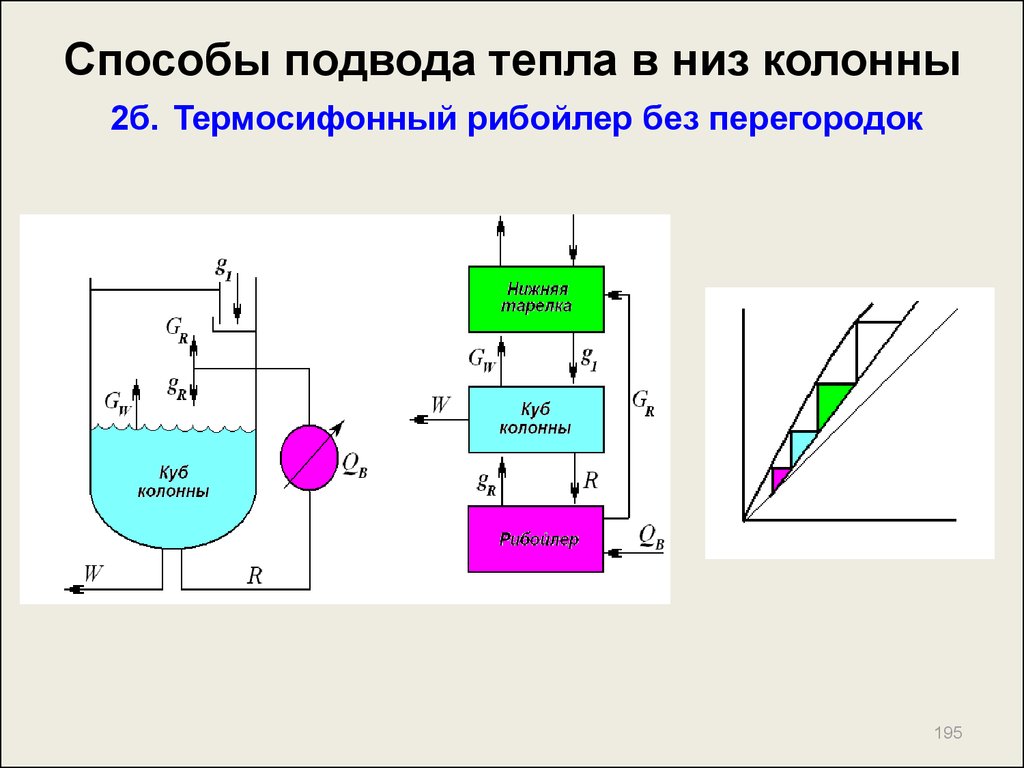
195. Способы подвода тепла в низ колонны 2б. Термосифонный рибойлер без перегородок
195196. Способы подвода тепла в низ колонны 2в. Термосифонный рибойлер с перегородкой
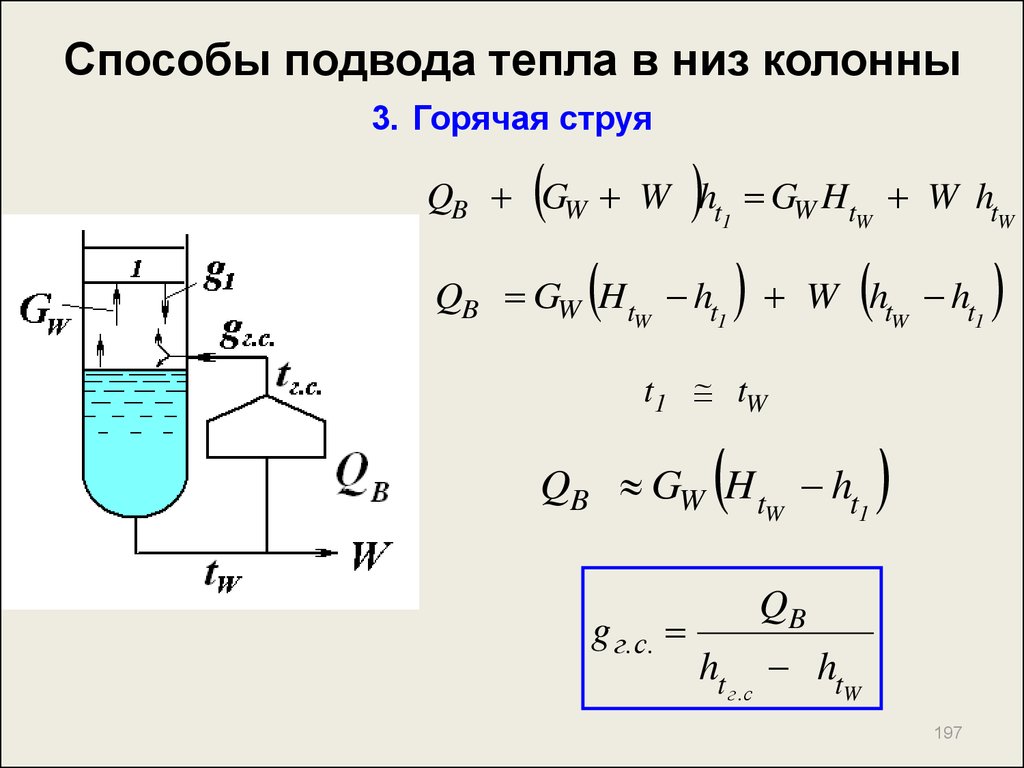
196197. Способы подвода тепла в низ колонны 3. Горячая струя
QB GW W ht GW Ht W ht1
QB GW H t ht
W
1
W
W
W h
tW
ht
1
t1 tW
QB GW H t ht
g г.с.
W
1
QB
ht
г.с
ht
W
197
198. Выбор давления при ректификации
Ректификационныеколонны
Атмосферные
p patm p
Вакуумные
p patm
Для разделения
легких
углеводородов
p patm
198
199. Особенности работы колонны с вводом водяного пара
P PZG
M P P
Z
PZ P
18
G
PM G Z
18( P )
t F tW
n
P Pi xi
i 1
GNo GW
П
GW
0 ,25 0 ,35
W
199
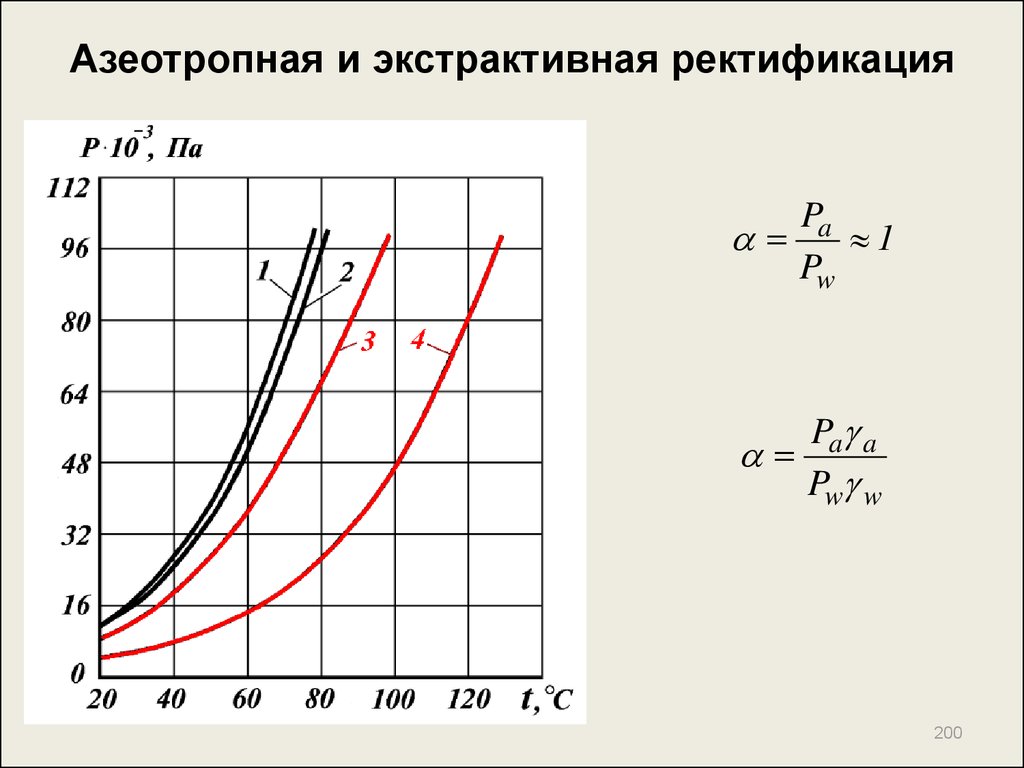
200. Азеотропная и экстрактивная ректификация
Pa1
Pw
Pa a
Pw w
200
201. Азеотропная и экстрактивная ректификация
Схема азеотропной перегонки201
202. Азеотропная и экстрактивная ректификация
Схема азеотропной перегонкиэтанол+ вода+бензол
э+в
96,5%+3,5%
t = 78,1оС
F
э+б+в
18,5%+74,1%+7,4%
t = 64,85оС
э+б
32,4%+67,6%
t = 68,2оС
D1
D2
Отстойник
t = 20оС
верхняя фаза
нижняя фаза
84% об.
16% об.
э+в+б
э+в+б
14,5%+1,0%+84,5%
53%+36%+11%
W1 - практически чистый этанол
W2 - слабый водный раствор этанола
D3 - азеотроп этанол+вода
W3 - вода
202
203. Азеотропная и экстрактивная ректификация
Схема азеотропной перегонкиТребования к растворителю:
1) образует низкокипящий азеотроп с одним из
компонентов;
2) химически стабильный;
3) дешевый и доступный.
Растворители:
спирты, МЭК, бензол
203
204. Азеотропная и экстрактивная ректификация
Схема экстрактивной перегонкиТребования к
растворителю:
1) высокая избирательная
способность;
2) хорошо растворяет оба
компонента;
3) легко отделяется;
4) термически и химически
стабильный;
5) не вызывает коррозию;
6) не токсичен;
7) невысокая стоимость.
Растворители:
фенол, фурфурол
204
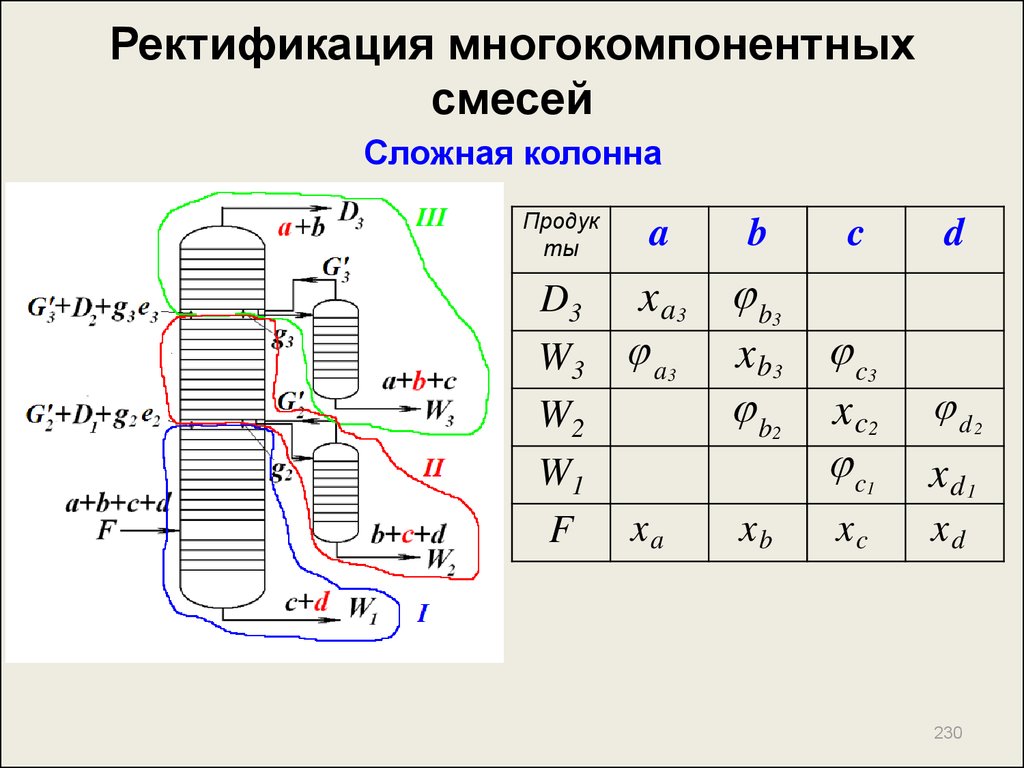
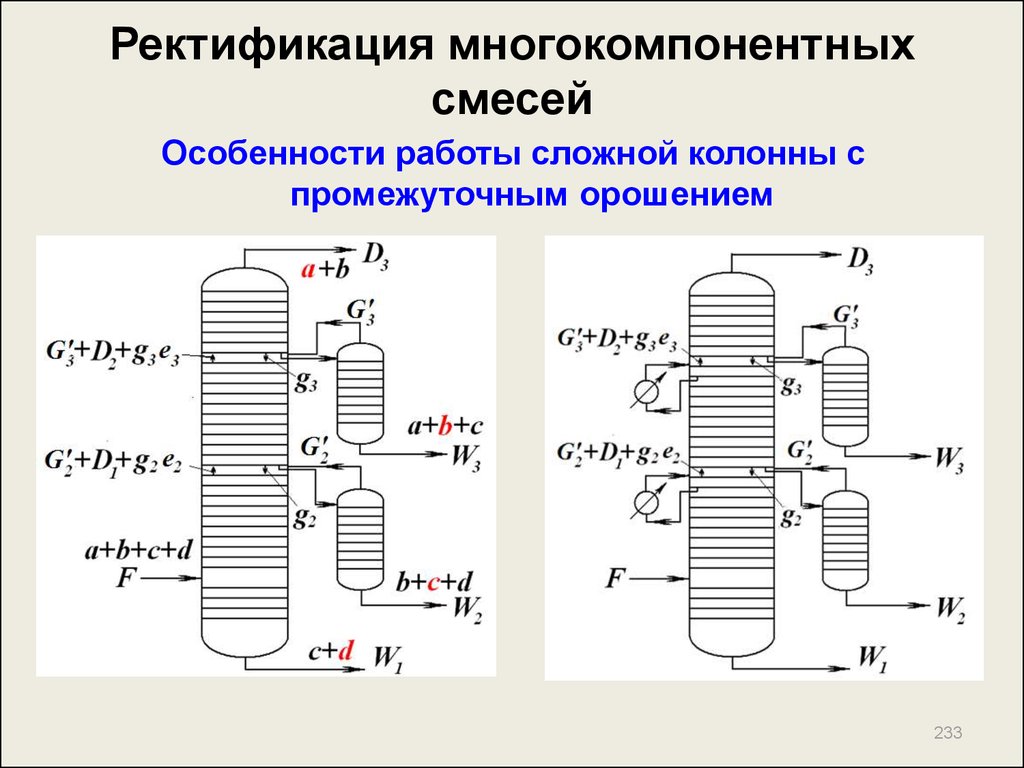
205. Ректификация многокомпонентных смесей
Лекция 15.РЕКТИФИКАЦИЯ
МНОГОКОМПОНЕНТНЫХ
СМЕСЕЙ
205
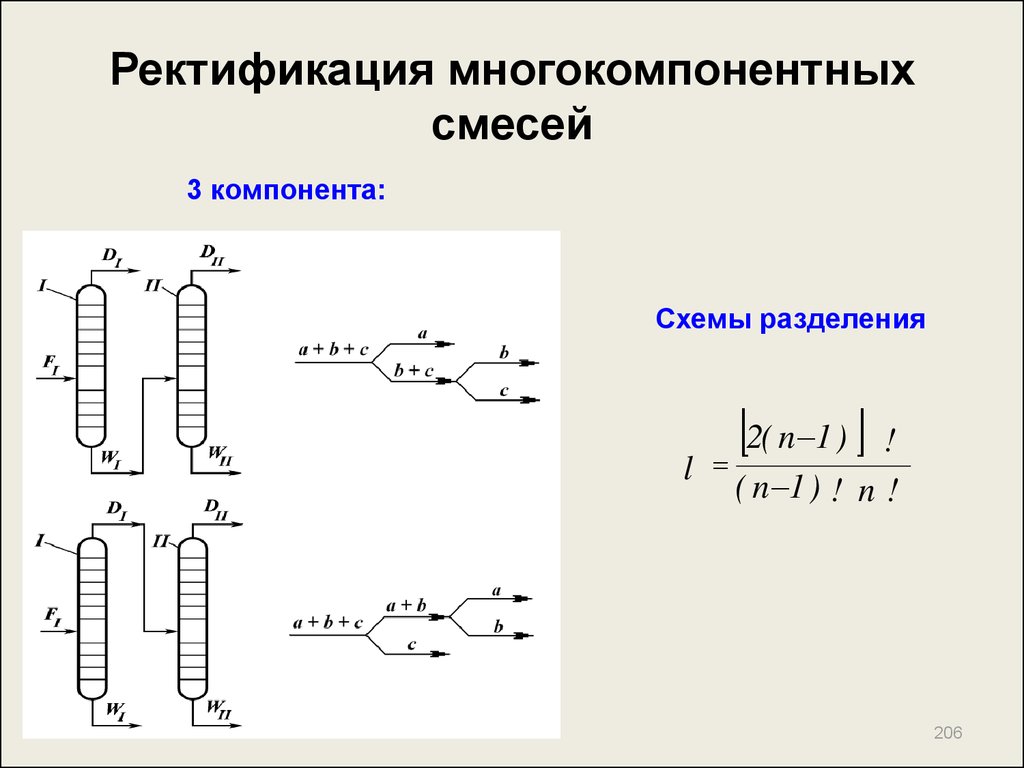
206. Ректификация многокомпонентных смесей
3 компонента:Схемы разделения
l
2( n 1 )
!
( n 1 ) ! n !
206
207. Ректификация многокомпонентных смесей
Особенности расчетаD
xi ,F xi ,W
yi ,D xi ,W
F
1
W
F
yi ,D xi ,F
yi ,D xi ,W
k
k
i 1
k
i 1
k
i 1
i 1
k
k
i 1
k
i 1
k
i 1
i 1
xi ,F xi ,W
yi ,D xi ,W
yi ,D xi ,F
yi ,D xi ,W
207
208. Ректификация многокомпонентных смесей
Расчет процесса однократного испарения*
i ,F
x' i ,F e' y
Материальный баланс:
( 1 e' ) x*i ,F
*
i ,F
y K i x*i ,F
Равновесие:
*
*
x' i ,F e' K i xi ,F ( 1 e' ) xi ,F
*
xi ,F
n *
xi ,F
i 1
x' i ,F
1 e' ( K i 1 )
n
i 1
x' i ,F
1
1 e' ( K i 1 )
208
209. Ректификация многокомпонентных смесей
Расчет процесса однократного испаренияРавновесие:
x
*
i ,F
*
i ,F
y
Ki
x' i ,F e' y ( 1 e' )
*
i ,F
*
yi ,F
n *
y
i ,F
i 1
n
i 1
*
i ,F
y
Ki
K i x' i ,F
1 e' ( K i 1 )
K i x' i ,F
1 e' ( K i 1 )
1
209
210. Ректификация многокомпонентных смесей
Расчет режима полного орошенияy m 1 x m
y i ,m 1 x i ,m
yi ,m 1 K i xi ,m 1
R
Ф
Ф
g
G
g
G
N N мин
R 1
1
R
П 1
1
П
y j ,m 1 K j x j ,m 1
yi ,m 1 K i xi ,m 1 i xi ,m 1
y j ,m 1 K j x j ,m 1 j x j ,m 1
210
211. Ректификация многокомпонентных смесей
Расчет режима полного орошенияxi ,m i xi ,m 1
x j ,m j x j ,m 1
y i ,m 1 x i ,m
y j ,m 1 x j ,m
yi ,m 1 xi ,m
y j ,m 1 x j ,m
xi ,m 1 i xi ,m 2
x j ,m 1 j x j ,m 2
2
xi ,m i xi ,m 2
x j ,m j x j ,m 2
211
212. Ректификация многокомпонентных смесей
Расчет режима полного орошенияxi ,D
x j ,D
i
j
N
xi ,W
x j ,W
N N мин
N
xi ,0 i xi ,N
x j ,0 j x j ,N
N мин
xi ,D x j ,W
ln
x j ,D xi ,W
i
ln
j
212
213. Ректификация многокомпонентных смесей
Расчет режима полного орошенияN мин
x
i i ,D
xi ,W
xi ,D x j ,D
ln
ln
xi ,W
x j ,W
i
ln
j
ln
ln
N
ln ln
i
j
i
j
м ин
- Уравнение Фенске
213
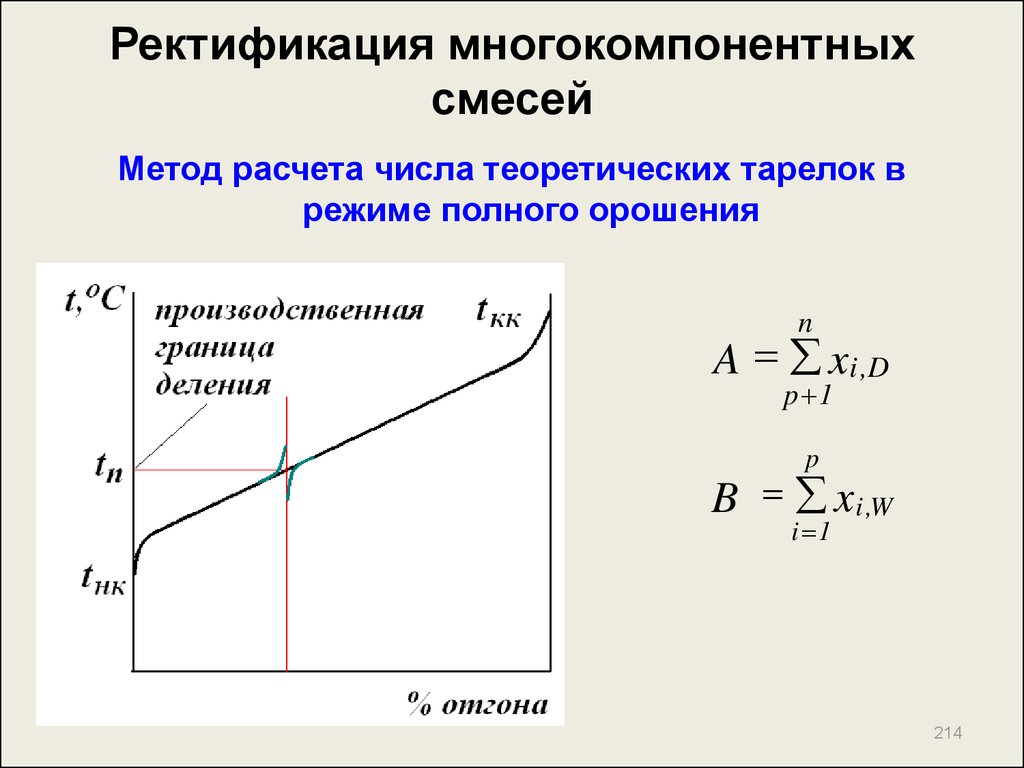
214. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
n
A x i ,D
p 1
p
B x i ,W
i 1
214
215. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
№№
комп.
1
2
…
p
p+1
…
…
n
Σ
i xi,F xi,D xi,W
1 x1,F
2 x2,F
…
…
…
B
1
m>1
p p 1
…
p xp,F
p+ xp+
1
1-A
i,
t p t t p 1
A
1-B
k<1
…
…
n xn,F
1,000 1,000 1,000
215
216. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
n
p
m
y
i 1
p
i ,D
x
i ,W
i 1
k
p 1
n
x
p 1
p 1
i ,D
p
x
i 1
n
y
1 y
1 A
B
i ,W
n
i ,D
i ,W
y
p 1
p
i ,D
1 xi ,W
A
1 B
i 1
216
217. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
ln
ln
m
k
N min
ln m ln k
(1)
m 1
m)
ln
exp
N min
(
в первом приближении принимаем:
(1)
m
(1)
k n 1
(1)
или
(1)
(1)
ln
ln
m
k
N min
ln m ln k
(1)
(1)
(1)
k
(1)
ln
k)
exp (
N min
(1)
217
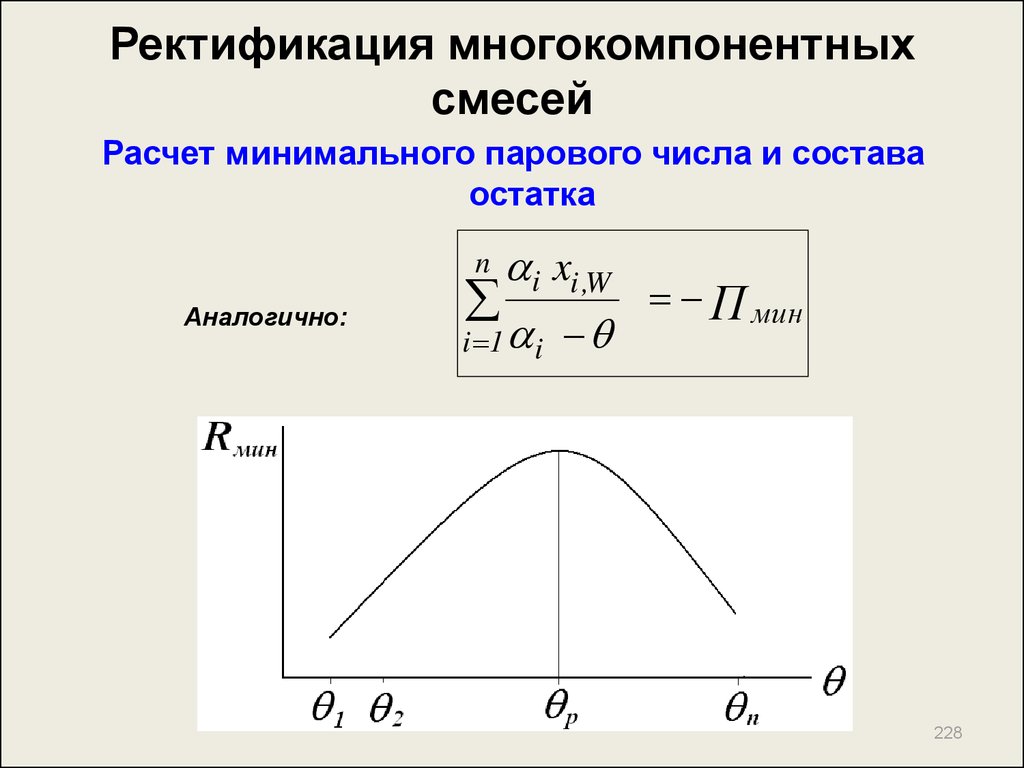
218. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
p
x
p
i ,F
i 1
xi ,W
p
n
1 y
p 1
i 1
i ,D
(1)
i
xi ,W
p
x
i ,F
i 1
B
1 A B
i 1
( i )
(1)
( 1 ) N m in
1
i xi ,F
yi ,D
1 1 1
i
(1)
(1)
i ,W
x
xi ,F
1
1
1
i
218
219. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
(1)
m
(1)
k
p
x
i 1
n
(1)
i ,D
x
p 1
(1)
i ,D
p
x
i 1
n
(1)
i ,W
x
p 1
(1)
i ,W
Для второго приближения:
m( 2 ) ( 1 ) exp
ln ( 1 )
m
(
1
)
N
min
k exp
(2)
(1)
ln k( 1 )
(
1
)
N
min
219
220. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
Во втором приближении:
N
N
( j 1 )
min
(2)
min
N
ln m ln k
(2)
(2)
ln m ln k
( j)
min
0 ,001
220
221. Ректификация многокомпонентных смесей (продолжение)
Лекция 16.РЕКТИФИКАЦИЯ
МНОГОКОМПОНЕНТНЫХ
СМЕСЕЙ (ПРОДОЛЖЕНИЕ)
221
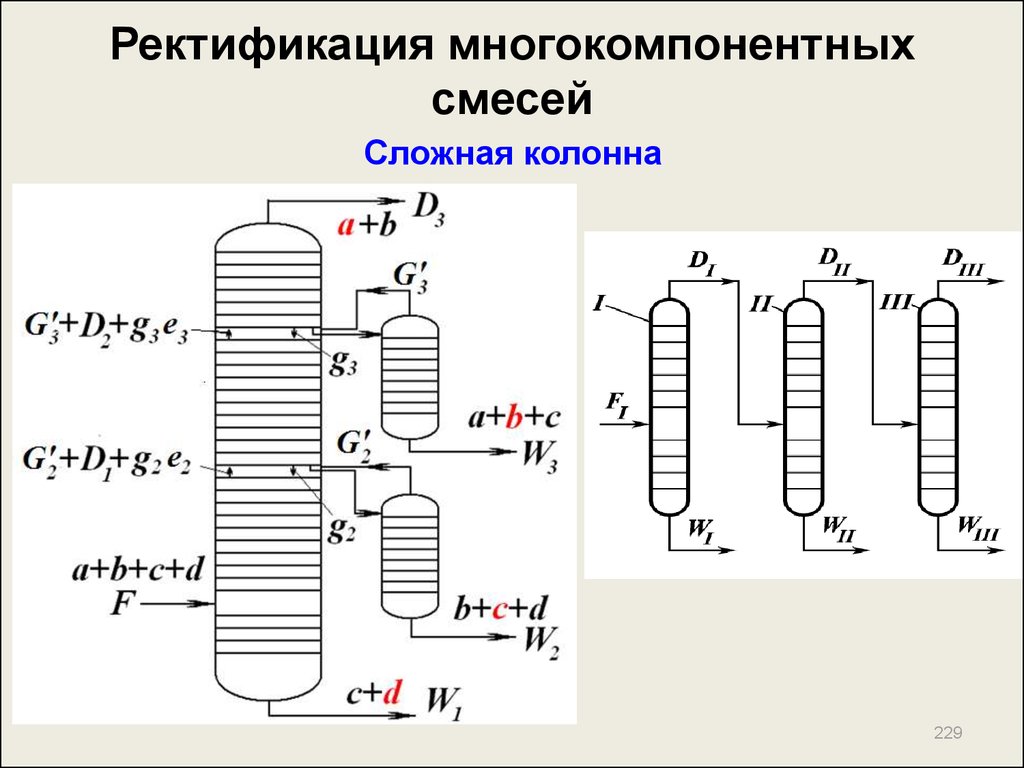
222. Ректификация многокомпонентных смесей
Метод расчета числа теоретических тарелок врежиме полного орошения
N k N k ,min
N o N o ,min
Сечение ввода сырья:
N
k ,min
x
ln
x
i ,D
ln
i ,F
ln
x
x
j ,D
j ,F
xF x F
ln
ln
xW
x
i ,W
i,
;
N o ,min
i
j,
j,
ln i
j
i p
j p 1
j
























































































































































































 Физика
Физика Химия
Химия








