Похожие презентации:
Предмет и значение органической химии. Сравнение органических веществ с неорганическими
1.
Государственное бюджетное профессиональноеобразовательное учреждение города Москвы
"Колледж Архитектуры, Дизайна и Реинжиниринга
№ 26"
Введение. Предмет и значение органической
химии. Сравнение органических веществ с
неорганическими
Подготовил:
Преподаватель химии, Кандыбин А.А.
2.
История становления органическойхимии
Сведения об органических веществах и их
превращениях известны человеку с глубокой
древности.
Получение красителей
Изготовление вина
Получение сахара
из сахарного тростника
3.
Возникновение и развитиеорганической химии
Первые классификации (по происхождению)
IX – X в. арабский алхимик Абу Бакр ар-Рази
(865-925):
Вещества
(изучались раздельно)
Минеральные
Растительные
Животные
4.
Возникновение органической химии какнауки
Йенс Якобс Берцелиус – 1807г.
«Вещества, получаемые из организмов
(растительного и животного происхождения) –
ОРГАНИЧЕСКИЕ, наука, их изучающая –
ОРГАНИЧЕСКАЯ ХИМИЯ.»
По Берцелиусу органические вещества
нельзя получить в лаборатории, как
неорганические. Они создаются
организмами под влиянием «жизненной
силы»
Учение о «жизненной силе» виталистическое учение (от лат. vita
– жизнь)
5.
Берцелиус (Berzelius) ЙенсЯкоб (1779-1848), шведский
химик и минералог,
иностранный почетный член
Петербургской АН (1820).
Открыл церий (1803), селен
(1817), торий (1828).
Создал (1812-19)
электрохимическую теорию
химического сродства, на ее
основе построил
классификацию элементов,
соединений и минералов.
Определил (1807-18) атомные
массы 45 элементов, ввел
(1814) современные
химические знаки элементов.
Предложил термин «катализ».
6.
Развитие органической химии• 1824г. – синтезирована щавелевая кислота
(Ф.Вёллер);
• 1828г. – мочевина (Ф.Вёллер);
• 1842г. – анилин (Н.Н.Зинин);
• 1845г. – уксусная кислота (А.Кольбе);
• 1847г. – карбоновые кислоты (А.Кольбе);
• 1854г. – жиры (М.Бертло);
• 1861г. – сахаристые вещества (А. Бутлеров)
7.
Вёлер Фридрих (1800-82),немецкий химик,
иностранный членкорреспондент
Петербургской АН (1853).
Впервые синтезировал
из неорганических
веществ органическое
соединение (1824) и
установил его тождество
с мочевиной (1828).
Исследования Вёлера
поставили под сомнение
правоту витализма.
8.
Кольбе (Kolbe) АдольфВильгельм Герман
(1818-84), немецкий
химик.
Разработал методы
синтеза уксусной (1845),
салициловой (1860,
реакция Кольбе Шмитта) и муравьиной
(1861) кислот,
электрохимического
синтеза углеводородов
(1849, реакция Кольбе).
9.
Бутлеров Александр Михайлович(1828-86), российский химик-органик,
академик Петербургской АН (1874).
Создал (1861) и обосновал теорию
химического строения, согласно
которой свойства веществ
определяются порядком связей
атомов в молекулах и их взаимным
влиянием.
Первым объяснил (1864) явление
изомерии. Открыл полимеризацию
изобутилена.
Синтезировал ряд органических
соединений (уротропин, полимер
формальдегида и др.).
Труды по сельскому хозяйству,
пчеловодству.
10.
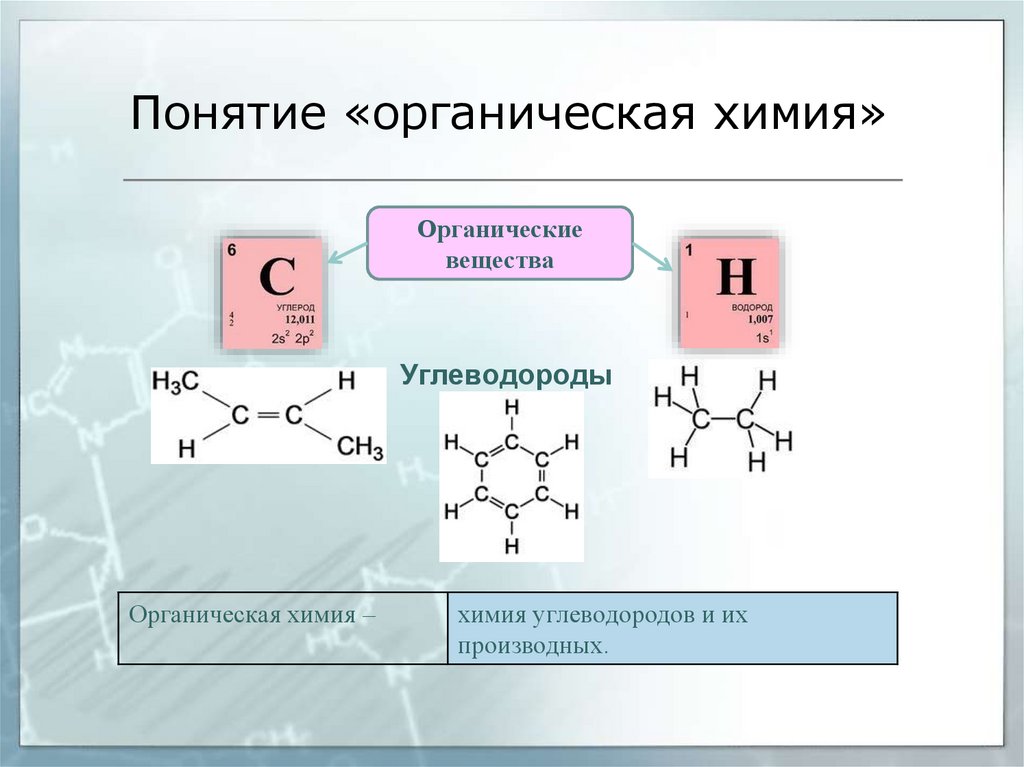
Понятие «органическая химия»Органические
вещества
Углеводороды
Органическая химия –
химия углеводородов и их
производных.
11.
Органическая химия изучает:строение органических веществ,
способы их получения,
химические свойства
области практического применения
12.
Производные углеводородовН
Н
Н
Н-С-Н
Н - С - ОН
Н - С - Cl
Н
МЕТАН
Н
МЕТАНОЛ
Н
ХЛОРМЕТАН
Н
Н
Н
Н - С – NH2
Н - С – NO2
Н-С=O
Н
МЕТИЛАМИН
Н
НИТРОМЕТАН
МЕТАНАЛЬ
13.
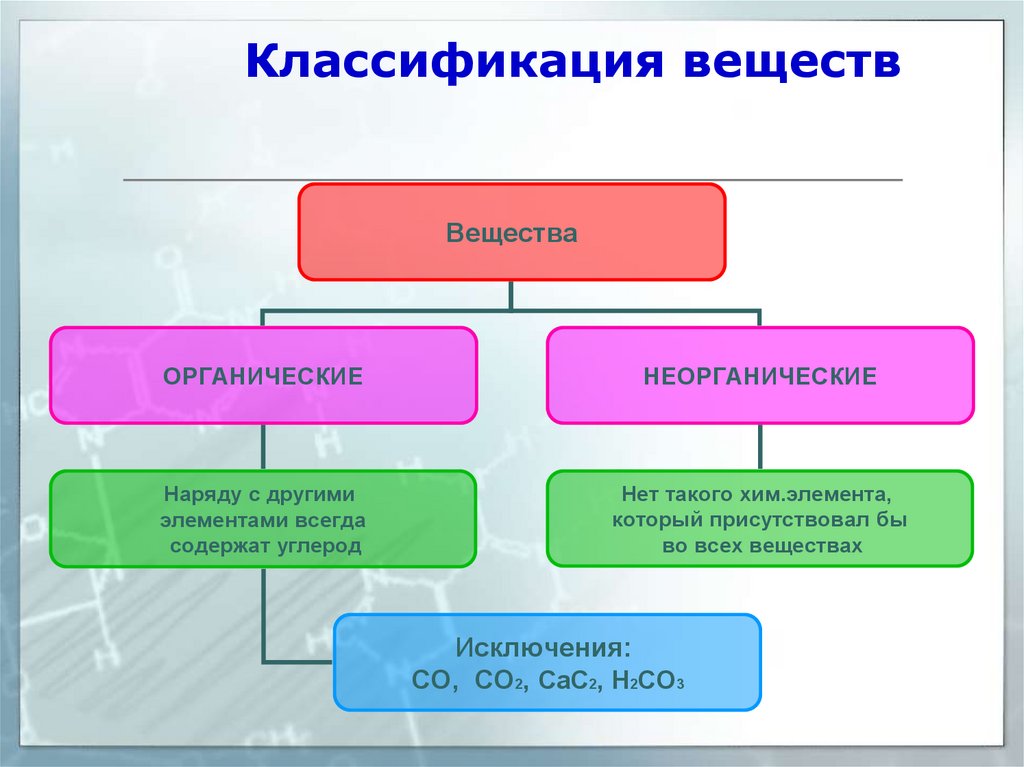
Классификация веществВещества
ОРГАНИЧЕСКИЕ
НЕОРГАНИЧЕСКИЕ
Наряду с другими
элементами всегда
содержат углерод
Нет такого хим.элемента,
который присутствовал бы
во всех веществах
Исключения:
CO, CO2, CaC2, H2CO3
14.
Природныевещества
Углеводы
Искусственные
вещества
Бензин
Нефть
Cинтетические
вещества
Капрон
Аспирин
Белки
Жиры
В природе
Вискоза
Созданы на
основе
природных
Синтезированы
15.
16.
17.
Органическиевещества
CH4
C2H5OH
C2H2
C6H12O6
C6H5NH2
CH3COOH
Примеры
Неорганические
вещества
H2
Ca(OH)2
H2CO3
CO2
NaCl
Fe
18.
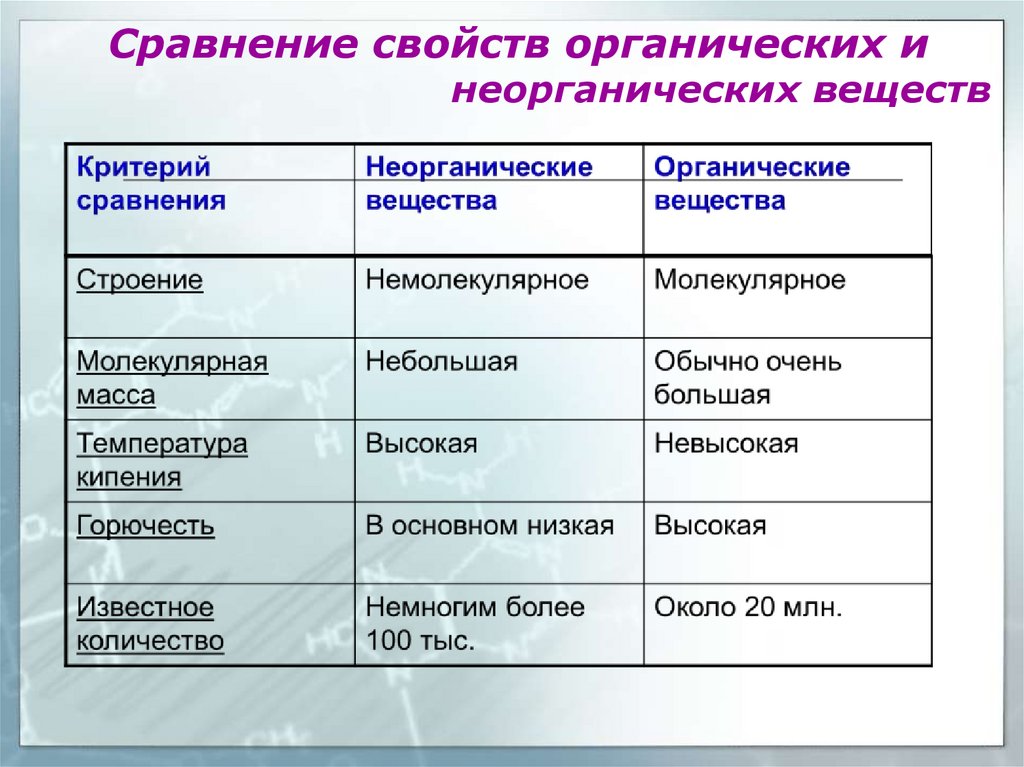
Особенности органических веществХарактерные особенности
1. В состав обязательно входят
атомы С и Н
Примечания
Горючесть, обугливание при
перегревании.
2. Имеют низкие температуры
плавления и кипения
Большинство имеют молекулярную
кристаллическую решетку
3. Большинство нерастворимы в
воде
Большинство образовано ковалентными
малополярными связями
4. Большинство являются
неэлектролитами
Реакции протекают медленно, чаще с
участием катализатора
5. Участники или продукты
процессов в живых организмах
6. Многочисленность
Сложные органические вещества
способны к самоорганизации
19.
Сравнение свойств органических инеорганических веществ
20.
Органические вещества горючи21.
Обугливаются при нагреванииДревесина
Мясо
Сахар
22.
Органические соединения~ 100 млн.
Неорганические соединения
~ 700 тыс.
23.
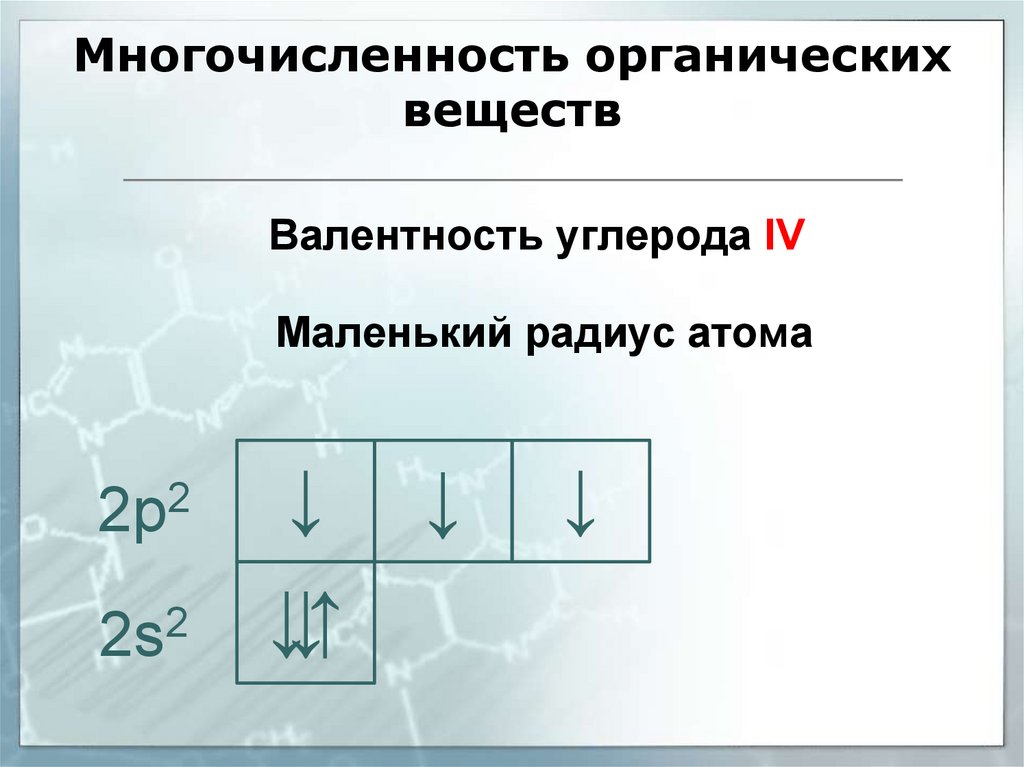
Многочисленность органическихвеществ
Валентность углерода IV
Маленький радиус атома
2p2
↓
2
2s
↓↑
↓
↓
↓
24.
Типы связей между атомами СОдинарная
связь
Двойная
связь
Тройная
связь
Связь - ковалентная!
25.
Виды углеродных цепейЦиклическая
цепь
Прямая
цепь
Разветвленная
цепь
26.
Причина многообразия органическихвеществ
H
H
HO
H
H
OH O
H
OHO
HO
H
H O
O
OH O
OH
HO
H
H
H
OH
O
H
H
H
H
H
H
O
O
HO
H
H
H
OH
H
HO
H
O
H
OH
HO
H
OH
O
HO
H
H
H
H
OH
O HO
H
HO H
H
H
O
H
OH O
HO
H
OH
H
O
H
Способность атомов углерода соединяться друг
с другом простыми и кратными связями и
образовывать
прямые,
разветвленные
и
циклические
цепи
различной
длины
называется катенацией
27.
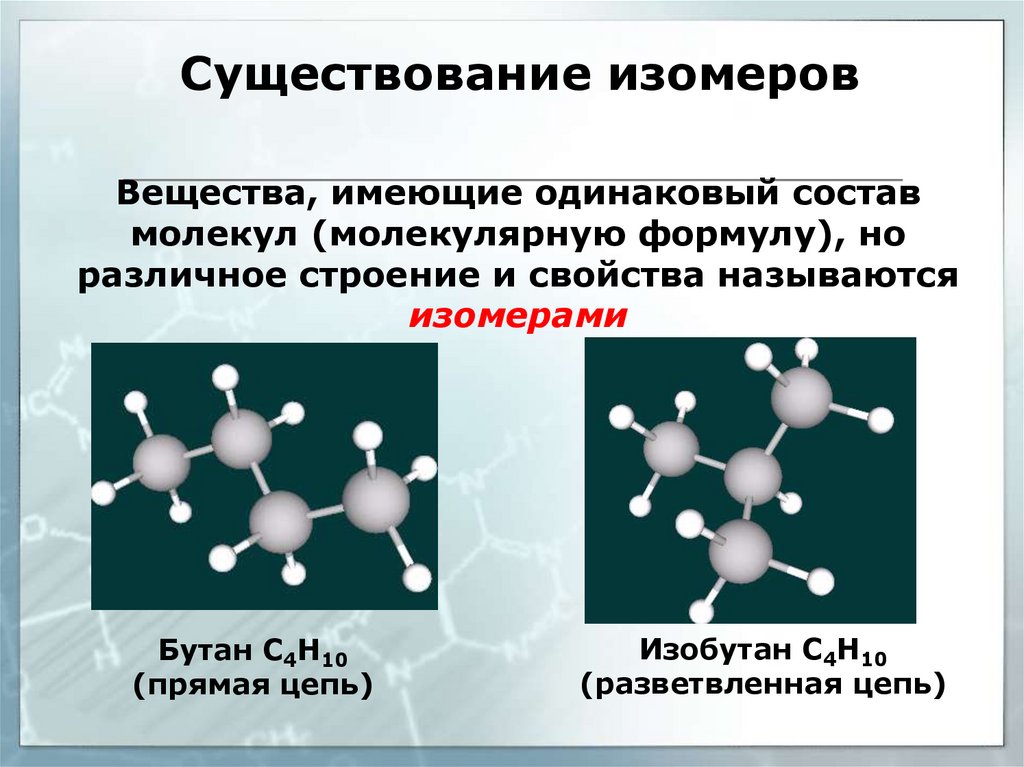
Существование изомеровВещества, имеющие одинаковый состав
молекул (молекулярную формулу), но
различное строение и свойства называются
изомерами
Бутан С4Н10
(прямая цепь)
Изобутан С4Н10
(разветвленная цепь)
28.
Изомерия - явлениесуществования изомеров
Молекулярная
формула
Число возможных
изомеров
С6Н12
С10Н22
С14Н30
С20Н44
5
75
1858
366 319
29.
Существование гомологовМолекулярные формулы первых представителей
гомологических рядов предельных углеводородов и
предельных одноатомных спиртов
СН4
С2Н6
С3Н8
С4Н10
+ СН2
+ СН2
+ СН2
+ СН2
СН3ОН + СН2
С2Н5ОН + СН2
С3Н7ОН + СН2
С4Н9ОН + СН2
Вещества, имеющие одинаковый качественный состав, сходное
строение и свойства, отличающиеся на одну или несколько
гомологических разниц - гомологи
30.
Причины многочисленности имногообразия органических соединений
Следствие
Катенация
Изомерия
Гомология
Следствие
Уникальность атома углерода
31.
Основные классы органическихвеществ
6
C
УГЛЕРОД
12,011
CH4
O
CH3-CH2-CH3
CH2 C
NH2
CH3─CH2─NO2
Алканы
OH
Аминокислоты
Нитросоединения
H2C=CH─CH2─CH3
Алкены
HC≡C─CH2─CH3
Алкины
Алкадиены
H2C=CH─CH=CH2
Амины
CH3─CH2─NH2
Циклоалканы
CH3
Слож ные эфиры
H3C
C
O
CH2
CH3
CH3
Арены
O
Карбоновые
кислоты
O
CH3 C
OH
Кетоны
H3C C CH3
O
Альдегиды
O
CH3 C
H
Фенолы
OH
Спирты
CH3─CH2─OH
Простые эфиры
H3C-O-CH3
32.
Идентификация, установлениесостава и строения органических веществ
Элементный анализ – определение
содержания атомов различных элементов.
2. Измерение физических свойств – плотности,
температуры плавления, показателя преломления.
3. Физические методы.
а) Спектроскопия:
ИК – идентификация функциональных групп
по частотам колебаний;
ЯМР – определение числа структурно
различных атомов по их поведению в
постоянном магнитном поле.
б) Масс-спектрометрия. Измерение молекулярных
масс фрагментов молекулы.


























 Химия
Химия








