Похожие презентации:
Основные способы получения металлов
1.
Основныеспособы
получения
металлов
Учитель химии и биологии ГКОУ
Кадетская школа №1785 Запорожец
Людмила Юрьевна
2.
Химия – это областьчудес, в ней скрыто
счастье человечества,
величайшие завоевания
разума будут сделаны
именно в этой области.
(М. Горький)
3.
Металлургия – это наука, изучающаяспособы получения металлов из
природного сырья.
4.
К металлургии относятся:Производство металлов из природного сырья и других
металлосодержащих продуктов
Получение сплавов
Обработка металлов в горячем и холодном состоянии
Сварка
5.
К металлургии примыкает разработка, производство иэксплуатация машин, аппаратов, агрегатов, используемых в
металлургической промышленности.
С металлургией тесно связаны коксохимия (область химии и
химической промышленности, занимающаяся переработкой
природного топлива), производство огнеупорных материалов.
Обобщённое название лиц, занятых в металлургии - металлург.
6.
Разновидности металлургииЧёрная металлургия
(добыча и обогащение руд
чёрных металлов,
производство чугуна,
стали и ферросплавов)
Цветная
металлургия
(добыча и обогащение
руд цветных металлов,
производство цветных
металлов и их сплавов)
Физические свойства:
Лёгкие алюминий, титан, магний
(Al, Ti, Mg)
Тяжёлые медь, свинец, цинк, олово,
никель (Cu, Pb, Zn, Sn, Ni)
7.
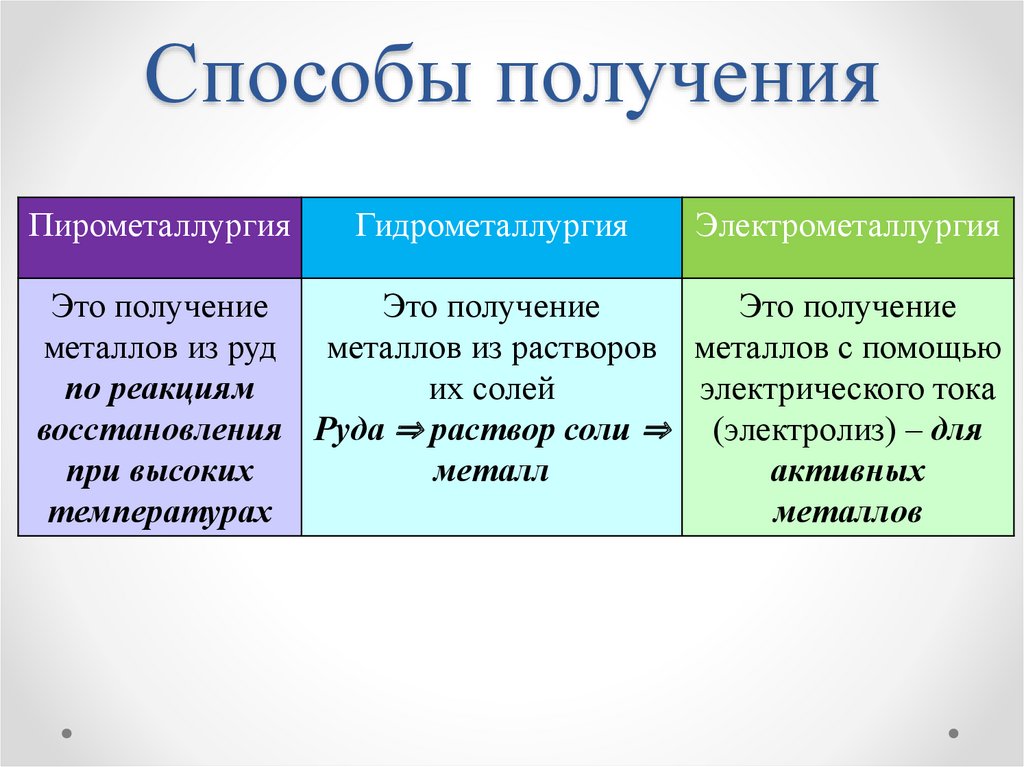
Способы полученияПирометаллургия
Гидрометаллургия
Электрометаллургия
Это получение
Это получение
Это получение
металлов из руд металлов из растворов металлов с помощью
по реакциям
их солей
электрического тока
восстановления Руда ⇒ раствор соли ⇒ (электролиз) – для
при высоких
металл
активных
температурах
металлов
8.
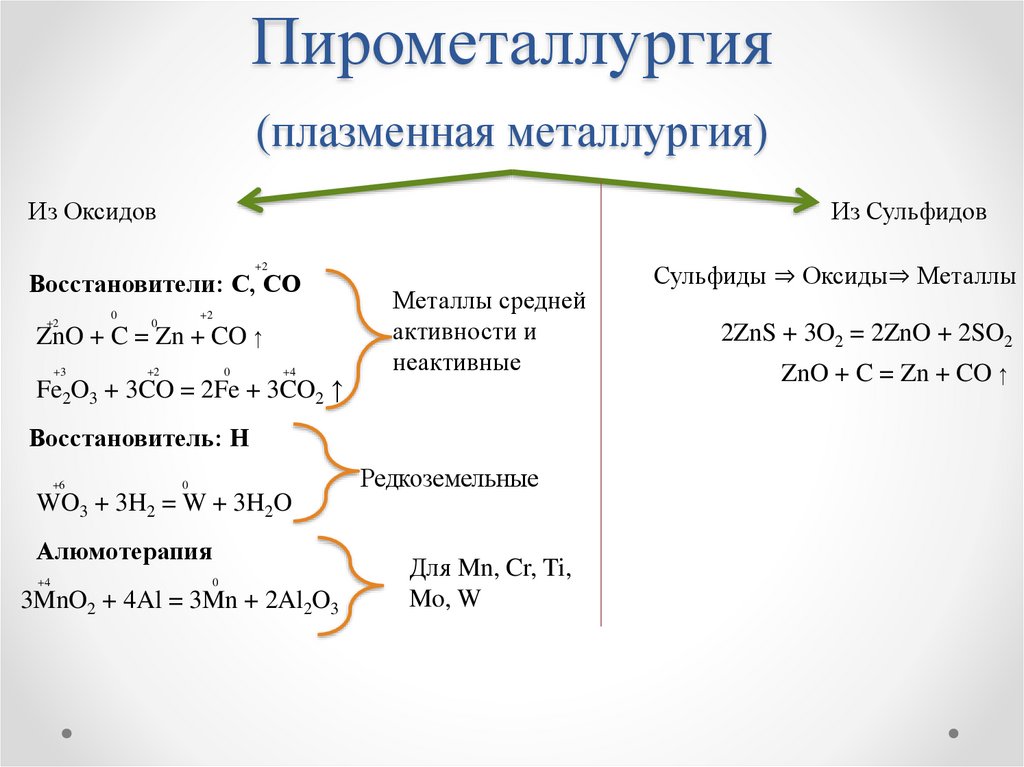
Пирометаллургия(плазменная металлургия)
Из Оксидов
Из Сульфидов
+2
Восстановители: С, СО
+2
0
+2
0
ZnO + C = Zn + CO ↑
+3
+2
0
+4
Fe2O3 + 3CO = 2Fe + 3CO2 ↑
Металлы средней
активности и
неактивные
Восстановитель: Н
+6
Редкоземельные
0
WO3 + 3H2 = W + 3H2O
Алюмотерапия
+4
0
3MnO2 + 4Al = 3Mn + 2Al2O3
Для Mn, Cr, Ti,
Mo, W
Сульфиды ⇒ Оксиды⇒ Металлы
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C = Zn + CO ↑
9.
ГидрометаллургияРуда ⇒ раствор соли ⇒ металл
CuO + H2SO4 = CuSO4 + H2O
(Для Cu, Au, Ag, Zn, Mo, U и др.)
CuSO4 + Fe = Cu ↓ + FeSO4
10.
ЭлектролизЭлектролиз – это восстановительный
процесс, который возникает на
электродах при прохождении
электрического тока через раствор или
расплав электролита.
На катоде ( - ) – восстановление
На аноде ( + ) - окисление
11.
ЭлектролизРасплав
(жидкое расплавленное состояние
вещества при температурах, в
определённых границах, удалённых
от критической точки плавления и
расположенных между
температурами плавления и кипения)
Раствор
(Однородная смесь, состоящая из частиц
растворённого вещества, растворителя и
продуктов их взаимодействия)
Для солей неактивных металлов и бескислородных кислот
(CuCl2) электролиз раствора или расплава соли одинаков)
12.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
2
3
о
л
л
и
5
1
е
13.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
2
3
о
л
5
1 м е т а лл л у р г и я
14.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
3
2
п
и
р
о
е
т
а
о
лл
л
5
у
р
г
1 м е т а лл л у р г и я
я
15.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
3
г
и
д
р
о
2
п
и
р
о
е
т
а
лл
л
е
5
у
т
р
а
г
1 м е т а лл л у р г и я
л
я
р
г
и
я
16.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
э
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
3
2
п
и
р
о
г
и
е
д
т
р
а
л е к т р о м е т а лл л у р г и я
л
е
5
у
т
р
а
г
1 м е т а лл л у р г и я
л
я
р
г
и
я
17.
1. область наукиохватывающая
процессы получения
металлов из руд или
других материалов
2. Восстановление при
высоких температурах 4
э
3. Восстановление
металлов из растворов
их солей
4. электролиз раствора
или расплава
5. пропускание тока
через расплав
металлического
соединения
3
2
п
и
р
о
г
и
е
д
т
р
а
л е к т р о м е т а лл л у р г и я
л
е
5
у
э
т
р
а
л
г
1 м е т а лл л у р г и я
к
л
я
р
о
л
и
з
р
г
и
я
18.
РасплавI. Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2. Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
II. Менее активные металлы
Точно так же
III. Неактивные металлы
Точно так же
19.
РастворI. Активные металлы
1. Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): 2H2O + 2e = H2 + 2OH−
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2. Соль активного металла и кислородсодержащей
кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
20.
РастворII. Менее активные металлы
1. Соль менее активного металла и бескислородной
кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K"катод"(-): Zn2+ + 2e = Zn0
A"анод"(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2. Соль менее активного металла и
кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 +
O2
3. Гидроксид: невозможно (нерастворим)
III. Неактивные металлы
Точно так же
21.
109
7
2
11
13
8
18
3
14
1
15
12
4
17
5
6
16
22.
1. Самый теплопроводный металл2. Самый твёрдый металл
3. Способность материала получать остаточные деформации без разрушения и
сохранять их после снятия нагрузки
4. Самый пластичный металл
5. Однородная смесь, состоящая из частиц растворённого вещества, растворителя и
продуктов их взаимодействия
6. Наука, изучающая способы получения металлов из природного сырья
7. Самый лёгкий металл
8. Восстановительный процесс, который возникает на электродах при прохождении
электрического тока через раствор или расплав электролита
9. Самый тугоплавкий металл
10. Один из самых лёгкоплавких металлов
11. Один из самых мягких металлов
12. Работник в этой сфере деятельности (по теме)
13. Способность материальных тел к переносу энергии
14. Благородный металл. Занимает второе место по пластичности
15. «Стройматериал» для костей. Металл, содержащийся в меле
16. Жидкое расплавленное состояние вещества при температурах, в определённых
границах, удалённых от критической точки плавления и расположенных между
температурами плавления и кипения
17. Самый тяжёлый металл
18. Самый электропроводный металл
23.
107
2
4 З
5
8
Э Л
9
Ц
В
Е
13
Е К Т Р О Л И З
Т
11
Х
И
А
Л
И
3
Р
Т
Л
Ь
Й
П
О
И
И
Ф
1 А Л ЮМ И Н И Й
Й
Р
15
О
А
А
К
П
С
12 М Е
О Л О Т О
Р А С Т В
18 М Е Д
П
14 П Л А
Т А Л Л У
О
И
Ь
В
Ч
Ц
Н
И
Д
О Р
Й
Н
17 О С М И Й
С
Ь
Т И Н А
Р Г
Л
6 М Е Т А Л Л У Р Г
Ь
О
И Я
16 Р А
С П Л А
Т
Ь
В





















 Химия
Химия








