Похожие презентации:
Электролитические способы получение веществ
1.
«Химик без знания физики подобен человеку, который вседолжен искать щупом» М.В.Ломоносов
Учитель химии – Мельситова Татьяна Васильевна
Учитель физики – Кузьменко Елена Валерьевна
г. Владикавказ, 2018
2.
1. Что называется электрическим током?2.Чем обусловлен электрический ток в
металлах?
3.Какие вы знаете заряженные частицы?
4.На какие группы делятся все вещества по
способности проводить электрический
ток?
5. Какие виды проводников вы знаете?
3.
Электролиты – вещества, растворы илирасплавы которых проводят
электрический ток.
Эти вещества имеют ионную связь или
сильно ковалентно – полярную.
щёлочи (Ме ОН)
кислоты (Н Ко)
соли (Ме Ко)
4.
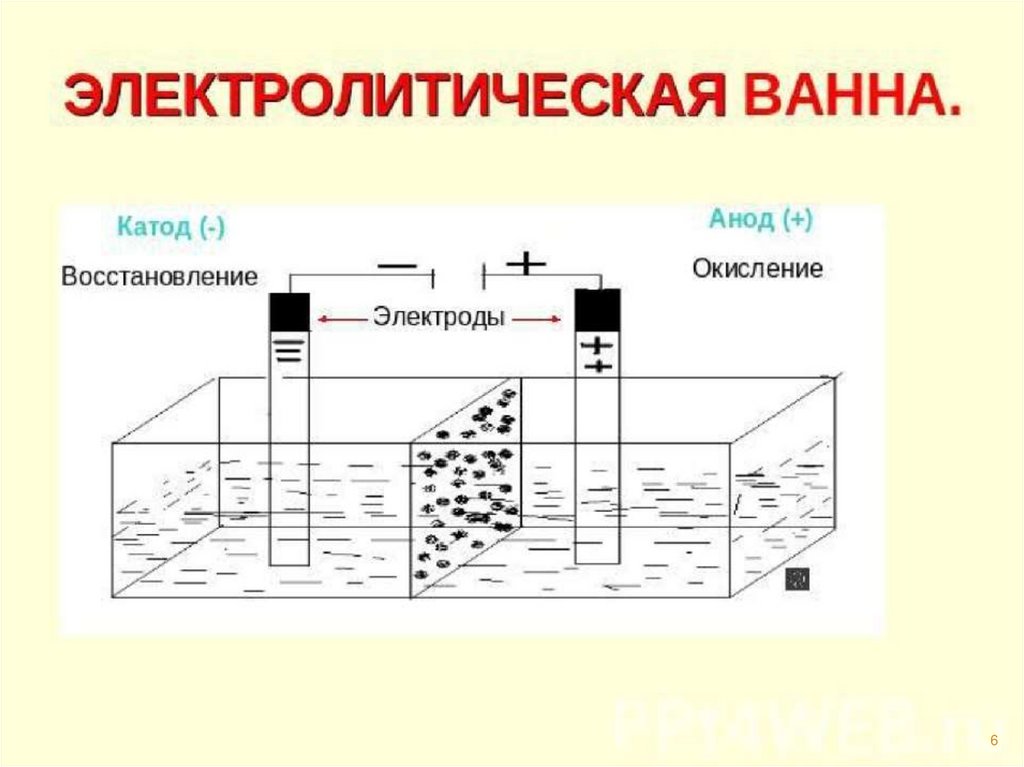
Электролиз – этоокислительно –
восстановительный процесс,
протекающий на электродах
при прохождении
электрического тока
через расплав или
раствор электролита.
5.
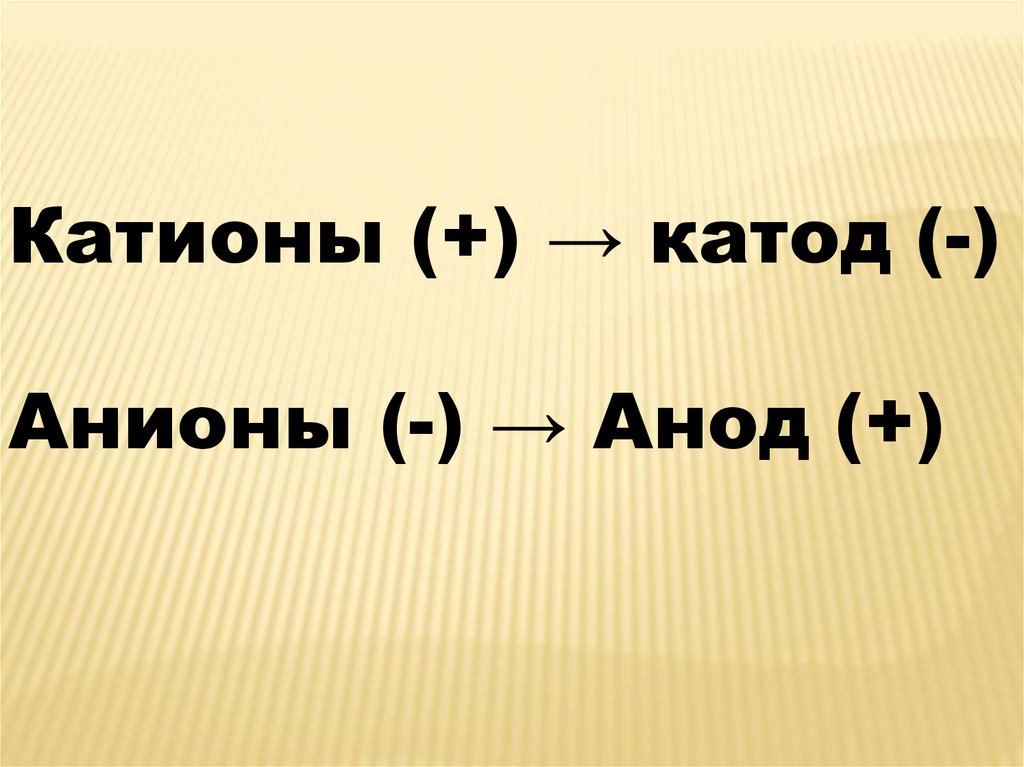
Катионы (+) → катод (-)Анионы (-) → Анод (+)
6.
67.
78.
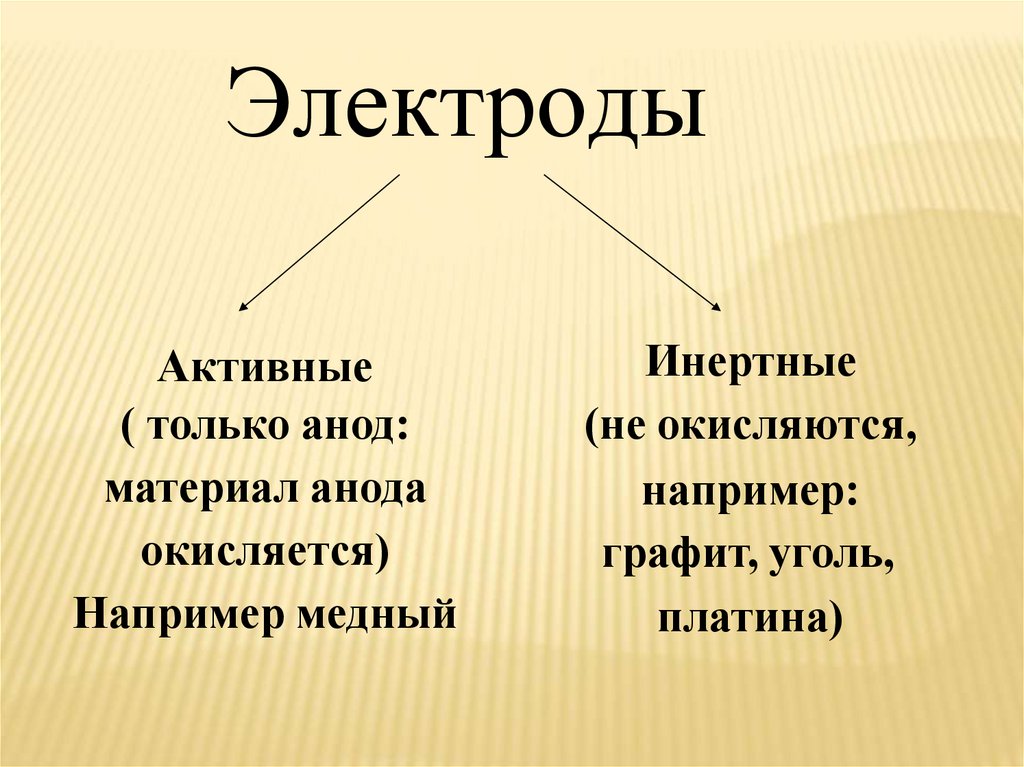
ЭлектродыАктивные
( только анод:
материал анода
окисляется)
Например медный
Инертные
(не окисляются,
например:
графит, уголь,
платина)
9.
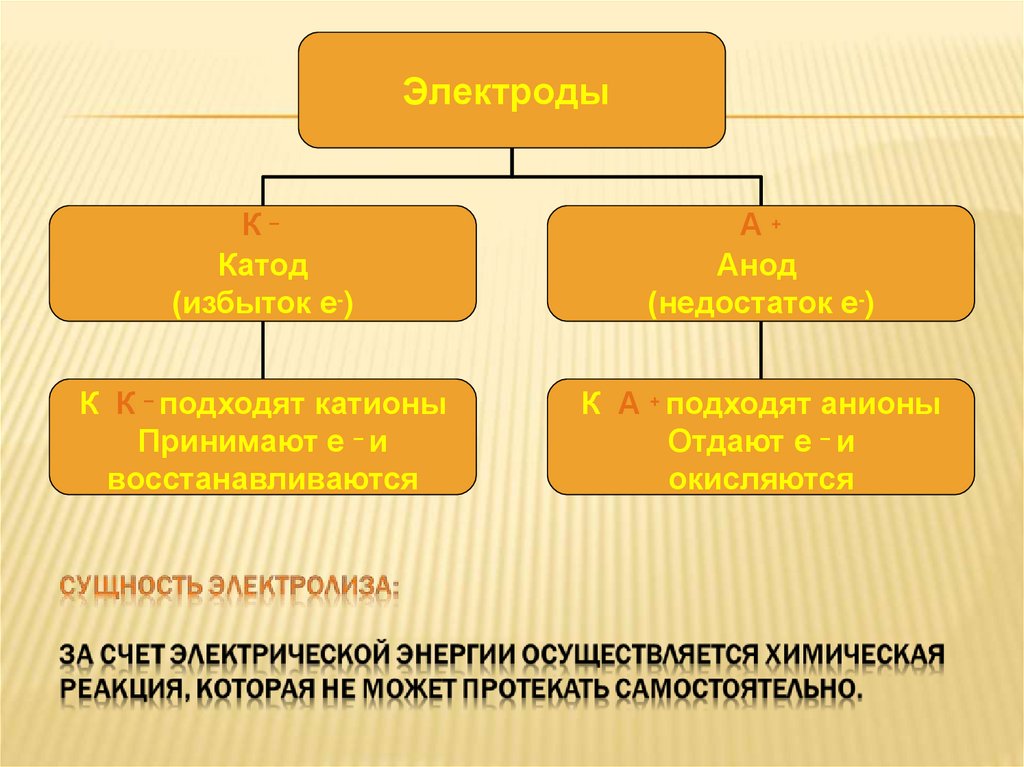
ЭлектродыК–
Катод
(избыток е-)
А+
Анод
(недостаток е-)
К К – подходят катионы
Принимают е – и
восстанавливаются
К А + подходят анионы
Отдают е – и
окисляются
10.
окислительно –- восстановительным
процессом:
на катоде всегда идёт процесс
восстановления,
на аноде всегда идёт процесс
окисления.
11.
2 вида электролиза:- электролиз расплавов
- электролиз растворов
12.
Электрическая энергияХимическая энергия
Расплав
NaCl
Катод(-) <- Na+ + Cl- -> Анод(+)
Na+ + e => Na0
Электролиз
Раст вор
NaCl
Кат од(-) <- N a + + Cl- -> Анод(+)
H2 О
2Cl- => Cl20 + 2e
Восстановление
Окисление
2Na+
2H2 О + 2e => H2 +
2OH-
2 Cl- => Cl2 + 2e
Восстановление
Окисление
Основные положения электродных процессов
1. На катоде:
Li, K+, Ca2+, Na+, Mg2+, Zn2+, Cr3+, Fe2+, Ni2+, Sn2+,
Al3+
Pb2+
Не восстанавливаются,
выделяется H2
H+
Cu2+, Ag+, Hg2+, Pt2+, Au3+
Возможно выделение Me и H2
Восстанавливаются, выделяется
Me
2. Анодные процессы
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne
б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S -, J-, Br-, Cl-, OH- и
молекулы H20:
2J- =>J20 + 2e;
4OH- =>O2 +2H2O +4e;
2H2O =>O2 +4H+ +4e
13.
Правила восстановления катионов на катоде:Li
K
Ca
Na
Mg
Al
Li + K+ Ca2+ Na+ Mg2+ Al3+
Mn
Zn
Fe
Ni
Sn
Pb
Cu
Hg
Ag
Pt
Au
Mn2+ Zn 2+ Fe2+ Ni2+ Sn2+Pb2+
Cu2+ Hg2+2 Ag+ Pt2+ Au3+
2 H2O + 2 ẽ = H2↑ + 2 OH-
Mn++ n ẽ = M0
2H2O + 2ẽ=H2↑+2 OH-
Mn++ n ẽ = M0
Активные металлы - не
восстанавливаются,
восстанавливается вода
Восстанавливаются
катионы металлов и вода
Неактивные металлы восстанавливаются катионы
металлов
14.
Процесс на катоде не зависит отматериала катода, а зависит от
положения металла в
электрохимическом ряду
напряжений.
15.
А+I-
Br-
S2- Cl-
Нерастворимый
анод
остаются
OH-
окисление аниона
SO42-
4ОН- - 4е-
( Коn- )
Kon- - ne- = Koo
CO32-
NO3-
F-
2 Н 2 О - 4 е - = О2 + 4 Н +
= 2 Н2О +
( анионы Коn-
+ O2 в растворе )
Растворимый
Происходит окисление металла анода
анодМео – n e- = Men+
анод
р-р
16.
1.2.
Если анод нерастворимый, т.е.
инертный (уголь, графит, платина,
золото), то результаты зависят от
анионов кислотных остатков.
Если анод растворимый ( железо, медь,
цинк, серебро и все металлы, которые
окисляются в процессе электролиза),
то независимо от природы аниона
всегда идёт окисление металла анода.
17.
Сущность электролизасостоит в том, что за счёт
электрической энергии
осуществляется химическая
реакция, которая не может
протекать самопроизвольно.
18.
Закон Фарадея для электролиза:Масса вещества, выделившегося на
электроде, прямо пропорциональна
заряду
,
прошедшему
через
электролит:
Майкл Фарадей (1791 – 1867)
m kIt
m kq
m – масса вещества (кг)
I – сила тока (А)
t – время прохождения тока (с)
19.
k - электрохимический эквивалент – величинаравная отношению массы m0 иона данного вещества
к его заряду q0.
m0 N A
1
M
m0
k
q0 neNA F n
m0 и q0 – масса и заряд одного иона;
n – валентность иона
е = 1,6·10-19 Кл – элементарный заряд (заряд электрона)
NA – постоянная Авогадро
NA = 6,022·1023 моль–1
M = m0NA – молярная масса вещества;
20.
F = eNA – постоянная Фарадея величина, численно равная заряду, который необходимопропустить через электролит для выделения на электроде
одного моля одновалентного вещества.
4
F NA e 9.65 10Кл / мол ь
Тогда Закон Фарадея для электролиза принимает
вид:
m – масса вещества (кг)
М – молярная масса (кг/моль)
1 M
m I t n – валентность
F n
I – сила тока (А)
t – время прохождения тока (с)
21.
F N A e 9.65 10 Кл / моль4
При серебрении
деталей через
электролит проходит
ток силой 5 А на
протяжении 15 мин.
Какое количество
серебра было
израсходовано?
Электрохимический
эквивалент серебра
1,118 • 10-6 кг/Кл.
На деталях осаждалось
серебро в растворе
нитрата серебра. Ток
силой 10 А проходил
через электролит на
протяжении трех часов.
Валентность серебра 1,
а относительная
атомная масса — 108.
Сколько использовано
серебра?
22.
23.
1. При электролизе раствора сульфата цинка синертными электродами на аноде
выделяется:
а) цинк; б) кислород;
в) водород;
г) сера.
2. При электролизе раствора хлорида натрия
образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
24.
4. Платиновый электрод:а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
25.
6. При электролизе раствора нитрата меди(II) смедными электродами на аноде будет происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
26.
2627.
2728.
2829.
2930.
3031.
3132.
3233.
22
33
34.
3435.
3536.
3637.
3738.
3839.
3940.
4041.
КАТОДНЫЕ ПРОЦЕССЫВ гальваностегии
( никелирование,
серебрение).
В гальванопластике
(изготовление копий).
Получение чистых металлов
( медь, алюминий).
Электрометаллургия
расплавов. Очистка
металлов, полученных при
выплавке из руды, от
посторонних примесей.
АНОДНЫЕ ПРОЦЕССЫ
Промышленный способ
получения кислорода и
водорода.
Оксидирование
алюминия.
Электрополировка
поверхностей
(электроискровая
обработка,
электрозаточка).
Электрогравировка.

















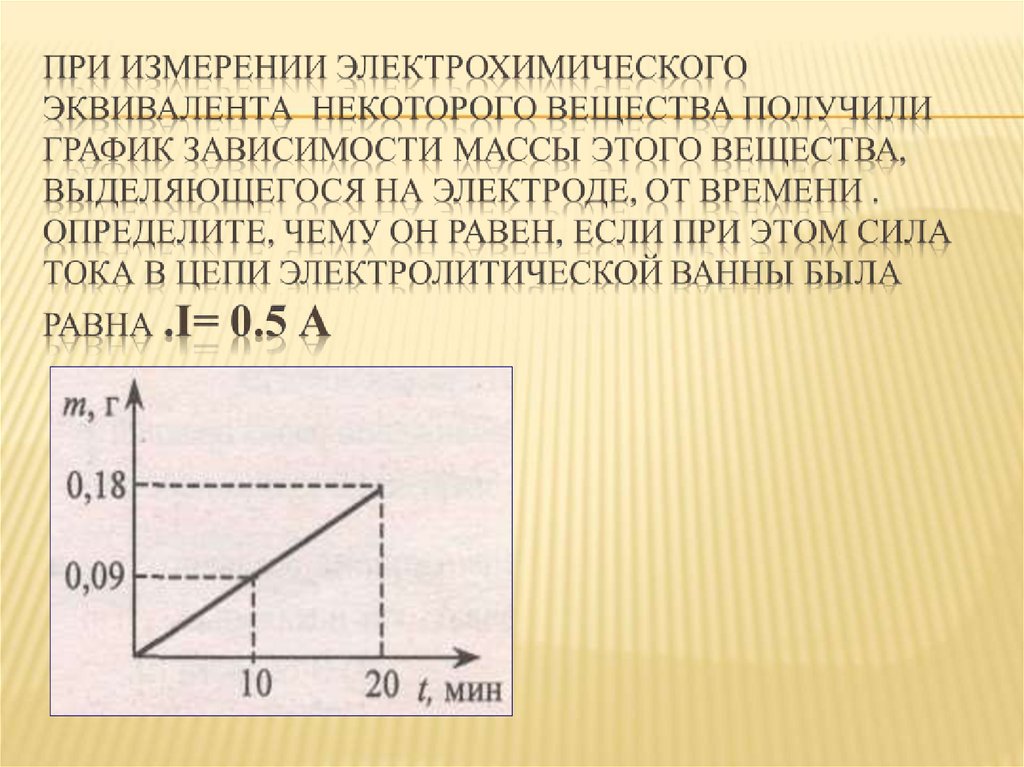























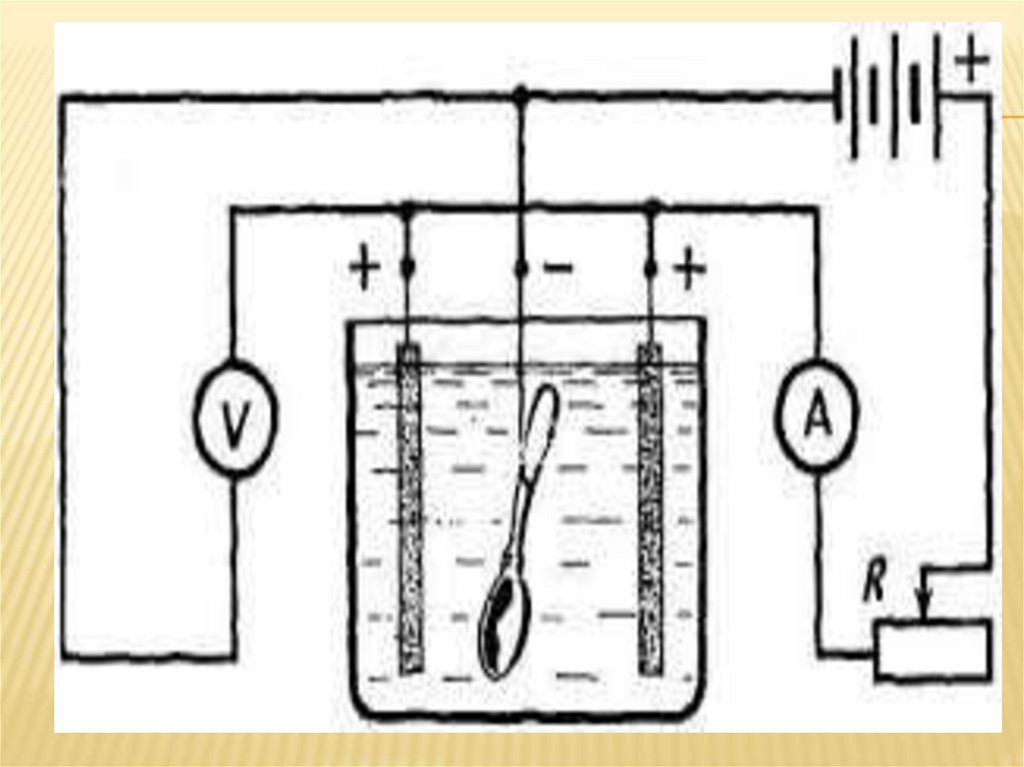







 Физика
Физика Химия
Химия








