Похожие презентации:
Фосфор – химический элемент
1. Расставьте коэффициенты методом электронного баланса
НNO3 + P + H2O H3PO4 + NO2. Светоносный элемент
Урок №83. 1. Фосфор – химический элемент
1.2.
3.
4.
Характеристика по
положению
Строение атома
Электронная
конфигурация,
энергетическая
диаграмма
Валентность, степень
окисления
А.Г.Волкова
3
4. Фосфор – химический элемент
Задание:Используя
периодическую систему
химических элементов, дайте
характеристику х.э. фосфору
Электронная конфигурация
1s2 2s2 2p6 3s2 3p3 3d0
Валентность III, V
Степени окисления -3,0,+5,+3
А.Г.Волкова
4
5. Фосфор – химический элемент
Задание: Зарисуйте схемустроения атома азота и фосфора.
Отметьте сходство и различие.
Сделайте вывод, какой Х.Э.,
фосфор или азот более
металличен и почему?
А.Г.Волкова
5
6. 2. Нахождение в природе
Л.- 0,105% по массеГ. - 0,07 мг/л
Ч. – 1%
Фосфор — один из самых распространённых элементов
земной коры. Известно около 200 фосфорных
минералов, все они представляют собой фосфаты. Из
них важнейшие – апатит Ca5(PO4)3(F,Cl,OH),
фосфорит Ca3(PO4)2, бирюза СuАL16(РО4)4(ОН)8·5Н2О
и другие.
Вопросы: В каком состоянии фосфор встречается в природе?
Где в России находятся наибольшие запасы апатитов?
Вывод: только в составе сложных веществ из-за высокой химической
активности.
А.Г.Волкова
6
7. 3. Биологическая роль фосфора
Задание: «Почему академик А.Е. Ферсманназвал фосфор «элементом жизни и
мысли»? Стр. 103
Суточная потребность человека в фосфоре
до 1,5г.
А.Г.Волкова
7
8. 4. Фосфор - простое вещество
1.2.
3.
4.
5.
Аллотропия
Физические свойства
Химические свойства
Применение
История открытия фосфора
А.Г.Волкова
8
9. Модификации фосфора
белыйкрасный
черный
Р4
(Р4)п
Рп
металлический
Вопрос: В чем причина явления аллотропии фосфора?
Вывод: разное строение кристаллической решетки
А.Г.Волкова
9
10. Схема строения модификаций фосфора
А.Г.Волкова10
11. Получение модификаций фосфор
КРАСНЫЙБЕЛЫЙ
200 °С, 2·109 Па
А.Г.Волкова
ЧЕРНЫЙ
11
12. Физические свойства
Задание: проанализируйте Таблицу№18 стр.104 и ответьте на вопрос
«Химическая активность какого
фосфора выше и почему?
Вывод: Химическая активность белого фосфора выше из-за
непрочной кристаллической решетки и молекулярного
строения
А.Г.Волкова
12
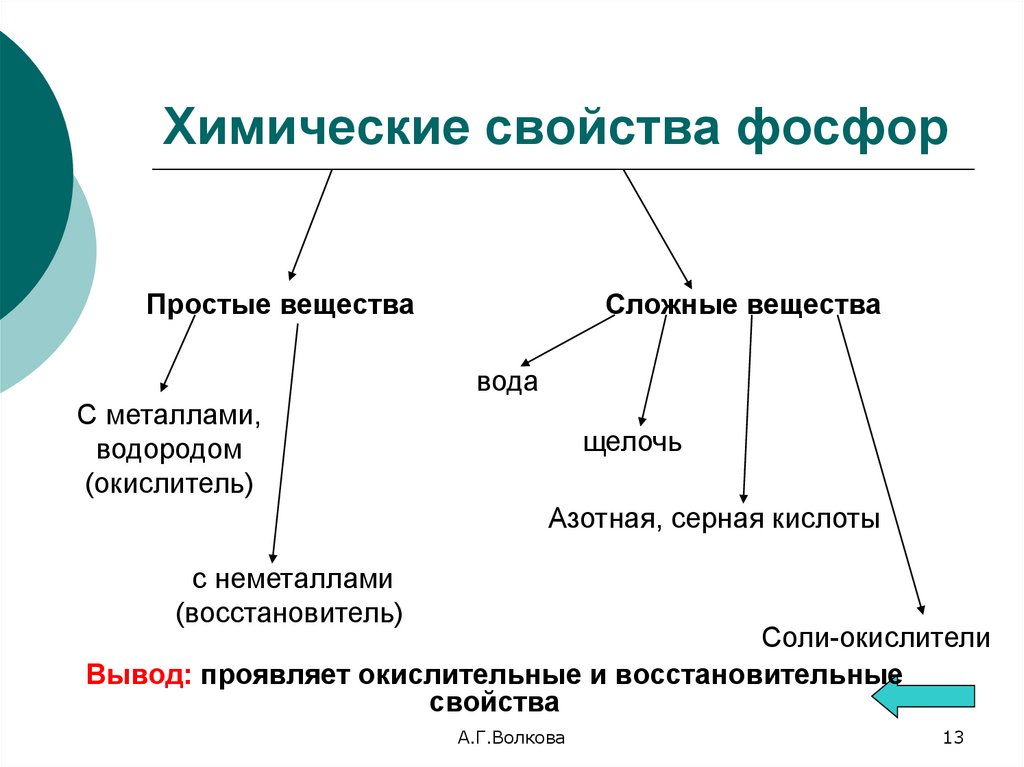
13. Химические свойства фосфор
Простые веществаСложные вещества
вода
С металлами,
водородом
(окислитель)
щелочь
Азотная, серная кислоты
с неметаллами
(восстановитель)
Соли-окислители
Вывод: проявляет окислительные и восстановительные
свойства
А.Г.Волкова
13
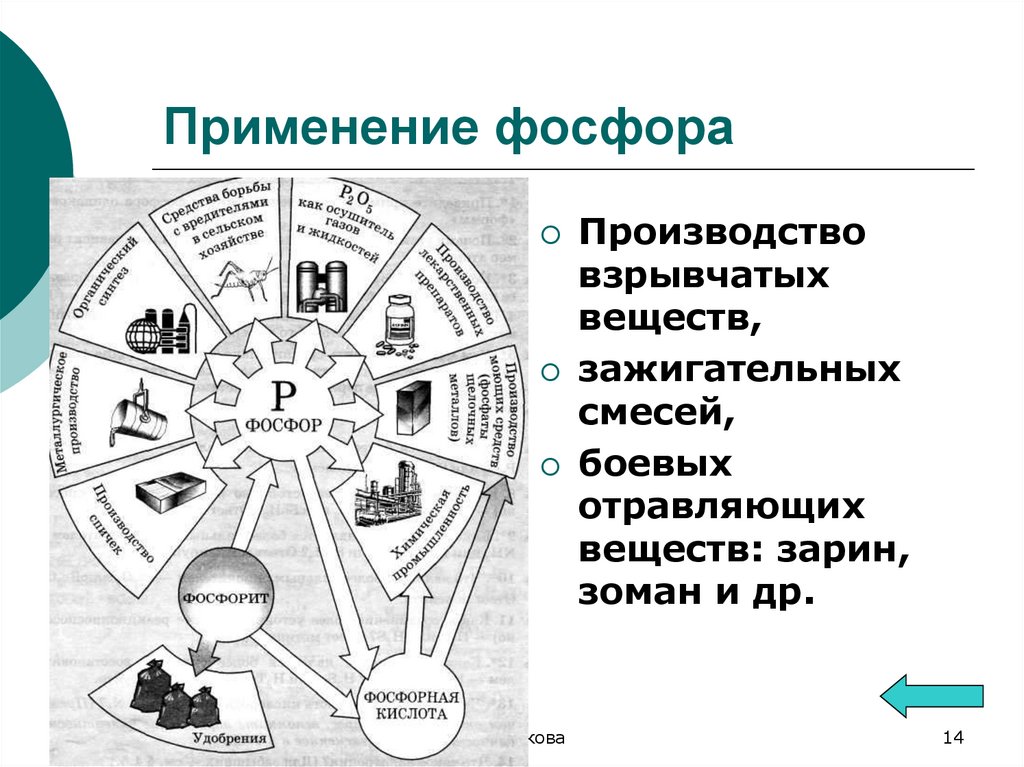
14. Применение фосфора
А.Г.ВолковаПроизводство
взрывчатых
веществ,
зажигательных
смесей,
боевых
отравляющих
веществ: зарин,
зоман и др.
14
15. История открытия фосфора
Вопрос: Кем и когда былоткрыт фосфор?
Фосфор открыт немецким
химиком Хеннигом Брандом в
1669 году и назвал «холодным
огнём».
То, что фосфор — простое
вещество, доказал Лавуазье.
В России термин «фосфор»
введён в 1746 г. М.В.
Ломоносовым.
А.Г.Волкова
15
16. Домашнее задание
П. 29 читатьСтр.105 ? 1 и 3
Какова масса фосфора в вашем
теле?
Т/з «Применение фосфора»
А.Г.Волкова
16
17. Закрепление
Почемуатом фосфора больше
атома азота, от чего это зависит?
Какие валентности проявляет
фосфор?
Фосфор может быть и
окислителем и восстановителем,
почему?
А.Г.Волкова
17















 Химия
Химия








