Похожие презентации:
Серная кислота. Физические свойства
1. Серная кислота
2. Физические свойства
1. H2SO4 – маслянистая жидкость, безцвета и запаха;
2. Температура плавления – 10, 3° С;
3. Плотность – 1, 83 г / мл. (тяжёлая);
4. При 2800С кипит, а при 10,40С –
кристаллизуется.
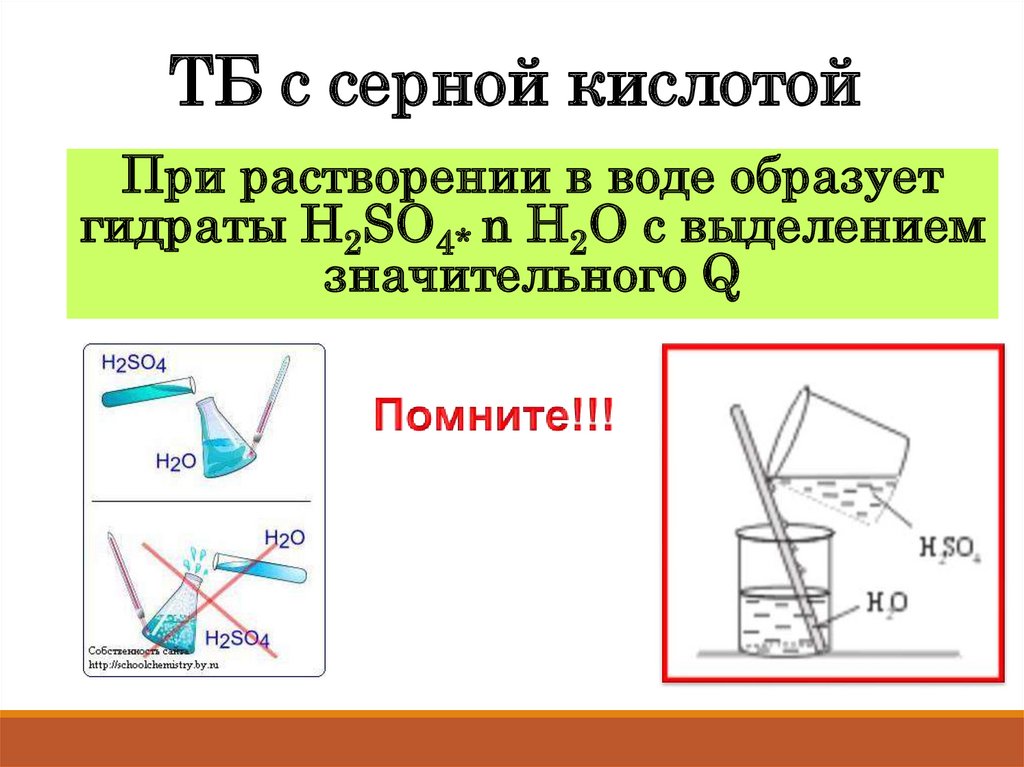
3. ТБ с серной кислотой
При растворении в воде образуетгидраты Н2SO4* n H2O с выделением
значительного Q
4. ТБ с серной кислотой
1. Жидкость маслянистая, поэтомуплохо смывается;
2. Образует на поверхности кожи
токсичные соединения;
3. Способна поглощать воду
(гигроскопичность) не только
свободную и связанную, но и
удалять её из соединений,
вызывая обугливание.
5. Строение молекулы
6. Диссоциация серной кислоты
H2SO4 = H++HSO4¯гидросульфат ион
2–
HSO4– = H++сульфат
SO4ион
H2SO4 = 2H++ SO42–
7. Химические свойства (общие с другими кислотами)
Реагирует с металлами, расположенными в рядунапряжения до водорода
Zn + H2SO4 → ZnSO4 + H2↑
0
Zn
+
+
2H
→
Zn0 -2е → Zn 2+
2H+ +2е → Н20
2+
Zn
+ H2
0↑
Восстановитель, окисляется
Окислитель, восстанавливается
8. Химические свойства (общие с другими кислотами)
Реагирует с оксидамиCuO + H2SO4→ CuSO4 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
9. Химические свойства (общие с другими кислотами)
Реагирует с основаниями2NaOH + H2SO4 → Na2SO4 + 2H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
10. Химические свойства (общие с другими кислотами)
Реагирует с солями (образуется осадок)Качественная реакция на сульфат - ион
BaCl2 + H2SO4 → BaSO4↓ + HCl
BaCl2 + Na2SO4 → BaSO4↓ + NaCl
Ba2+ + SO42- → BaSO4↓
11. Химические свойства (специфические)
Реагирует с металлами12.
САМОСТОЯТЕЛЬНО:расставьте коэффициенты методом электронного
баланса
Na + H2SO4 (конц.) → Na2SO4 + H2S +H2O
Sn + H2SO4
(конц.)
→ SnSO4 + S + H2O
Ag + H2SO4 (конц.) → Ag2SO4 + SO2 + H2O
13. Химические свойства (специфические)
Реагирует с неметалламиС + 2H2SO4 (конц.) → 2SO2 + CO2 + 2H2O
S + 2H2SO4 (конц.) → 3SO2 + 2H2O
2P + 5H2SO4 (конц.) → 2H3PO4 + 5SO2 + 2H2O
14. Химические свойства (специфические)
обугливание органических веществ конц. H2SO4С12Н22О11 + 2H2SO4 (конц.) = 11С + 2SO2 + CO2 +
13H2O
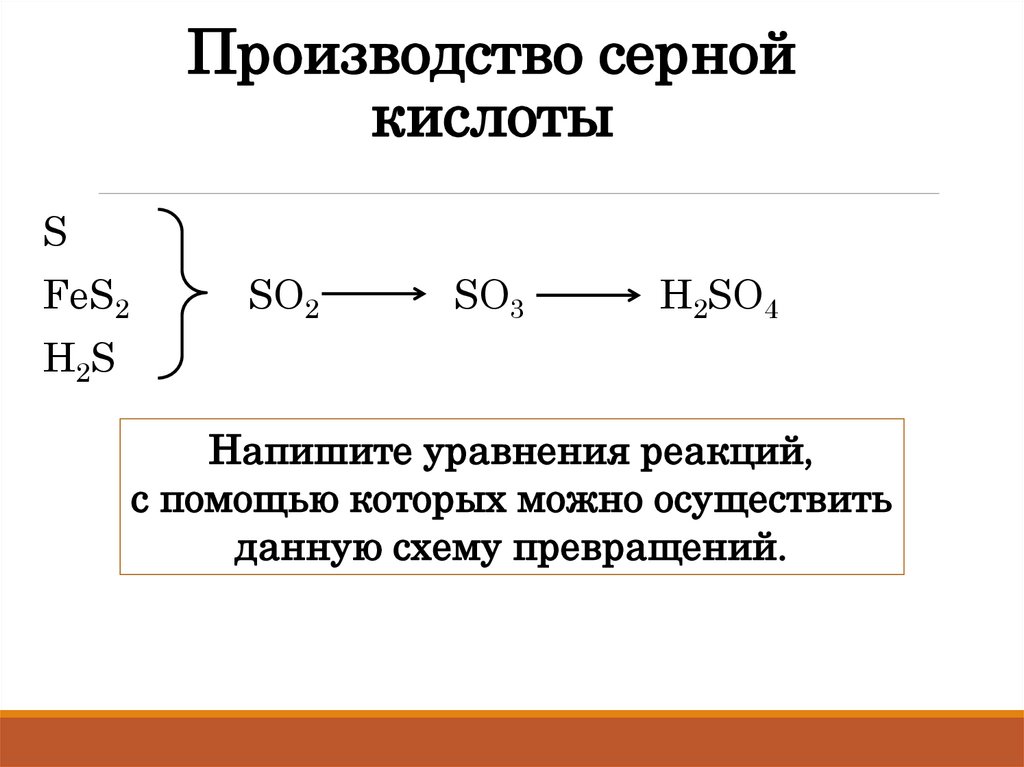
15. Производство серной кислоты
SFeS2
SO2
SO3
H2SO4
H2S
Напишите уравнения реакций,
с помощью которых можно осуществить
данную схему превращений.













 Химия
Химия








