Похожие презентации:
Серная кислота и её свойства
1. СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
2. ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
Серная кислота известна с древности.Первое упоминание о кислых газах,
получаемых при прокаливании
квасцов или железного купороса
«зеленого камня», встречается в
сочинениях, приписываемых
арабскому алхимику Джабир ибн
Хайяну.
Позже, в IX веке персидский
алхимик Ар-Рази, прокаливая смесь
железного и медного купороса
(FeSO4•7H2O и CuSO4•5H2O), также
получил раствор серной кислоты.
Этот способ усовершенствовал
европейский алхимик Альберт
Магнус, живший в XIII веке.
Абу Абдаллах Джабир ибн
Хайян ад-Азди ас-Суфи
(ок. 721 г., — ок. 815г.)
Абу Бакр Мухаммад
ибн Закария Ар-Рази
(около 865 г.— около
925 г.)
Алберт Магнус
(ок. 1193г.— 15
ноября 1280 г.)
3. ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
В XV веке алхимики обнаружили,что серную кислоту можно получить,
сжигая смесь серы и селитры, или
из пирита — серного колчедана,
более дешевого и распространенного
сырья, чем сера. Таким способом
получали серную кислоту на
протяжении 300 лет, небольшими
количествами в стеклянных ретортах.
И только в середине 18 столетия,
когда было установлено, что свинец
не растворяется в серной кислоте, от
стеклянной лабораторной посуды
перешли к большим промышленным
свинцовым камерам.
4. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ
Се́рная кислота́ H2SO4— сильная двухосновная
кислота, отвечающая
высшей степени
окисления серы (+6).
При обычных условиях
концентрированная
серная кислота —
тяжёлая маслянистая
жидкость без цвета и
запаха. Вязкая.
Нелетучая.
5. ТОКСИЧЕСКОЕ ДЕЙСТВИЕ НА ОРГАНИЗМ
Сернаякислота
и
олеум
—
чрезвычайно агрессивные вещества,
поражают дыхательные пути, кожу,
слизистые
оболочки,
вызывают
затруднение дыхания, кашель, нередко
— ларингит, трахеит, бронхит и т. д.
Поражающая
концентрация
паров
серной
кислоты
0,008
мг/л
(экспозиция 60 мин), смертельная 0,18
мг/л (60 мин).
Аэрозоль
серной
кислоты
может
образовываться
в
атмосфере
в
результате выбросов химических и
металлургических
производств,
содержащих оксиды S, и выпадать в
виде кислот.
6. Серная кислота прожигает бумагу, ткани, обугливает сахар
Действиесерной кислоты
на бумагу
Действие
серной кислоты
на ткань
Действие
серной кислоты
на сахар
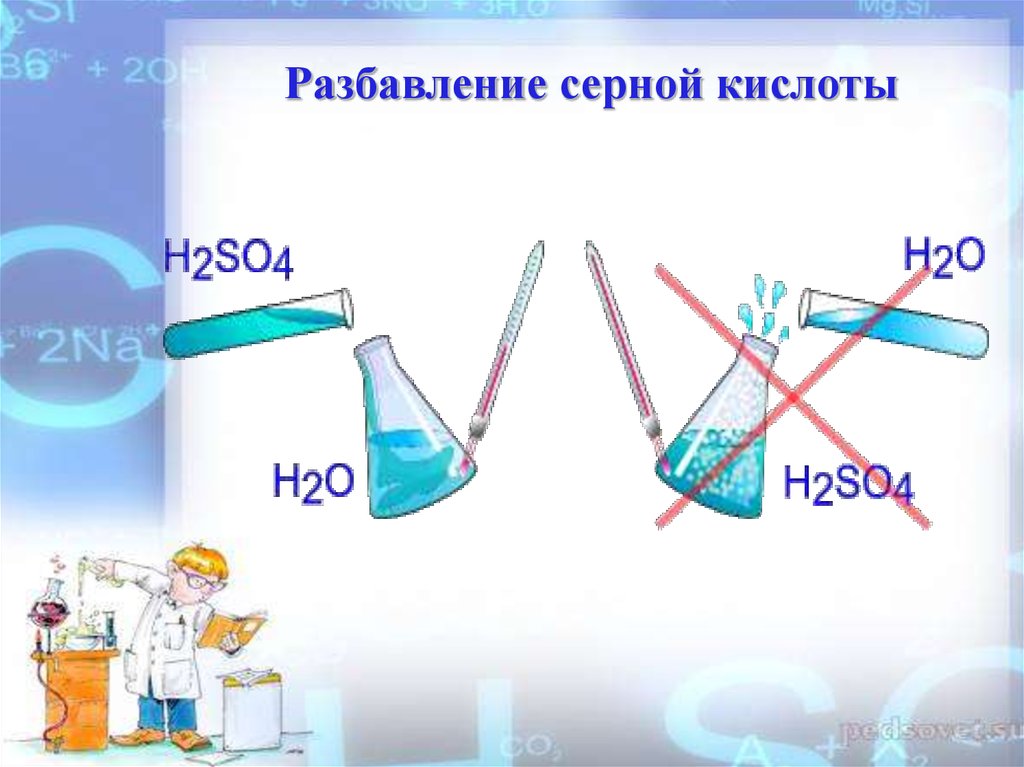
7. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРА СЕРНОЙ КИСЛОТЫ
Относительно смешивания сернойкислоты с водой с давних пор
существует строгое правило:
«Сначала вода, потом кислота,
иначе произойдет ужасное».
Если же сделать наоборот, то
первые же порции воды,
оставшись наверху (вода легче
кислоты) и взаимодействуя с
кислотой, разогреваются так
сильно, что вскипают и
разбрызгиваются вместе с
кислотой; могут попасть в глаза,
на лицо и одежду.
8.
Разбавление серной кислоты9.
Получение сернойFeS2 кислоты
SO2 → SO3 → H2SO4
S
H2S
Пирит
Серный колчедан
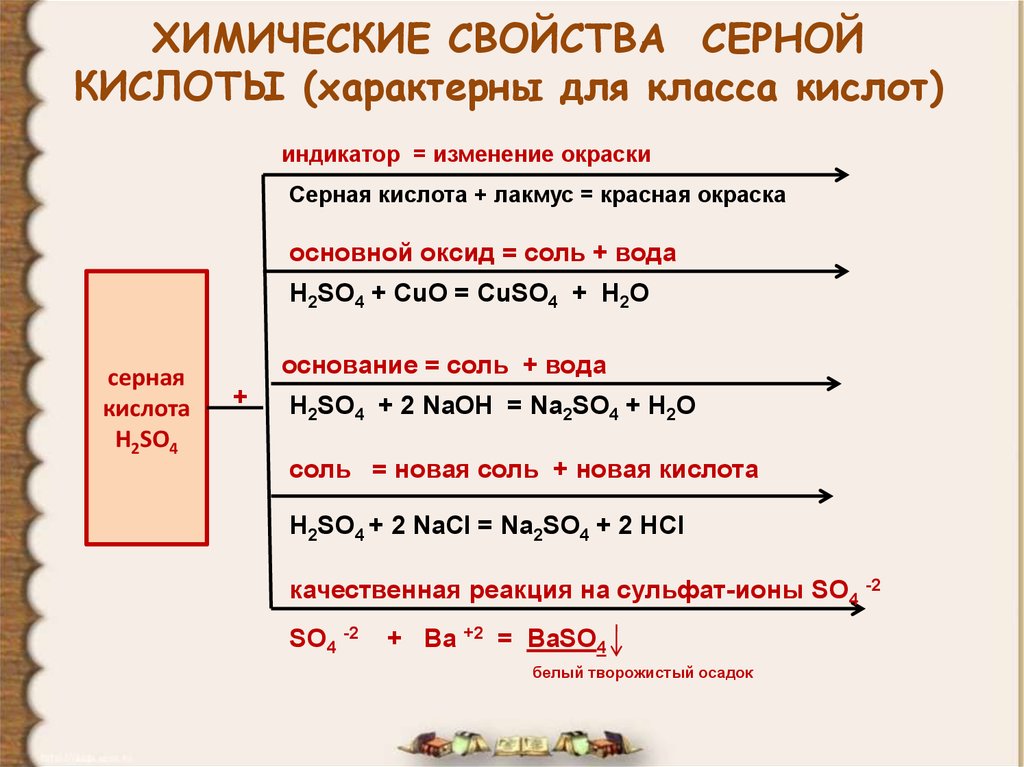
10. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ (характерны для класса кислот)
индикатор = изменение окраскиСерная кислота + лакмус = красная окраска
основной оксид = соль + вода
H2SO4 + CuO = CuSO4 + H2O
серная
кислота
H2SO4
основание = соль + вода
+
H2SO4 + 2 NaOH = Na2SO4 + H2O
соль = новая соль + новая кислота
H2SO4 + 2 NaCl = Na2SO4 + 2 HCl
качественная реакция на сульфат-ионы SO4 -2
SO4 -2
+ Ba +2 = BaSO4
белый творожистый осадок
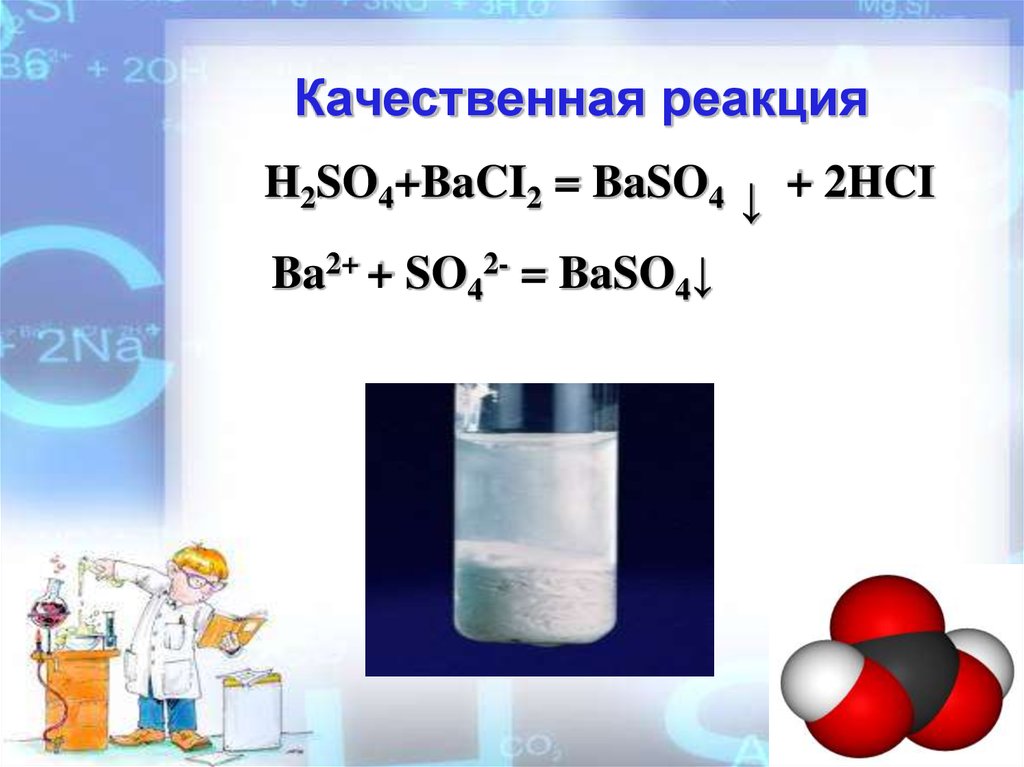
11.
Качественная реакцияH2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2+ + SO42- = BaSO4↓
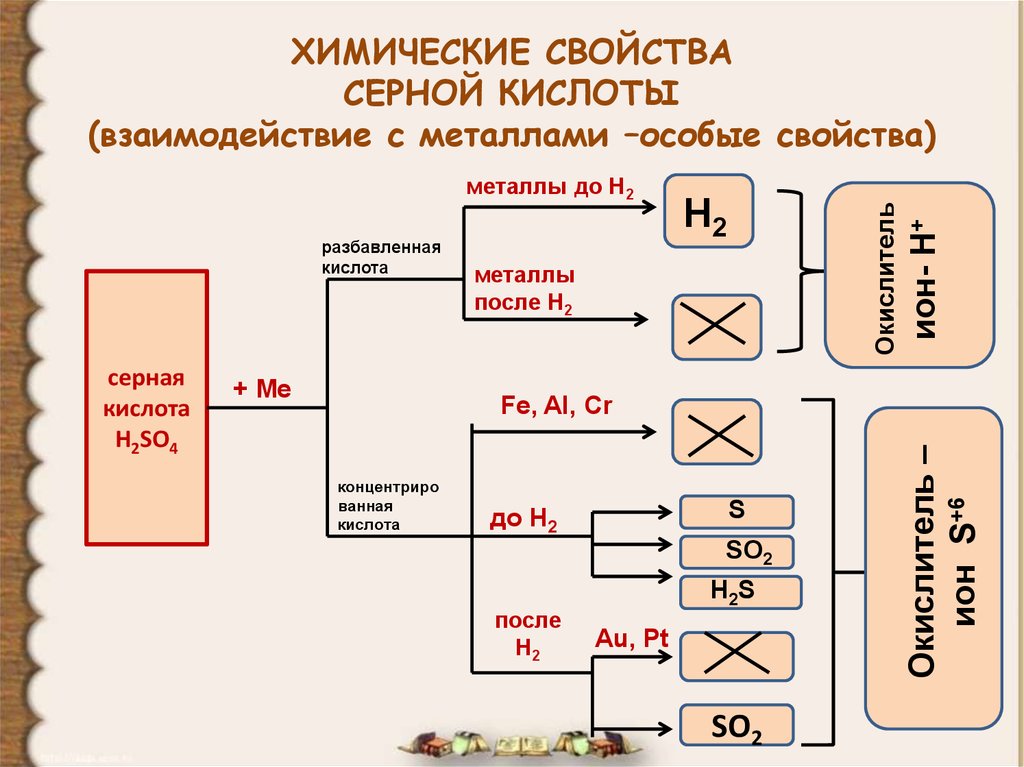
12. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ (взаимодействие с металлами –особые свойства)
разбавленнаякислота
+ Ме
металлы
после Н2
Fe, Al, Cr
концентриро
ванная
кислота
S
до Н2
SO2
после
Н2
H2S
Au, Pt
SO2
Окислитель –
ион S+6
серная
кислота
H2SO4
Н2
Окислитель
металлы до Н2
ион- Н+
ХИМИЧЕСКИЕ СВОЙСТВА
СЕРНОЙ КИСЛОТЫ
(взаимодействие с металлами –особые свойства)
13.
Свойства концентрированной сернойкислоты
C12H22O11 (сахароза)
→
12С (уголь)
Органические вещества
обугливаются !!!
14.
концентрированная серная кислотаокисляет неметаллы
неМе + H2SO4(конц.) = H2O + SO2 +
кислородсодержащая кислота неМе,
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O










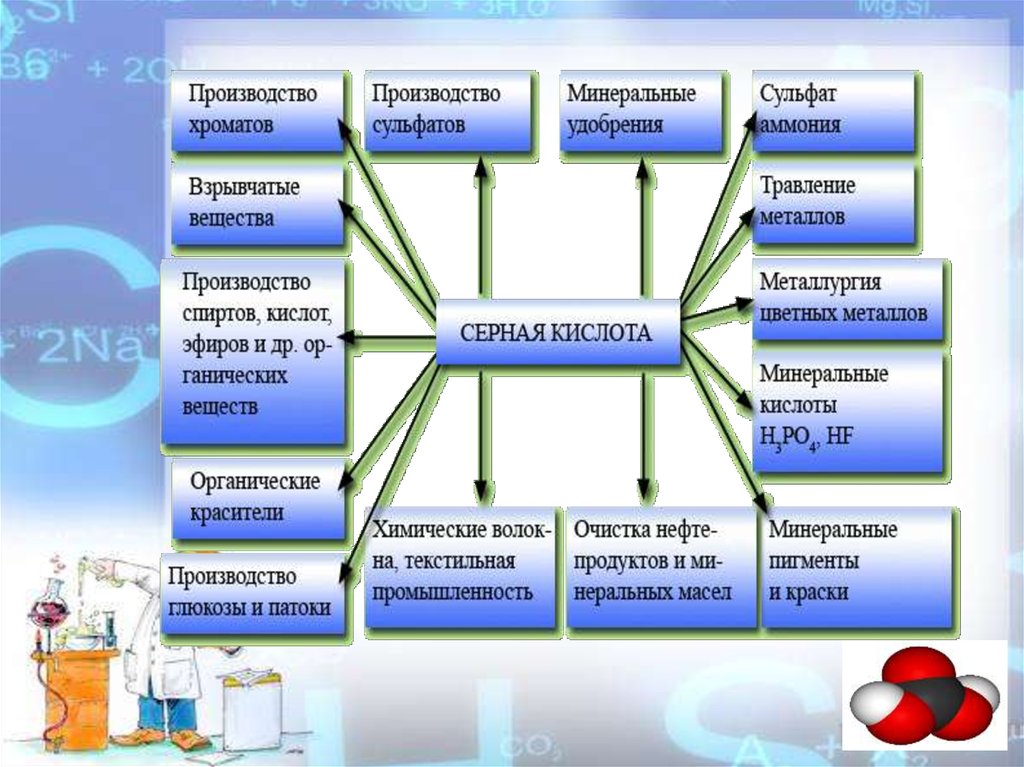
 Химия
Химия








