Похожие презентации:
Соли. Классификация. Физические и химические свойства. Получение и применение солей
1. Соли. Классификация. Физические и химические свойства. Получение и применение солей.
2. Цели урока:
1)Познакомить учащихся с понятием соли,изучить основные классификации солей;
2)Изучить основные химические свойства
солей;
3)Изучить основные способы получения солей;
4)Продолжить формирование умений составлять
уравнения химических реакций;
3. Что такое соли?
Соли–это сложные вещества, образованныеатомами металлов и кислотными остатками
4. Номенклатура солей
НазваниеКислотного
Название
+ металла (в Р.п.) + валентности
остатка
Указание
NaCl
хлорид натрия
CaCO3
карбонат кальция
Са3(РО4)2 фосфат кальция
МgCI2
хлорид магния
(если она переменная)
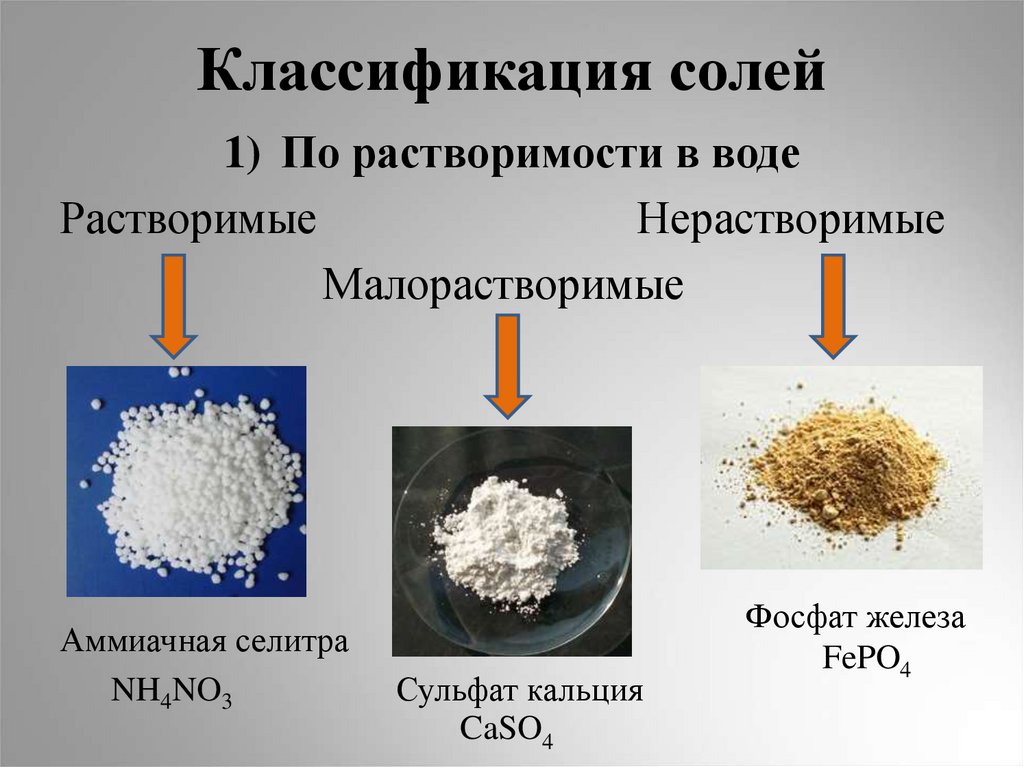
5. Классификация солей
1) По растворимости в водеРастворимые
Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3
Сульфат кальция
CaSO4
Фосфат железа
FePO4
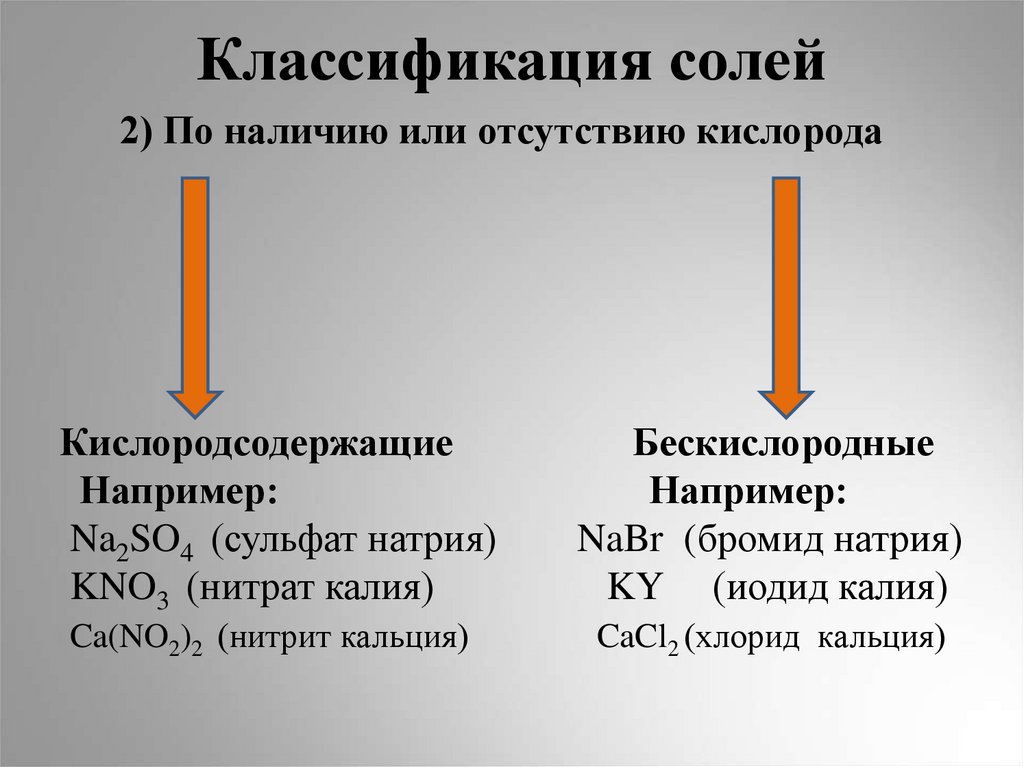
6. Классификация солей
2) По наличию или отсутствию кислородаКислородсодержащие
Например:
Na2SO4 (сульфат натрия)
KNO3 (нитрат калия)
Бескислородные
Например:
NaBr (бромид натрия)
KY (иодид калия)
Ca(NO2)2 (нитрит кальция)
CaCl2 (хлорид кальция)
7. Классификация солей
СолиСредние
(нормальные)
Кислые
Основные
8. Разновидности солей
Соли бывают:1) Средние соли – это продукты полного
замещения атомов водорода в кислоте на
металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
9. Разновидности солей
2) Кислые соли – это продукты неполногозамещения атомов водорода в кислоте на
металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
10. Разновидности солей
3) Основные соли – это продуктынеполного замещения гидроксогрупп в
основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
11. Физические свойства:
Все соли твердые кристаллические вещества.Соли имеют различную окраску, и разную
растворимость в воде.
12. Химические свойства
1) Соль + кислота = другая соль + другая кислотаНапример: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
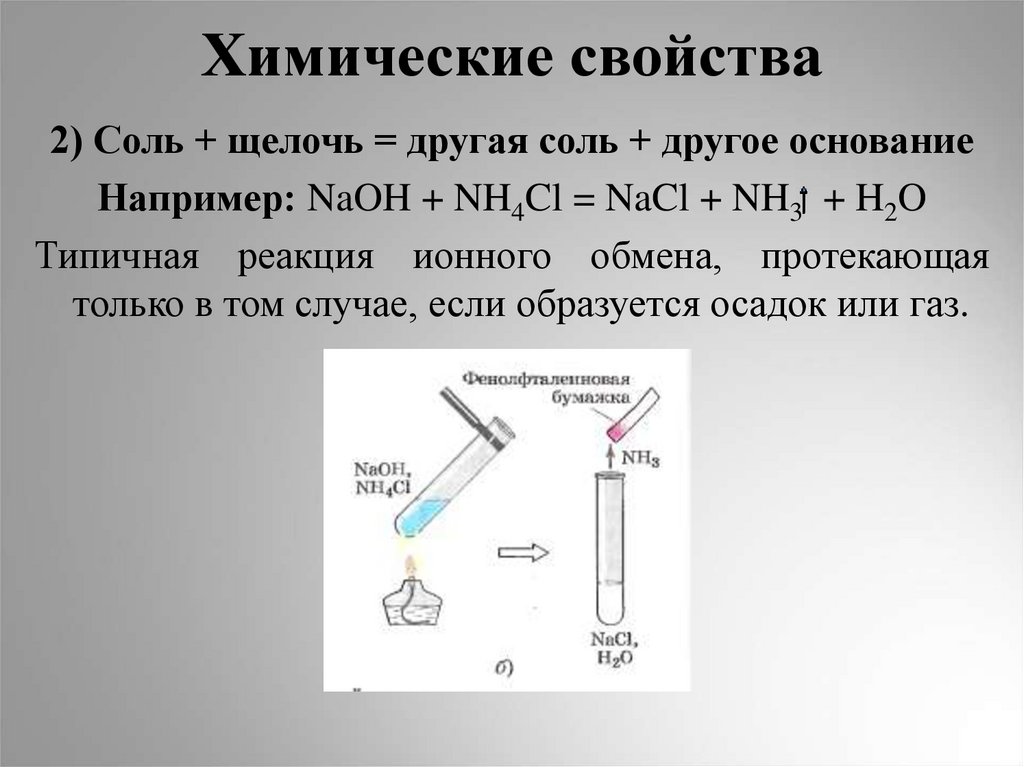
13. Химические свойства
2) Соль + щелочь = другая соль + другое основаниеНапример: NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
14. Химические свойства
3) Соль1 + соль2 = соль3 + соль4Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок.
15. Химические свойства
4) Соль + металл = другая соль + другой металлНапример: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из
растворов
солей
все
другие
металлы,
расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в
результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой,
поэтому металлы главных подгрупп I и II группы
ПС Д.И.Менделеева не вытесняют другие
металлы из растворов солей.
16. Получение солей:
1. Взаимодействие кислоты с Ме:Zn + 2HCI → ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным
оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
17. Применение солей
- в стирке, с помощью порошка, с состав котороговходит стиральная (кальцинированная) сода –
Na2CO3;
- удобрения, которые мы вносим в почву –
NH4NO3- аммиачная селитра; CaHPO4- простой
суперфосфат и другие.
- в домашней аптечке – ляпис AgNO3
- СuSO4- медный купорос, который добавляют в
побелку, применяют против болезней и вредителей
растений.
да и сам наш организм содержит соли, в костях –
Ca3(PO4)2
18. Мрамор, известняк, мел
19.
ИЗДЕЛИЯ ИЗМАЛАХИТА















 Химия
Химия








