Похожие презентации:
Соли. Классификация. Физические и химические свойства. Получение и применение солей
1.
Задание 1. Запишите формулы веществ по их названию• Оксид магния –
Оксид серы (IV) -
• Гидроксид алюминия • Соляная кислота • Гидроксид калия • Серная кислота –
Задание 2. Напишите название веществ и к какому классу
соединений относится вещество
P2O5, NaСl, CuOН, Са3(РО4)2, HNO3, Ba(OH)2, MgO, H2SO4, KOН,
SO3, CaCO3
2.
Соли. Классификация.Физические и химические
свойства. Получение и
применение солей.
3.
Соли–это сложные вещества,образованные атомами металлов и
кислотными остатками
KCI
Кислотный
Ме остаток
CaCl2
Ме
Кислотный
остаток
BaCO3
Ме Кислотный
остаток
4.
Номенклатура солейНазвание
Название
Указание
Кислотного + металла (в Р.п.) + валентности
остатка
• NaCl
хлорид натрия
• CaCO3
карбонат кальция
• Са3(РО4)2 фосфат кальция
• МgCI2
хлорид магния
(если она переменная)
5.
Классификация солей1) По растворимости в воде
Растворимые
Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3
Сульфат кальция
CaSO4
Фосфат железа
FePO4
6.
Классификация солей2) По наличию или отсутствию кислорода
Кислородсодержащие
Например:
Na2SO4 (сульфат натрия)
KNO3 (нитрат калия)
Бескислородные
Например:
NaBr (бромид натрия)
KY (иодид калия)
Ca(NO2)2 (нитрит кальция)
CaCl2 (хлорид кальция)
7.
8.
Разновидности солейСоли бывают:
1) Средние соли – это продукты полного
замещения атомов водорода в кислоте на
металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
9.
Разновидности солей2) Кислые соли – это продукты неполного
замещения атомов водорода в кислоте на
металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
10.
Разновидности солей3) Основные соли – это продукты
неполного замещения гидроксогрупп в
основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
11.
Химические свойства1) Соль + кислота = другая соль + другая кислота
H2SO4 + BaCl2 = BaSO4 +2HCl
12.
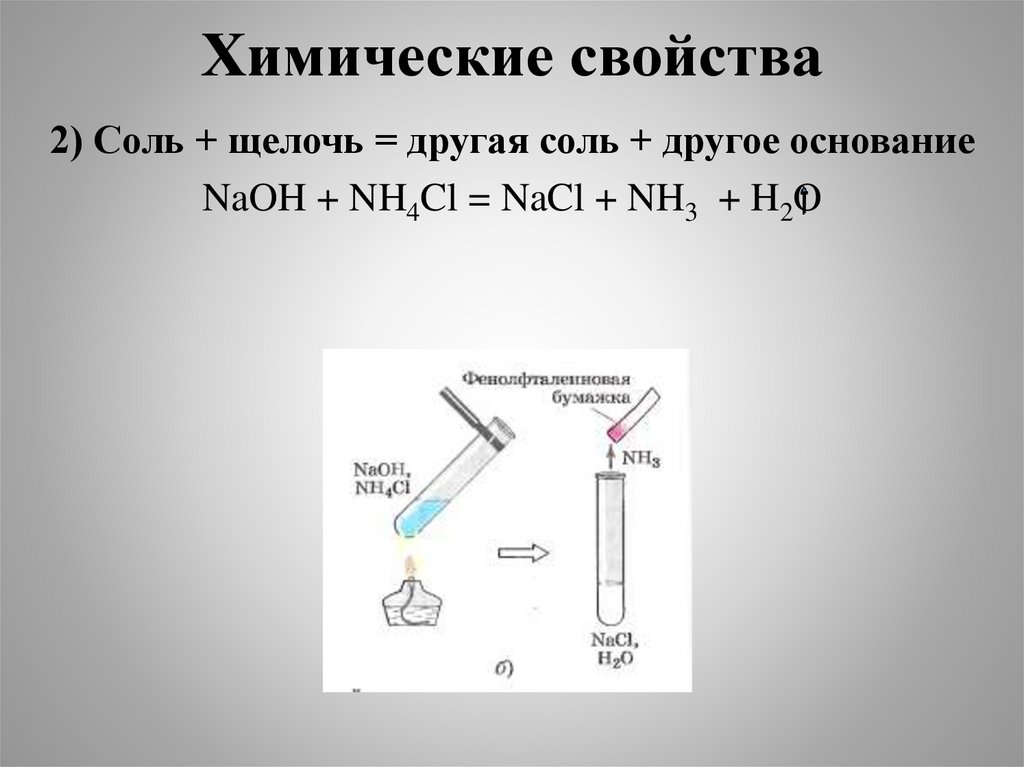
Химические свойства2) Соль + щелочь = другая соль + другое основание
NaOH + NH4Cl = NaCl + NH3 + H2O
13.
Химические свойства3) Соль1 + соль2 = соль3 + соль4
Na2SO4 + BaCl2 = BaSO4 +2NaCl
4) Соль + металл = другая соль + другой металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
14.
Получение солей:1. Взаимодействие кислоты с Ме:
Zn + 2HCI → ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным
оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
15.
Домашнее задание .1. Описать физические свойства и применение
следующих солей:
Кальцинированная сода – Na2CO3;
Аммиачная селитра NH4NO3;
Простой суперфосфат CaHPO4;
Ляпис AgNO3
Медный купорос- СuSO4;
Фосфат калия - Ca3(PO4)2
2. Напишите формулы мела, известняка и малахита.
Назовите изделия где используют данные вещества














 Химия
Химия








