Похожие презентации:
Электрохимия: электролиз и его применение
1. ЭЛЕКТРОХИМИЯ: Электролиз и его применение
2.
Среди научных идей, оказавшихогромное влияние на развитие
человеческого
общества,
на
прогресс техники, экономики и
культуры, на весь облик нашей
цивилизации,
немаловажное
место занимает идея взаимосвязи
электрических и
химических
явлений.
3.
Высказанная болеедвухсот лет назад М.В.
Ломоносовым и воплотившись в открытиях
Л.Гальвани и А.Вольты, она привела к созданию
химического источника тока – вольтова столба,
появление которого стимулировало изучение
природы электричества и его действия на
различные вещества.
М.В.
Ломоносов
(1711-1765 г.г.)
Луиджи
Гальвани
(1737—1798 г.г.)
Вольтов
столб
Алессандро
Вольта
(1745-1827 г.г.)
4.
С 1832 г. М. Фарадей все больше и большезадумывался
над
действием
электрического тока. С 1832 по 1855 г.г. он
опубликовал
30
серий
своих
«Экспериментальных исследований по
электричеству», изложенных в форме
кратких параграфов.
Общее число
параграфов достигло 3420.
Именно
М.
Фарадею
принадлежит
первенство в формулировании основных
понятий электрохимии.
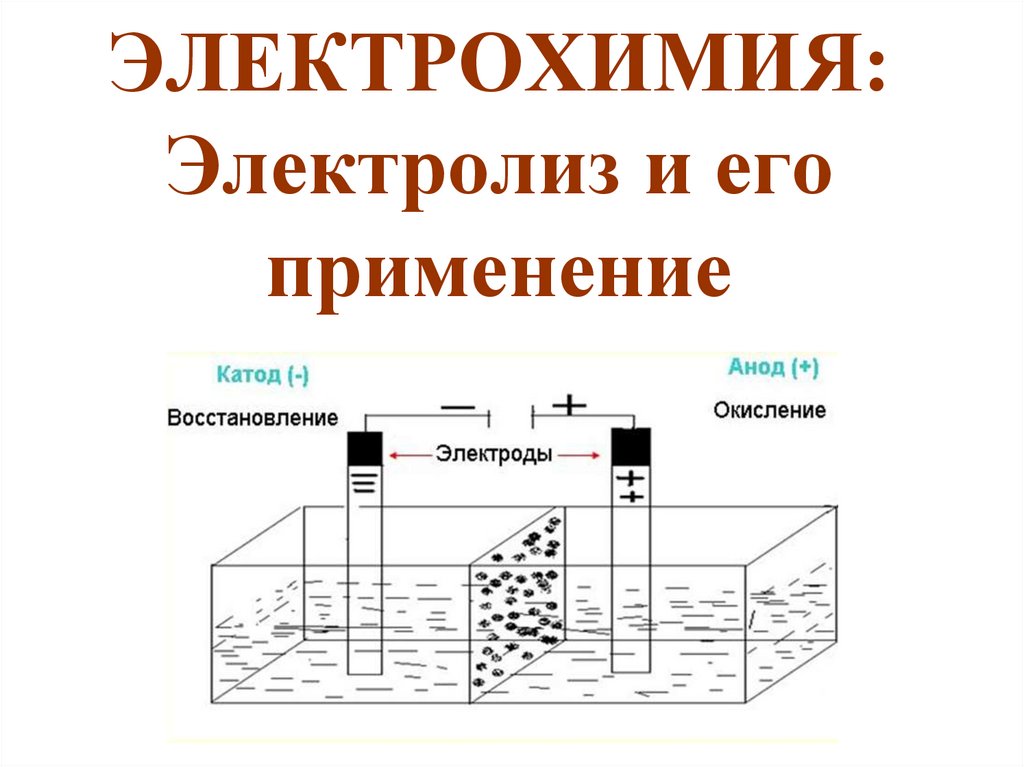
5. ОСНОВНЫЕ ПОНЯТИЯ ЭЛЕКТРОХИМИИ
Ионы – заряженные частицы.Электроды — проводники, соединённые с полюсами источника
электрической энергии.
Анодом при электролизе называется положительный
электрод (на нем происходит процесс восстановления),
катодом — отрицательный (на нем происходит процесс
окисления).
Положительные ионы — катионы —
(ионы металлов, ионы водорода, ионы
аммония и др.) — движутся к катоду,
отрицательные ионы — анионы — (ионы
кислотных остатков и гидроксид-ионы) —
движутся к аноду.
6.
Электролизокислительновосстановительный процесс, протекающий на
электродах
при
прохождении
постоянного
электрического тока через расплав или раствор
электролита.
Электролиты – это вещества
растворы и расплавы
которых проводят
электрический ток.
Электролиты: соли,
кислоты, щелочи.
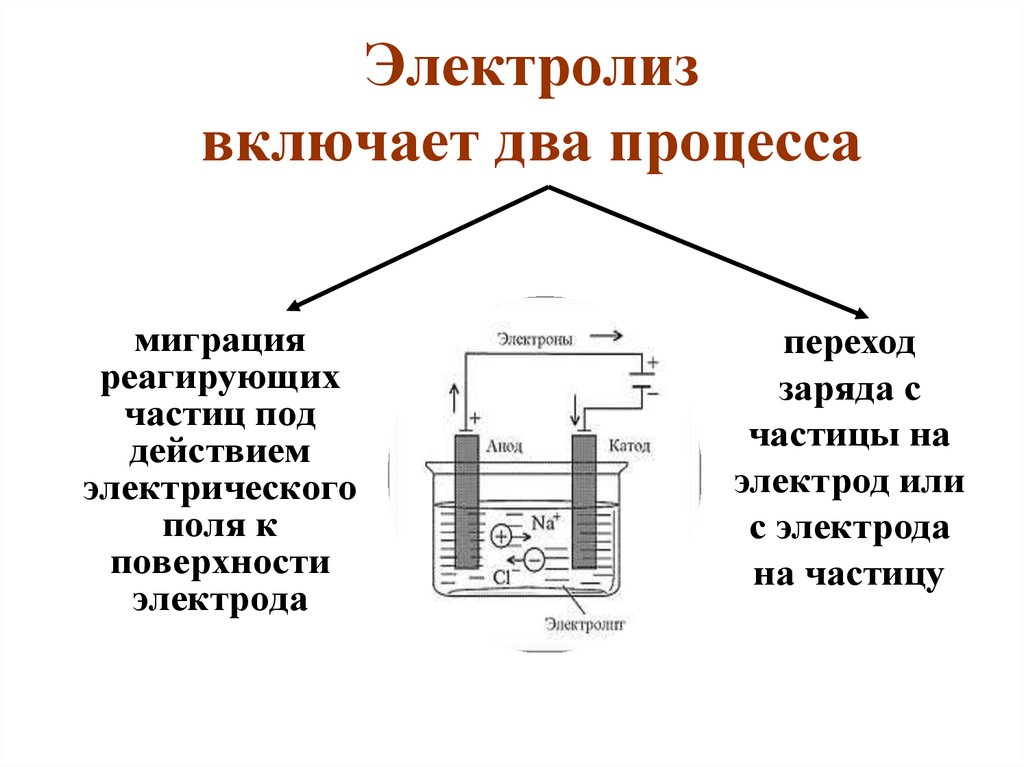
7. Электролиз включает два процесса
миграцияреагирующих
частиц под
действием
электрического
поля к
поверхности
электрода
переход
заряда с
частицы на
электрод или
с электрода
на частицу
8. Электроды
Электрический ток подводится с помощьюэлектродов.
Различают электроды:
инертные электроды не вступают в химические
реакции, находясь в контакте с электролитами и
при пропускании электрического тока (графит,
платина, уголь);
неинертные электроды вступают в химическую
реакцию окисления
на аноде при пропускании электрического тока (алюминий, медь и
др. металлы).
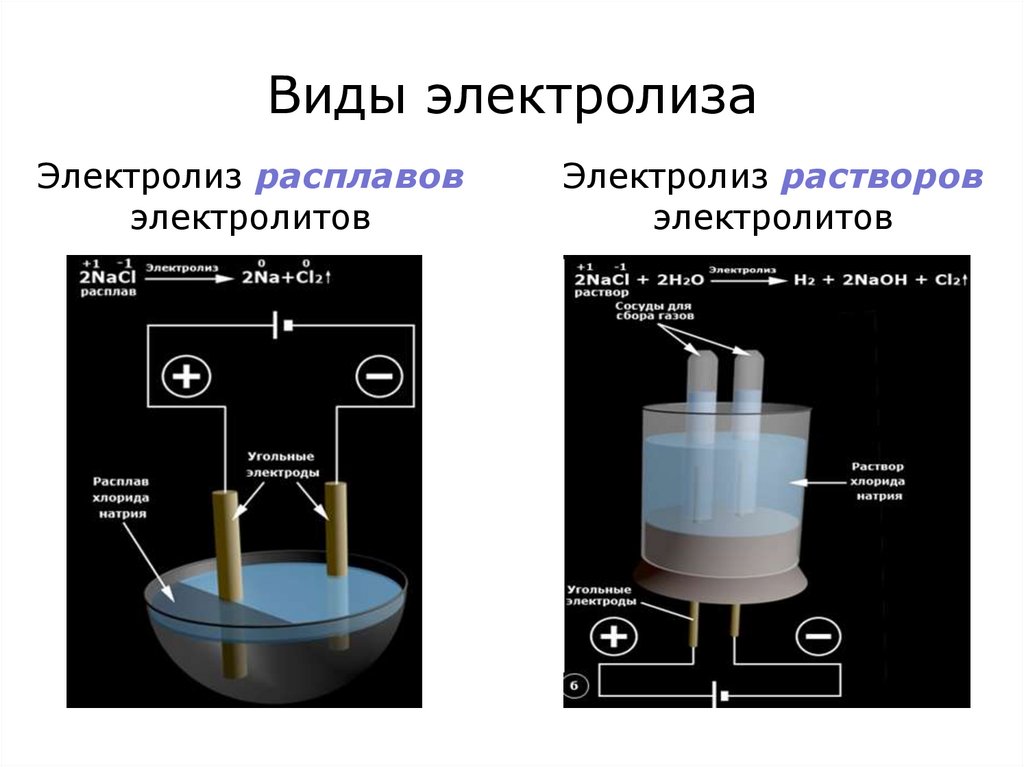
9. Виды электролиза
Электролиз расплавовэлектролитов
Электролиз растворов
электролитов
10. Электролиз расплавов с инертными электродами
В процессе электролиза расплавов на электродахпроисходят электрохимические реакции с участием только
ионов расплава.
На катоде восстанавливаются
катионы металлов: Меn+ + nе-→ Ме0
На аноде:
анионы бескислородных кислот (кроме F-) окисляются до
соответствующего простого вещества: 2Cl- - 2e- ⟶ Cl20↑
кислородсодержащие анионы выделяют кислород
превращаются в один из оксидов:
SO42- - 2e- ⟶ SO2↑ + O2↑
и
11. Алгоритм составления уравнения электролиза расплава
Помнить: в процессах на электродах участвуюттолько ионы электролита.
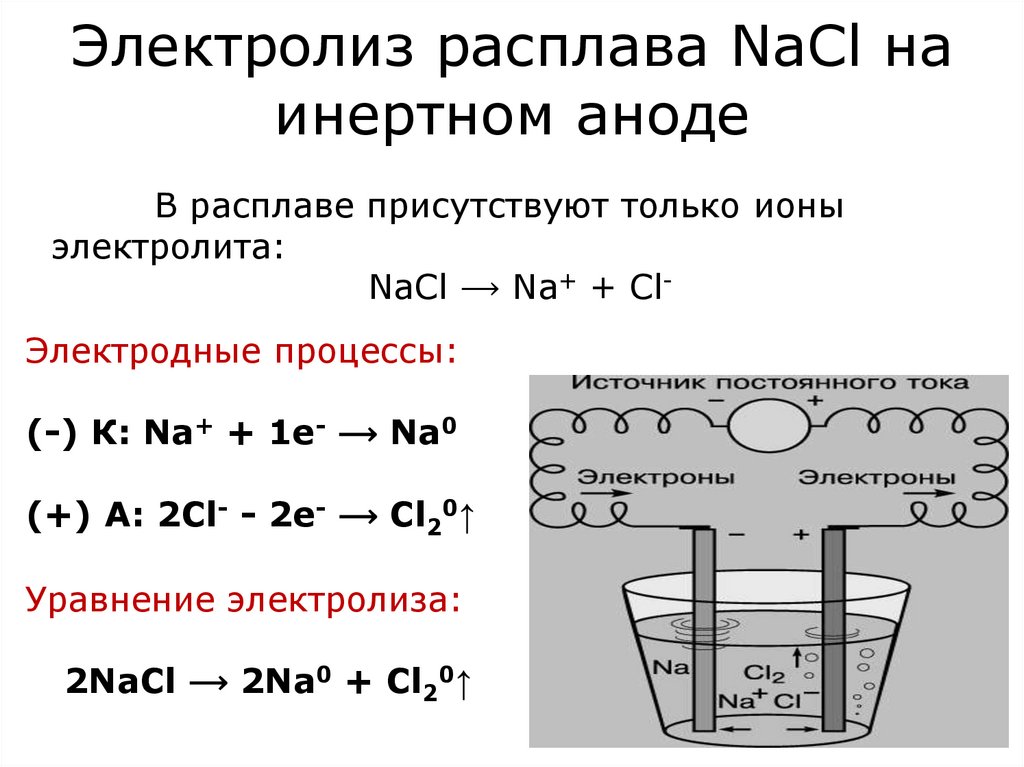
12. Электролиз расплава NaCl на инертном аноде
В расплаве присутствуют только ионыэлектролита:
NaCl ⟶ Na+ + ClЭлектродные процессы:
(-) К: Na+ + 1е- ⟶ Na0
(+) А: 2Cl- - 2e- ⟶ Cl20↑
Уравнение электролиза:
2NaCl ⟶ 2Na0 + Cl20↑
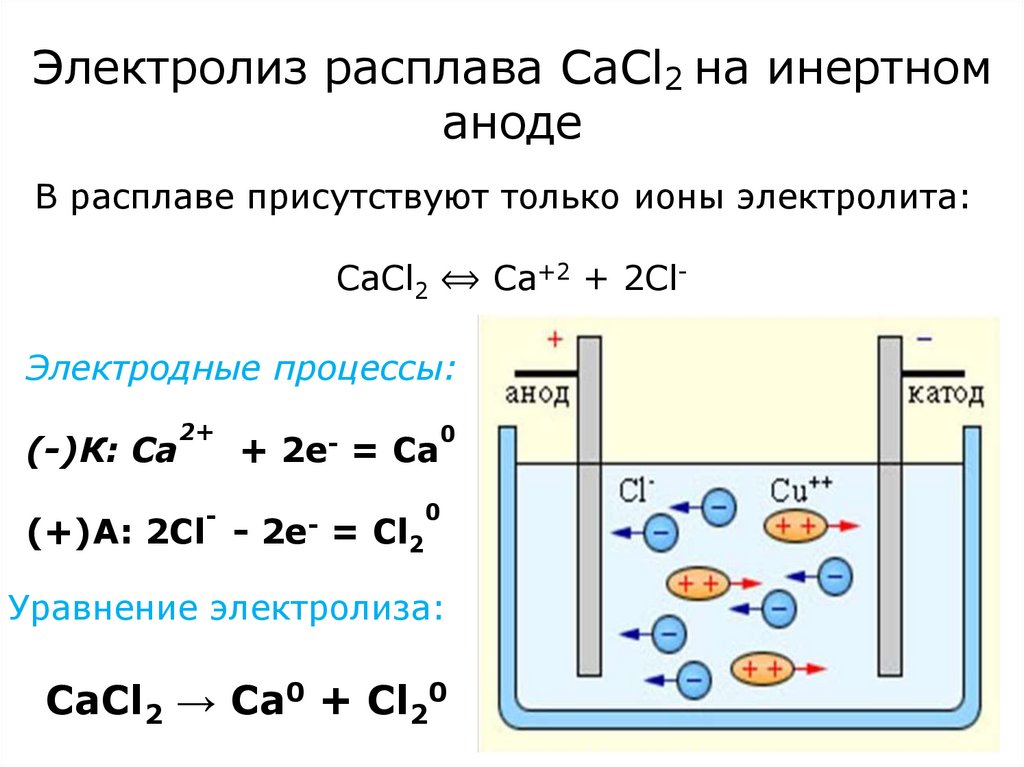
13. Электролиз расплава СаСl2 на инертном аноде
В расплаве присутствуют только ионы электролита:CaCl2 ⟺ Ca+2 + 2ClЭлектродные процессы:
(-)К: Ca
2+
-
+
(+)A: 2Сl -
2e-
2e-
= Ca
= Cl2
0
0
Уравнение электролиза:
CaCl2 → Ca0 + Cl20
14. Электролиз расплава КОН на инертном аноде
Электролизом расплавов получаютщелочные и щелочноземельные металлы.
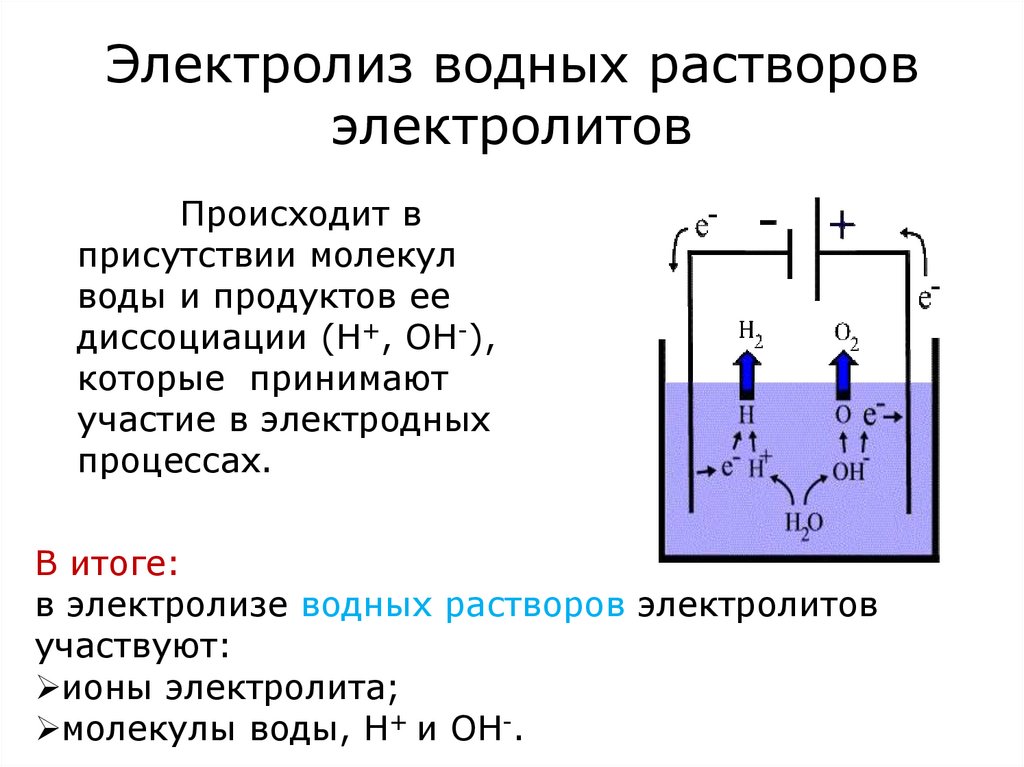
15. Электролиз водных растворов электролитов
Происходит вприсутствии молекул
воды и продуктов ее
диссоциации (Н+, ОН-),
которые принимают
участие в электродных
процессах.
В итоге:
в электролизе водных растворов электролитов
участвуют:
ионы электролита;
молекулы воды, Н+ и ОН-.
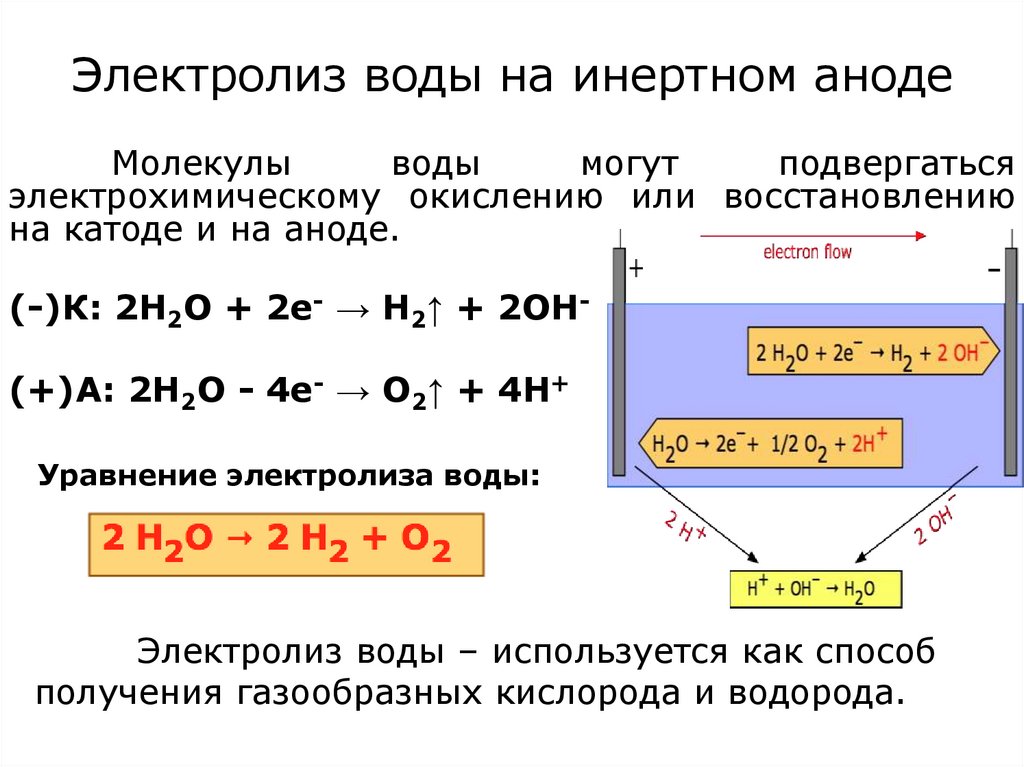
16. Электролиз воды на инертном аноде
Молекулыводы
могут
подвергаться
электрохимическому окислению или восстановлению
на катоде и на аноде.
(-)К: 2Н2О + 2е- → Н2↑ + 2ОН(+)А: 2Н2О - 4е- → О2↑ + 4Н+
Уравнение электролиза воды:
Электролиз воды – используется как способ
получения газообразных кислорода и водорода.
17. Последовательность разрядки ионов
Электролиз водных растворов сопровождаетсяизбирательным разрядом ионов при этом имеет
место
определенная
последовательность
разрядки ионов на электродах.
Последовательность разрядки ионов будет
зависеть от относительных значений электродных
потенциалов.
На катоде первым будет восстанавливаться
наиболее
сильный
окислитель
(имеющий
наибольшее значение φ).
На аноде первым окисляется наиболее
сильный восстановитель (имеющий наименьшее
значение электродного потенциала φ).
18. Правила электролиза. Процессы на катоде.
1. Катионы активных металлов (от Li до Al включительно) икатион аммония (NH4+) на катоде не восстанавливаются,
вместо них восстанавливаются молекулы воды по уравнению:
(-)К: 2Н2О + 2е- → Н2↑ + 2ОН2. Катионы металлов средней активности (от Al до водорода)
восстанавливаются на катоде совместно с молекулами воды:
(-)К: Меn+ + nе-→ Ме0
2Н2О + 2е- → Н2↑ + 2ОН3. Катионы малоактивных металлов (после водорода)
восстанавливаются на катоде:
(-)К: Меn+ + nе-→ Ме0
4. Ионы водорода восстанавливаются только из растворов кислот:
(-)К: 2Н+ + 2е- → Н2↑
19. Правила электролиза. Процессы на аноде.
1. Анионы бескислородных кислот (окисляются на аноде до простых веществ:
(+)А:
)
2. Анионы кислородсодержащих кислот (
и др.), не окиляются на аноде, вместо них окисляются
молекулы воды по уравнению:
(+)А: 2Н2О - 4е- → О2↑ + 4Н+
и
3. Фторид ионы (F-) не окисляются на аноде, вместо них
окисляются молекулы воды:
(+)А: 2Н2О - 4е- → О2↑ + 4Н+
4. Анионы ОН- окисляются на аноде только при электролизе
растворов щелочей:
(+)А:
20. Алгоритм составления уравнений электролиза водных растворов
Помнить: правила электролиза на катодеи аноде.
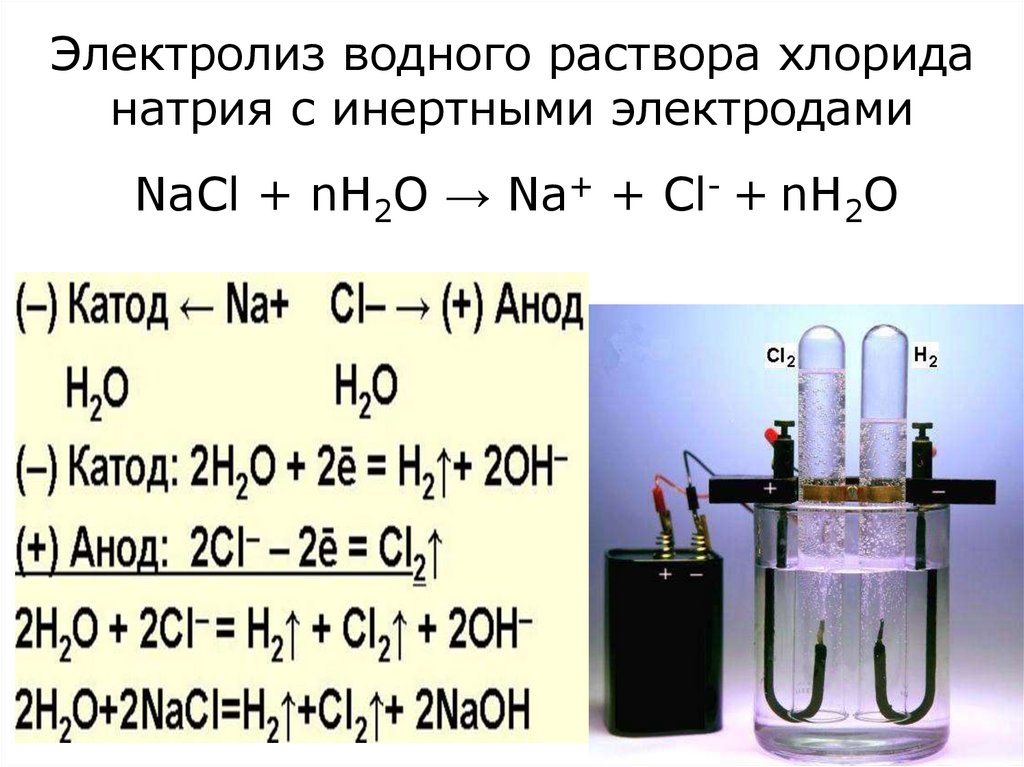
21. Электролиз водного раствора хлорида натрия с инертными электродами
NaCl + nH2O → Na+ + Cl- + nH2O22. Электролиз водного раствора хлорида цинка с инертным анодом
Диссоциация соли:ZnCl2 + nH2O → Zn2+ + 2Cl- + nH2O
Электродные процессы:
(-) К: Zn2+ + 2е- ⟶ Zn0
2Н2О + 2е- → Н2↑ + 2ОН-
(+) А: 2Cl- - 2e- ⟶ Cl20↑
Уравнение электролиза:
2ZnCl2 + 2H2O → Zn0 + 2Cl20 + Н2↑ + Zn(OH)2↓
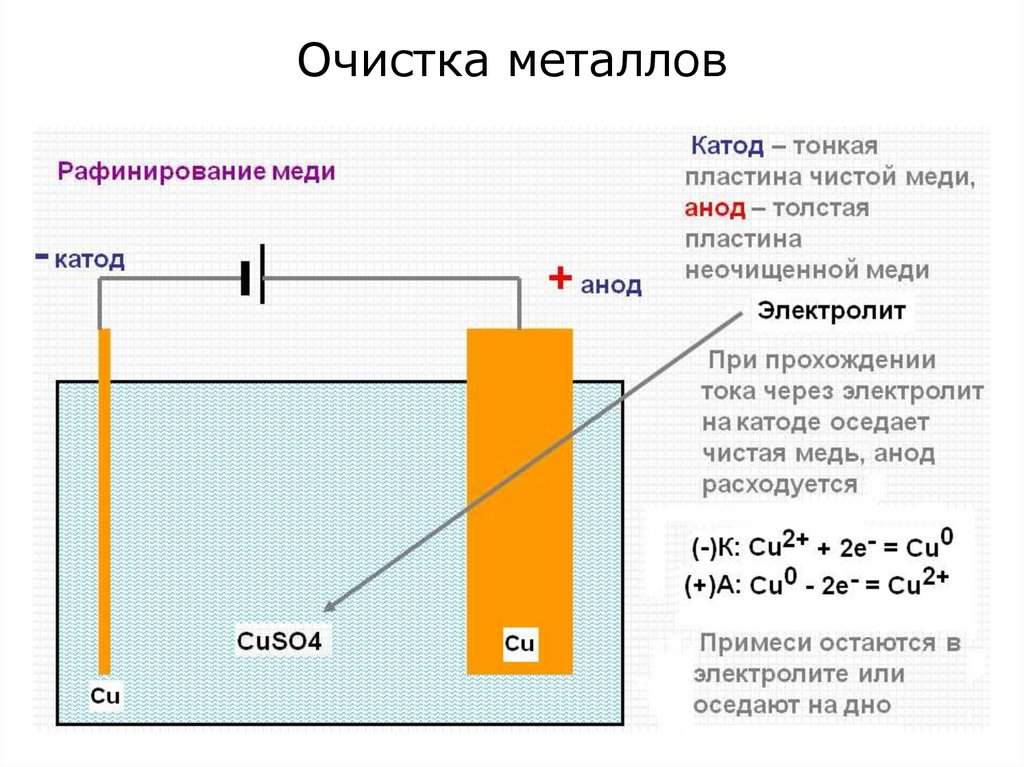
23. Участие неинертных электрордов в электродных процессах.
Если электроды неинертны (т.е. изготовлены изметаллов), то анионы из раствора не окисляются,
а окисляется сам анод:
(+)А:
В итоге:
Анод растворяется.
Применение: Для получения химически чистых
металлов.
24. Очистка металлов
25. Электролиз водного раствора нитрата серебра с неинертным (растворимым) анодом
Диссоциация соли:AgNO3 + nH2O → Ag+ + NO3- + nH2O
Электродные процессы:
В итоге:
26.
Применение электролиза1) Основная химическая
промышленность:
• получение щелочей;
• получение галогенов;
• получение водорода.
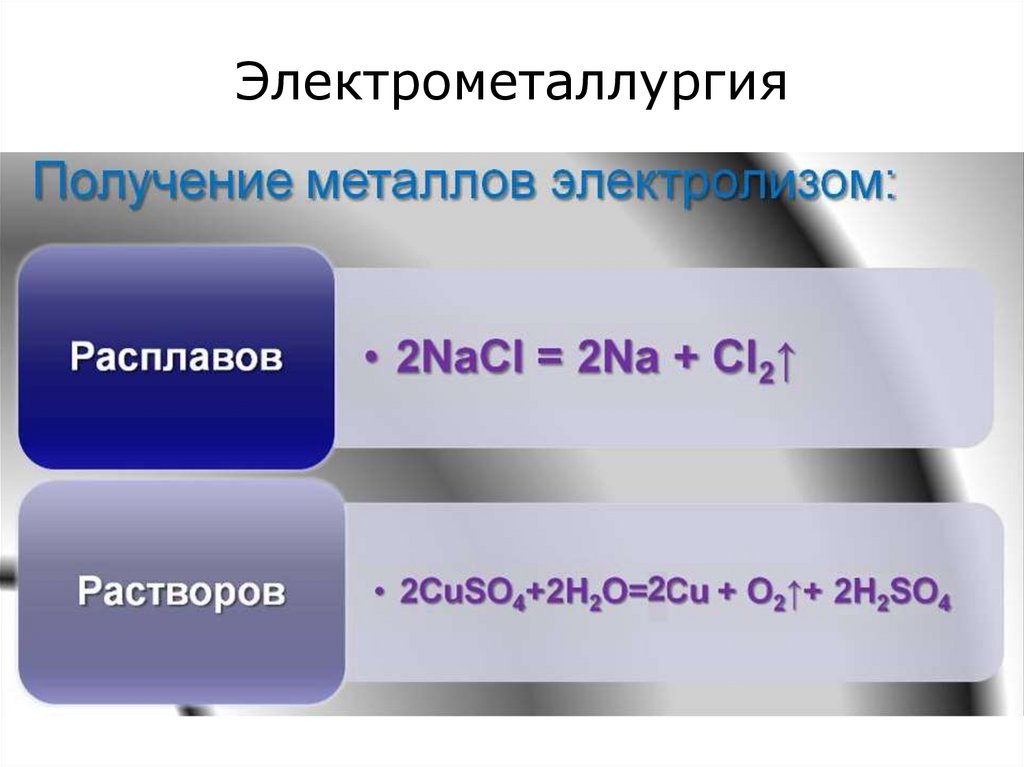
2) Электрометаллургия:
получение активных металлов из расплавов
солей;
•получение металлов из расплавов и растворов
• очистка металлов от примесей
27. Электрометаллургия
28. 3) Металлообработка
Гальванопластика - электрохимическийспособ копирования (получение точных
копий изделий).
Широко используется в технике при
изготовлении матриц в полиграфии,
пресс-форм
для
прессования
грампластинок и т.п.
Этим
способом
изготовляют
металлические
сетки,
ювелирные
изделия, копии скульптур, гравюр,
детали сложной конфигурации. Способ
отличается исключительно высокой
точностью воспроизведения рельефа
изделия.
29. 3) Металлообработка
Гальваностегияэлектрохимический
процесс покрытия одного
металла
другим,
более
устойчивым
в
механическом
и
химическом
отношении,
например, стальные детали
покрывают
хромом,
никелем;
медные
никелем, серебром или
другими металлами.
30. ОТЛИЧИЕ ГАЛЬВАНОПЛАСТИКИ ОТ ГАЛЬВАНОСТЕГИИ
Вгальваностегии
поверхность
подготавливается так, чтобы покрытие
прочно держалось на ней.
В гальванопластике, наоборот, покрытие
должно легко отделяться.




















 Химия
Химия








