Похожие презентации:
Электролиз
1.
ЭлектролизВыполнила работу: Ермакова В.А. ,учитель химии,
МБОУ «СОШ №106 г.Челябинска»
2. Определение
• Электролиз – это окислительно-восстановительныереакции, протекающие на электродах при пропускании
через раствор или расплав электролита постоянного
электрического тока.
«Электро - » означает электрический ток, а « - лиз» разложение. Значит, «электролиз» означает – разложение
электрическим током.
• Электрод – проводник, обычно провод или стержень, по
которому электрический ток поступает в какую-либо
среду или уходит из нее.
Рассмотрим, какие бывают электроды
3. Электроды
• Катод – это отрицательно заряженный электрод• Анод – положительно заряженный электрод
При электролизе электрическая энергия переходит в химическую.
• На катоде протекает процесс восстановления, т.е. процесс
присоединения электронов.
• На аноде протекает процесс окисления, т.е. процесс
отдачи электронов.
Так как катод заряжен отрицательно, к нему стремятся положительно
заряженные ионы, называемые катионами. К положительно
заряженному аноду стремятся отрицательно заряженные ионы,
называемые анионами. Катод является восстановителем, т.е. он отдает
электроны катионам. Анод является окислителем, т.е он принимает
электроны от анионов. Т.е., достигнув электродов, ионы разряжаются,
превращаясь в атомы или группы атомов.
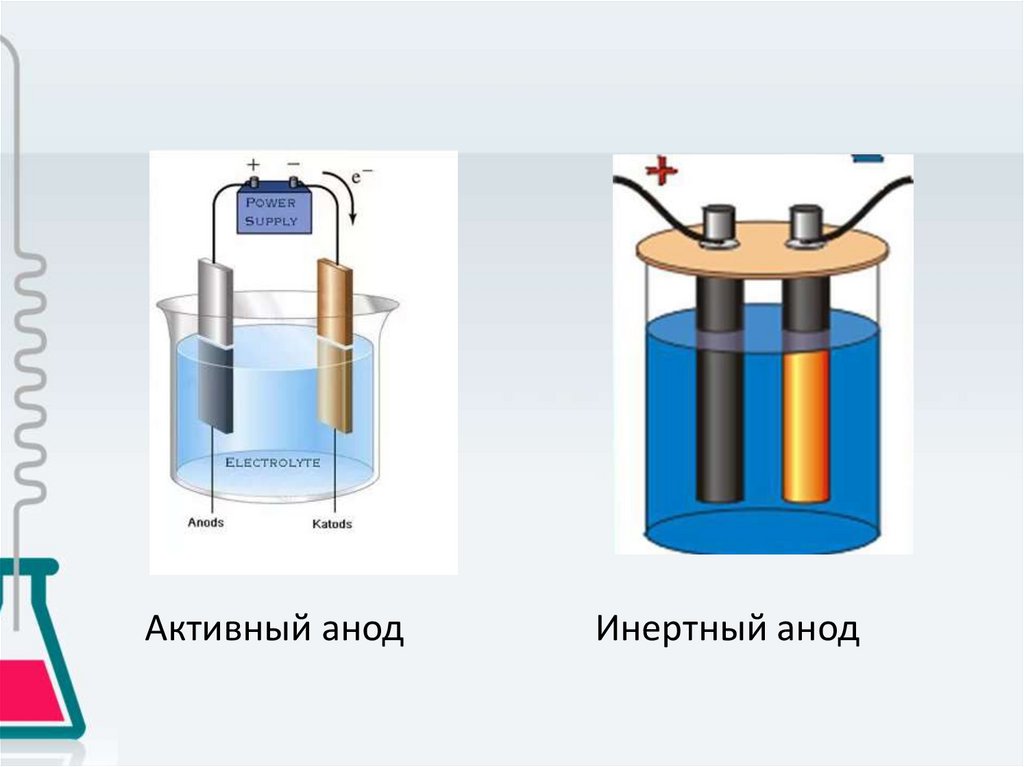
4. Разновидность анода
• Активный• Инертный
Активным называется анод, материал которого
может окисляться в ходе электролиза, в
результате чего анод растворяется и в виде
катионов переходит в раствор
Инертным называется анод, материал которого
не претерпевает окисления в ходе электролиза.
Инертные аноды делают из графита, угля,
платины.
5.
Активный анодИнертный анод
6. Виды электролиза
Существует два вида электролиза:• электролиз расплавов
• электролиз растворов
Электролитическая диссоциация – это процесс распада
электролита на ионы при растворении его в воде или
расплавлении.
Электроли́т — вещество, которое проводит
электрический ток вследствие диссоциации на ионы, что
происходит в растворах и расплавах, или движения ионов
в кристаллических решётках твёрдых электролитов.
7.
Для того чтобы произошла диссоциация,необходимо, чтобы вещество было электролитом
(должны быть заряженные частицы, так как
электрический ток – это направленное
движение заряженных частиц). Электролит надо
расплавить или растворить, чтобы заряженные
частицы свободно передвигались.
А для того, чтобы прошел электролиз,
необходим постоянный электрический ток.
8. Рассмотрим электролиз расплава соли хлорида натрия NaCl
Рассмотрим электролиз расплава солихлорида натрия NaCl
Прежде всего, составляем уравнение электролитической
диссоциации.
Электролиз расплава хлорида натрия
NaCl → Na + + Cl –
K (-)
Na+ + ẽ →Na0
2 восстановление
A (+)
2Cl- -2ẽ → Cl02↑
1 окисление
2 Na+ + 2Cl- = 2Na0 + Cl02↑
• На катоде разряжаются катионы натрия, на аноде – анионы
хлора, суммарное уравнение электролиза имеет вид:
2NaCl → 2Na0 + Cl20
9. Рассмотрим электролиз для растворов
Для определения результатов электролиза водных растворов
существуют следующие правила:
Процесс на катоде не зависит от материала катода, а зависит
от положения металла в электрохимическом ряду напряжений.
1. Если катион электролита находится в начале ряда напряжений (по
Al включительно), то на катоде идёт процесс восстановления воды
(выделяется Н2). Катионы металла не восстанавливаются, остаются
в растворе.
2. Если катион электролита находится в ряду напряжений между
алюминием и водородом, то на катоде восстанавливаются
одновременно и ионы металла, и молекулы воды.
3. Если катион электролита находится в ряду напряжений после
водорода, то на катоде идёт только процесс восстановления ионов
металла.
4. Если в растворе находится смесь катионов разных металлов, то
первым восстанавливается катион того металла, который имеет
наибольшее алгебраическое значение электродного потенциала.
10.
11.
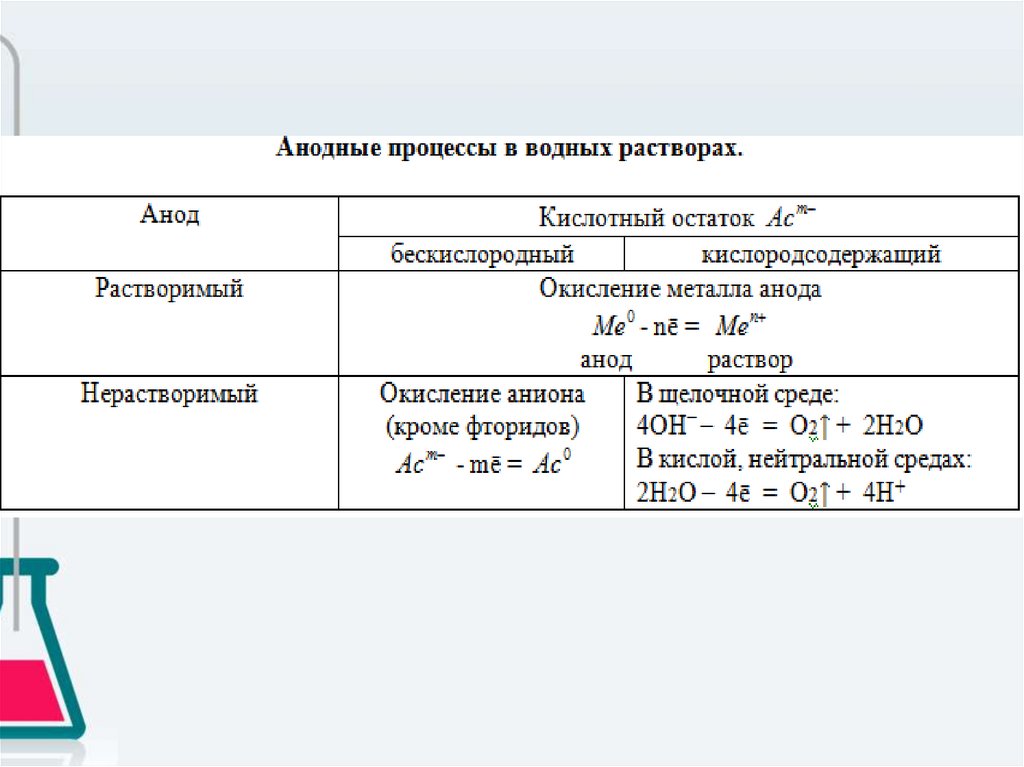
Процесс на аноде зависит от материала анода и от природыаниона.
• 1. Если анод растворимый (железо, медь, цинк, серебро и все
металлы, которые окисляются в процессе электролиза), то
независимо от природы аниона всегда идёт окисление металла
анода.
• 2. Если анод нерастворимый, т.е. инертный (уголь, графит, платина,
золото), то:
А) при электролизе растворов солей бескислородных кислот (кроме
фторидов) на аноде идёт процесс окисления аниона;
Б) при электролизе растворов солей оксокислот и фторидов на
аноде идёт процесс окисления воды (выделяется кислород); анион
не окисляется, остаётся в растворе. При электролизе растворов
щелочей идёт окисление гидроксид-ионов
12.
13. Рассмотрим электролиз раствора хлорида натрия
Рассмотрим электролиз растворахлорида натрия
NaCl = Na+ + ClК (-)
2 Н2О + 2ẽ = Н2↑ + 2 ОНА (+) 2 Cl- - 2ẽ = Cl02
Суммарное ионное уравнение
2 Н2О + 2 Cl- = Н2↑+ Cl2↑ + 2OH2NaCl + 2 Н2О Электролиз Н2↑ + Cl02↑+ 2NaOH
14. Электролиз раствора сульфата меди (II) на нерастворимом аноде:
Электролиз раствора сульфата меди (II)на нерастворимом аноде:
CuSO4 = Cu2+ + SO2-4
К (-)
Cu2+ +2ẽ = Cu0
2
А (+)
2 Н2О - 4ẽ = O2↑+ 4 H+
1
Суммарное ионное уравнение:
2 Cu2+ + 2 Н2О = 2 Cu0 + O2↑ + 4 Н+
Суммарное молекулярное уравнение:
2CuSO4 + 2 Н2О Электролиз 2 Cu0+ O2+ 2 H2SO4












 Химия
Химия








