Похожие презентации:
Гальванический элемент
1.
Измерение ЭДС гальваническогоэлемента и определение ΔG в
окислительно-восстановительных
реакциях
Исследование зависимости ЭДС
гальванического элемента от
концентрации соли
2.
Овладение методикой измерения ЭДС инапряжения гальванических элементов в
изучение зависимости напряжения от
концентрации потенциалоопределяющих
ионов, рН раствора и плотности тока.
3.
растворы солей электролитов:сульфата меди СuSO4 (1 М, 0,01 М),
сульфата цинка ZnSО4 (1 М),
сульфата кадмия (1 М)
медный, цинковый и кадмиевый электроды (пластины)
химические стаканы,
электролитический ключ (солевой мост)
вольтметр.
4.
5.
6.
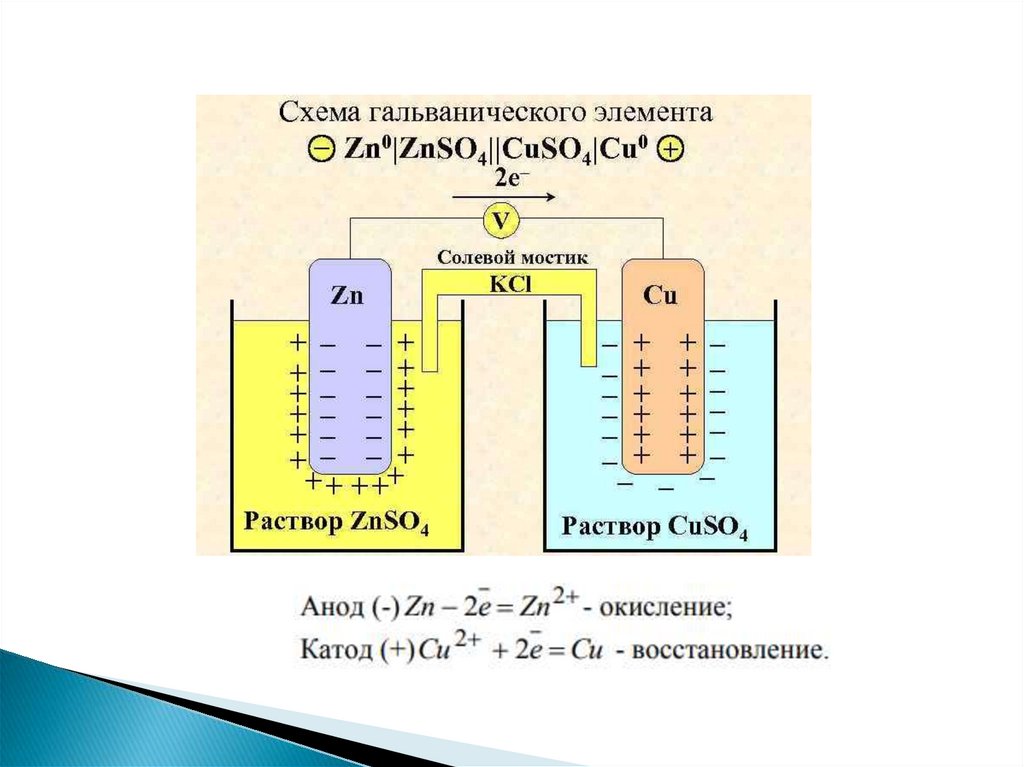
Процессы окисления в электрохимии получили название анодныхпроцессов, а электроды, на которых идут процессы окисления, называются
анодами.
Процессы восстановления в электрохимии получили название
катодных процессов, а электроды, на которых идут процессы
восстановления, называют катодами.
7.
Электродвижущая сила (ЭДС) гальванического элемента естьразность между большим и меньшим потенциалами
электродов, т.е. разность потенциалов катода и анода.
При работе гальванического элемента концентрация Сu2+
уменьшается,
а концентрация Zn2+ растет. Следовательно, согласно уравнению
Нернста,
потенциал катода уменьшается, анода – увеличивается и ЭДС
гальванического элемента уменьшается. Схема элемента Даниэля –
Якоби
записывается в виде:
8.
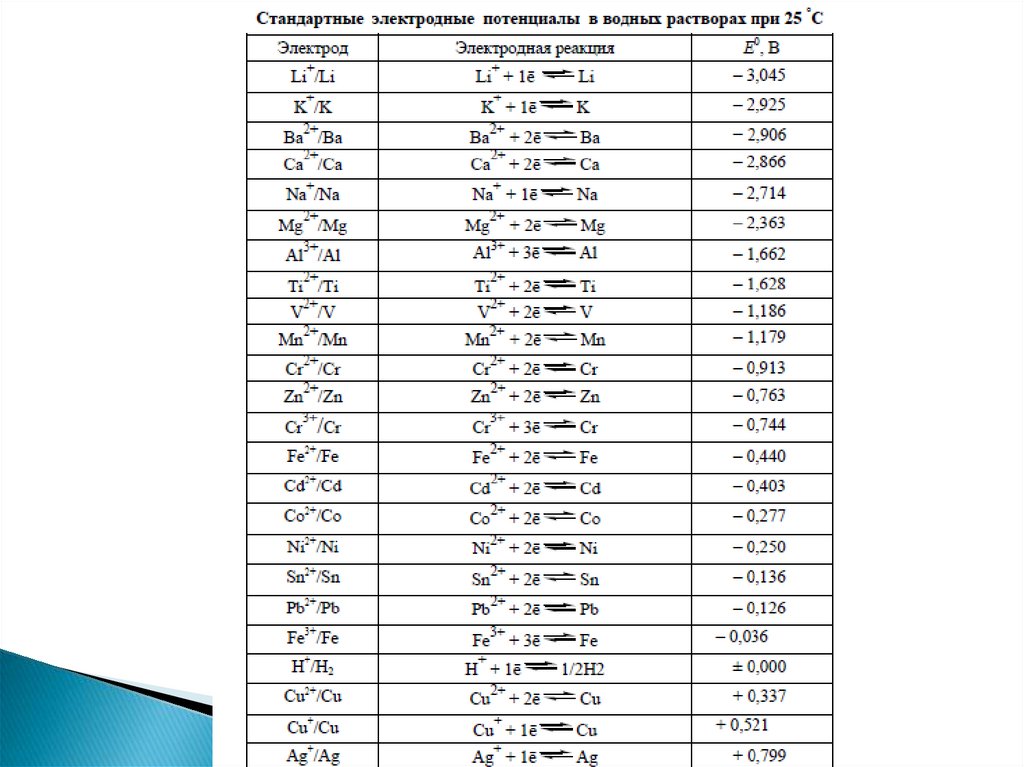
Равновесный электродный потенциал рассчитывается по уравнению Нернста. Врезультате изучения потенциалов различных электродных процессов установлено,
что их величины зависят от следующих факторов:
1) от природы веществ – участников электродного процесса;
2) от соотношения между концентрациями этих веществ;
3) от температуры системы.
9.
После подстановки числовых значений констант иперевода натуральных логарифмов в десятичные
уравнение Нернста имеет вид:
Из уравнения Нернста ясно, что возрастание
концентрации окисленной формы или уменьшение
концентрации восстановленной формы вызывает
увеличение электродного потенциала системы и
наоборот.
10.
11.
12.
13.
Произвести расчет равновесных потенциалов металлическихэлектродов по уравнению Нернста при разных концентрациях
потенциал-определяющих ионов в растворе, ЭДС гальванических
элементов
Результаты опыта внести в таблицу:
Составить схемы гальванических элементов и записать уравнение
процессов, которые протекают на катоде и аноде:
Сu – Zn
Cd – Zn
Сделать выводы.











 Химия
Химия








