Похожие презентации:
Галогены
1. ГАЛОГЕНЫ
2. Историческая справка
Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиусгалогены (греч. hals – соль, gen – рождаю)
1886 – открыт фтор
(Анри Муассан, фр. химик,
Нобелевская премия)
Фтор (греч. phtoros – разрушение)
1774 – открыт хлор (Карл Шееле,
шведский химик)
1826 – открыт бром
(Антуан Балар, фр. химик)
1811 – открыт йод (Бернар Куртуа,
фр. химик)
Бром (греч. bromos – зловонный)
Иод (греч. iodes – фиолетовый)
1940 – открыт астат (Д. Корсон,
К. Р. Маккензи, Э. Сегре, калифорнийский
университет в Беркли)
2009—2010 – открыт элемент №117
(унунсептий) (Объединённый институт
ядерных исследований в Дубне, Россия)
Астат (греч. astatos – неустойчивый)
Унунсептий (лат. – сто семнадцатый)
Хлор (греч. khloros –
бледно-зеленый)
3. Распространенность в природе
флюорит CaF2галит NaCl
сильвин KCl
сильвинит KCl•NaCl
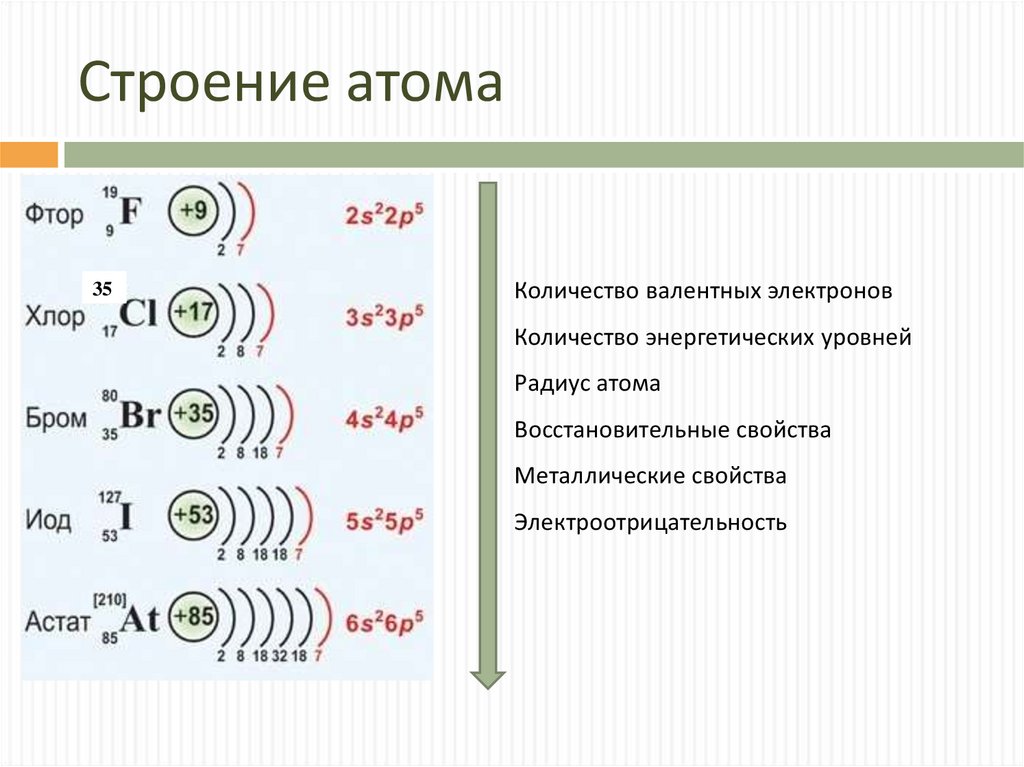
4. Строение атома
35Количество валентных электронов
Количество энергетических уровней
Радиус атома
Восстановительные свойства
Металлические свойства
Электроотрицательность
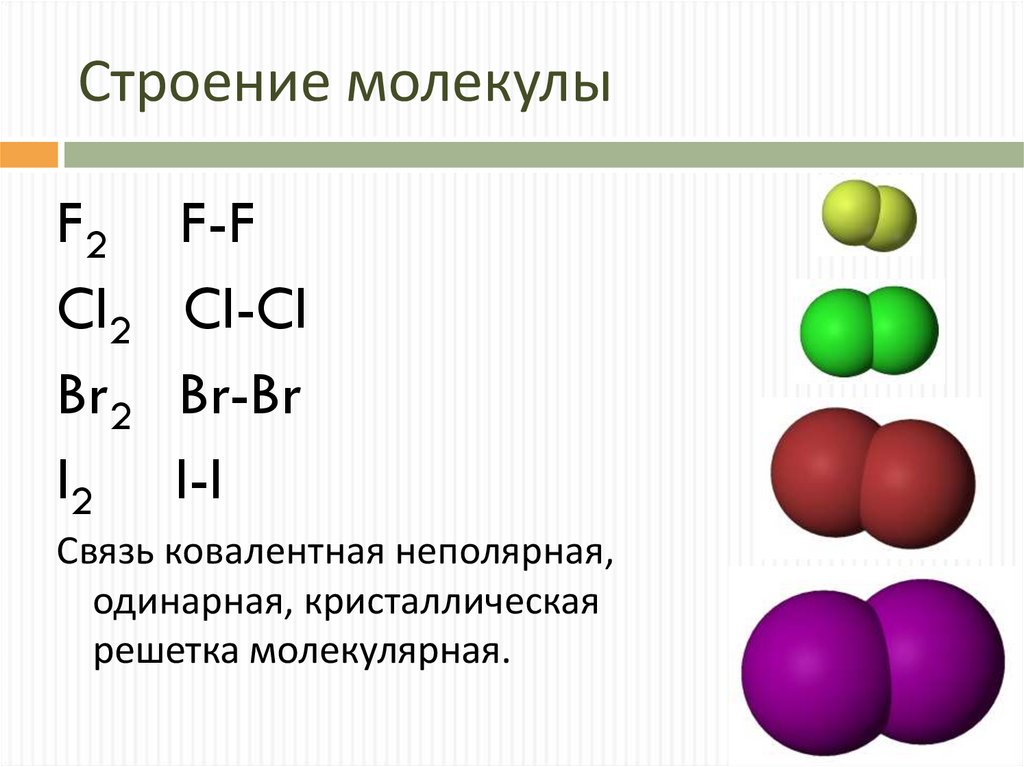
5. Строение молекулы
F2Cl2
Br2
I2
F-F
Cl-Cl
Br-Br
I-I
Связь ковалентная неполярная,
одинарная, кристаллическая
решетка молекулярная.
6. Физические свойства
,способно к
возгонке
7. Химические свойства
1) Взаимодействие с металлами:Cu + Cl2 =
Fe + Cl2 =
2) Взаимодействие с неметаллами (галогены не
взаимодействует с кислородом и азотом):
H2 + F2 = 2HF (со взрывом)
H2 + Cl2 = 2HCl (на свету)
H2 + Br2 = 2HBr (при нагревании)
H2 + I2 = 2HI (при нагревании, обратимая реакция)
8. Химические свойства
3) Взаимодействие с водой:2F2 + 2H2O = 4HF + O2
H2O + Cl2 HCl + HClO (хлорная вода)
4) Вытеснение менее активных галогенов из
галогенидов : Cl2>Br2>I2
Cl2 + NaI =
I2 + NaCl =
9. Химические свойства
5) Взаимодействие со щелочамина холоду:
2NaOH + Cl2 = NaCl + гипохлорит
NaClO + H2O
натрия
при нагревании:
t
6NaOH + 3Cl2 = 5NaCl + NaClO
+ 3H2O
хлорат 3
натрия
Составить электронный баланс
10. Получение
F2 и Cl2 в промышленности получаютэлектролизом расплавов или растворов их
солей:
эл.ток
2Na + Cl
2NaCl
2
расплав
ток
H
2NaCl + 2H2O эл.
2 + Cl2+ H2O
Cl2 в лаборатории получают:
MnO2 + 4HCl = MnCl2 + Cl2 + H2O
11.
В периодической системе галогены находятся в:А) главной подгруппе VIII группы;
Б) побочной подгруппе VII группы;
В) главной подгруппе VII группы;
Г) главной подгруппе VI группы.
12.
Для галогенов характерна степень окисления:А) -2;
Б) -1 и -2;
В) -2 и -3;
Г) -1.
13.
Галогены могут проявлять положительнуюстепень окисления в соединениях с:
А) водородом;
Б) кислородом;
В) с металлами;
Г) ни с одним из этих веществ.
14.
Как меняется химическая активность галогенов вряду: F, Cl, Br, I?
А) увеличивается;
Б) меняется беспорядочно;
В) уменьшается;
Г) не меняется.
15.
При обычных условиях бром - это:А) газ;
Б) жидкость;
В) кристаллическое в-во;
Г) жидкость или кристаллическое в-во.
16.
Свободных орбиталей нет у:А) хлора;
Б) брома;
В) йода;
Г) фтора.
17.
Галогены в твердом состоянии имеют:А) атомную кристаллическую решетку;
Б) молекулярную кристаллическую решетку;
В) А и Б;
Г) имеют особое строение.
18. Домашнее задание
§23, 241.
1.Составить электронный баланс для реакций
хлора со щелочами (для сдающих).
2.
2. Для несдающих сообщение «Соединение
галогенов»
















 Химия
Химия








