Похожие презентации:
Галогены. Элементы VII группы
1.
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3.
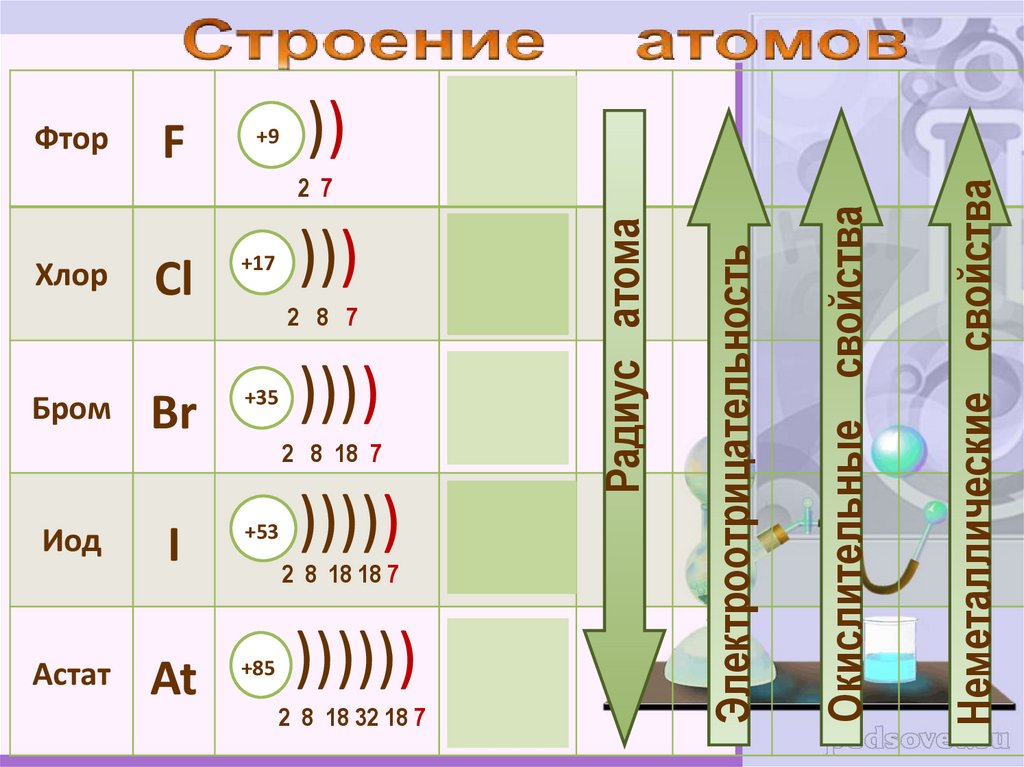
F+9
))
2s22р5
Иод
I
+53
Астат
At
+85
2 8 7
))))
4s24p5
2 8 18 7
)))))
2 8 18 18 7
))))))
2 8 18 32 18 7
5s25p5
6s26p5
Окислительные свойства
Br
+35
Бром
3s23p5
Электроотрицательность
)))
Cl
+17
Хлор
Радиус атома
2 7
Неметаллические свойства
Фтор
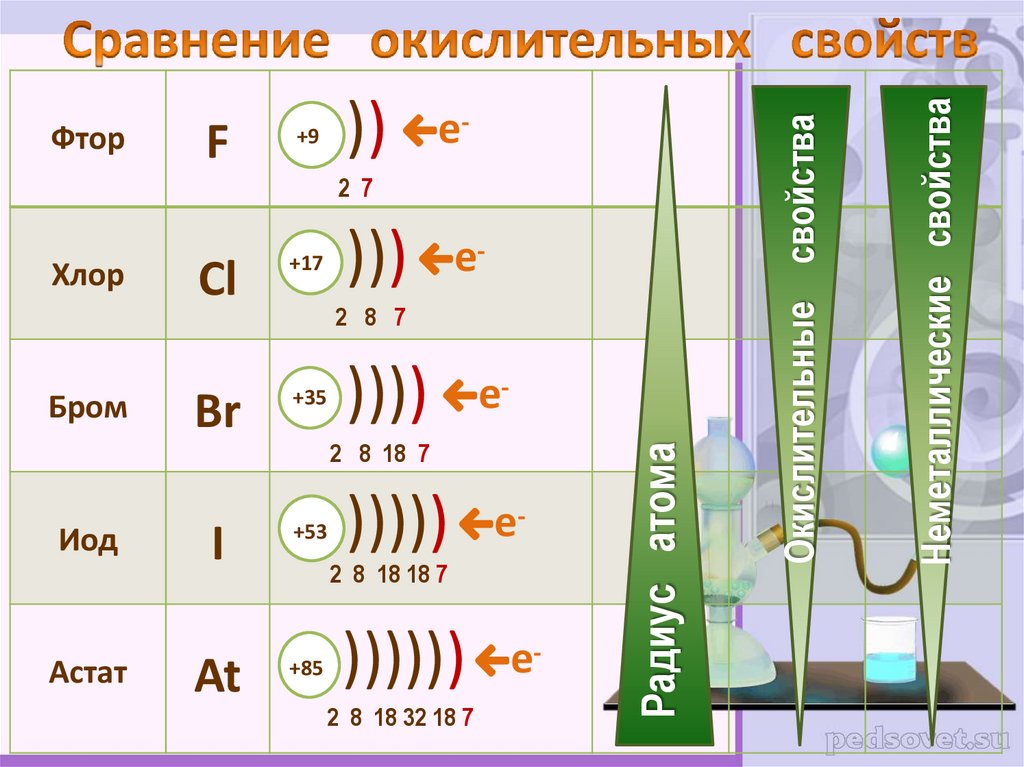
4. Сравнение окислительных свойств
е-2 7
)))
Cl
+17
Br
+35
Иод
I
+53
Астат
At
+85
Бром
2 8 7
))))
е-
2 8 18 7
)))))
е-
2 8 18 18 7
))))))
2 8 18 32 18 7
е-
Радиус атома
Хлор
е-
Неметаллические свойства
F
))
+9
Окислительные свойства
Фтор
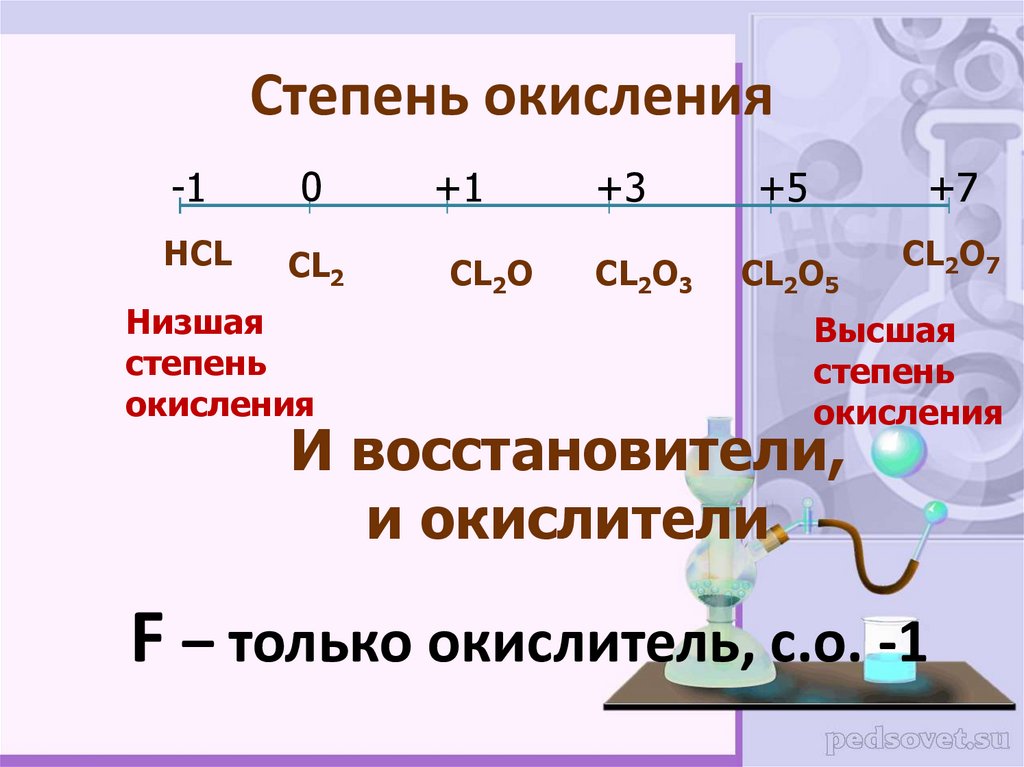
5. Степень окисления
-10
НCL
CL2
Низшая
степень
окисления
+1
CL2O
+3
CL2O3
+5
+7
CL2O5
CL2O7
Высшая
степень
окисления
И восстановители,
и окислители
F – только окислитель, с.о. -1
6.
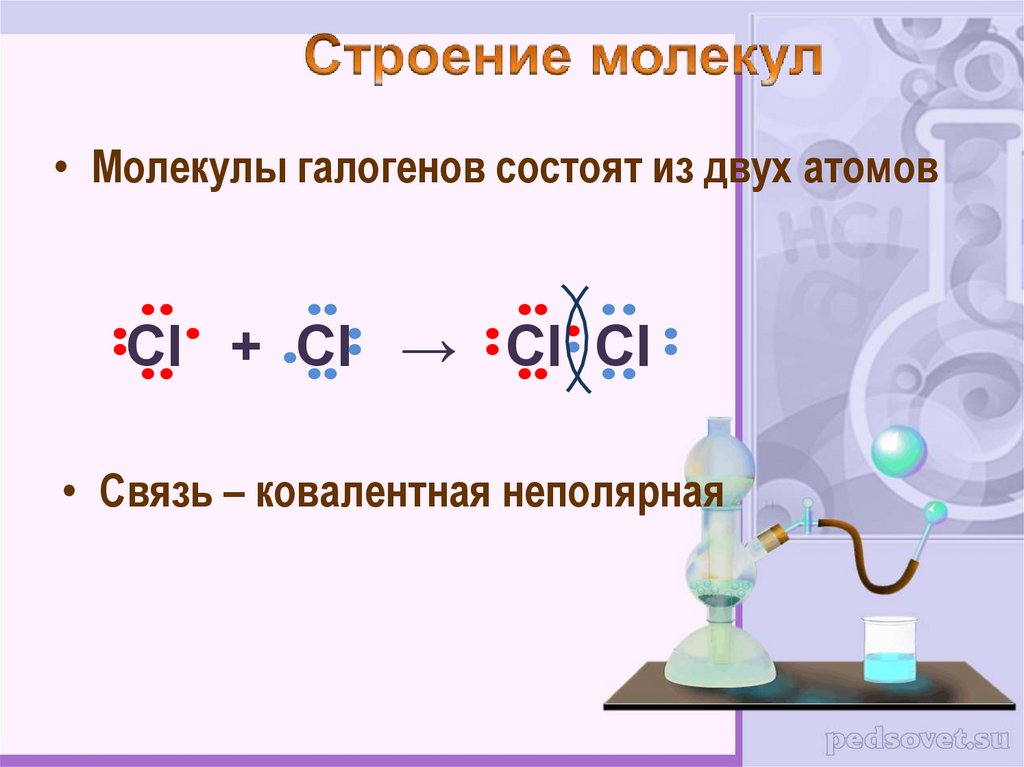
• Молекулы галогенов состоят из двух атомовCl + Cl → Cl Cl
• Связь – ковалентная неполярная
7.
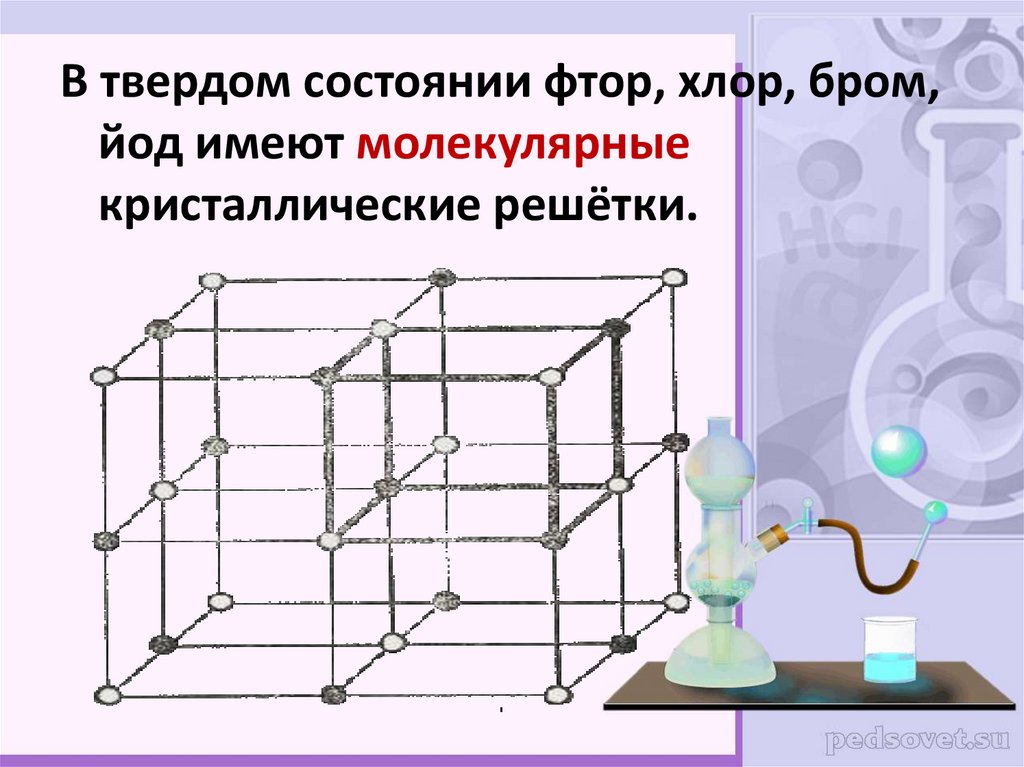
В твердом состоянии фтор, хлор, бром,йод имеют молекулярные
кристаллические решётки.
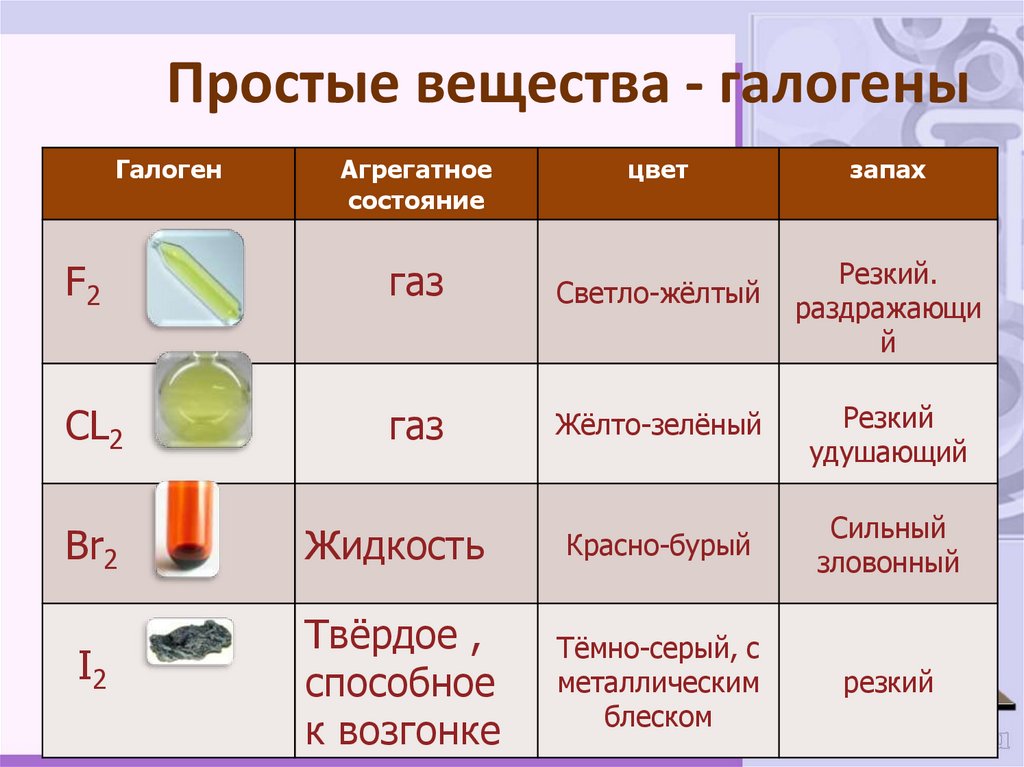
8. Простые вещества - галогены
ГалогенАгрегатное
состояние
цвет
запах
F2
газ
Светло-жёлтый
CL2
газ
Жёлто-зелёный
Резкий
удушающий
Сильный
зловонный
резкий
Br2
Жидкость
Красно-бурый
I2
Твёрдое ,
способное
к возгонке
Тёмно-серый, с
металлическим
блеском
Резкий.
раздражающи
й
9. Выберите два высказывания, в которых говорится о броме как о химическом элементе:
:Выберите два высказывания, в которых
говорится о броме как о химическом
элементе:
1)
Бром
принадлежит
к
главной
подгруппе VII группы — галогенам
2) Бром ядовит, при соприкосновении с
кожей образуются ожоги
3) При обычных условиях бром —
красно-бурая
летучая
жидкость
с
резким неприятным запахом
4) Бром используется для производства
боевых отравляющих веществ
5) Препараты брома имеют солёный
вкус и оказывают седативный и с
10.
1. Взаимодействие с металламиХлор непосредственно реагирует почти со
всеми металлами (с некоторыми только в
присутствии влаги или при нагревании):
2Na + Cl2
2Fe + 3Cl2
-1
2NaCl
-1
2FeCl3
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота,
кислорода и инертных газов), образует
соответствующие хлориды.
5Cl2 + 2P
-1
2PCl5
F2 -наиболее
реакционноспо
собен , реакции
идут на холоду,
при
нагревании –
даже с
участием Au,
Pt.
11. 4. Взаимодействие с водородом
H2 + F2 = 2HF (со взрывом)H2 + Cl2 = 2HCl (на свету)
H2 + Br2 = 2HBr (при нагревании)
H2 + I2 = 2HI (при нагревании,
обратимая реакция)
12.
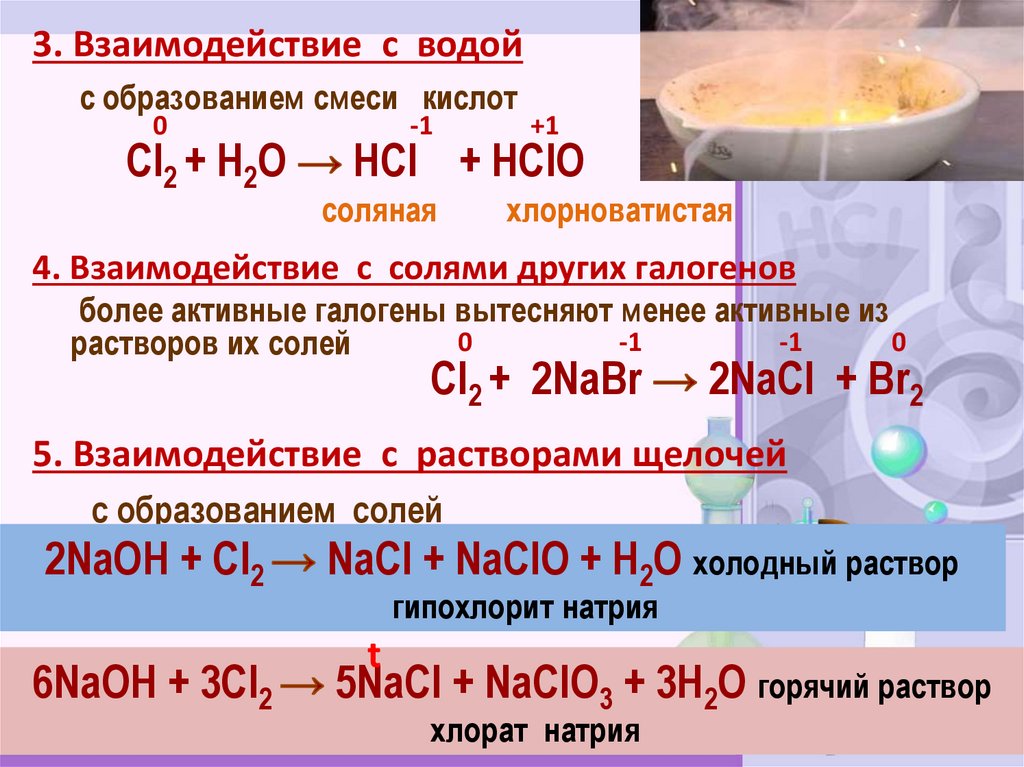
3. Взаимодействие с водойс образованием смеси кислот
0
Cl2 + H2О
-1
+1
HCl + HClO
соляная
хлорноватистая
4. Взаимодействие с солями других галогенов
более активные галогены вытесняют менее активные из
0
-1
-1
0
растворов их солей
Cl2 + 2NaBr
2NaCl + Br2
5. Взаимодействие с растворами щелочей
с образованием солей
2NaOH + Cl2
6NaOH + 3Cl2
NaCl + NaClO + H2O холодный раствор
гипохлорит натрия
t
5NaCl + NaClO3 + 3H2O горячий раствор
хлорат натрия
13. Историческая справка
Слово «галогены» (“halogen”) ввел шведский химикЙ.Я.Берцелиус
галогены (греч. hals – соль, gen – рождаю)
1886 – открыт фтор
(Анри Муассан, фр. химик,
Нобелевская премия)
Фтор (греч. phtoros –
разрушение)
1774 – открыт хлор (Карл
Шееле,
шведский химик)
1826 – открыт бром
(Антуан Балар, фр. химик)
1811 – открыт йод (Бернар
Куртуа,
фр. химик)
Хлор (греч. khloros –
бледно-зеленый)
Бром (греч. bromos –
зловонный)
Иод (греч. iodes – фиолетовый)
1940 – открыт астат (Д. Корсон,
К. Р. Маккензи, Э. Сегре,
калифорнийский университет в
2009—2010 – открыт элемент №117
(унунсептий) (Объединённый институт
ядерных исследований в Дубне,
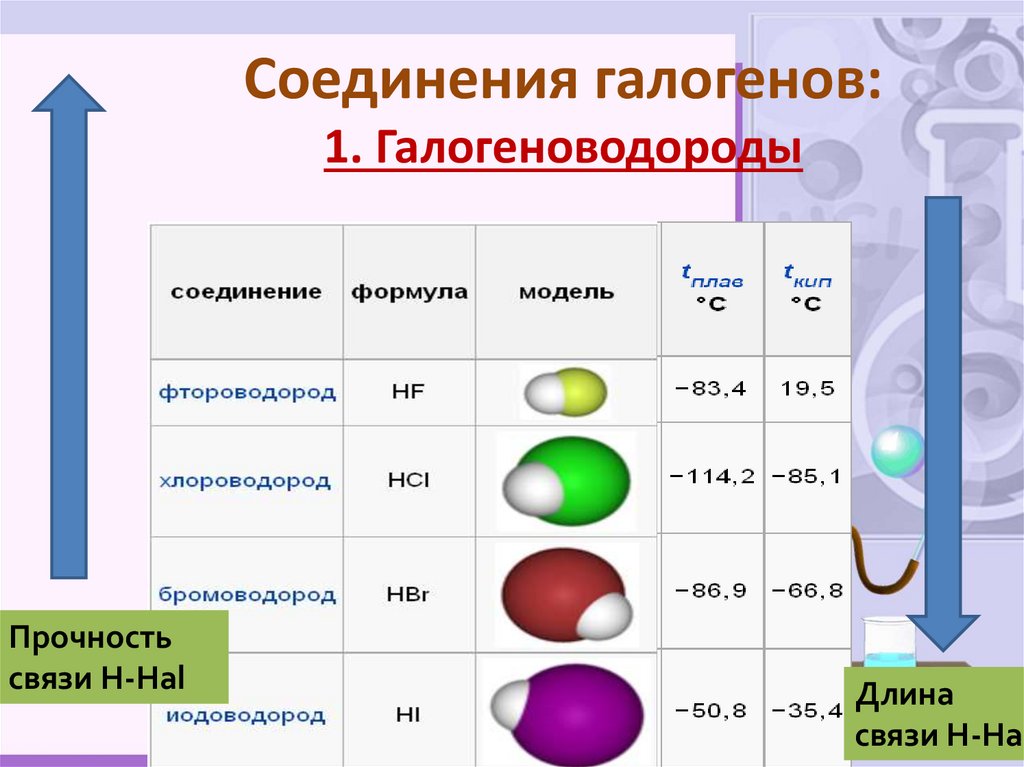
14. Соединения галогенов: 1. Галогеноводороды
Прочностьсвязи Н-Hal
Длина
связи Н-Hal
15. Физические свойства галогеноводородов
1) Бесцветные газы (HF при t<19,5 0C –жидкость)
2) С резким запахом
3) Токсичны
4) Хорошо растворяются в воде
5) Дымят во влажном воздухе
6) Растворы галогеноводородов – кислоты
1V (H2O) растворяется 500V (HCl)
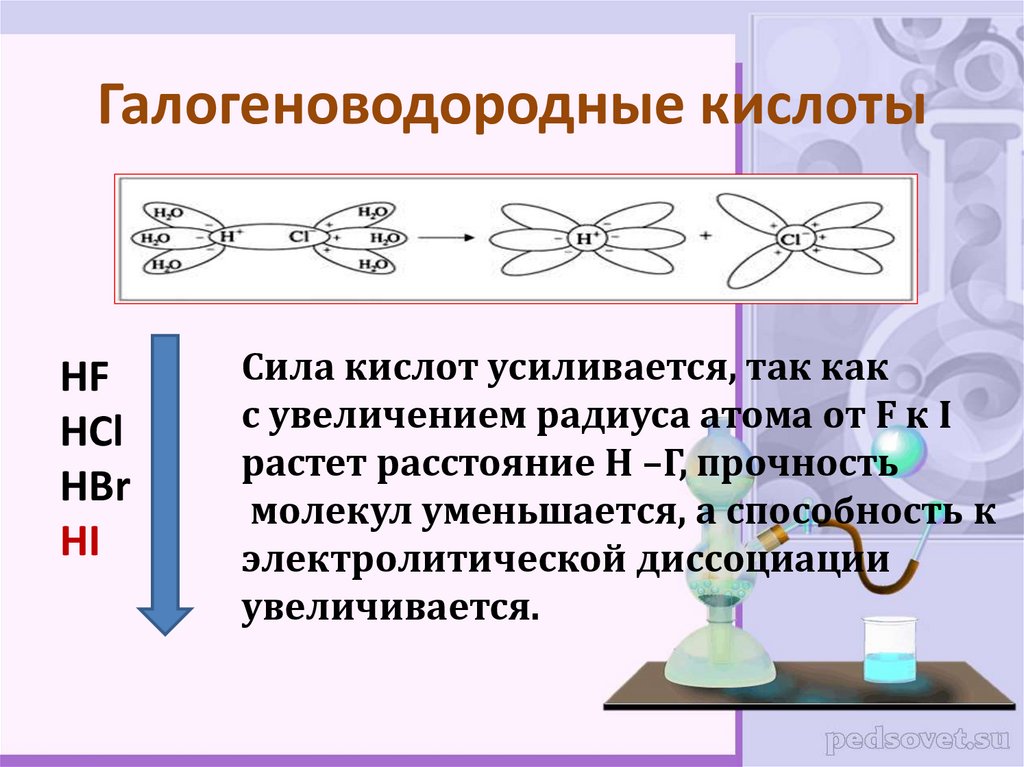
16. Галогеноводородные кислоты
HFHCl
HBr
HI
Сила кислот усиливается, так как
с увеличением радиуса атома от F к I
растет расстояние Н –Г, прочность
молекул уменьшается, а способность к
электролитической диссоциации
увеличивается.
17. Получение хлороводорода
1) В промышленности: синтезом изводорода и хлора:
H2 + Cl2 = 2HCl
2) В лаборатории:
t
NaCl (крист.) + H2SO4 (конц.) = HCl↑ + NaHSO4
18. Соляная кислота
Физические свойства: бесцветная,дымящая на воздухе жидкость,
тяжелее воды
Химические свойства:
Типичная кислота
С какими веществами
взаимодействуют кислоты?
19. Плавиковая кислота
Используют для изготовления надписей ирисунков на стекле.
SiO2 + 2HF = SiF4↑ + 2H2O
Травление или сатинирование
Эту технологию начали использовать в
1771 г. с открытием плавиковой кислоты.
Сама эта кислота делает стекло
блестящим, а ее газы - матовым. Травить
можно всю поверхность полностью (при
этом она остается гладкой) или выборочно
(только рисунок).
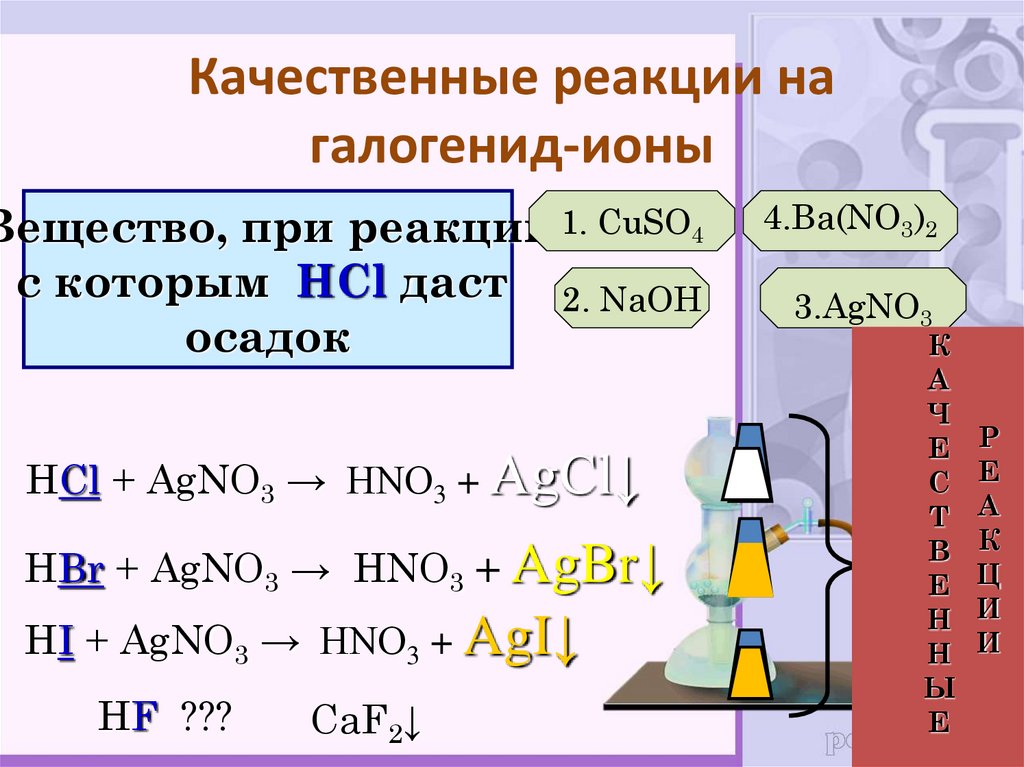
20. Качественные реакции на галогенид-ионы
Вещество, при реакции 1. CuSO4с которым HCl даст 2. NaOH
осадок
HCl + AgNO3 → HNO3 + AgCl↓
HBr + AgNO3 → HNO3 + AgBr↓
HI + AgNO3 → HNO3 + AgI↓
HF ???
CaF2↓
4.Ba(NO3)2
3.AgNO3
К
А
Ч
Е
С
Т
В
Е
Н
Н
Ы
Е
Р
Е
А
К
Ц
И
И
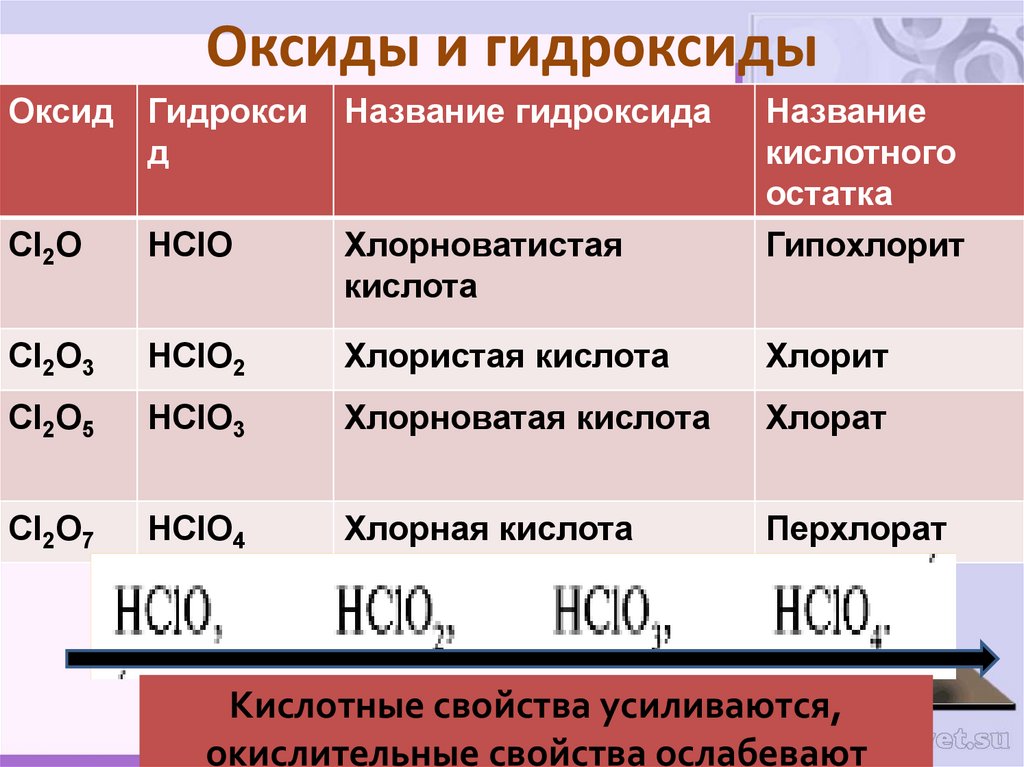
21. Оксиды и гидроксиды
Оксид Гидроксид
Название гидроксида
Название
кислотного
остатка
Гипохлорит
Cl2O
HClO
Хлорноватистая
кислота
Cl2O3
HClO2
Хлористая кислота
Хлорит
Cl2O5
HClO3
Хлорноватая кислота
Хлорат
Cl2O7
HClO4
Хлорная кислота
Перхлорат
Кислотные свойства усиливаются,
окислительные свойства ослабевают
22. Распространенность в природе
Плавиковый шпат - флюорит CaF2галит NaCl
сильвин KCl
сильвинит
KCl•NaCl
23. Получение галогенов:
F2 и Cl2 в промышленности получаютэлектролизом расплавов или растворов их
солей:
ток 2Na + Cl2
2NaCl эл.
расплав
ток H2 + Cl2 + 2NaOH
2NaCl + 2H2O эл.
раствор
Cl2 в лаборатории получают:
MnO2 + 4HCl = MnCl2 + Cl2 + H2O
24.
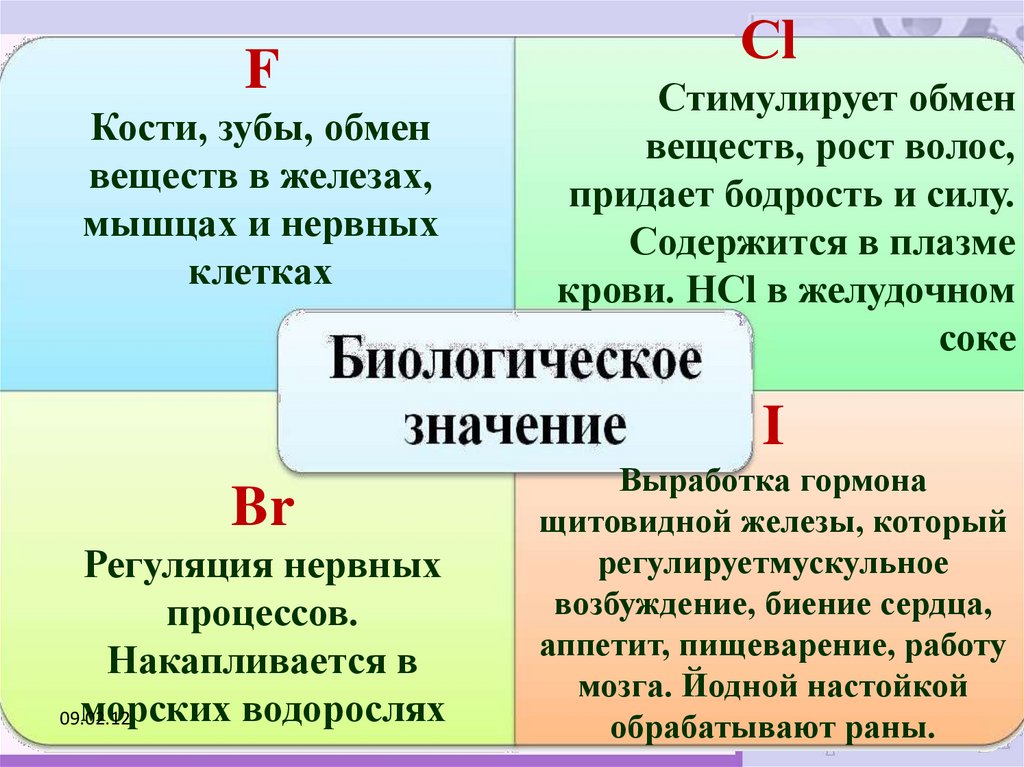
FКости, зубы, обмен
веществ в железах,
мышцах и нервных
клетках
Сl
Стимулирует обмен
веществ, рост волос,
придает бодрость и силу.
Содержится в плазме
крови. НСl в желудочном
соке
I
Br
Регуляция нервных
процессов.
Накапливается в
морских водорослях
09.02.12
Выработка гормона
щитовидной железы, который
регулируетмускульное
возбуждение, биение сердца,
аппетит, пищеварение, работу
мозга. Йодной настойкой
обрабатывают раны.
25.
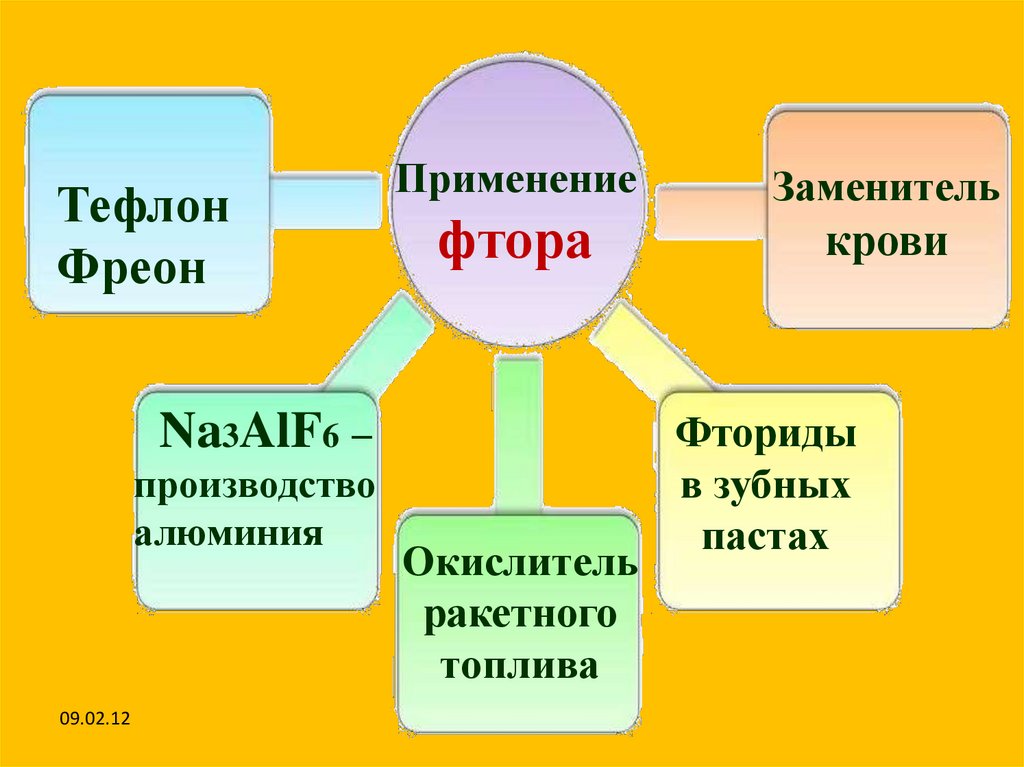
ТефлонФреон
Применение
фтора
Na3AlF6 –
производство
алюминия
09.02.12
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
26.
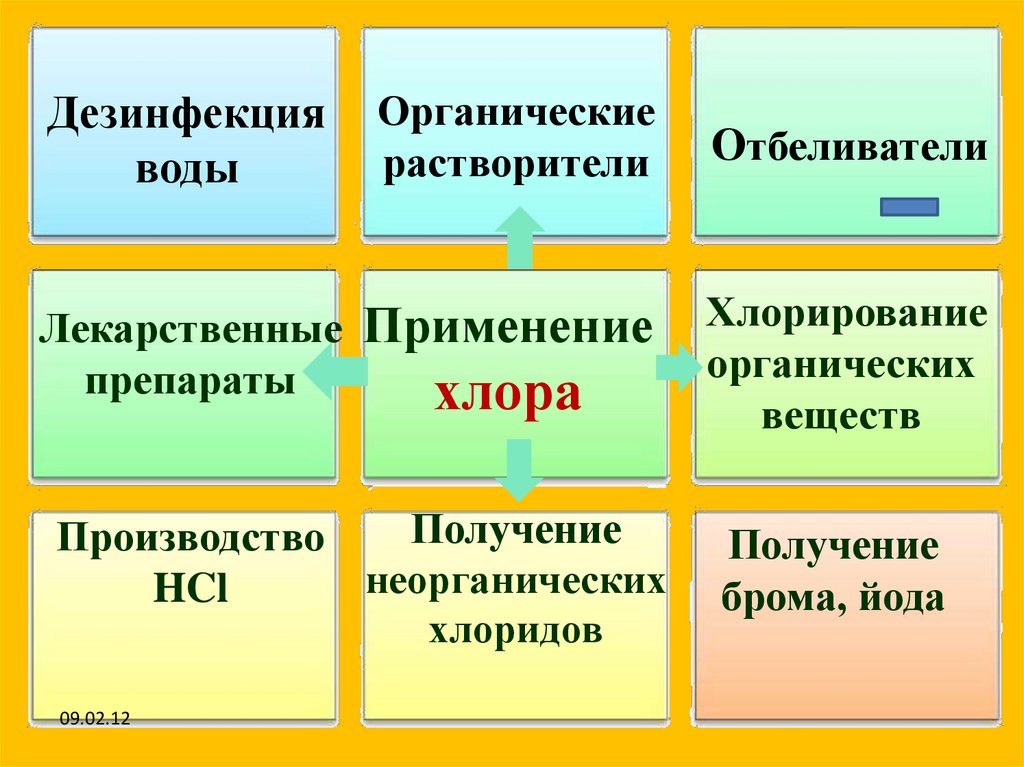
Дезинфекцияводы
Органические
растворители
Лекарственные
препараты
Применение
хлора
Получение
Производство
неорганических
HCl
хлоридов
09.02.12
Отбеливатели
Хлорирование
органических
веществ
Получение
брома, йода
27.
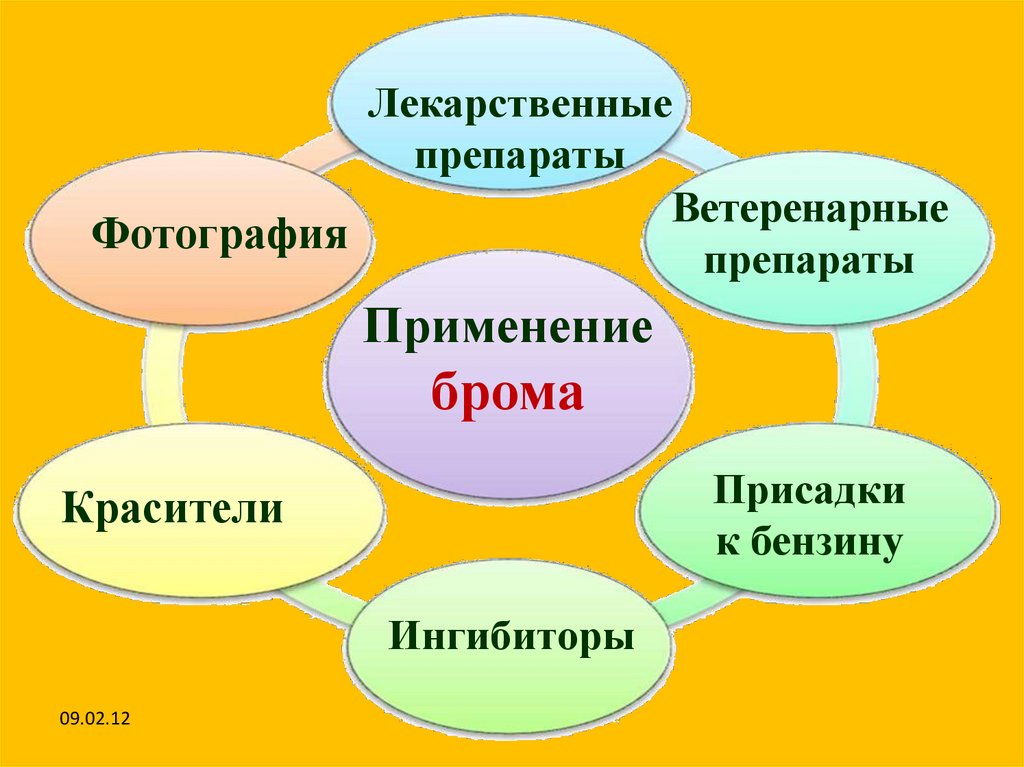
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Присадки
к бензину
Красители
Ингибиторы
09.02.12
28.
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
09.02.12
Красители













 Химия
Химия








