Похожие презентации:
Кремний
1.
07.02.2022§24 стр.123-127
2.
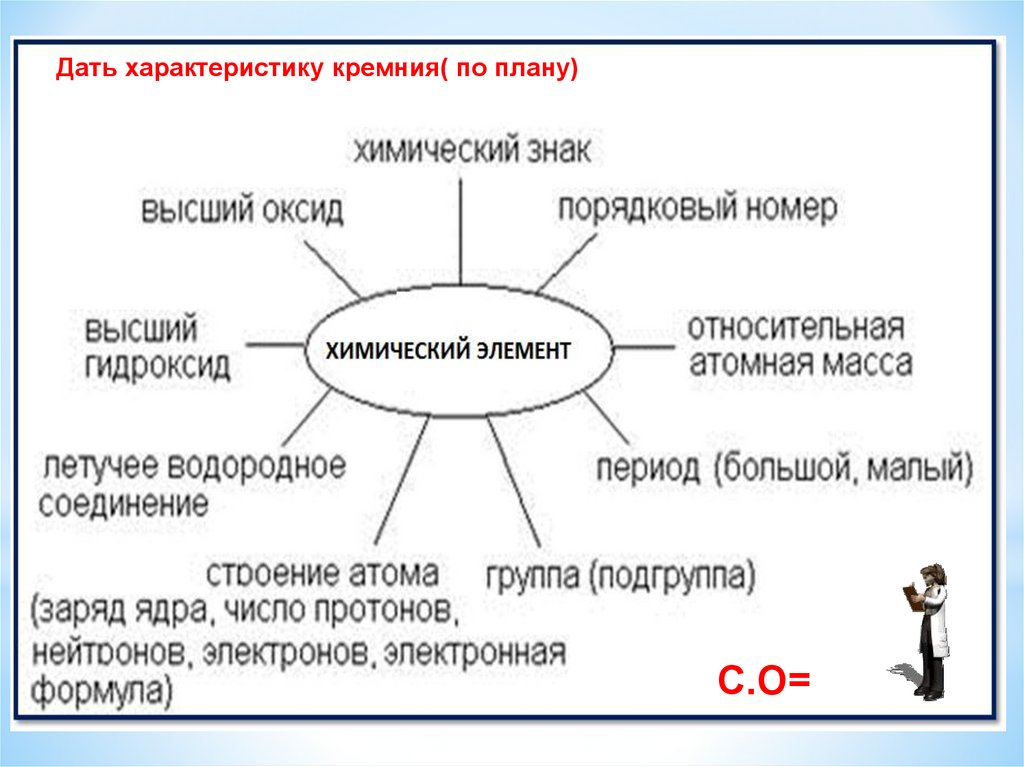
Дать характеристику кремния( по плану)C.О=
3.
Разновидности минералов наоснове оксида кремния
Агат
Горный
хрусталь
Кварц
Цитрин
Опал
ПЕСОК
Кошачий
глаз
Аметист
Яшма
Сердолик
4.
Физические свойства• Тугоплавкое вещество
(tпл.=1400°С) темносерого цвета с
металлическим
блеском, хрупкое,
плохо проводит
электрический ток.
• Неметалл
• Бурый порошок, не
имеющий постоянной
температуры
плавления.
5.
Химические свойстваI. С простыми веществами =БС
II.С сложными веществами
1 .Si + Неме Si+H2
1)со щелочами
Si + 2NaOH+H2O t Na2SiO3+2H2
Si + 2F2 =SiF4 ↑силан
При нагревании с O2 ,Cl2, N2, C, S
Si + O2= t = SiO2
2) с оксидами металлов
Si +FeO = SiO2+Fe+Q
Si+C= t~2000= SiC (карборунд, близок
по твёрдости к алмазу)
3) только с плавиковой кислотой
Si+4HF=SiF4+2H2
2. Si + Ме
4) Растворяется в смеси
концентрированных
азотной и плавиковой кислот
3Si +4HNO3+12HF= 3SiF4↑+4NO+8H2O
Д/З изучить параграф 24, выполнить
упр.3 (сдаём сообщения)
Si + Са =Са2Si
Са2Si + 4HCl =2СаCl2+SiF4 ↑.
6.
Свойства оксидаСО2
SiO2
Кислотный оксид
Кислотный оксид
Молекулярная
кристаллическая решетка
Атомная
кристаллическая решетка
Бесцветный газ.
Кристаллическое, твердое
вещество, тугоплавкое.
Химические
свойства
H2O + CO2 = H2CO3
Не взаимодействует
CO2 + CaO = CaCO3
SiO2 + CaO = CaSiO3
CO2 + Ca(OH)2 =CaCO3 + H2O
SiO2 + NaOH = Na2SiO3 + H2O
CO2 + Mg = MgO + C
SiO2 + C = MgO + Si
C + CO2 = CO
SiO2 + C = Si + CO
7.
H2CO3H2SiO3
Двухосновная,
кислородсодержащая, слабая,
непрочная, т.к. летучая.
Двухосновная,
кислородсодержащая, слабая,
нерастворимая в воде.
Получение: СО2 + Н2О = Н2СО3
Получение: SiO2 + H2O = нельзя
Нестойкая, непрочная, при
стоянии или нагревании
разлагается:
Н2СО3 = СО2 + Н2О
Выделить в чистом виде нельзя,
т.к. при нагревании разлагается:
H2SiO3 = SiO2 + H2O
Zn + H2CO3 = ZnCO3 + H2
Незначительное выделение газа
__________
8.
Угольной кислоты- карбонаты;
- гидрокарбонаты;
Карбонаты обладают
всеми свойствами
солей, являются
сильными
электролитами,
полностью
диссоциируют на
ионы(растворимых в
воде).
Кремниевой кислоты
- силикаты;
Растворимыми
являются только соли
щелочных металлов,
остальные образуют
нерастворимые или
вообще не образуют
солей(Al+3, Cr+3, Ag+).
9.
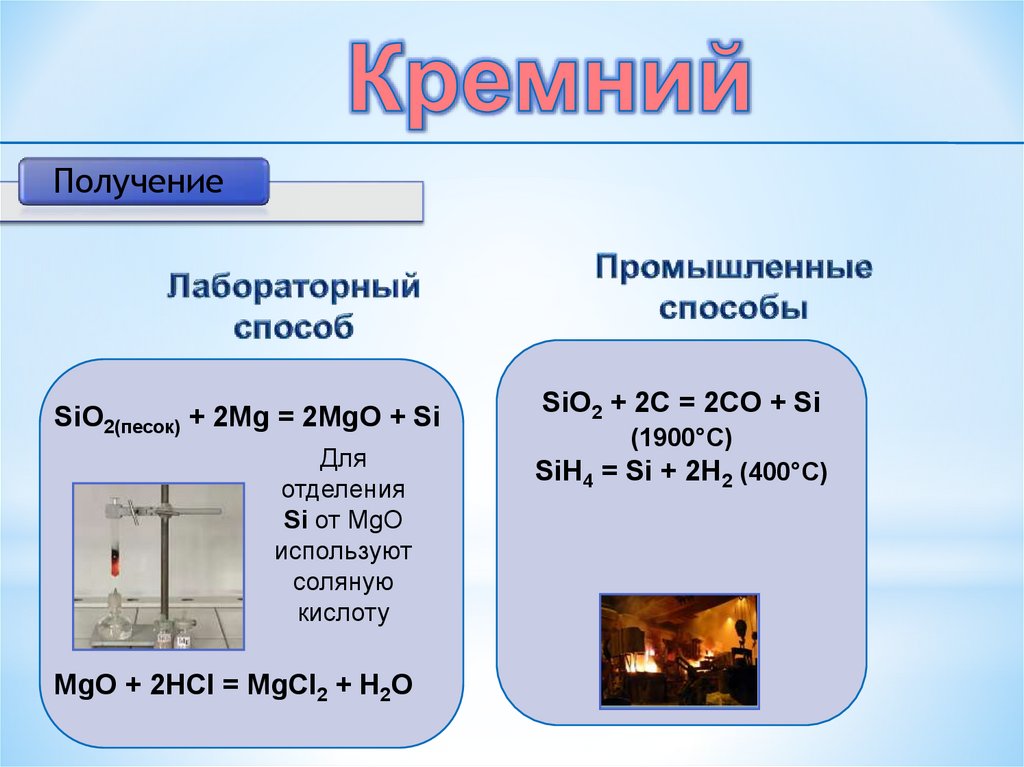
ПолучениеSiO2(песок) + 2Mg = 2MgO + Si
Для
отделения
Si от МgO
используют
соляную
кислоту
MgO + 2HCl = MgCl2 + H2O
SiO2 + 2C = 2CO + Si
(1900°C)
SiH4 = Si + 2H2 (400°C)







 Химия
Химия








