Похожие презентации:
Молекулярно-кинетическая теория идеальных газов
1. Молекулярно-кинетическая теория идеальных газов
Доцент Кравцова О.С.2. 1.Статистический и термодинамический методы
3.
4. Идеальный газ
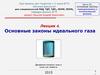
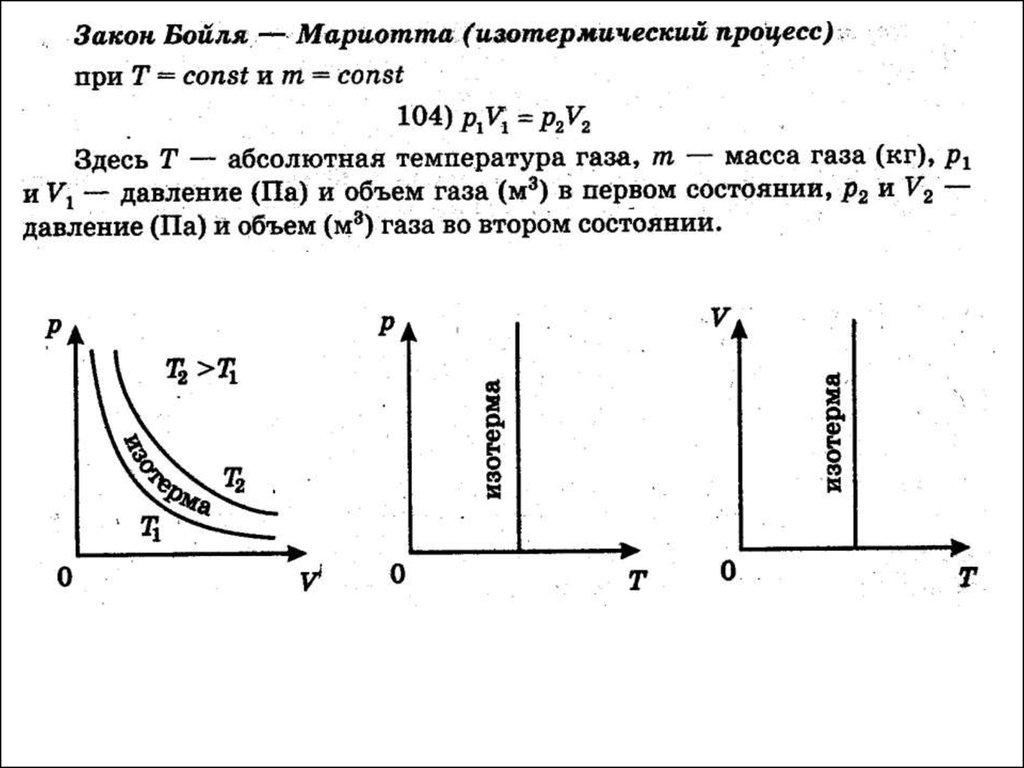
5. 2. Изопроцессы
6. Уравнение Клапейрона
PVconst
T
7.
8.
9.
10. ЗАКОН ДАЛЬТОНА: Давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
P P P Pn1 2
11. Уравнение Клапейрона – Менделеева
PVm RTm
PV RT νRT
M
P nkT
12. Основное уравнение молекулярно-кинетической теории газов
ÊÂ2
3kT
3RT
m0
M
13. Закон Максвелла о распределении молекул идеального газа по скоростям
14.
Максимум кривой на рис. 1.6 соответствуетзначению наиболее вероятной скорости
B
.
Скорости, характеризующие состояние газа
15. 1. Из формулы наиболее вероятной скорости следует, что при повышении температуры максимум функции распределения молекул по скоростям смес
1. Из формулы наиболее вероятной скорости следует, что при повышениитемпературы максимум функции распределения молекул по скоростям
сместится вправо (значение наиболее вероятной скорости становится
больше).
2. Площадь, ограниченная кривой, остается неизменной, поэтому при
повышении температуры кривая распределения молекул по скоростям
будет растягиваться и понижаться.
3. При нагревании газа доля молекул, обладающих малыми скоростями,
уменьшается, а доля молекул с большими скоростями увеличивается.
4. Площадь, ограниченная кривой распределения и осью абсцисс, равна
единице.
16. Барометрическая формула
17. Распределение Больцмана
18. Средняя длина свободного пробега молекул
19. Явление переноса
20. Теплопроводность
21. Диффузия
22. Внутреннее трение (вязкость)
23. Основы термодинамики
24. Важной характеристикой термодинамической системы является ее внутренняя энергия. Внутренняя энергия - однозначная функция термодинамиче
Важной характеристикой термодинамической системы является еевнутренняя энергия.
Внутренняя энергия - однозначная функция термодинамического
состояния системы (при переходе системы из одного состояния в другое
изменение внутренней энергии определяется разностью значений
внутренней энергии этих состояний и не зависит от пути перехода).
Положение тела в каждый момент времени характеризуется числом
степеней свободы.
Число степеней свободы молекулы – число независимых переменных
(координат), полностью определяющих положение системы в
пространстве.
Средняя энергия молекулы равна:
i
kT
2
i i ПОСТ. i ВРАЩ. 2i КОЛЕБ.
25. Внутренняя энергия для произвольной массы идеального газа:
i mU
RT
2M
26. Первое начало термодинамики
27. Закон сохранения и превращения энергии, получил название первого начала термодинамики: количество теплоты , переданное системе, идет на из
Закон сохранения и превращения энергии, получил названиепервого начала термодинамики:
Q U A
количество теплоты , переданное системе, идет на
изменение ее внутренней энергии и на совершение системой
работы .
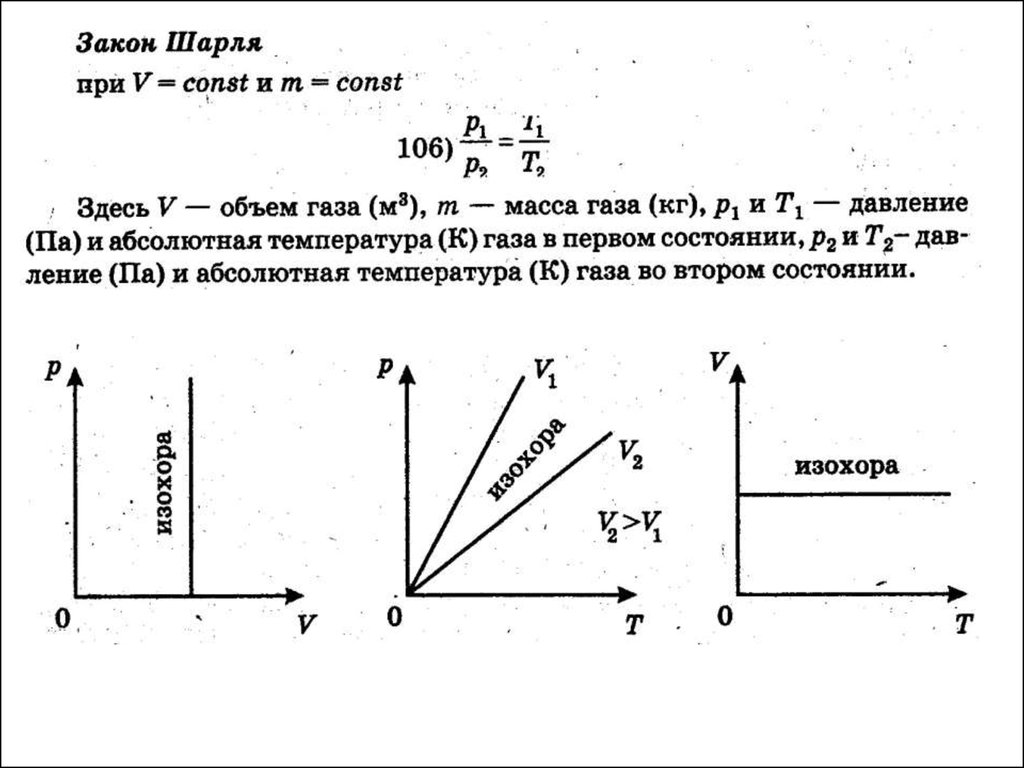
28. Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
δQc
mdT
29. Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
δQCm
νdT
Связь удельной и молярной теплоемкости:
C m cM
30. Уравнение Майера
CP CV Ri 2
CP
R
2
i
CV R
2
CP i 2
CV
i
- постоянная Пуассона.
31. Применение первого начала термодинамики к изопроцессам.
32. Изотермический процесс.
Q AV2
V2
1
1
m
dV m
V2 m
P1
A PdV RT
RT ln
RT ln
V M
V1 M
P2
V
VM
33. Изобарный процесс.
mm
Q CV R T P V CP T
M
M
34. Изохорный процесс.
Q Um
U CV T
M
35. Адиабатный процесс - процесс, при котором отсутствует теплообмен между системой и окружающей средой. Все быстропротекающие процессы можно
Адиабатный процесс - процесс, при котором отсутствуеттеплообмен между системой и окружающей средой.
Q 0
Все быстропротекающие процессы можно отнести к
адиабатным.
Адиабатный процесс описывается уравнением Пуассона
γ
PV const
TV
γ 1
A U
const
T γ P γ 1 const
Рис. Адиабатный процесс
36. Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой пр
Термодинамический процесс называется обратимым, еслион может происходить как в прямом, так и в обратном
направлении. Причем, если такой процесс происходит
сначала в прямом, а затем в обратном направлении и система
возвращается в исходное состояние, то в окружающей среде и
в этой системе не происходит никаких изменений.
Всякий процесс, не удовлетворяющий этим условиям,
является необратимым.
37. Энтропией называется функция состояния системы, дифференциалом которой является :
δQdS
T
38. Для обратимых процессов изменение энтропии: - это выражение называется равенство Клаузиуса.
Для обратимых процессов изменениеэнтропии:
ΔS обр 0, т.к.
dQобр
T
0
- это выражение называется равенство
Клаузиуса.
39. это неравенство Клаузиуса. При любом необратимом процессе в замкнутой системе энтропия возрастает (dS > 0).
dQT 0
ΔSнеобр 0
это неравенство Клаузиуса.
При любом необратимом процессе в замкнутой системе энтропия
возрастает (dS > 0).
40. Тогда для замкнутой системы – математическая запись второго начала термодинамики.
Таким образом, для произвольного процесса,Q
S
,
T
где, знак равенства – для обратимого процесса;
знак больше для необратимого.
Тогда для замкнутой системы
dS 0
– математическая запись второго начала
термодинамики.
41.
Изменение энтропии в изопроцессах:Изохорический
процесс:
T2
m
ΔS CV ln ,
μ
T1
Изобарический
процесс:
m
T2
ΔS C p ln ,
μ
T1
Изотермический ΔS mR ln V2 ,
V1
процесс:
Адиабатический
процесс:
т.к.
V1 V2
т.к.
P1 = P2
т.к. Т1 = Т2
то ΔS 0,
изоэнтропийный процесс
dQ 0,
42. Второе начало термодинамики
1) по Кельвину: невозможен круговой процесс,единственным результатом которого является
превращение теплоты, полученной от нагревателя, в
эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс,
единственным результатом которого является
передача теплоты от менее нагретого тела к телу более
нагретому.
43. Математической формулировкой второго начала является выражение Энтропия замкнутой системы при любых происходивших в ней процессах не мо
Математической формулировкой второго началаявляется выражение
dS 0
Энтропия замкнутой системы при любых
происходивших в ней процессах не может убывать
(или увеличивается или остается неизменной).
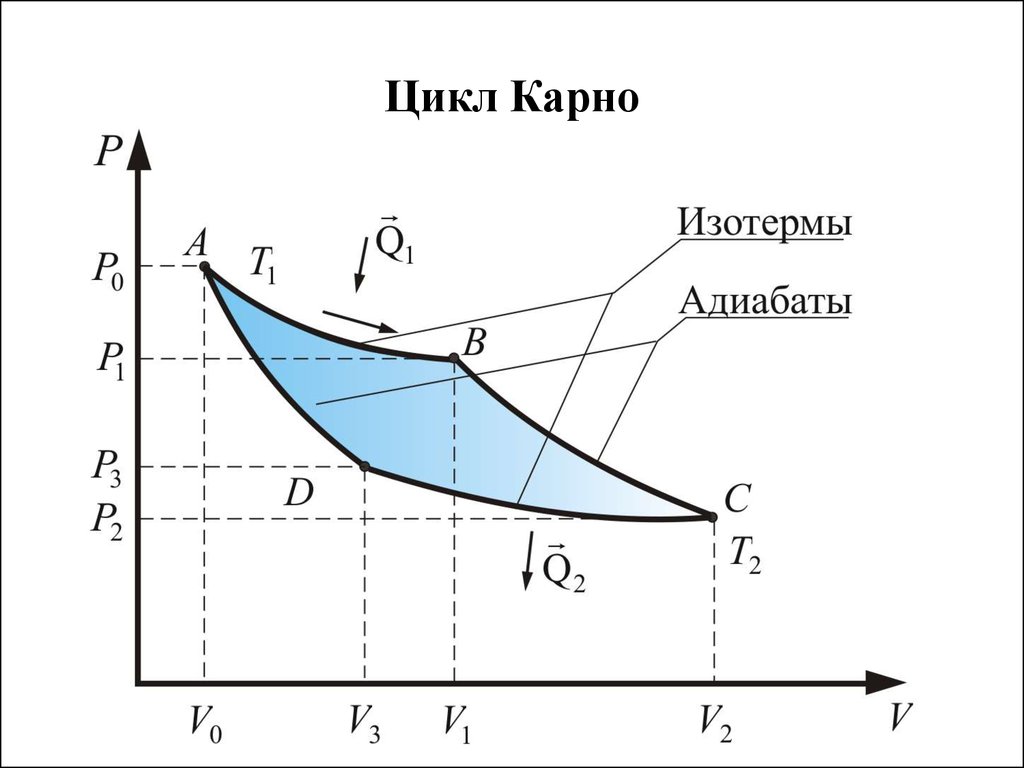
44. Цикл Карно
45. Следствия: 1). КПД цикла Карно не зависит от рода рабочего тела. 2). КПД определяется только разницей температур нагревателя и холодильника. 3)
Следствия:1). КПД цикла Карно не зависит от рода рабочего тела.
2). КПД определяется только разницей температур
нагревателя и холодильника.
3). КПД не может быть 100% даже у идеальной тепловой
машины.
4). Невозможно создать вечный двигатель второго рода,
работающий в тепловом равновесии без перепада температур.









































 Физика
Физика