Похожие презентации:
Структура и функции аминокислот с полярным (заряженным отрицательно) радикалом
1.
Структура и функции аминокислотс полярным (заряженным
отрицательно ) радикалом. Роль
этих аминокислот в обеспечении
специфических функций белков.
Амфотерные свойства аминокислот.
Шамитова Елена Николаевна, к.б.н., доцент
2.
Аминокислоты с полярным (заряженнымотрицательно) радикалом
К этой группе относят аспарагиновую и
глутаминовую аминокислоты, имеющие в
радикале дополнительную карбоксильную группу,
при рН около 7,0 диссоциирующую с образованием
СОО- и Н+. Следовательно, радикалы данных
аминокислот - анионы. Ионизированные формы
глутаминовой и аспарагиновой кислот называют
соответственно глутаматом и аспартатом. Все они
гидрофильны
3.
4.
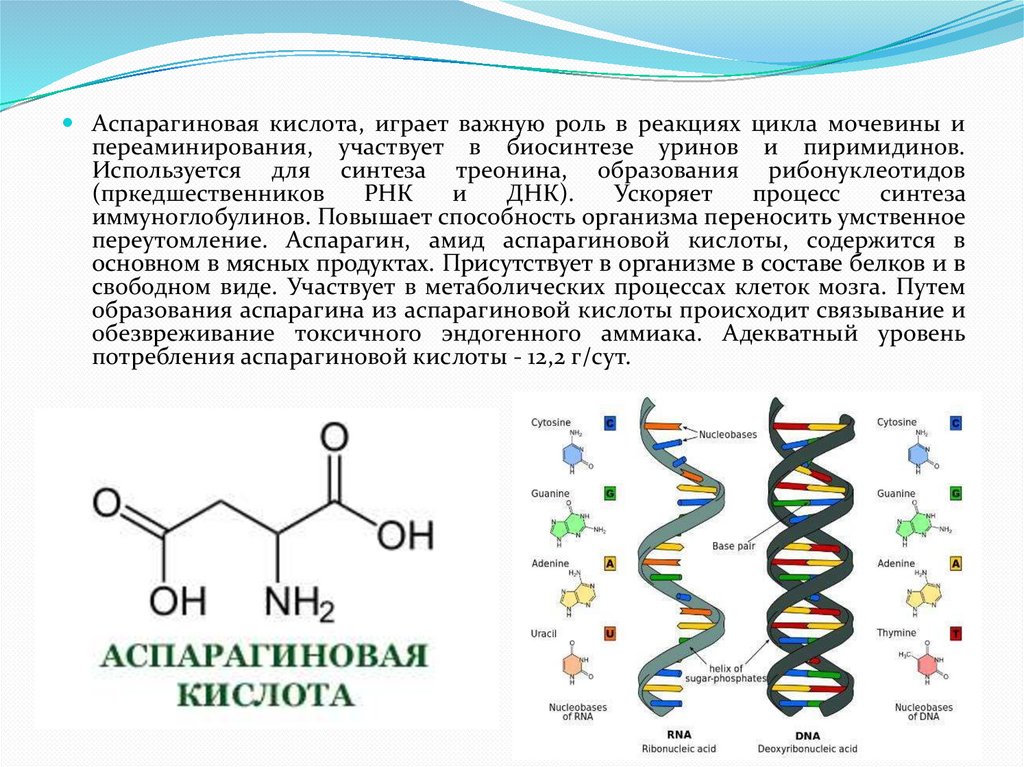
Аспарагиновая кислота, играет важную роль в реакциях цикла мочевины ипереаминирования, участвует в биосинтезе уринов и пиримидинов.
Используется для синтеза треонина, образования рибонуклеотидов
(пркедшественников
РНК
и
ДНК).
Ускоряет
процесс
синтеза
иммуноглобулинов. Повышает способность организма переносить умственное
переутомление. Аспарагин, амид аспарагиновой кислоты, содержится в
основном в мясных продуктах. Присутствует в организме в составе белков и в
свободном виде. Участвует в метаболических процессах клеток мозга. Путем
образования аспарагина из аспарагиновой кислоты происходит связывание и
обезвреживание токсичного эндогенного аммиака. Адекватный уровень
потребления аспарагиновой кислоты - 12,2 г/сут.
5.
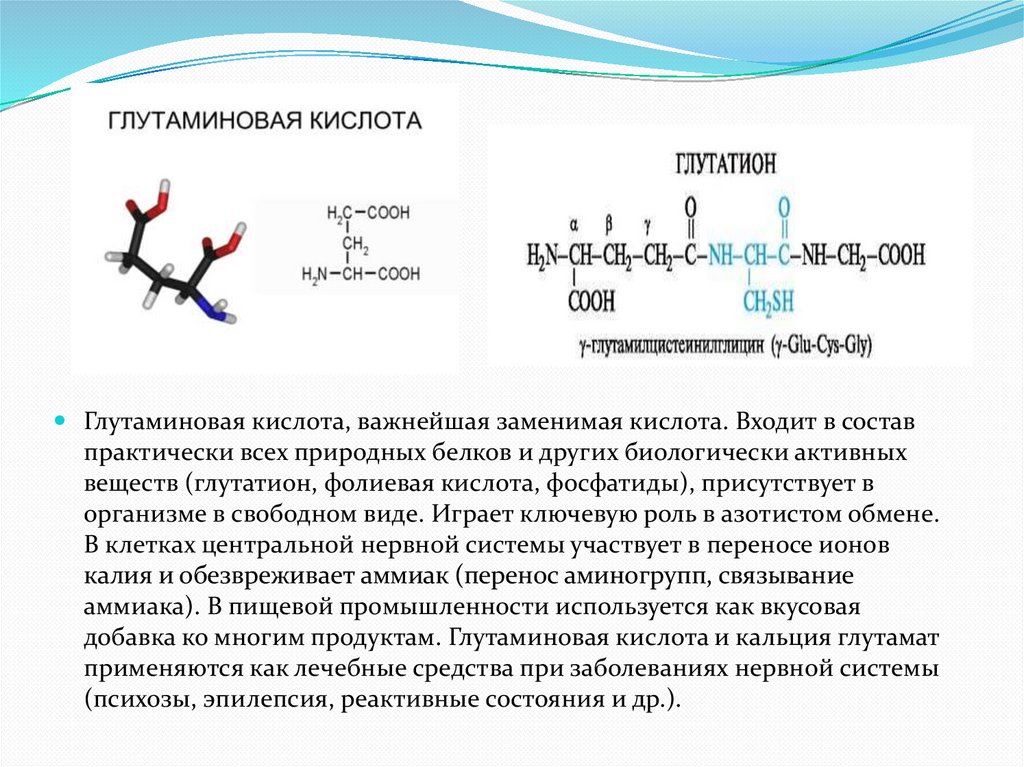
Глутаминовая кислота, важнейшая заменимая кислота. Входит в составпрактически всех природных белков и других биологически активных
веществ (глутатион, фолиевая кислота, фосфатиды), присутствует в
организме в свободном виде. Играет ключевую роль в азотистом обмене.
В клетках центральной нервной системы участвует в переносе ионов
калия и обезвреживает аммиак (перенос аминогрупп, связывание
аммиака). В пищевой промышленности используется как вкусовая
добавка ко многим продуктам. Глутаминовая кислота и кальция глутамат
применяются как лечебные средства при заболеваниях нервной системы
(психозы, эпилепсия, реактивные состояния и др.).
6.
Амфотерность аминокислотВсе аминокислоты — амфотерные соединения, они могут
проявлять как кислотные свойства, обусловленные
наличием в их молекулах карбоксильной группы —COOH,
так и основные свойства, обусловленные аминогруппой —
NH2. Аминокислоты взаимодействуют с кислотами и
щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH
(хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —
COONa (натриевая соль глицина)
7.
Растворы аминокислот в воде благодаря этому обладают свойствамибуферных растворов, то есть находятся в состоянии внутренних солей.
NH2 —CH2COOH N+H3 —CH2COO Аминокислоты обычно могут вступать во все реакции, характерные для
карбоновых кислот и аминов.
При растворении в воде кристаллическая аминокислота, например
аланин, может реагировать или как кислота(донор протона):
или как основание (акцептор протона):






 Химия
Химия








