Похожие презентации:
Химия аминокислот, пептидов и белков
1.
Лекция для студентов 1 курса лечебного,педиатрического и стоматологического факультетов
Составитель: Трофимова С.Р.
ХИМИЯ
АМИНОКИСЛОТ, ПЕПТИДОВ
И БЕЛКОВ
2. План лекции
1.2.
3.
4.
5.
6.
Аминокислоты. Определение, строение, виды классификаций.
Свойства аминокислот: амфотерность, образование цвиттериона, образование комплекса с медью, реакция с нингидрином и
азотистой кислотой, биологически важные реакции:
дезаминирование, трансаминирование, декарбоксилирование,
Пептиды, полипептиды, образование пептидов. Биологически
важные пептиды.
Белки: определение, структуры, связи, участвующие в
стабилизации структуры молекулы белка, формы белковых
молекул.
Свойства белков: амфотерность, растворимость, факторы,
стабилизирующие белки в растворе, изоэлектрическое
состояние, изоэлектрическая точка.
Классификация и роль белков
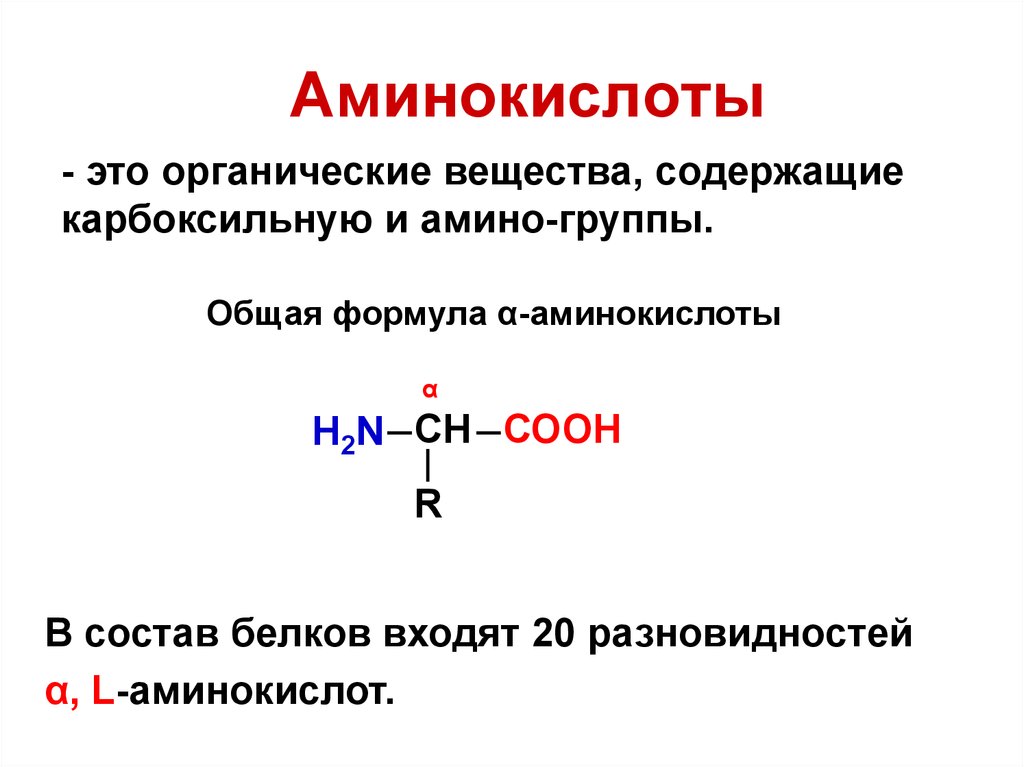
3. Аминокислоты
- это органические вещества, содержащиекарбоксильную и амино-группы.
Общая формула α-аминокислоты
α
H2N СН СООН
R
В состав белков входят 20 разновидностей
α, L-аминокислот.
4.
Классификации аминокислот1) по полярности и заряду радикала
(рациональная)
Полярные (с гидрофильным радикалом)
Положительно- Отрицательнозаряженные
заряженные
Незаряженные
1. Лизин
2. Аргинин
3. Гистидин
1. Глицин
2. Серин
3. Треонин
4. Тирозин
5. Цистеин
6. Аспарагин
7. Глутамин
1. Аспарагиновая кислота
2. Глутаминовая
кислота
Неполярные
(с гидрофобным
радикалом)
1. Аланин
2. Валин
3. Лейцин
4. Изолейцин
5. Пролин
6. Фенилаланин
7. Триптофан
8. Метионин
5.
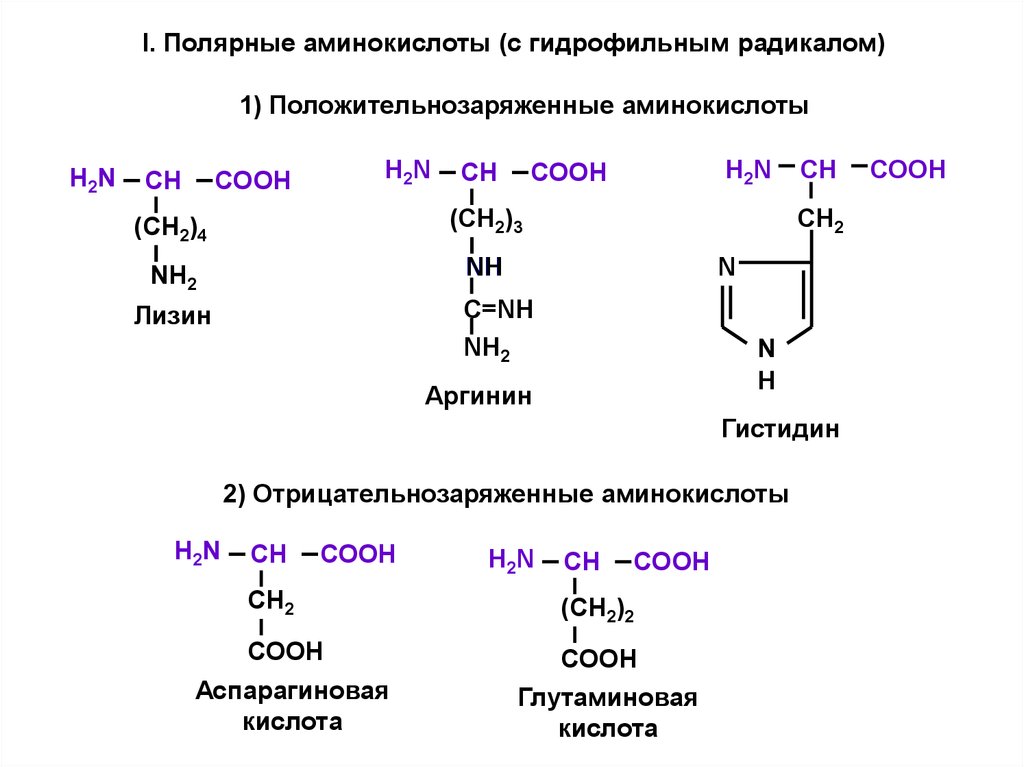
I. Полярные аминокислоты (с гидрофильным радикалом)1) Положительнозаряженные аминокислоты
H2N
СН
H2N
СООН
СН
СООН
(СН2)4
(СН2)3
NН2
NН
H2N
СН2
N
C=NH
NH2
Лизин
СН
N
H
Аргинин
Гистидин
2) Отрицательнозаряженные аминокислоты
H2N
СН
СООН
СН2
СООН
Аспарагиновая
кислота
H2N
СН
СООН
(СН2)2
СООН
Глутаминовая
кислота
СООН
6.
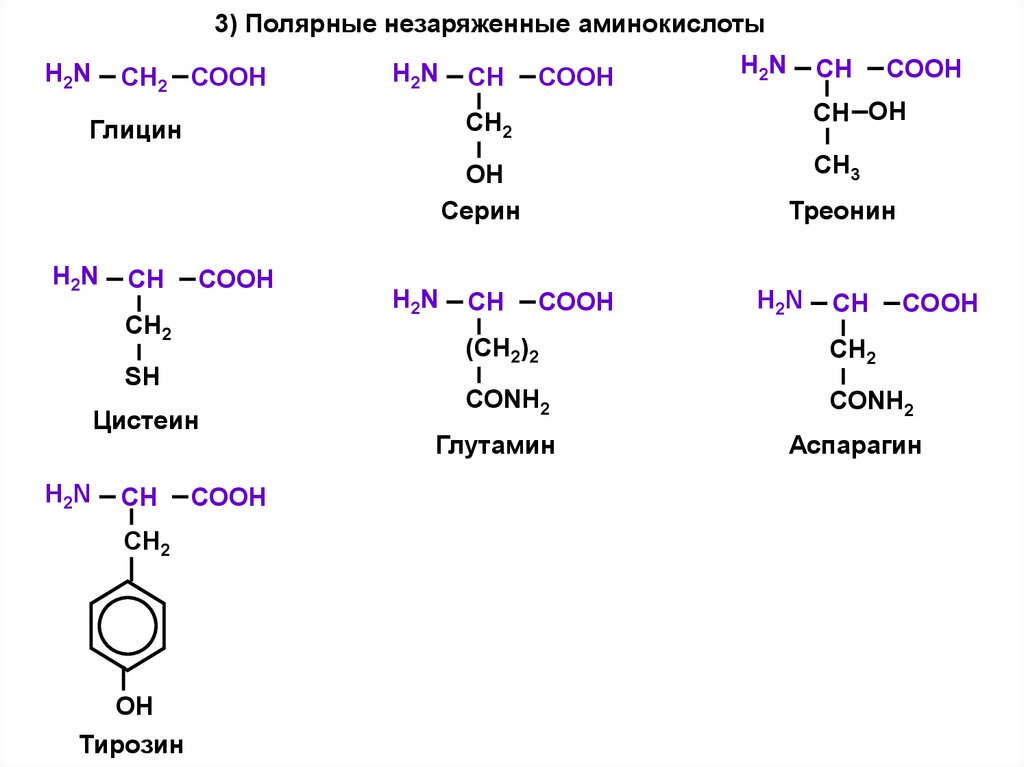
3) Полярные незаряженные аминокислотыСН2 СООН
H2N
H2N
СН
СООН
CH3
ОН
Серин
СН
СООН
СН2
SН
Цистеин
H2N
СН
СH2
ОН
Тирозин
СООН
H2N
СН
СООН
СH ОH
СН2
Глицин
H2N
СН
H2N
Треонин
СООН
H2N
СН
СООН
(СН2)2
СН2
СОNH2
СОNH2
Глутамин
Аспарагин
7.
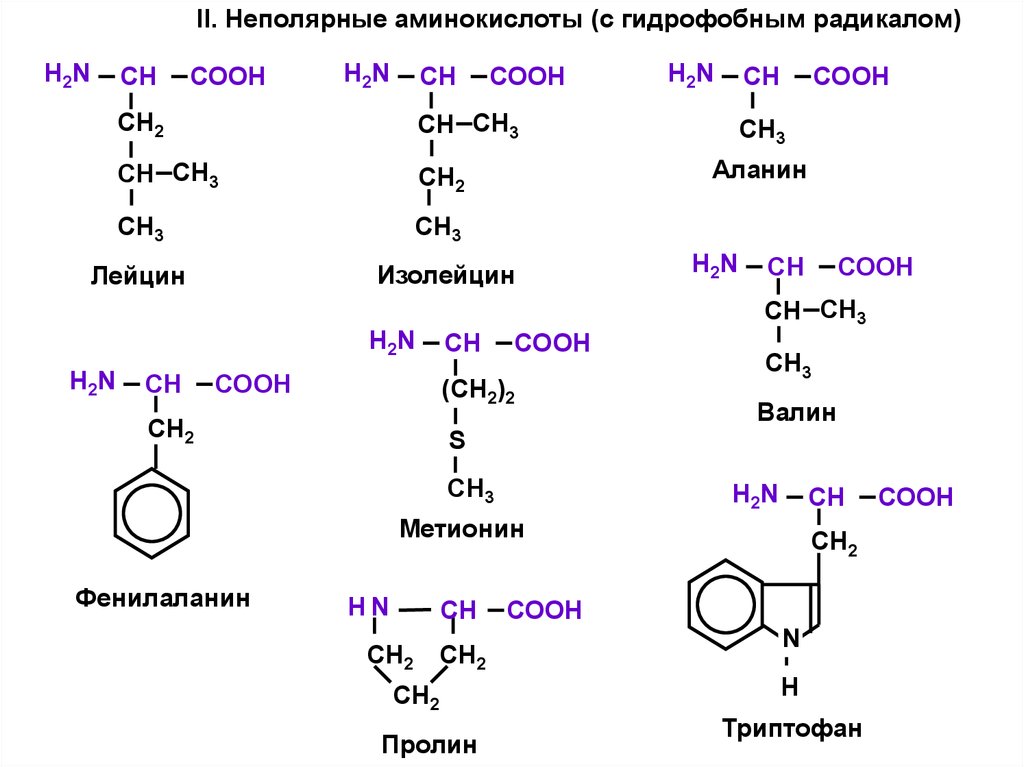
II. Неполярные аминокислоты (с гидрофобным радикалом)H2N
СН
СООН
СН
H2N
СООН
СН2
СH CH3
СH CH3
CH2
CH3
CH3
СООН
CH3
Аланин
Изолейцин
Лейцин
СН
H2N
H2N
СН
СООН
СH CH3
СН
H2N
H2N
СН
СООН
СООН
(СН2)2
СH2
CH3
Валин
S
CH3
СН
H2N
Метионин
Фенилаланин
СН
HN
CH2
CH2
СН2
Пролин
СH2
СООН
N
H
Триптофан
СООН
8.
2) По числу карбоксильных групп и аминогруппНейтральные
Основные
Кислые
1 NH2 и 1 СООН
группы
2 NH2 и 1 СООН
группы
1 NH2 и 2 СООН
группы
1) Глицин
2) Аланин
3) Валин
4) Лейцин
5) Изолейцин
6) Цистеин
7) Серин
8) Треонин и др.
1) Лизин
2) Орнитин
3) Аргинин
1) Аспарагиновая
кислота
2) Глутаминовая
кислота
9.
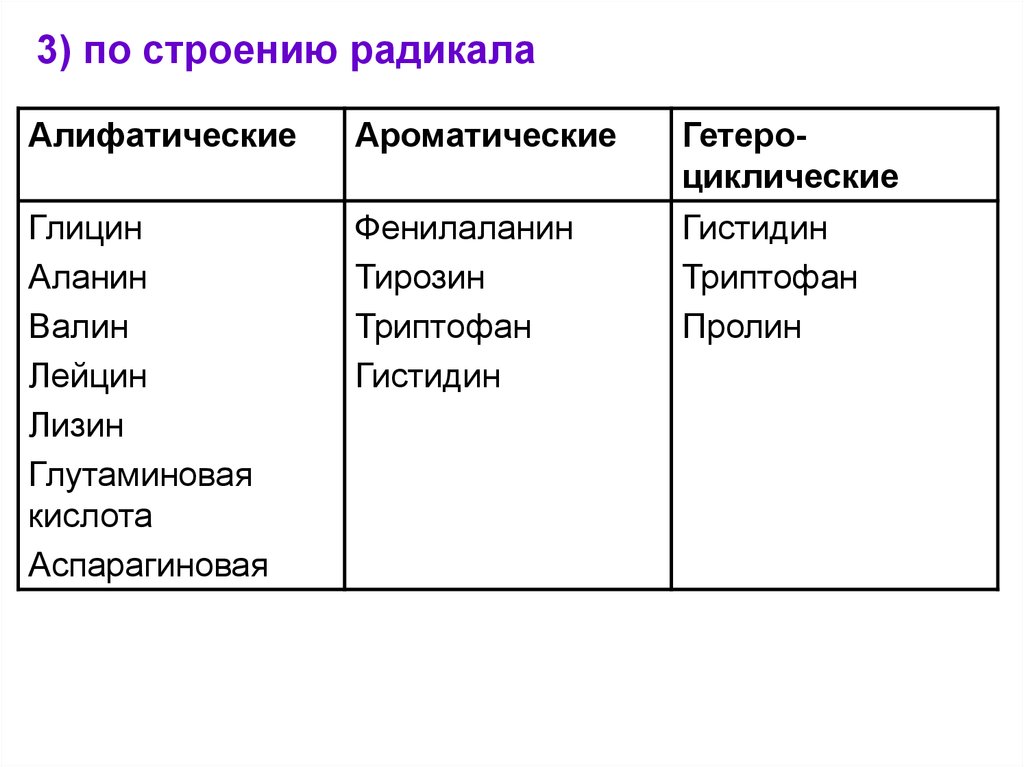
3) по строению радикалаАлифатические
Ароматические
Гетероциклические
Глицин
Аланин
Валин
Лейцин
Лизин
Глутаминовая
кислота
Аспарагиновая
Фенилаланин
Тирозин
Триптофан
Гистидин
Гистидин
Триптофан
Пролин
10.
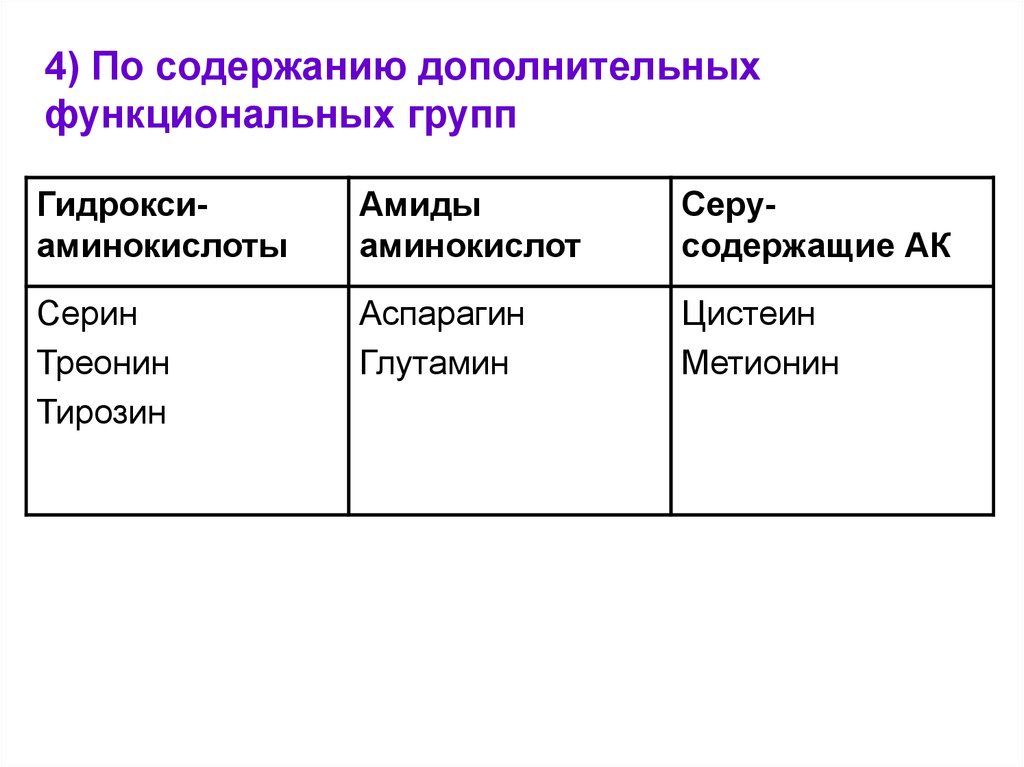
4) По содержанию дополнительныхфункциональных групп
Гидроксиаминокислоты
Амиды
аминокислот
Серусодержащие АК
Серин
Треонин
Тирозин
Аспарагин
Глутамин
Цистеин
Метионин
11.
5) Биологическая классификацияЗаменимые
1. Глицин
2. Аланин
3. Серин
4. Аспарагиновая кислота
5. Глутаминовая кислота
6. Аспарагин
7. Глутамин
8. Пролин
Условно заменимые
1. Цистеин
2. Тирозин
Абсолютно незаменимые
1. Валин
2. Лейцин
3. Изолейцин
4. Треонин
5. Метионин
6. Лизин
7. Триптофан
8. Фенилаланин
Условно незаменимые
1. Аргинин
2. Гистидин
12.
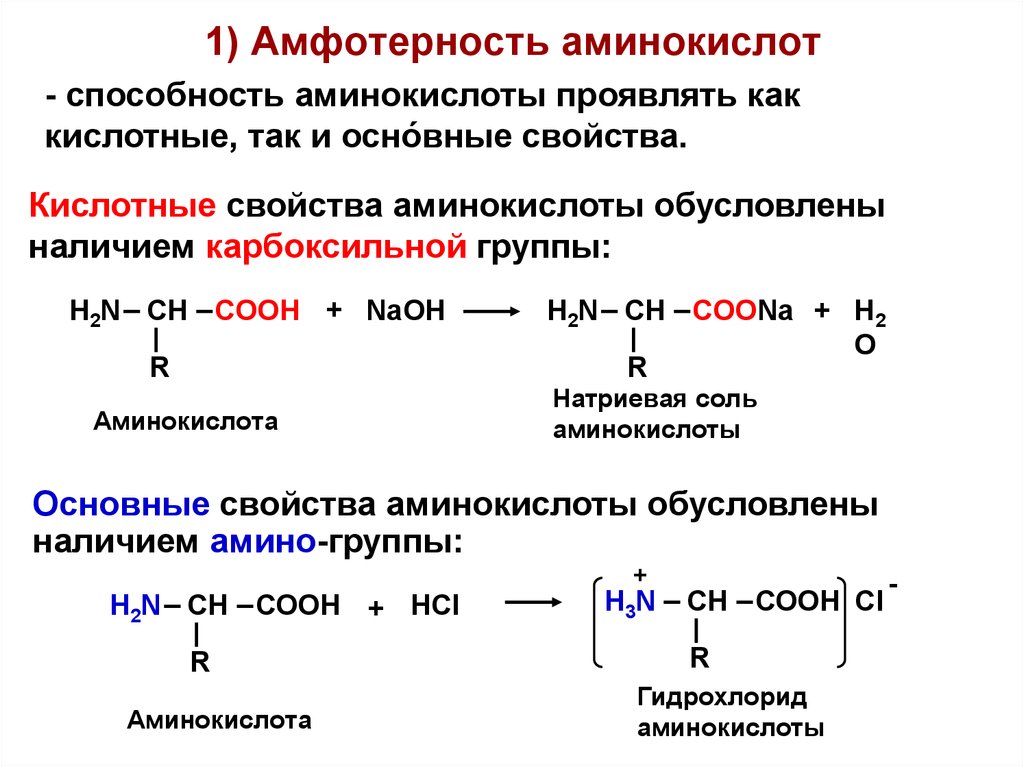
Свойства аминокислот13. 1) Амфотерность аминокислот
- способность аминокислоты проявлять каккислотные, так и осно́вные свойства.
Кислотные свойства аминокислоты обусловлены
наличием карбоксильной группы:
H2N СН СООН + NaOH
R
Аминокислота
H2N СН СООNa + Н2
О
R
Натриевая соль
аминокислоты
Основные свойства аминокислоты обусловлены
наличием амино-группы:
H2N СН СООН + HCl
R
Аминокислота
+
H 3N
СН СООН Cl
R
Гидрохлорид
аминокислоты
-
14.
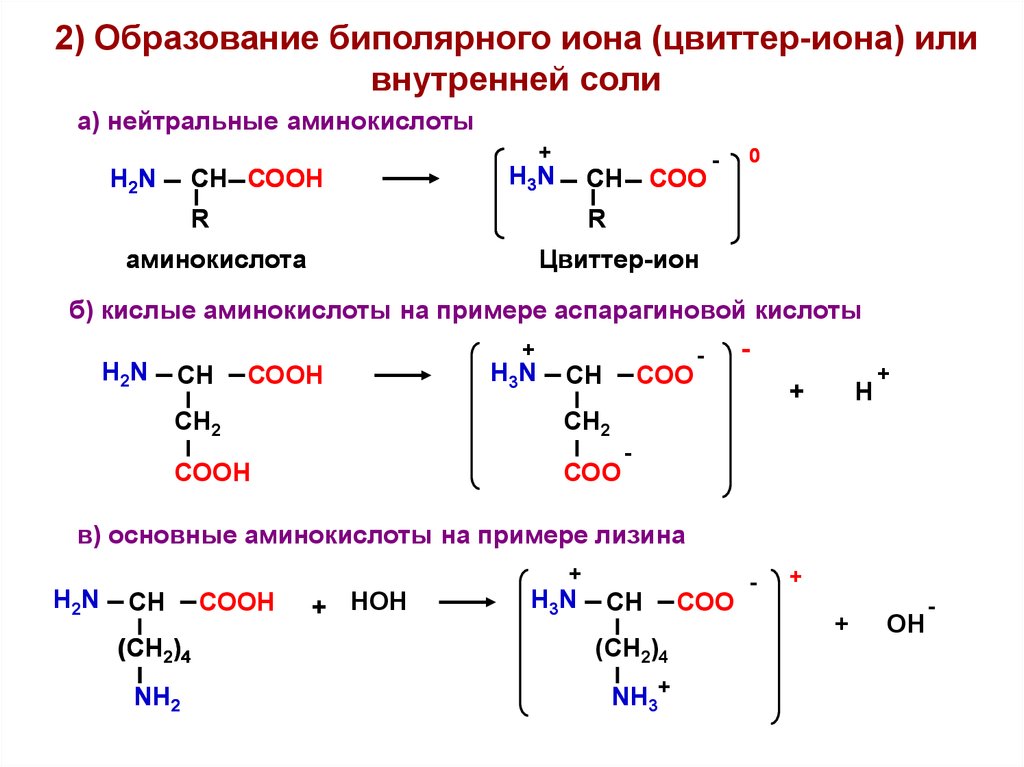
2) Образование биполярного иона (цвиттер-иона) иливнутренней соли
а) нейтральные аминокислоты
СН СООН
H2N
+
СН
H3N
R
СОО
-
0
R
аминокислота
Цвиттер-ион
б) кислые аминокислоты на примере аспарагиновой кислоты
+
H2N СН СООН
+
H3N СН СОО
+
Н
СН2
СН2
СООН
СОО
-
в) основные аминокислоты на примере лизина
+
H2N
СН
(СН2)4
NН2
СООН
+ НОН
H3N
СН
(СН2)4
NН3+
СОО
-
+
+
ОН
-
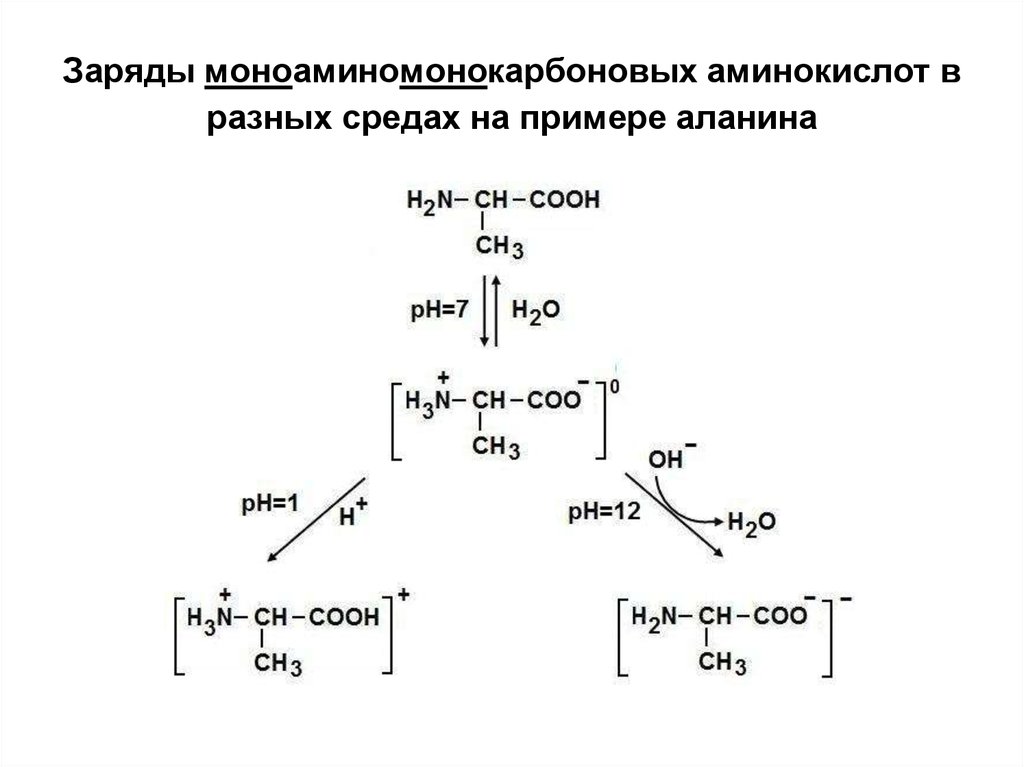
15. Заряды моноаминомонокарбоновых аминокислот в разных средах на примере аланина
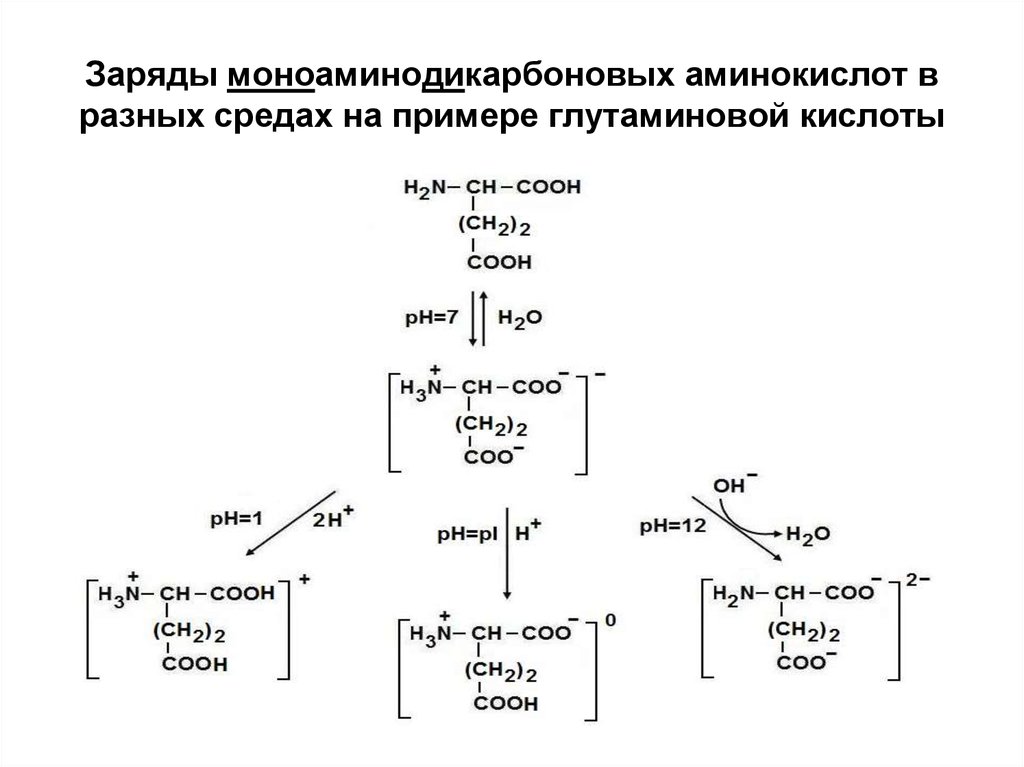
16. Заряды моноаминодикарбоновых аминокислот в разных средах на примере глутаминовой кислоты
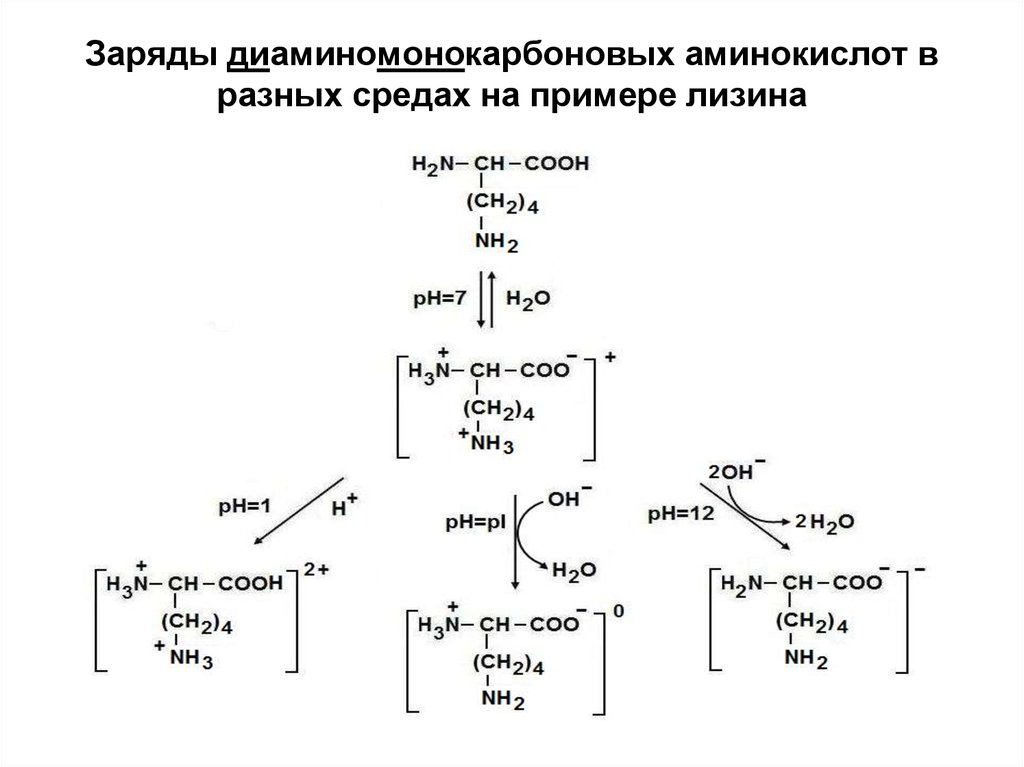
17. Заряды диаминомонокарбоновых аминокислот в разных средах на примере лизина
18.
3) Образование комплексной (хелатной) солимеди (II) с α-аминокислотами
R
R
α-Аминокислота
+ Cu(ОН)2
O
СН СООН
О
2 H2N
- 2Н2О
C
HC
R
H2N
..
Cu
..
NH2
CH
C
О
O
Комплексная соль меди (II)
с α-аминокислотой
синего цвета
19.
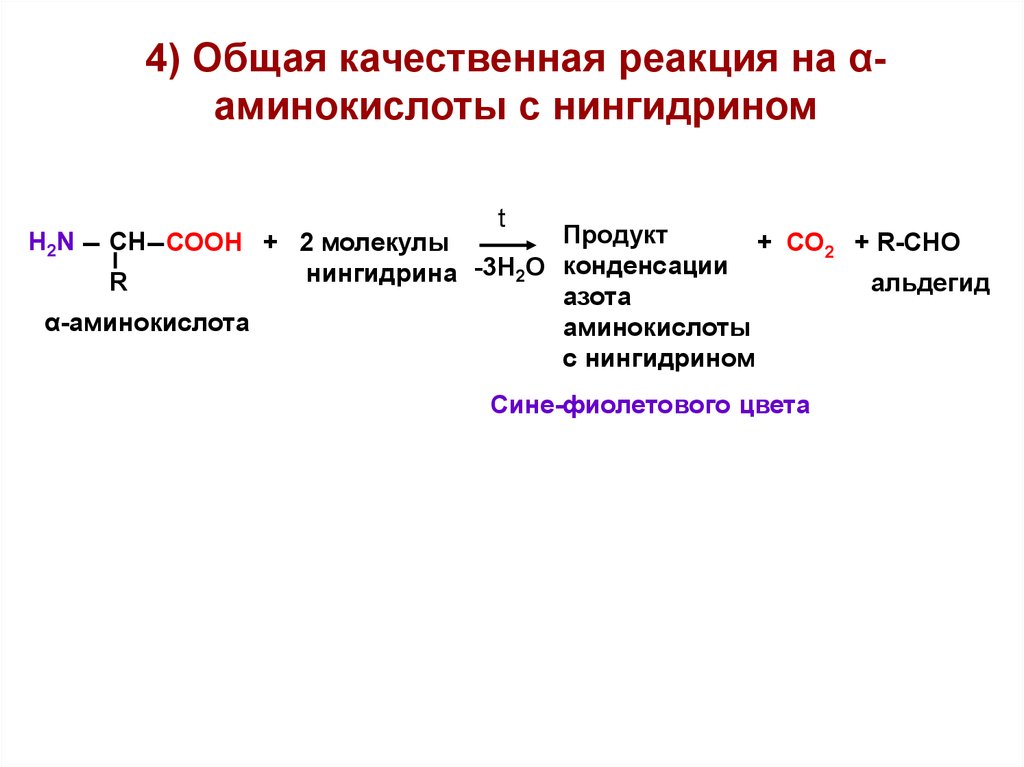
4) Общая качественная реакция на αаминокислоты с нингидриномt
Продукт
СН СООН + 2 молекулы
+ СО2 + R-СНО
нингидрина -3Н2О конденсации
R
альдегид
азота
α-аминокислота
аминокислоты
с нингидрином
H2N
Сине-фиолетового цвета
20.
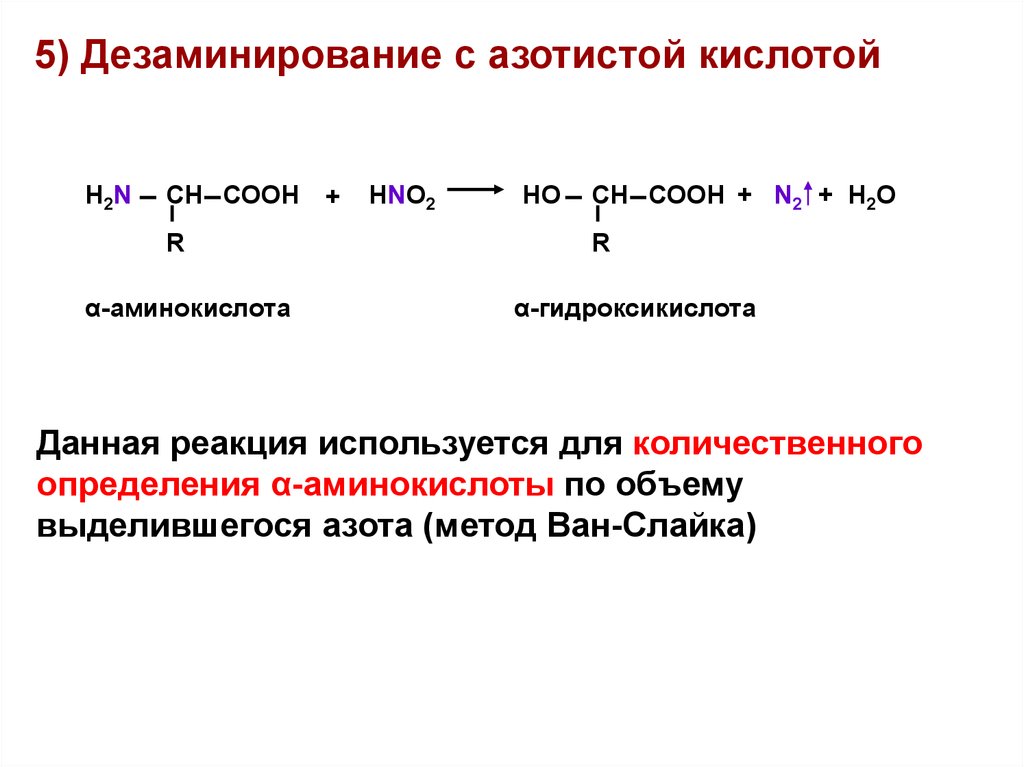
5) Дезаминирование с азотистой кислотойH2N
СН СООН
R
α-аминокислота
+
HNO2
HO
СН СООН + N2 + H2O
R
α-гидроксикислота
Данная реакция используется для количественного
определения α-аминокислоты по объему
выделившегося азота (метод Ван-Слайка)
21. Общие пути превращения аминокислот в организме животных и человека
1. Дезаминирование2. Трансаминирование
3. Декарбоксилирование
22.
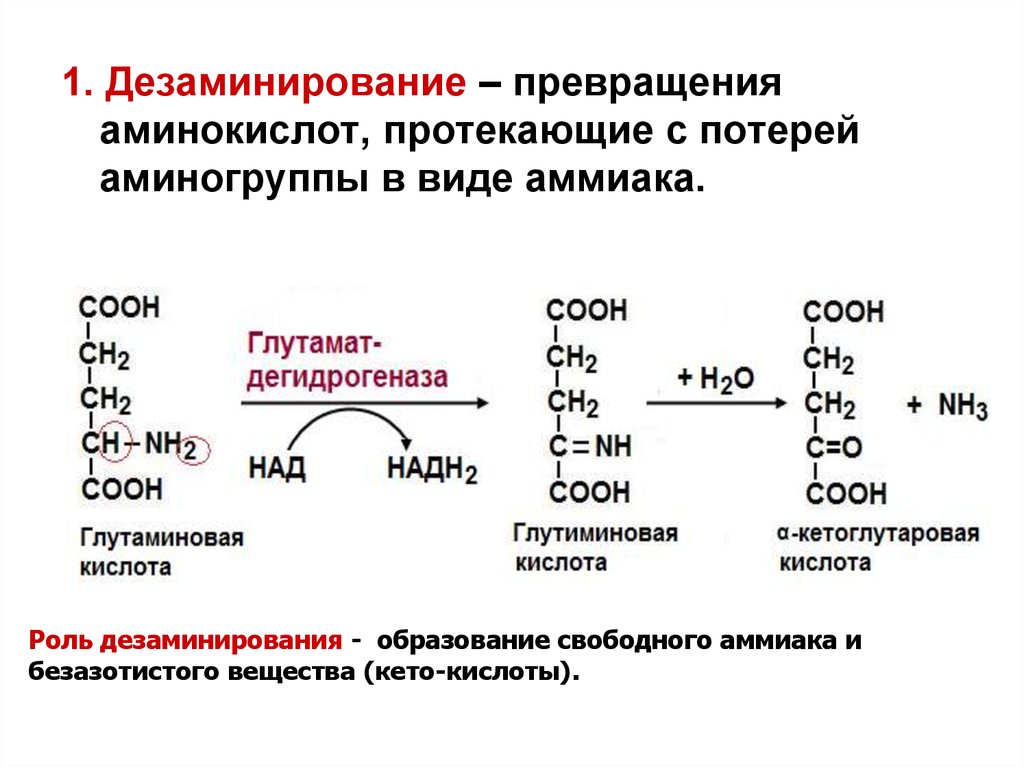
1. Дезаминирование – превращенияаминокислот, протекающие с потерей
аминогруппы в виде аммиака.
Роль дезаминирования - образование свободного аммиака и
безазотистого вещества (кето-кислоты).
23.
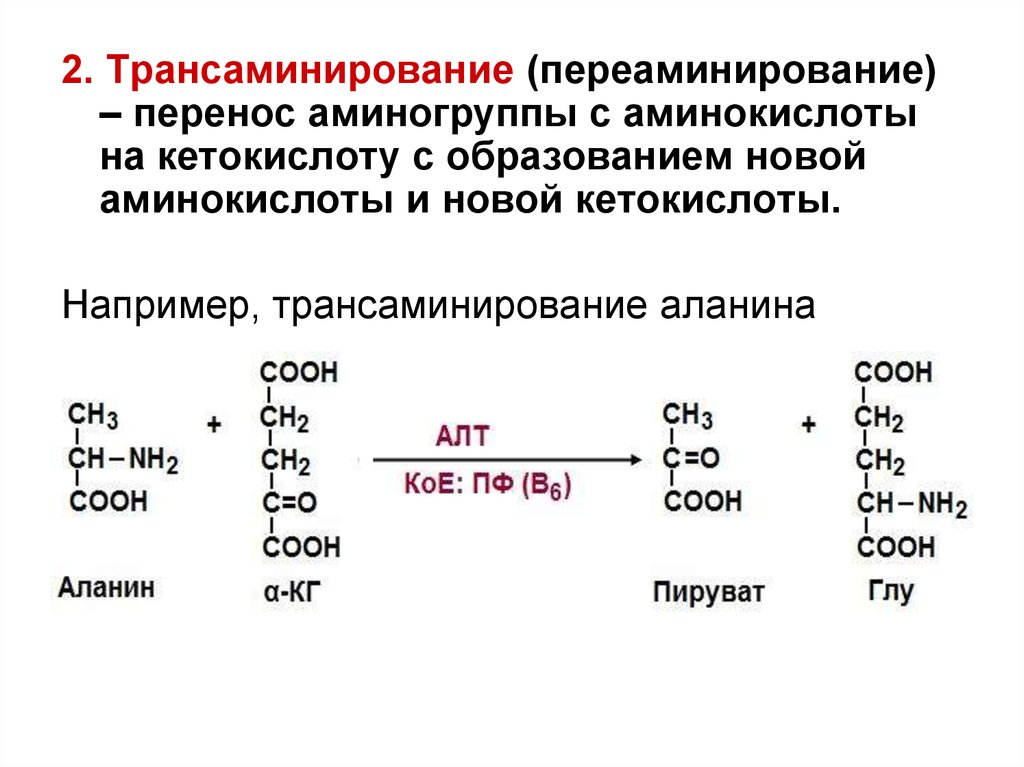
2. Трансаминирование (переаминирование)– перенос аминогруппы с аминокислоты
на кетокислоту с образованием новой
аминокислоты и новой кетокислоты.
Например, трансаминирование аланина
24.
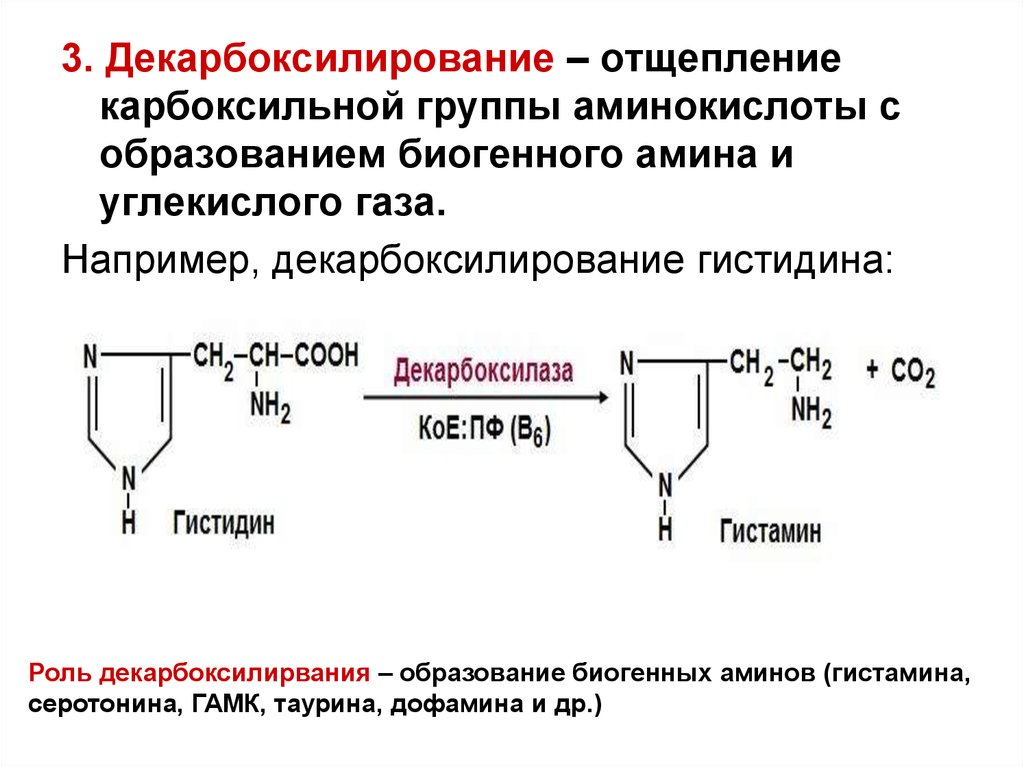
3. Декарбоксилирование – отщеплениекарбоксильной группы аминокислоты с
образованием биогенного амина и
углекислого газа.
Например, декарбоксилирование гистидина:
Роль декарбоксилирвания – образование биогенных аминов (гистамина,
серотонина, ГАМК, таурина, дофамина и др.)
25.
ПептидыПептиды - это органические вещества, содержащие в
своем составе от 2 до 10 аминокислотных остатка,
соединенных пептидными связями
Полипептиды - это органические вещества,
содержащие в своем составе более 10 АК остатка.
Белки – полипептиды, содержащие более 50 АК
остатков.
26.
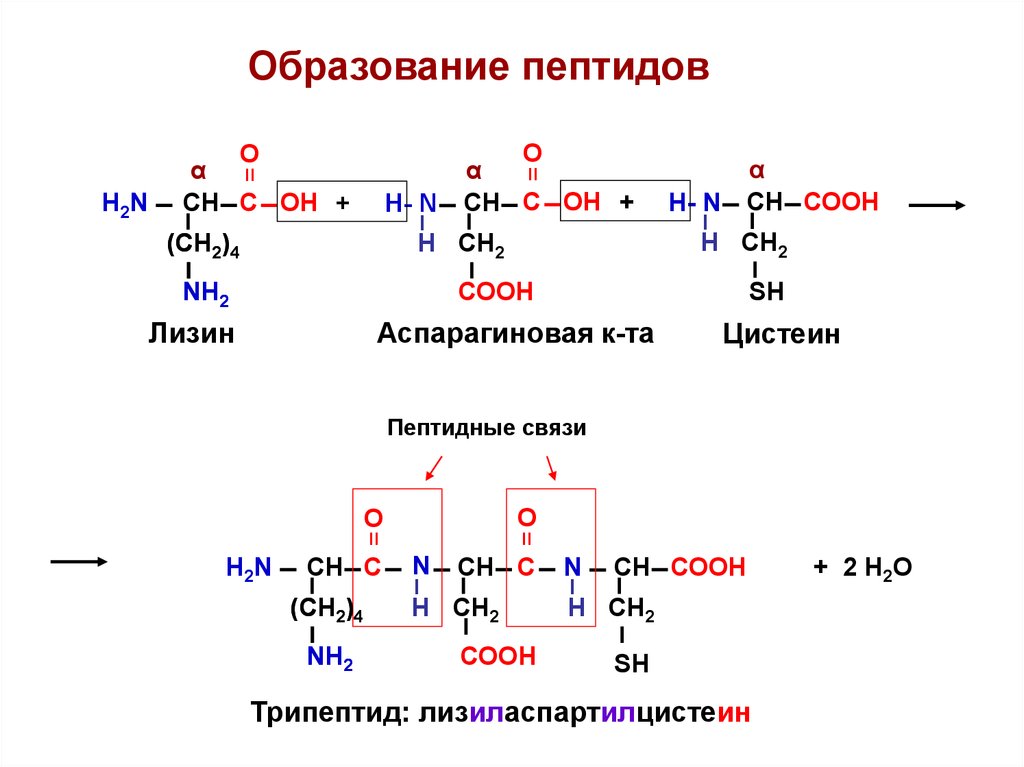
Образование пептидов=
=
_
(СН2)4
Н СН2
Н СН2
СООН
NН2
Лизин
SH
Аспарагиновая к-та
Цистеин
Пептидные связи
О
(СН2)4
NН2
N
СН С
Н СН2
СООН
N
_
СН С
_
H2N
=
О
=
H2N
α
H- N СН СООН
_
О
α
H- N СН С ОН +
О
α
СН С ОН +
СН СООН
Н СН2
SH
Трипептид: лизиласпартилцистеин
+ 2 Н2О
27. Белки
– высокомолекулярныеазотсодержащие биополимеры
(полипептиды), построенные из αаминокислот, соединенных друг с
другом при помощи пептидных
связей.
Элементарный состав белков
• Углерод – 52%
• Кислород – 22%
• Азот – 16%
• Сера – 1%
28. Строение белковых молекул
Первичная структура – линейное последовательноерасположение аминокислотных остатков, связанных
между собой пептидными связями.
=
R1
Н
СН С
N
R2
Н
СН С
R2
…
N
_
N
_
N-конец
СН С
_
H2N
О
=
О
=
О
Н
СН СООН
Rn
С-конец
Пептидные связи
Первичная структура белка
• уникальна и детерминирована генетически
• придает белку видовую специфичность
• определяет дальнейшую структурную организацию
29.
Секвенирование – определение первичнойструктуры белка путем последовательного
отщепления α-аминокислот с N-конца
полипептида по методу Эдмана.
Секвенирование проводят в автоматическом
приборе секвенаторе.
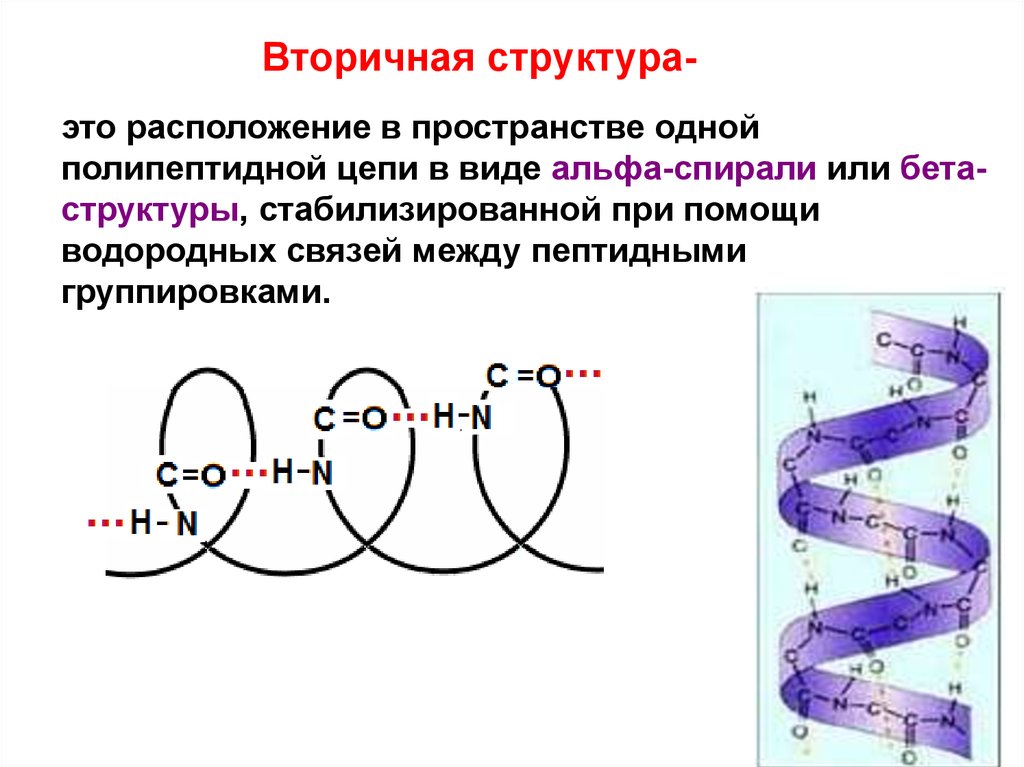
30. Вторичная структура-
Вторичная структураэто расположение в пространстве однойполипептидной цепи в виде альфа-спирали или бетаструктуры, стабилизированной при помощи
водородных связей между пептидными
группировками.
31. Третичная структура -
Третичная структура это расположение в пространстве однойполипептидной цепи, стабилизированной
связями между радикалами аминокислот:
• водородными,
• дисульфидными,
• ионными,
• Ван-дер-Ваальсовыми силами,
• гидрофобными взаимодействиями.
32. Четвертичная структура-
Четвертичная структураЭто расположение в пространстве несколькихполипептидных цепей, соединенных между
собой нековалентными межрадикальными
связями. В итоге образуется единая
функциональная система.
Каждая отдельная цепь называется протомером
(субъединицей).
• Белок, состоящий из протомеров, называется
олигомерным белком (н-р: гемоглобин).
33.
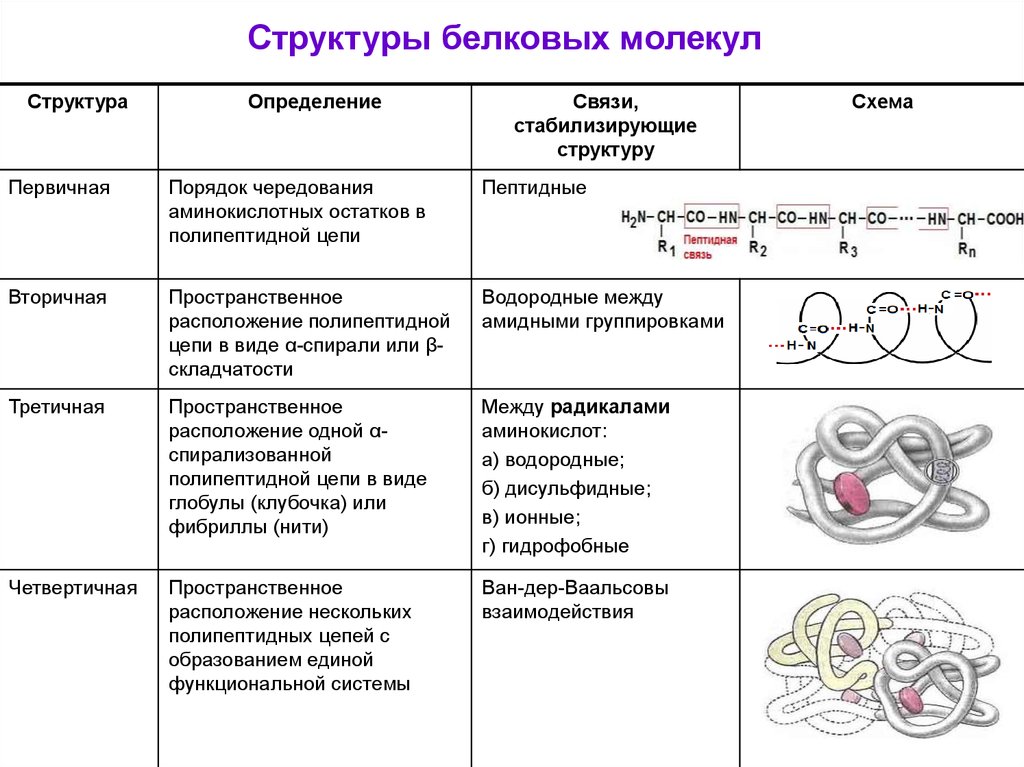
Структуры белковых молекулСтруктура
Определение
Связи,
стабилизирующие
структуру
Первичная
Порядок чередования
аминокислотных остатков в
полипептидной цепи
Пептидные
Вторичная
Пространственное
расположение полипептидной
цепи в виде α-спирали или βскладчатости
Водородные между
амидными группировками
Третичная
Пространственное
расположение одной αспирализованной
полипептидной цепи в виде
глобулы (клубочка) или
фибриллы (нити)
Между радикалами
аминокислот:
а) водородные;
б) дисульфидные;
в) ионные;
г) гидрофобные
Четвертичная
Пространственное
расположение нескольких
полипептидных цепей с
образованием единой
функциональной системы
Ван-дер-Ваальсовы
взаимодействия
Схема
34.
Физико-химические свойства белков1) Наличие высокой молекулярной массы
(>5000 Да)
2) Амфотерность - обусловлена наличием
свободных амино- и карбоксильных групп
в радикалах аминокислот.
35.
3) Изоэлектрическая точка (рI) – значение рНраствора, при котором суммарный заряд
молекулы белка равен нулю, т.е. белок
находится в изоэлектрическом состоянии.
рI белка зависит от соотношения свободных
амино- и карбоксильных групп в молекуле
белка:
Если число –NH2 > -COOH, то рI > 7
Если число –NH2 < -COOH, то рI < 7
В изоэлектрическом состоянии белок
выпадает в осадок!
36.
4) Наличие определенной формы белковыхмолекул
Глобулярные
Фибриллярные
37.
5) Растворимость в водеФакторы, стабилизирующие белки в растворе:
а) заряд молекулы
б) гидратная оболочка
Растворимость придают гидрофильные
группы в составе радикалов аминокислот:
-СООН
-NН2
-ОН
-SН
Глобулярные белки (альбумины, глобулины) обычно
растворимые,
Фибриллярные (коллаген, эластин) – не растворимые
38. 6) осаждаемость
Обратимое осаждениебелок лишается гидратной оболочки, но не теряет способности
растворяться вновь в воде после удаления осаждающего
фактора.
Высаливание – обратимое осаждение белка солями щелочных и
щелочно-земельных металлов и (NH4)2SO4
Необратимое осаждение (денатурация)
Денатурация – любое негидролитическое нарушение уникальной
структуры белка, приводящее к потере физических,
химических и биологических свойств.
При денатурации нарушаются все структуры, кроме первичной.
Денатурирующие факторы: высокая температура, кислоты,
щелочи, соли тяжелых металлов, алкалоиды, разные виды
излучения.
39. Классификация белков
Простые - при гидролизе дают только аминокислотыАльбумины и глобулины (белки крови)
Протамины и гистоны (ядерные белки)
Проламины и глютелины (растительные белки)
Протеиноиды (фибриллярные белки соединительной ткани:
коллаген, эластин)
Сложные - при гидролизе дают аминокислоты и
небелковый компонент – простетическую группу
Нуклеопротеины
Хромопротеины
Гликопротеины
Металлопротеины
Фосфопротеины
Липопротеины
40. Функции белков
1. Структурная (коллаген, эластин, кератин)2. Сократительная (актин, миозин и др.)
3. Транспортная (альбумины, глобулины,
трансферрин и др.)
4. Защитная (иммуноглобулины)
5. Питательная (казеин, овоальбумин)
6. Гормональная или регуляторная
(инсулин)
7. Каталитическая или ферментативная
(пепсин, амилаза, липаза и др.)
8. Энергетическая (1 г белка дает 4,1 ккал)






















 Химия
Химия