Похожие презентации:
Обобщение и повторение за курс основной школы по химии. 9 класс
1.
Обобщение иповторение за
курс основной
школы по химии 9
класс
2.
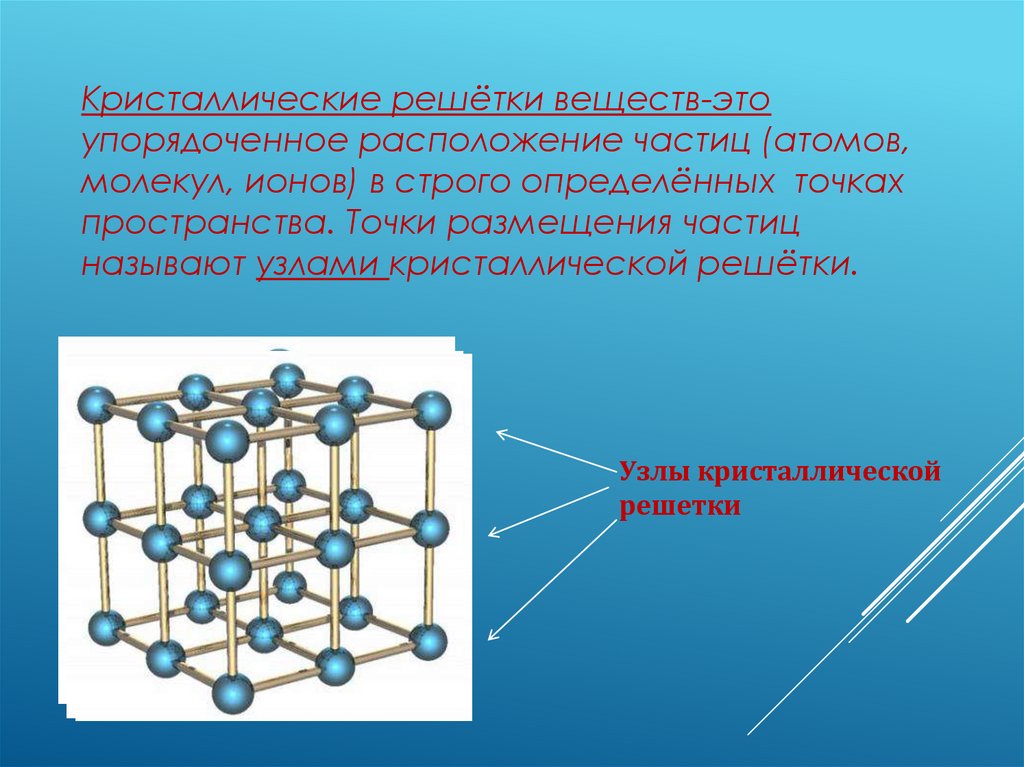
Кристаллические решётки веществ-этоупорядоченное расположение частиц (атомов,
молекул, ионов) в строго определённых точках
пространства. Точки размещения частиц
называют узлами кристаллической решётки.
Узлы кристаллической
решетки
3.
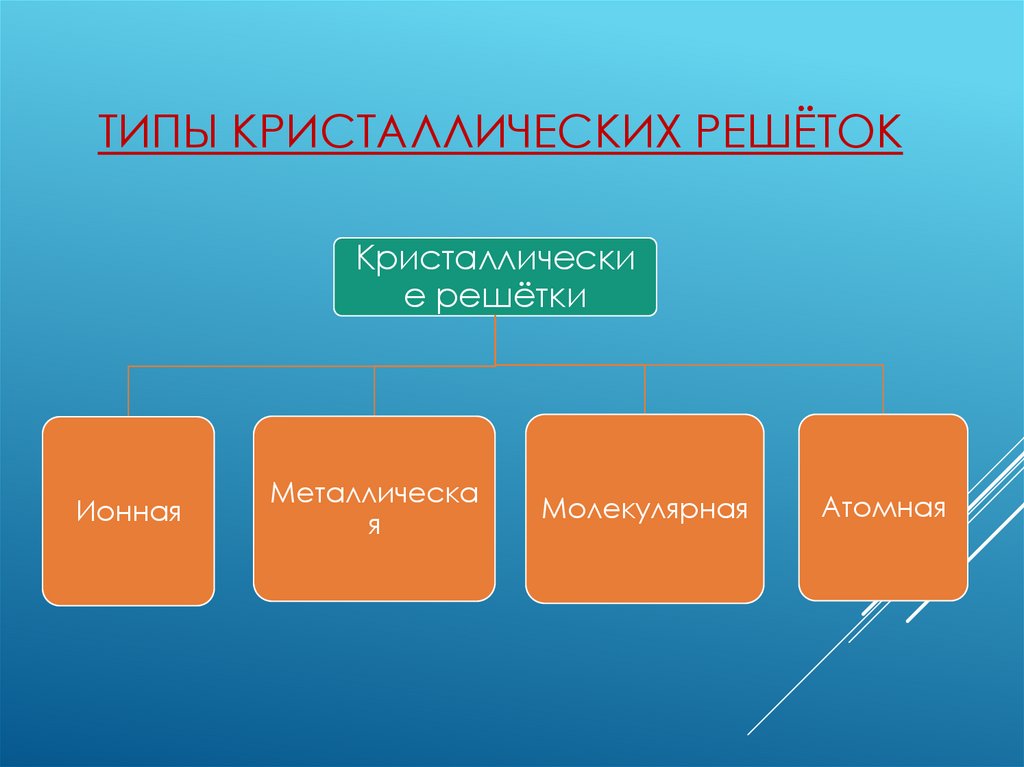
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОККристаллически
е решётки
Ионная
Металлическа
я
Молекулярная
Атомная
4.
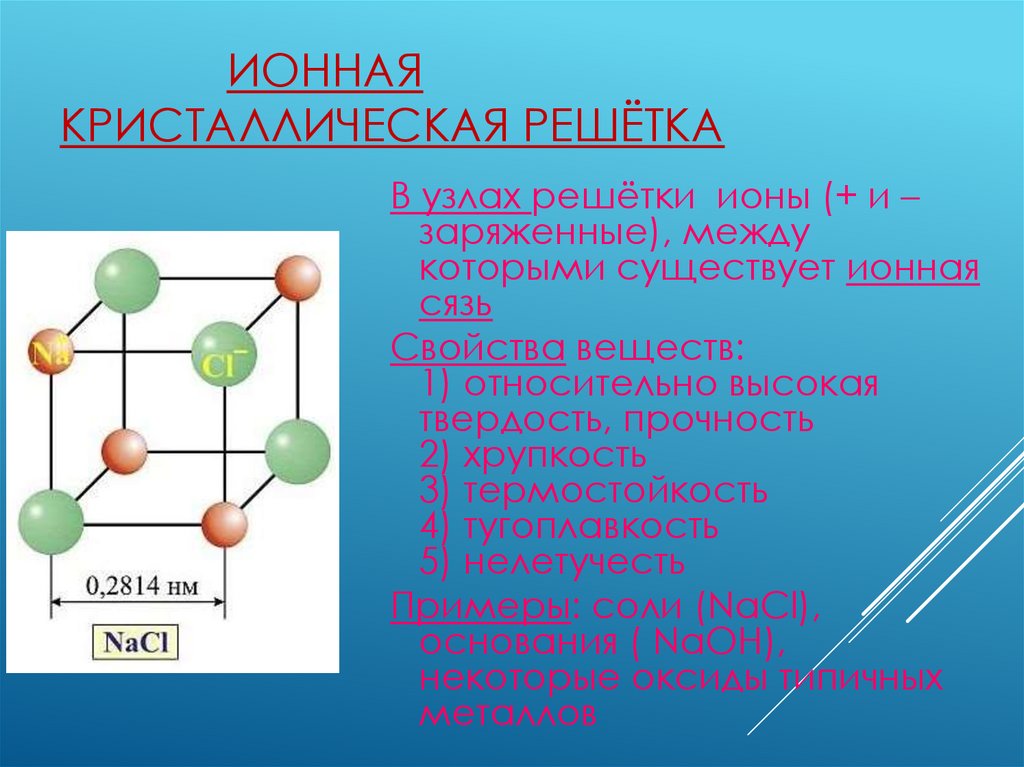
ИОННАЯКРИСТАЛЛИЧЕСКАЯ РЕШЁТКА
В узлах решётки ионы (+ и –
заряженные), между
которыми существует ионная
сязь
Свойства веществ:
1) относительно высокая
твердость, прочность
2) хрупкость
3) термостойкость
4) тугоплавкость
5) нелетучесть
Примеры: соли (NaCl),
основания ( NaOH),
некоторые оксиды типичных
металлов
5.
АТОМНАЯКРИСТАЛЛИЧЕСКАЯ РЕШЁТКА
алмаз
графит
В узлах решётки отдельные
атомы.
Химическая связь ковалентная
Свойства веществ:
1) высокая твердость,
прочность
2) высокая Тпл.
3) тугоплавкость
4) практически
нерастворимы
5) нелетучесть
Примеры: углерод в форме
алмаза, графита; бор и др.
6.
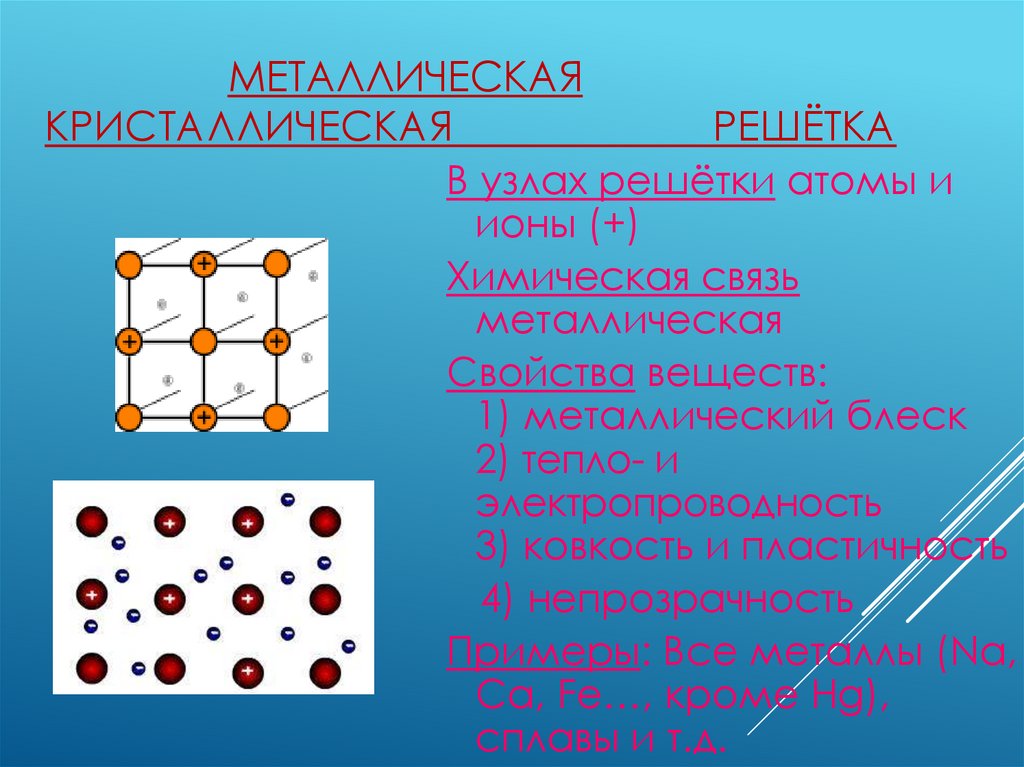
МЕТАЛЛИЧЕСКАЯКРИСТАЛЛИЧЕСКАЯ
РЕШЁТКА
В узлах решётки атомы и
ионы (+)
Химическая связь
металлическая
Свойства веществ:
1) металлический блеск
2) тепло- и
электропроводность
3) ковкость и пластичность
4) непрозрачность
Примеры: Все металлы (Na,
Ca, Fe…, кроме Hg),
сплавы и т.д.
7.
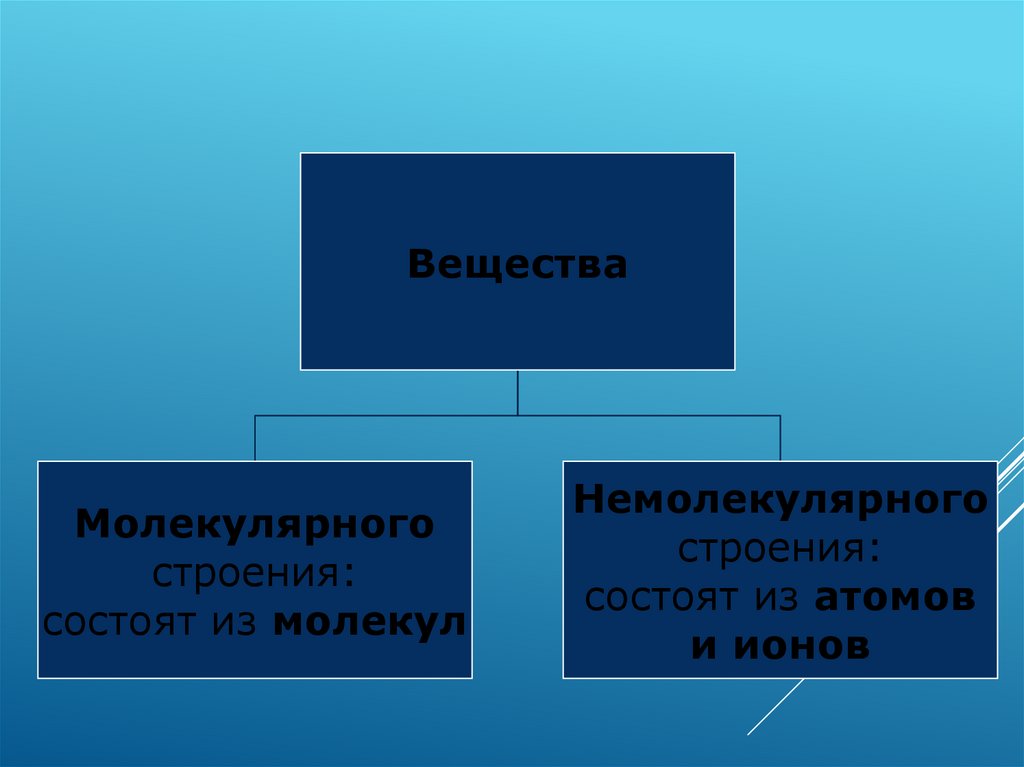
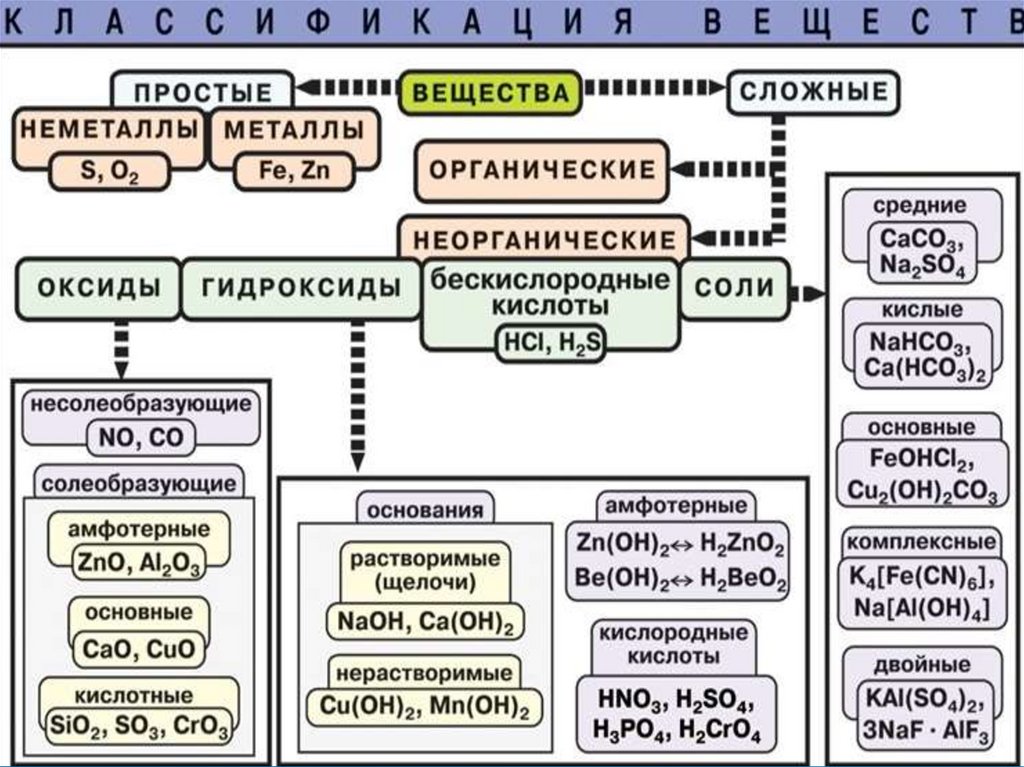
ВеществаМолекулярного
строения:
состоят из молекул
Немолекулярного
строения:
состоят из атомов
и ионов
8.
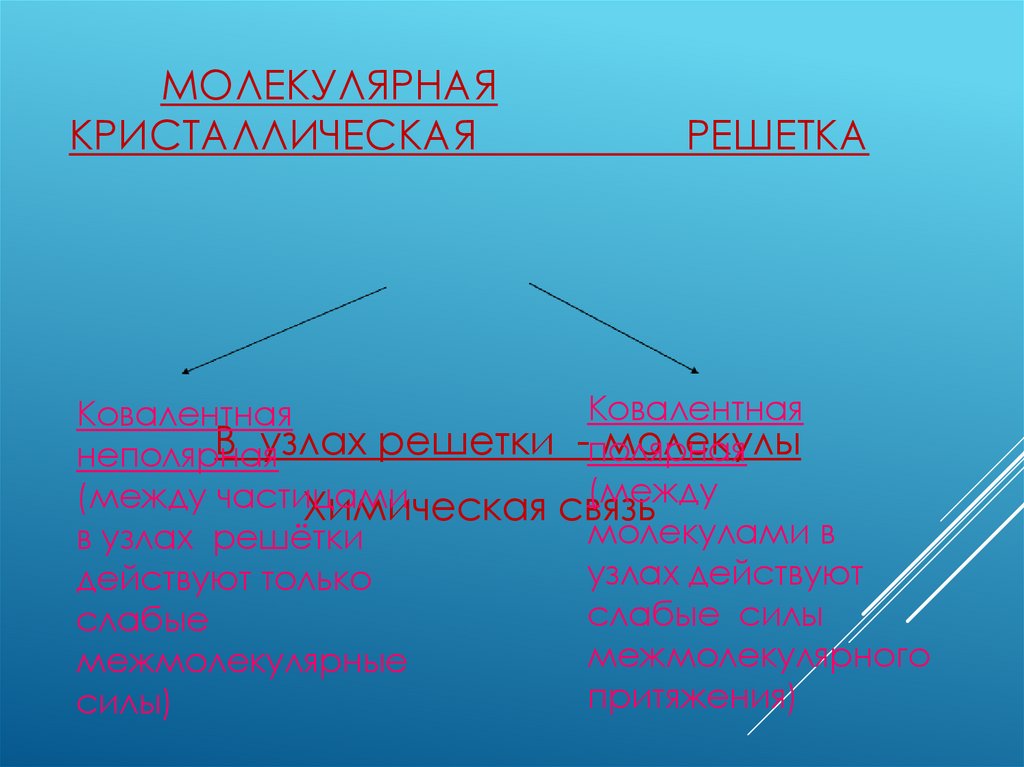
МОЛЕКУЛЯРНАЯКРИСТАЛЛИЧЕСКАЯ
РЕШЕТКА
Ковалентная
Ковалентная
В узлах решетки -полярная
молекулы
неполярная
(между
(между частицами
Химическая связь
молекулами в
в узлах решётки
узлах действуют
действуют только
слабые силы
слабые
межмолекулярного
межмолекулярные
притяжения)
силы)
9.
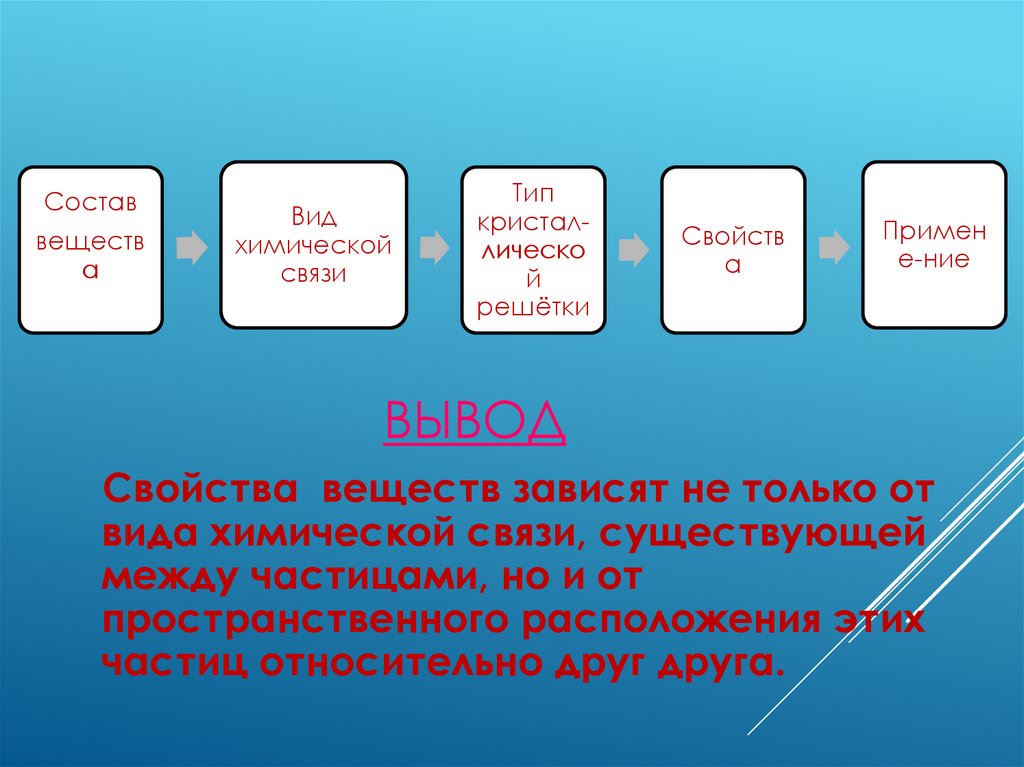
Составвеществ
а
Вид
химической
связи
Тип
кристаллическо
й
решётки
Свойств
а
Примен
е-ние
ВЫВОД
Свойства веществ зависят не только от
вида химической связи, существующей
между частицами, но и от
пространственного расположения этих
частиц относительно друг друга.
10.
11.
12.
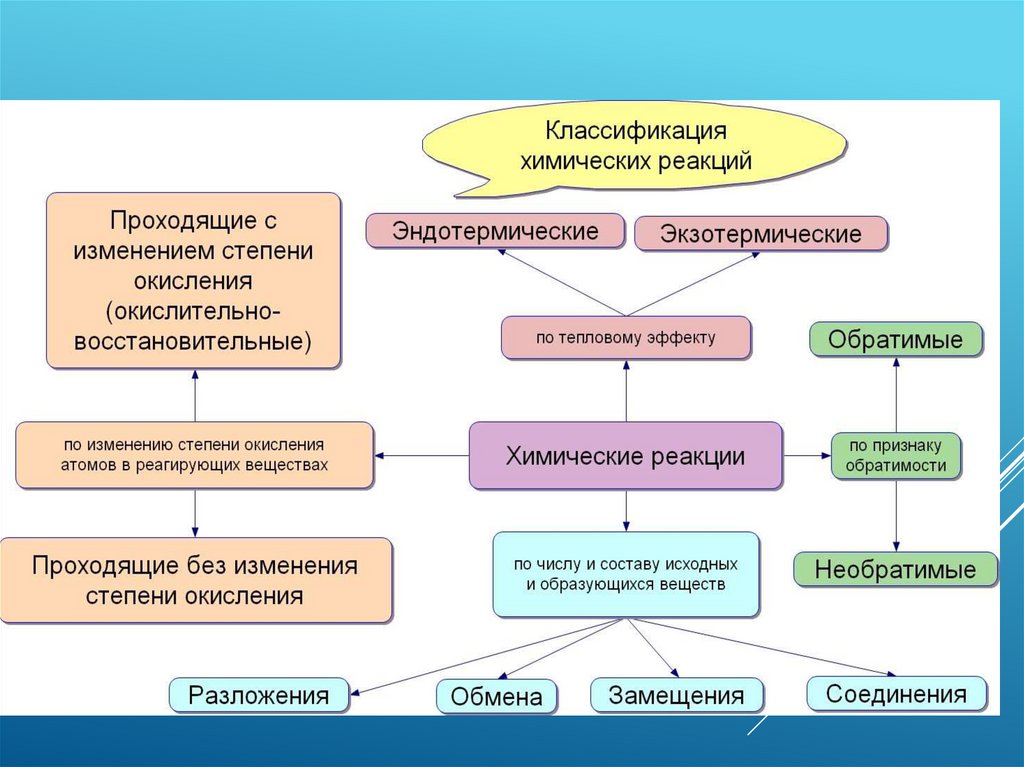
«эндотермические реакции» - это реакции,протекающие с выделением тепла;
«экзотермические реакции» - это реакции,
протекающие с поглощением тепла.
необратимые химические реакции
это реакции, которые идут до конца, при этом
образуется:
- осадок;
- выделяется газ;
- образуется мало диссоциирующее вещество,
например, вода.
13.
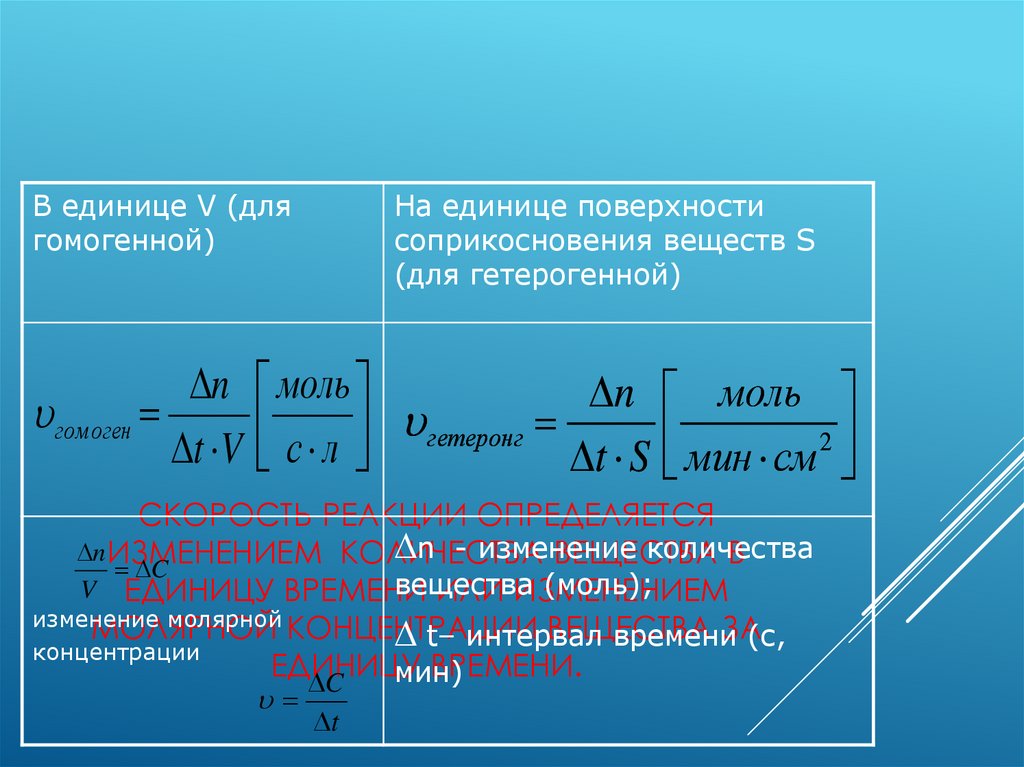
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ- ЭТОВЕЛИЧИНА, ПОКАЗЫВАЮЩАЯ ИЗМЕНЕНИЕ
МОЛЯРНОЙ КОНЦЕНТРАЦИИ В ЕДИНИЦУ
ВРЕМЕНИ.
Факторы,
1.Природа
влияющие на скорость:
реагирующих веществ.
2.Концентрация
3.Поверхность
реагирующих веществ.
соприкосновения
реагирующих веществ.
4.Температура.
5.Наличие
катализатора.
14.
В единице V (длягомогенной)
n
гомоген
t V
На единице поверхности
соприкосновения веществ S
(для гетерогенной)
моль
n моль
с л гетеронг
t S мин см 2
СКОРОСТЬ РЕАКЦИИ ОПРЕДЕЛЯЕТСЯ
n - изменение
количества
n ИЗМЕНЕНИЕМ КОЛИЧЕСТВА
ВЕЩЕСТВА
В
C
вещества
(моль);
V ЕДИНИЦУ ВРЕМЕНИ
ИЛИ ИЗМЕНЕНИЕМ
изменение молярной
МОЛЯРНОЙ КОНЦЕНТРАЦИИ
ВЕЩЕСТВА
ЗА(с,
t– интервал
времени
концентрации
ЕДИНИЦУ
ВРЕМЕНИ.
мин)
C
t





 Химия
Химия








