Похожие презентации:
Строение вещества. Виды химической связи (9 класс)
1.
СТРОЕНИЕВЕЩЕСТВА.
ВИДЫ
ХИМИЧЕСКОЙ
СВЯЗИ
2.
Химическая связь- явление взаимодействия атомов,
обусловленное перекрыванием
электронных облаков связывающихся
частиц.
При образовании химической связи атомы
стремятся приобрести устойчивую электронную
конфигурацию, соответствующую строению
атома ближайшего инертного газа.
3.
4.
Ковалентная связь- это связь, возникающая между атомами
за счет образования общих электронных
пар.
По степени смещенности общих
электронных пар к одному из связанных
ими атомов ковалентная связь может
быть полярной и неполярной.
5.
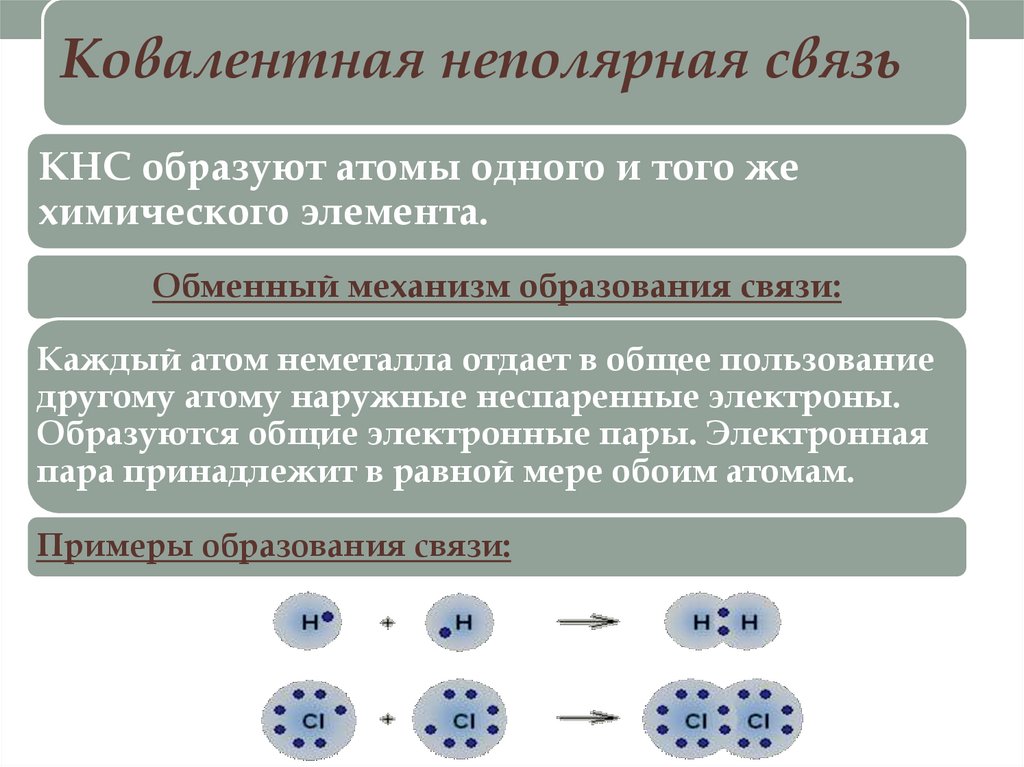
Ковалентная неполярная связьКНС образуют атомы одного и того же
химического элемента.
Обменный механизм образования связи:
Каждый атом неметалла отдает в общее пользование
другому атому наружные неспаренные электроны.
Образуются общие электронные пары. Электронная
пара принадлежит в равной мере обоим атомам.
Примеры образования связи:
6.
Ковалентная полярная связьКПС образуют атомы разных неметаллов (с разной
электроотрицательностью).
Электроотрицательность (ЭО)- это свойство атомов
одного элемента притягивать к себе электроны от атомов
других элементов.
Самый электроотрицательный элемент – F.
Обменный механизм образования связи:
Каждый атом неметалла отдает в общее пользование
другому атому свои наружные неспаренные электроны.
Образуются общие электронные пары. Общая
электронная пара смещена к более
электроотрицательному элементу.
Примеры образования связи:
..
.
H + Cl
.. :
. ..
H Cl
.. :
H
+
-
Cl
+
- Диполь
7.
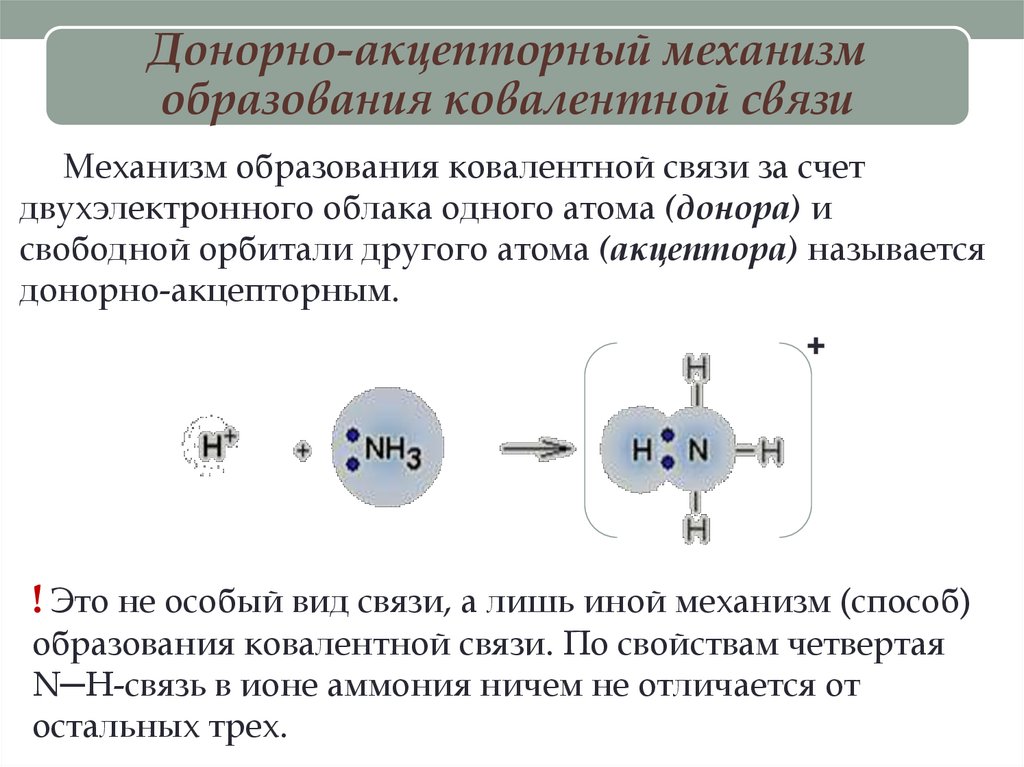
Донорно-акцепторный механизмобразования ковалентной связи
Механизм образования ковалентной связи за счет
двухэлектронного облака одного атома (донора) и
свободной орбитали другого атома (акцептора) называется
донорно-акцепторным.
+
! Это не особый вид связи, а лишь иной механизм (способ)
образования ковалентной связи. По свойствам четвертая
N─H-связь в ионе аммония ничем не отличается от
остальных трех.
8.
Ионная связьИС образуется между атомами металлов и неметаллов,
т.е. между атомами резко отличающимися друг от друга
по электроотрицательности.
Механизм образования связи
Атом неметалла забирает наружные электроны у атома
металла и превращается в анион (отрицательно
заряженный ион). Атом металла теряет электроны и
превращается в катион (положительно заряженный
ион). Ионы связаны электростатическими силами.
9.
Металлическая связь- химическая связь, обусловленная наличием
относительно свободных электронов в кристаллической
решетке.
Схема образования металлической связи :
Ме0 – nē = Mе n+
Свойства веществ:
Твердость, ковкость, электропроводность и
теплопроводность, пластичность,
металлический блеск.
10.
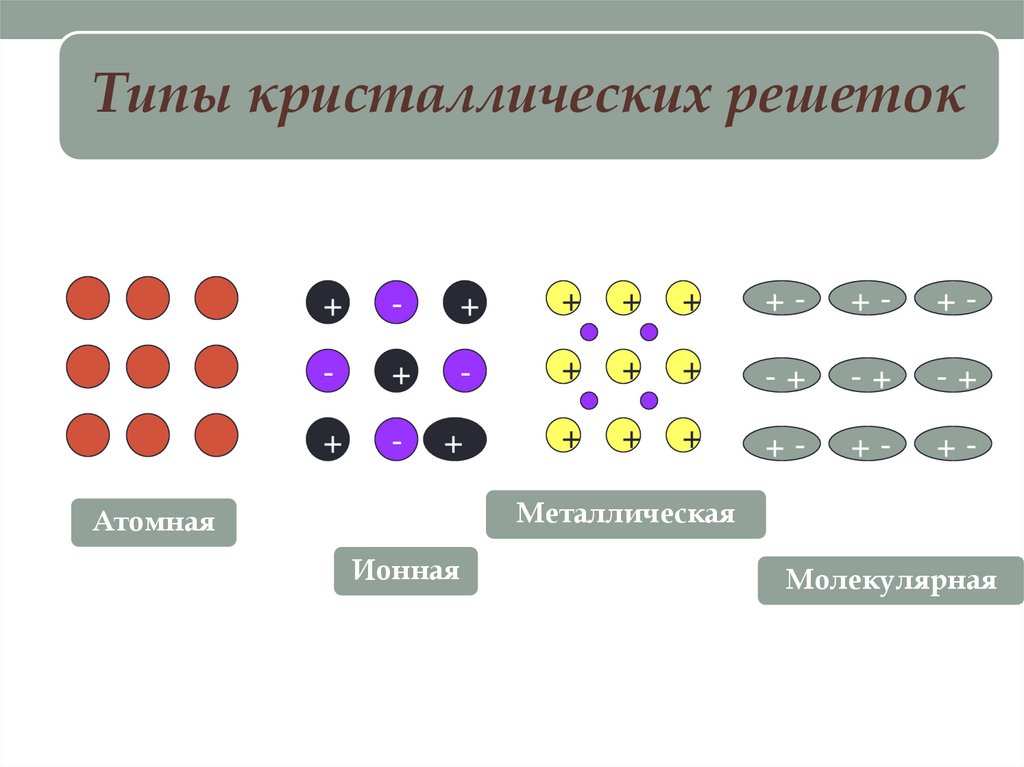
Типы кристаллических решеток+
-
+
+
+
+
+-
+-
+-
-
+
-
+
+
+
-+
-+
-+
+
-
+
+
+
+
+-
+-
+-
Металлическая
Атомная
Ионная
Молекулярная
11.
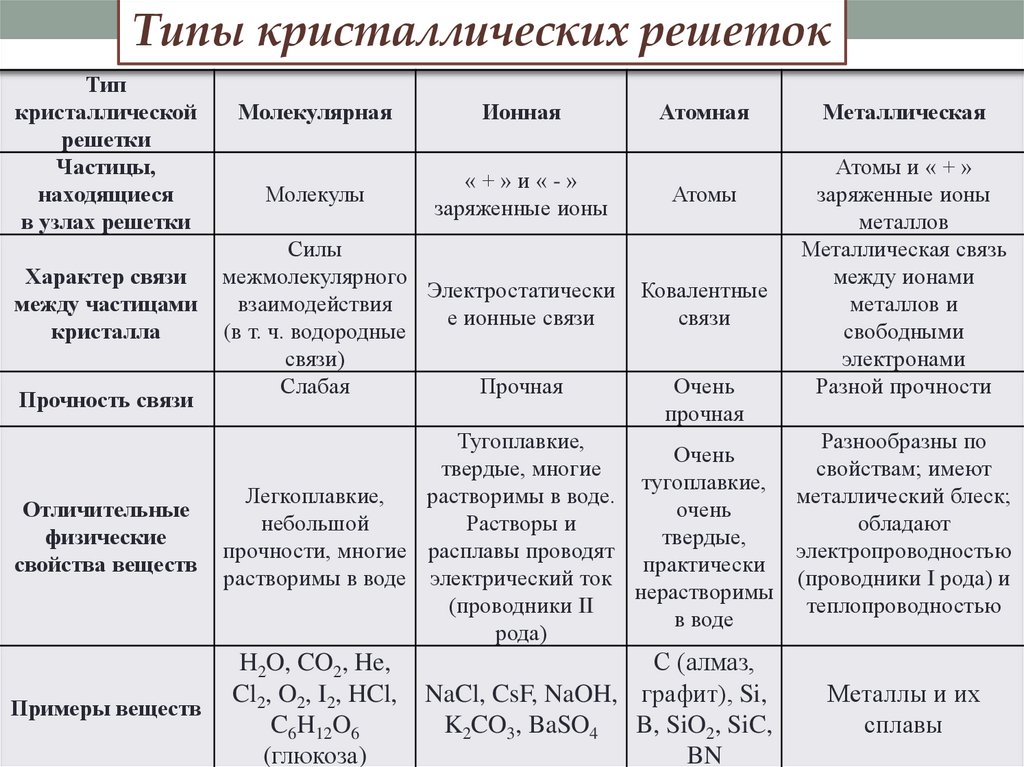
Типы кристаллических решетокТип
кристаллической
решетки
Частицы,
находящиеся
в узлах решетки
Характер связи
между частицами
кристалла
Прочность связи
Молекулярная
Ионная
Молекулы
«+»и«-»
заряженные ионы
Силы
межмолекулярного
Электростатически
взаимодействия
е ионные связи
(в т. ч. водородные
связи)
Слабая
Прочная
Атомная
Атомы
Ковалентные
связи
Очень
прочная
Металлическая
Атомы и « + »
заряженные ионы
металлов
Металлическая связь
между ионами
металлов и
свободными
электронами
Разной прочности
Отличительные
физические
свойства веществ
Тугоплавкие,
Разнообразны по
Очень
твердые, многие
свойствам; имеют
тугоплавкие,
Легкоплавкие,
растворимы в воде.
металлический блеск;
очень
небольшой
Растворы и
обладают
твердые,
прочности, многие расплавы проводят
электропроводностью
практически
растворимы в воде электрический ток
(проводники I рода) и
нерастворимы
теплопроводностью
(проводники II
в воде
рода)
Примеры веществ
H2O, CO2, He,
Cl2, O2, I2, HCl,
C6H12O6
(глюкоза)
С (алмаз,
NaCl, CsF, NaOH, графит), Si,
K2CO3, BaSO4 B, SiO2, SiC,
BN
Металлы и их
сплавы
12.
Домашнее заданиеВыполните тестовые
задания. Ответы
обоснуйте
13.
1. Связь между атомами двуххимических элементов, незначительно
отличающихся по ЭО, является:
1) ковалентной неполярной
2) ковалентной полярной
3) металлической
4) ионной
14.
2. Соединением с ковалентной полярнойсвязью является:
1) Cl2
2) СаО
3) СО
4) Ваl2
15.
3. Соединениями с ковалентнойполярной и ионной связью являются
соответственно:
1) кислород и бромид натрия
2) бром и метан
3) сероуглерод и хлорид цинка
4) вода и оксид азота (II)
16.
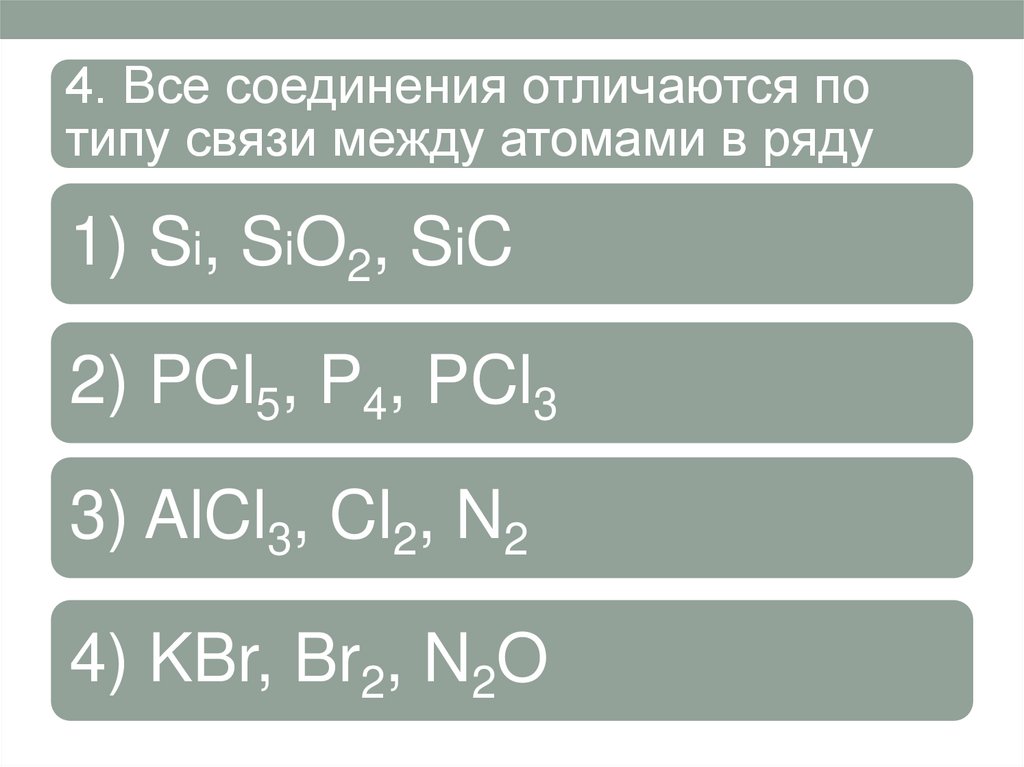
4. Все соединения отличаются потипу связи между атомами в ряду
1) Si, SiO2, SiC
2) PCl5, P4, PCl3
3) AlCl3, Cl2, N2
4) KBr, Br2, N2O
17.
5. Полярность связи более всеговыражена в молекуле
1) фтора
2) сероводорода
3) аммиака
4) фтороводорода
18.
6. Термин «молекула» нельзяупотреблять при характеристике
строения
1) сероводорода
2) иодида магния
3) соляной кислоты
4) азота
19.
7. Немолекулярное строение имеютвсе вещества, расположенные в ряду
1) алмаз, оксид азота (IV), графит
2) аммиак, белый фосфор, кремний
3) алмаз, кремний, карбид кремния
4) озон, хлорид натрия, белый фосфор
20.
8. Ионная связь существует в соединениях1) оксид углерода (II)
2) оксид алюминия
3) йод
4) бромоводород
5) фторид магния
6) хлорид аммония
21.
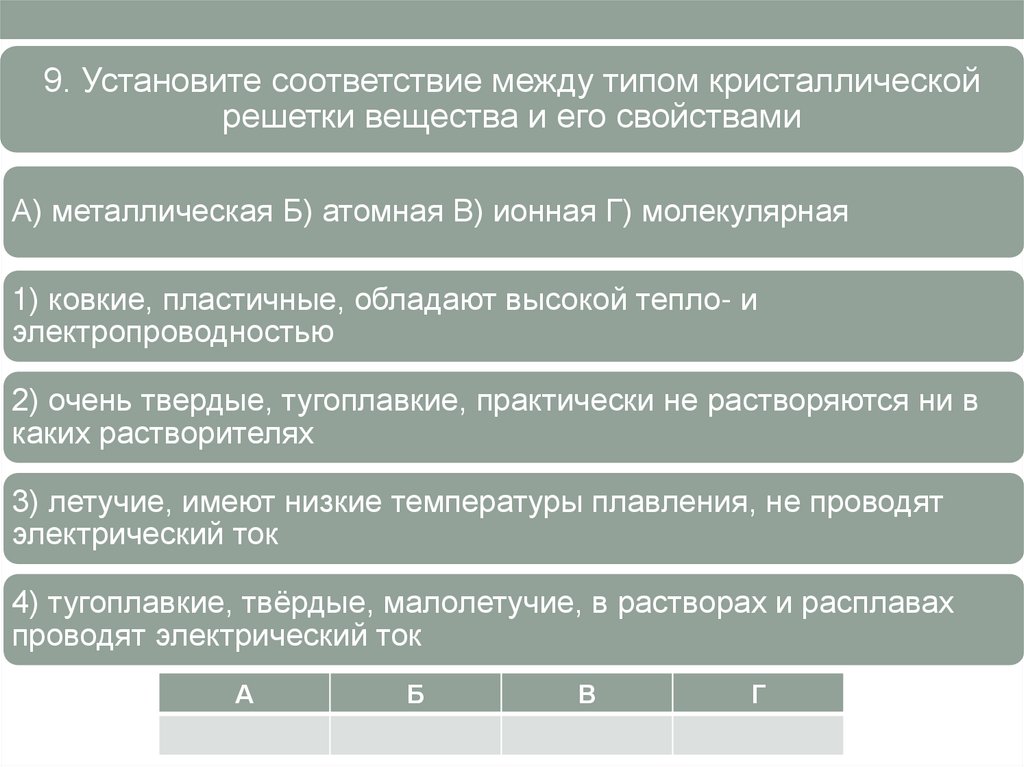
9. Установите соответствие между типом кристаллическойрешетки вещества и его свойствами
А) металлическая Б) атомная В) ионная Г) молекулярная
1) ковкие, пластичные, обладают высокой тепло- и
электропроводностью
2) очень твердые, тугоплавкие, практически не растворяются ни в
каких растворителях
3) летучие, имеют низкие температуры плавления, не проводят
электрический ток
4) тугоплавкие, твёрдые, малолетучие, в растворах и расплавах
проводят электрический ток
А
Б
В
Г
22.
10. Установите соответствие между типом химическойсвязи и формулой химического вещества
А) ковалентная неполярная
полярная
В) ионная
Б) ковалентная
Г) металлическая
3) H2O2
1) Fe
2) KCl
A
4) S8
Б
В
Г
















 Химия
Химия








