Похожие презентации:
Клинические испытания лекарственных препаратов
1.
КЛИНИЧЕСКИЕИСПЫТАНИЯ
ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ
ВЫПОЛНИЛА:
СТУДЕНТКА 531 ГРУППЫ СКОРЧЕНКО ВИОЛЕТТА
ПРЕПОДАВАТЕЛЬ:
ТИТАРЕНКО ОЛЬГА АЛЕКСАНДРОВНА
2.
КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ИЗУЧЕНИЕ ДИАГНОСТИЧЕСКИХ, ЛЕЧЕБНЫХ, ПРОФИЛАКТИЧЕСКИХ,ФАРМАКОЛОГИЧЕСКИХ СВОЙСТВ ЛЕКАРСТВЕННОГО ПРЕПАРАТА В
ПРОЦЕССЕ ЕГО ПРИМЕНЕНИЯ У ЧЕЛОВЕКА, ЖИВОТНОГО, В ТОМ ЧИСЛЕ
ПРОЦЕССОВ ВСАСЫВАНИЯ, РАСПРЕДЕЛЕНИЯ, ИЗМЕНЕНИЯ И
ВЫВЕДЕНИЯ. ПУТЕМ ПРИМЕНЕНИЯ НАУЧНЫХ МЕТОДОВ ОЦЕНОК В
ЦЕЛЯХ ПОЛУЧЕНИЯ ДОКАЗАТЕЛЬСТВ БЕЗОПАСНОСТИ, КАЧЕСТВА И
ЭФФЕКТИВНОСТИ ЛЕКАРСТВЕННОГО ПРЕПАРАТА, ДАННЫХ О
НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ ОРГАНИЗМА ЧЕЛОВЕКА НА ПРИМЕНЕНИЕ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА И ОБ ЭФФЕКТЕ ЕГО ВЗАИМОДЕЙСТВИЯ
С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ И (ИЛИ) ПИЩЕВЫМИ
ПРОДУКТАМИ.
ФЕДЕРАЛЬНЫЙ ЗАКОН ОТ 12.04.2010 № 61 - ФЗ "ОБ ОБРАЩЕНИИ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
"
3.
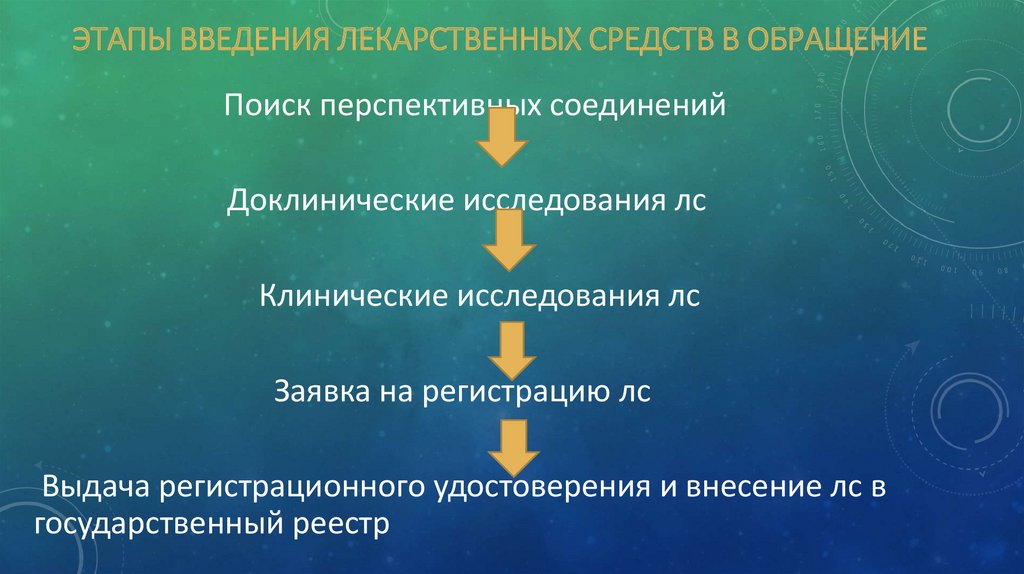
ЭТАПЫ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОБРАЩЕНИЕПоиск перспективных соединений
Доклинические исследования лс
Клинические исследования лс
Заявка на регистрацию лс
Выдача регистрационного удостоверения и внесение лс в
государственный реестр
4.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ ЛС ПРОХОДЯТ ЧЕТЫРЕ ФАЗЫ:• Фаза I – Проверка механизма действия (длительность: от нескольких месяцев до 1 года):
в исследование включается небольшая группа здоровых добровольцев. Участникам увеличивают дозы
препарата, начиная с минимальной и до максимально допустимой. После каждого приема отслеживается
состояние пациента. Выясняется предпочтительный вариант применения и уровень дозировки.
• Фаза II - Проверка действия на заданную цель (длительность: от нескольких месяцев до 2 лет):
группа пациентов по заболеванию увеличивается, в течение этой фазы определяется краткосрочная
безопасность лекарственного препарата (фаза IIa), эффективность лекарственного препарата и его
дозировка (фаза IIb), насколько новый препарат эффективнее по сравнению с плацебо или уже
существующим лечением.
• Фаза III – Подтверждающие исследования (длительность: от года до нескольких лет)
на данном этапе происходит полномасштабная оценка показателя риск/польза. самый длительный этап
клинических исследований с самым большим количеством включаемых пациентов (тысячи пациентов в
разных странах), которая проводится в разных исследовательских центрах в различных странах.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Министерство Здравоохранения РФ принимает решение о выдаче регистрационного удостоверения
лекарственного препарата, позволяющего вывести его на рынок.
• Фаза IV – проводится после получения регистрационного удостоверения лекарственного препарата с
целью получения расширенных данных по его безопасности, а также социо-экономических данных.
5.
ДИЗАЙНДизайн – это способ проведения научного исследования в клинике, т.е. его организация или архитектура.
По дизайну клинические исследования могут быть:
a) открытыми - пациент и врач знают, какой препарат принимает пациент;
b) слепыми - ни пациент, ни врач не знают, какой препарат принимает пациент;
c) рандомизированными - пациент распределяется в группу лечения исследуемым препаратом, группу лечения плацебо,
или группу лечения активным препаратом сравнения согласно изначально определенной схеме;
d) плацебо-контролируемыми – в качестве препарата сравнения используется плацебо - вещество без явных лечебных
свойств («пустышка»), используемое для имитации лекарственного средства в исследованиях;
e) сравнительными – применение нового исследуемого лекарственного препарата сравнивается с уже существующими
методами лечения или лекарственными препаратами.
6.
УЧАСТИЕ В КЛИНИЧЕСКИХИСПЫТАНИЯХ
Ни один новый препарат и новый способ лечения в мире не может
быть разрешен к широкой продаже без проведения необходимых
клинических исследований. Участники клинических исследований
получают бесплатный доступ к новым исследуемым видам лечения
до их широкого распространения.
Каковы риски при участии в клиническом исследовании?
Такие же, как и при лечении заболевания в условиях обычной
клинической практики: риск побочных эффектов и риск осложнений
от медицинских процедур и манипуляций.
Нужно ли платить за участие в КИ?
Участие в исследовании, включая все определенные Протоколом
процедуры и терапию, являются бесплатными для участника
исследования.
7.
КАКИЕ ПРАВА И ОБЯЗАННОСТИ ЕСТЬ У УЧАСТНИКАКЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ?
• ПРАВА:
Обязательно в письменном виде пациенту предоставляется информация о цели КИ, о том, как оно будет
проводиться, какое лекарство будет применяться, и т.д.
Всё изложенное отражено в особом документе — информированном согласии. Информация,
позволяющая идентифицировать участника исследования кодируется и сохраняется в тайне на
протяжении всего участия в исследовании и после завершения участия в нем.
С момента подписания формы информированного согласия участник исследования застрахован от
причинения вреда жизни и здоровью. Пострадавшим в результате участия в исследовании
гарантированы соответствующие компенсация и лечение.
• ОБЯЗАННОСТИ:
Участник клинического исследования берет на себя обязанность соблюдать все требования врача и
Протокола исследования (графики процедур и визитов в клинику, график приема исследуемого
лекарственного препарата и т.д.) и сообщать врачу, когда эти требования были нарушены по какой-либо
причине.
Участник может покинуть клиническое исследование в любое время, независимо от причины.







 Медицина
Медицина








