Похожие презентации:
Классификация и химические свойства основных классов неорганических соединений
1.
КЛАССИФИКАЦИЯИ ХИМИЧЕСКИЕ СВОЙСТВА
ОСНОВНЫХ КЛАССОВ
НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
8 класс
2.
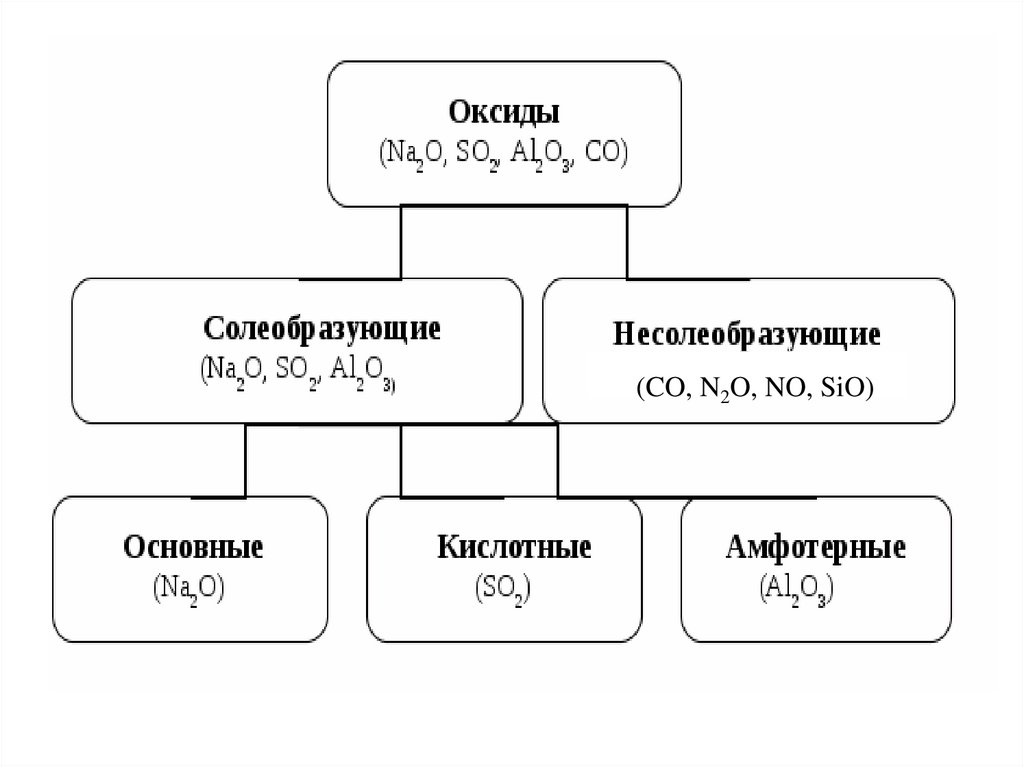
Оксиды-это сложныевещества, которые состоят из
двух элементов, одним из
которых является кислород.
Общая формула оксидов:
ЭnOm
3.
( NO, SiO)(CO, N2O,
4.
Типичные реакции кислотныхоксидов
1. Кислотный оксид + щёлочь→соль +
вода (реакция обмена).
SO3+2KOH→K2SO4+H2O
CO2+Ca(OH)2→CaCO3+H2O
2. Кислотный оксид + вода→кислота
(реакция соединения)
SO3 +H2O→H2SO4
5.
Кислоты, соответствующиеоксидам
CO2 H2CO3
SiO2 H2SiO3
P2O5 H3PO4
N2O3 HNO2
N2O5 HNO3
SO2 H2SO3
SO3 H2SO4
6.
Типичные реакции основныхоксидов
3. Основный оксид + кислота→соль + вода
(реакция обмена)
CuO + H2SO4→CuSO4 + H2O
K2O +2HCl→2KCl + H2O
4. Основный оксид + вода→щёлочь
(реакция соединения)
K2O + H2O→2KOH
CaO + H2O→Ca(OH)2
7.
Химические свойства гидроксидовКислотный оксид
Кислота
Me(OH)n +
Соль
С
О
Л
Ь
t0C
Н2О
Н2О
+
Основание
Оксид металла +
Н2О
8.
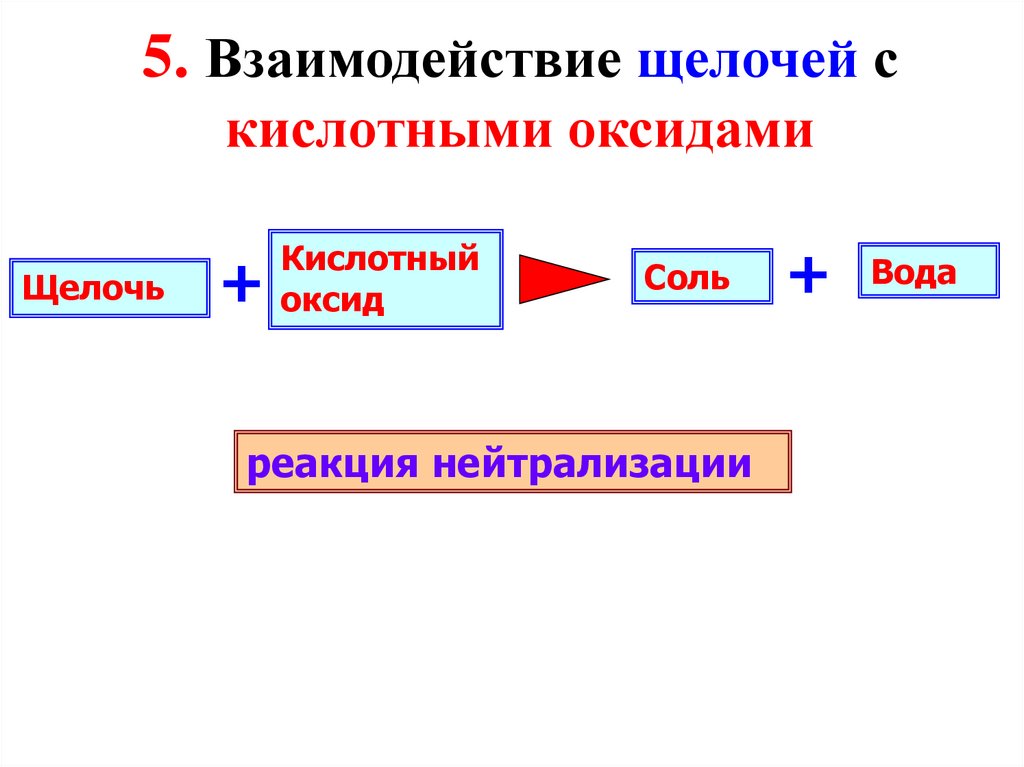
5. Взаимодействие щелочей скислотными оксидами
Щелочь
+
Кислотный
оксид
Соль
реакция нейтрализации
+
Вода
9.
6. Взаимодействие оснований с кислотамищелочи
нерастворимые
нейтрализации, обмена
основание
+ кислота
=
соль
+
вода
Me(OH) + HR =MeR+ H2O
= NaNO
NaOH + HNO33
…+…
3 + H2O
Cu(OH)
Cu(OH)22 +
+ HCl
2HCl
…
=CuCl
+…
2 + 2H2O
10.
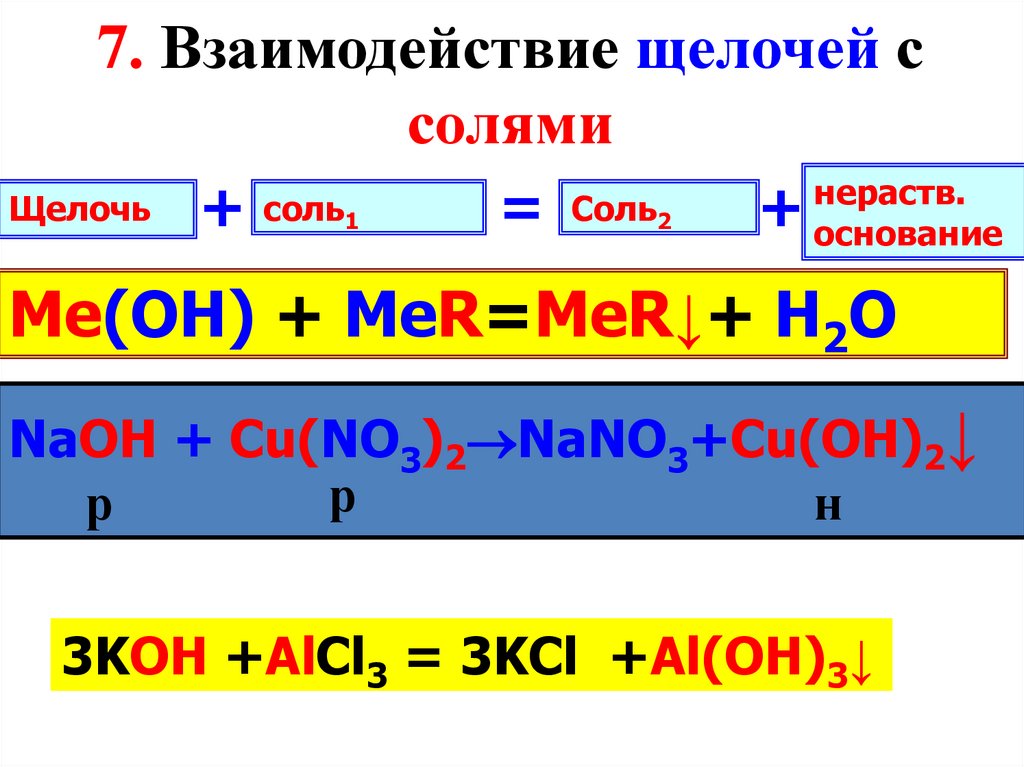
7. Взаимодействие щелочей ссолями
Щелочь
+
соль1
=
Соль2
+
нераств.
основание
Me(OH) + MeR=MeR↓+ H2O
NaOH + Сu(NO3)2 NaNO
3+Cu(OH)2↓
р
р
н
KOH
+AlCl
= … ++Al(OH)
…
3KOH
+AlCl
3 =3 3KCl
3↓
11.
8. Разложение нерастворимыхоснований(при t (нагревании ) )
основание↓
t
Оксид
металла
+
Вода
t
Me‹a (OH)↓ =MeO+ H2O
t
Cu(OH)2↓ = CuO + H2O
t
Fe(OH)3↓ … + …
2Fe(OH)3↓ Fe2O3 + 3H2O
12.
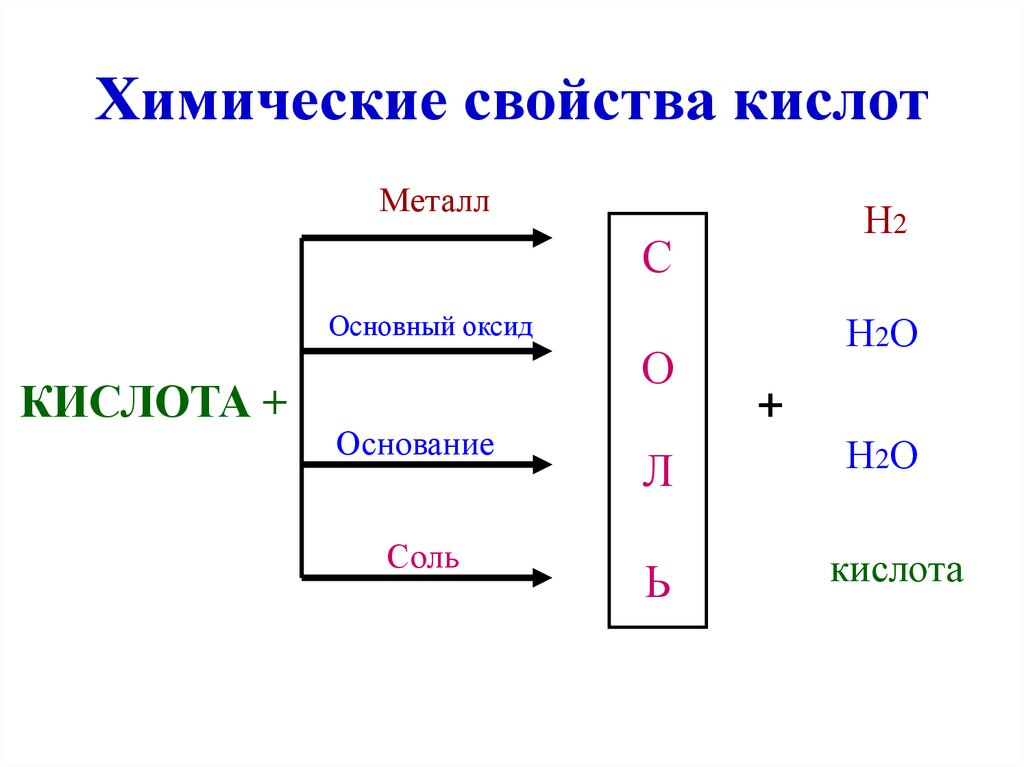
Химические свойства кислотМеталл
Н2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Л
Ь
Н2О
+
Н2О
кислота
13.
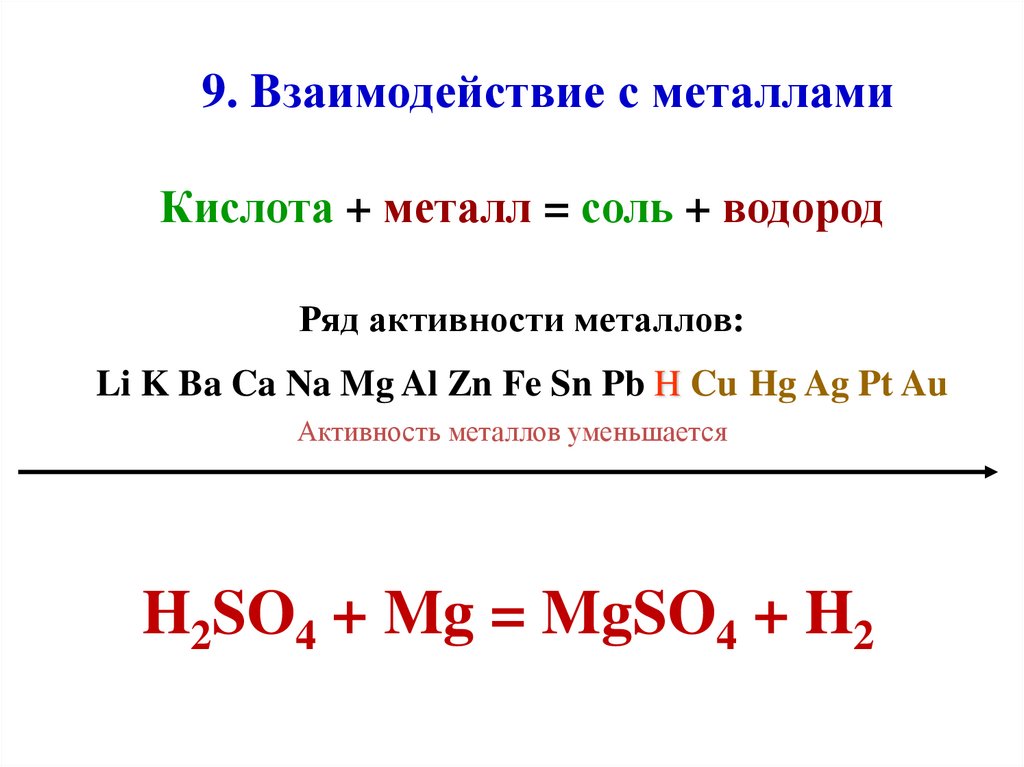
9. Bзаимодействие с металламиКислота + металл = соль + водород
Ряд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
H2SO4 + Mg = MgSO4 + H2
14.
10.Bзаимодействие с основнымиоксидами
Кислота + основной оксид = соль + вода
2HCl + CuO = CuCl2 + H2O
15.
11.Bзаимодействие с основаниямиКислота + основание = соль + вода
HBr + KOH = KBr + H2O
2HBr + Cu(OH)2 = CuBr2 + 2H2O
16.
12.Взаимодействие с солямислабых кислот
Кислота 1 + соль1 = соль2 + Кислота 2
H2SO4 + K2SiO3 = K2SO4 + H2SiO3
17.
Химические свойства солейс• + металл → новая соль + новый металл
новая
соль
+
новая
кислота
+
кислота
→
о
• + основание → новая соль + новое основание
л• + соль → две новые соли
• разложение при нагревании → два оксида
ь
18.
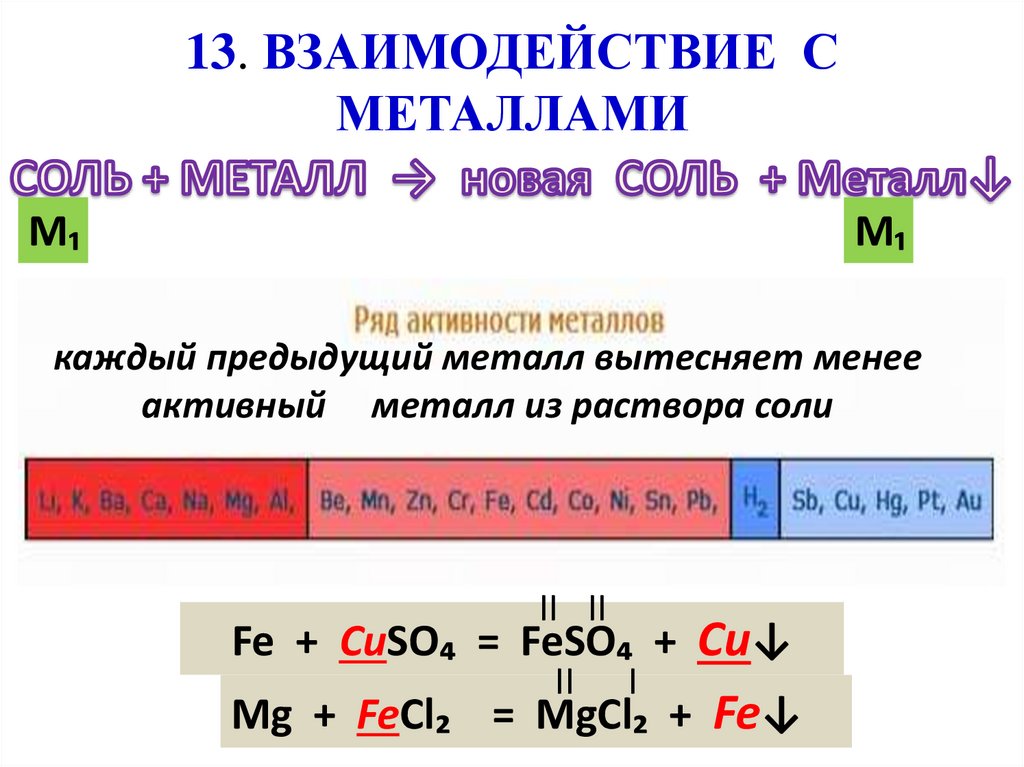
13. ВЗАИМОДЕЙСТВИЕ СМЕТАЛЛАМИ
М₁
М₁
каждый предыдущий металл вытесняет менее
активный металл из раствора соли
II II
Fe + CuSO₄ = FeSO₄ + Cu↓
II
I
Mg + FeCl₂ = MgCl₂ + Fe↓
19.
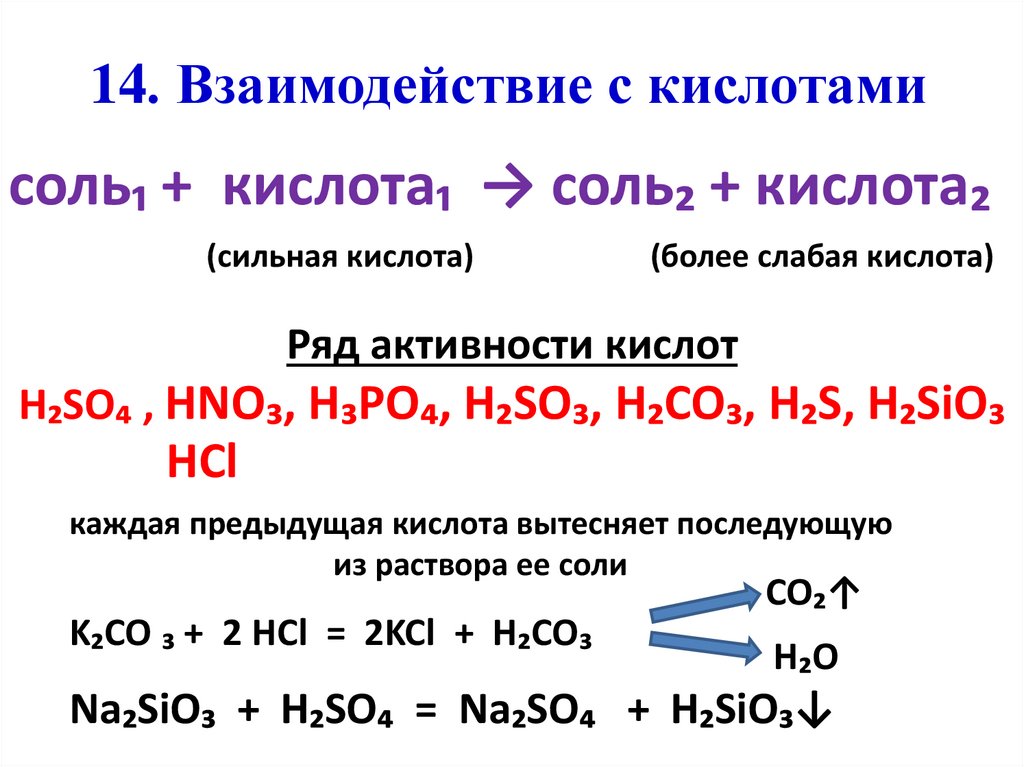
14. Взаимодействие с кислотамисоль₁ + кислота₁ → соль₂ + кислота₂
(сильная кислота)
(более слабая кислота)
Ряд активности кислот
H₂SO₄ , HNO₃, H₃PO₄, H₂SO₃, H₂CO₃, H₂S, H₂SiO₃
HCl
каждая предыдущая кислота вытесняет последующую
из раствора ее соли
CO₂↑
K₂CO ₃ + 2 HCl = 2KCl + H₂CO₃
H₂O
Na₂SiO₃ + H₂SO₄ = Na₂SO₄ + H₂SiO₃↓
20.
15. ВЗАИМОДЕЙСТВИЕ СОСНОВАНИЯМИ
соль₁ +основание₁ = соль₂ +основание₂↓
(р)
(щелочь)
(н)
II
I
I
II
CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
I I
III
I
AlCl₃ + 3KOH = 3KCl + Al(OH)₃↓
II
I
I I
FeCl₂ + 2NaOH = Fe(OH)₂↓ + 2NaCl
21.
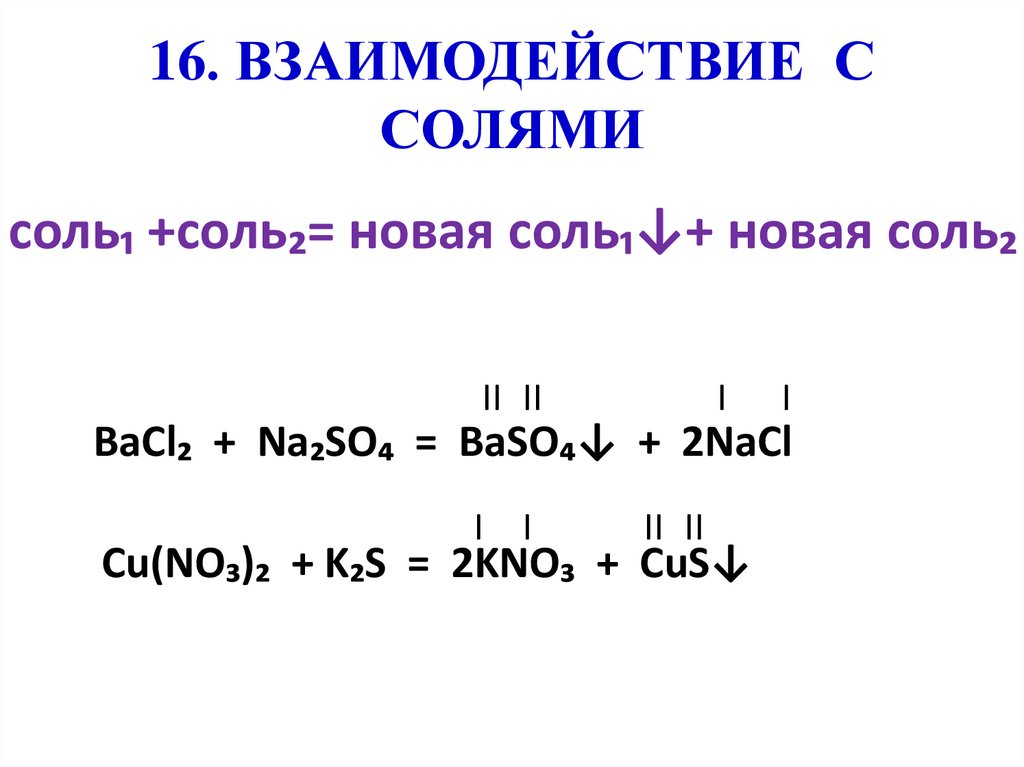
16. ВЗАИМОДЕЙСТВИЕ ССОЛЯМИ
соль₁ +соль₂= новая соль₁↓+ новая соль₂
II II
I
I
BaCl₂ + Na₂SO₄ = BaSO₄↓ + 2NaCl
I I
II II
Cu(NO₃)₂ + K₂S = 2KNO₃ + CuS↓
22.
17. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИНЕРАСТВОРИМЫХ СОЛЕЙ
t⁰C
соль ↓ → оксид металла + оксид неметалла
II II
IV II
BaSiO₃↓ = BaO + SiO₂
CaCO₃↓ = CaO + CO₂
V II
Ca₃(PO₄)₂↓ = 3CaO + P₂O₅
23.
Домашнее заданиеДопишите уравнения реакций:
SO2 + H2O
CaO + H2O
CaO + SO2
N2O5 + NaOH
CuSO4 + KOH
CaCO3 + HCl
24.
*Осуществите следующие превращения:алюминий→ оксид алюминия → хлорид
алюминия→ гидроксид алюминия → оксид
алюминия.
Напишите уравнения реакций.
















 Химия
Химия








