Похожие презентации:
Растворы. Концентрации растворов
1.
Растворы2.
Способы выражения концентраций растворов(приближенные и точные)
Массовая доля:
mX
[доля, или %]
ω 100
mp
где Х – массовая доля, растворенного вещества, %;
mХ – масса растворенного вещества, г; mр- масса
раствора, г.
Молярная концентрация раствора (молярность
раствора):
СМ= mХ/(MV), [моль/л]
где mХ – масса растворенного вещества, г; М –
молярная масса растворенного вещества, г/моль; Vобъем раствора, л.
2
3.
Молярная концентрация эквивалетнов вещества(нормальность раствора или нормальная
концентрация):
n ЭКВ (Х) mX z X
СН
Vp
M X Vp
[моль/л]
где mХ – масса растворенного вещества,г; zХ – число
эквивалентности; МХ – молярная масса растворенного
вещества, г/моль.
3
4.
Моляльная концентрация:m x 1000
Cm
,
M mS
[моль/кг]
где Сm – моляльная концентрация, моль/кг, nХ –
молей
растворенного
вещества;
mХ –
растворенного вещества, г; М – молярная
растворенного вещества, г/моль; mS –
растворителя, г.
число
масса
масса
масса
4
5.
Титр раствора вещества:Т = mХ/VР, [г/мл, кг/л]
где mХ - масса вещества,
VР – объем раствора
5
6.
ПРОЦЕССЫ, ПРОИСХОДЯЩИЕПРИ РАСТВОРЕНИИ ВЕЩЕСТВ
[+(Н2О)–]…Na+…[–(Н2О)+]
[–(Н2О)+]…Cl–…[+(Н2О)–]
6
7.
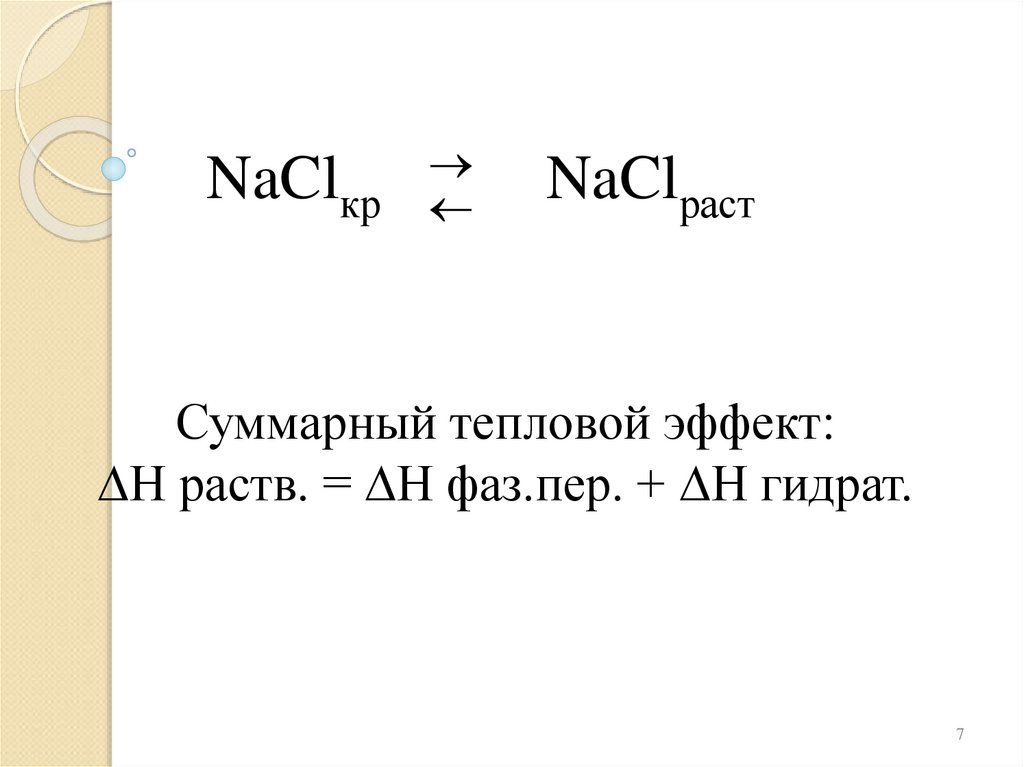
NaClкрNaClраст
Суммарный тепловой эффект:
раств. = фаз.пер. + гидрат.
7
8.
Коллигативные свойства разбавленныхрастворов
Понижение давления пара над
раствором. Законы Ф.Рауля.
Po
пар
жидкость
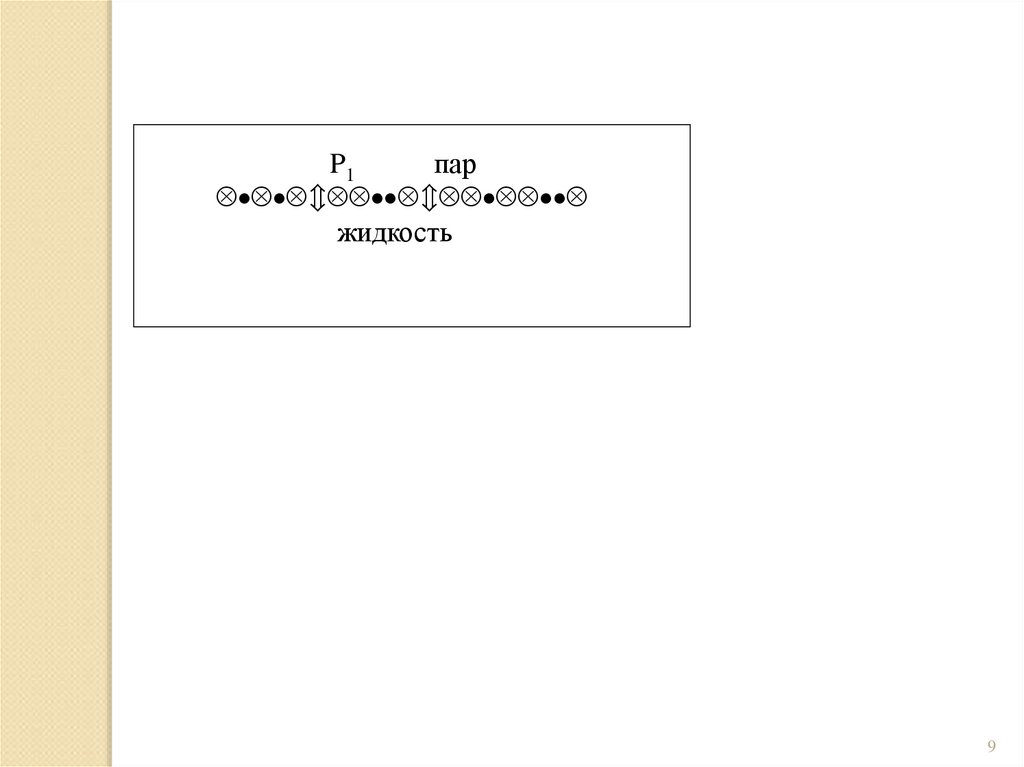
9.
P1пар
жидкость
9
10.
Давление пара надрастворами
Р1= РоN1 – I закон Рауля
10
11.
Температуры кипения и замерзаниярастворов
При 101 кПа, tкип(Н2О) =1000С
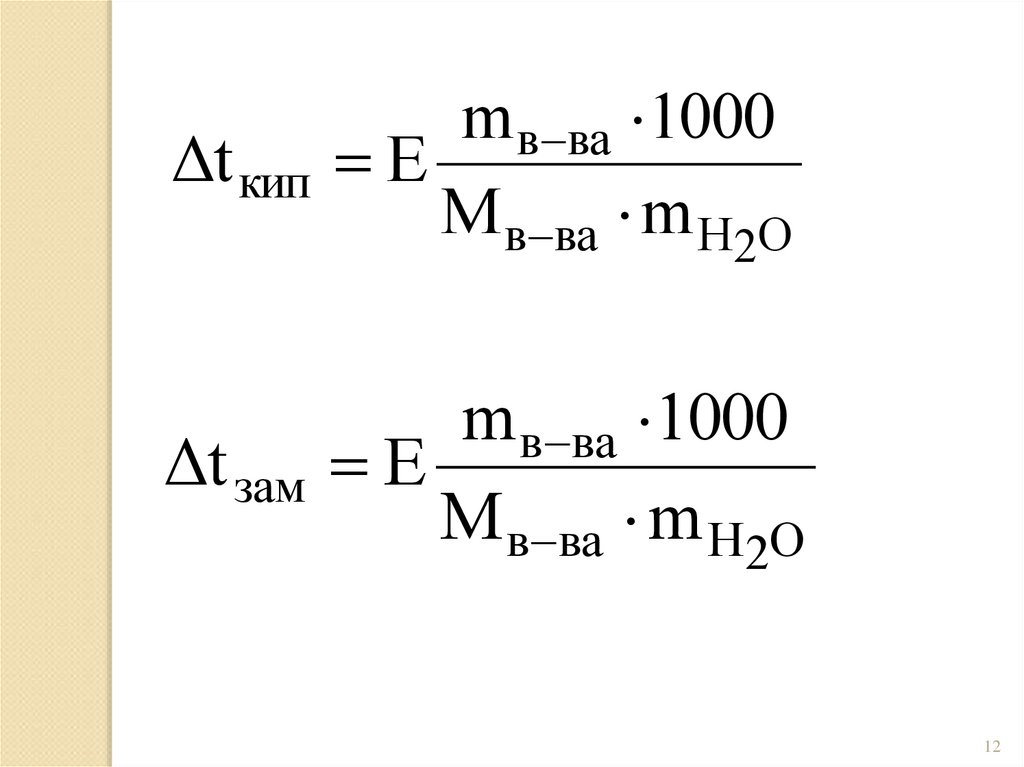
II закон Рауля:
∆tкип=ЕCm,
Е - эбулиоскопическая константа
(Н2О - 0,516)
∆tзам=КCm,
К - криоскопическая константа (Н2О - 1,86)
11
12.
Δt кипm в ва 1000
E
М в ва m H2O
Δt зам
m в ва 1000
E
М в ва m H2O
12
13.
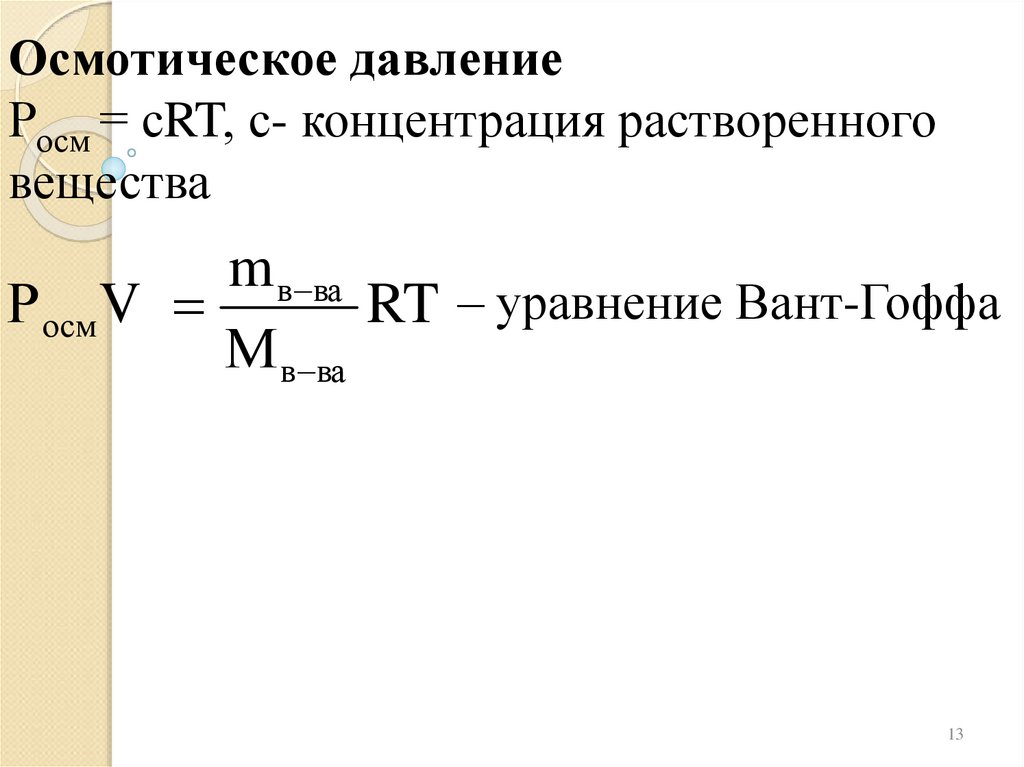
Осмотическое давлениеРосм = сRT, с- концентрация растворенного
вещества
m в ва
Р осм V
RT – уравнение Вант-Гоффа
М в ва
13
14.
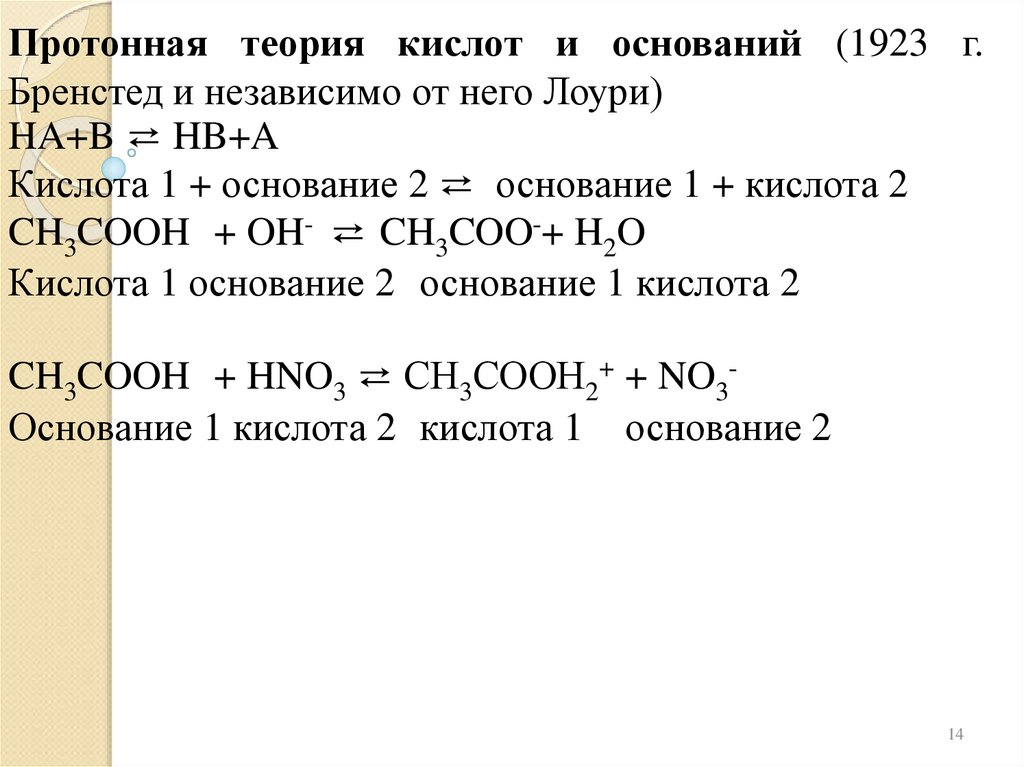
Протонная теория кислот и оснований (1923 г.Бренстед и независимо от него Лоури)
HA+B ⇄ HB+A
Кислота 1 + основание 2 ⇄ основание 1 + кислота 2
CH3COOH + OH- ⇄ CH3COO-+ H2O
Кислота 1 основание 2 основание 1 кислота 2
CH3COOH + HNO3 ⇄ СН3СООН2+ + NO3Основание 1 кислота 2 кислота 1 основание 2
14
15.
Буферные растворыЕсли 0,1М раствор HCl разбавить в 10 раз, то [Н+]
меньше в 10 раз (а pН увеличится на 1).
Если нейтрализовать полученный раствор кислоты
равным объемом щелочи СМ=10-2 М, то pН = 7 (среда
нейтральная).
Буферные растворы или буферные смеси:
СН3СООН+СН3СООNa и NH4OH+NH4Cl
15
16.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙДИССОЦИАЦИИ
17.
1887 году Сванте Аррениус –теория электролитической
диссоциации
Ионы «+» – катионы
и «–» – анионы
18.
дисNaCl
ас
Na+ + Cl–
Степень диссоциации ( )
n
100%
N
19.
Сильные кислотыHCl, HBr, HI, НNО3, H2SO4, НСlО4,
НСlО3, Н2СrО4, Н2Сr2О7, НМnО4
Сильные основания
LiOH, NaOH, KOH, RbOH, CsOH,
Ca(OH)2, Sr(OH)2, Ba(OH)2
20.
Константа равновесияСН3СООН ⇄ Н+ + СН3СОО–
К р Кд
СН СОО Н
3
СН3СООН
Kд (СН3СООН) = 1,8 10–5
Kд (НСN) = 8 10–10
21.
I. Н2СО3 ⇄ Н+ + НСО3–Н НСО
4,5 10
К
1
д
Н 2СО3
3
7
II. НСО3– ⇄ Н+ + СО3–2
Н СО
4,7 10
НСО
К
2
д
3
2
3
1
2
3
Кд Кд Кд
11
22.
Растворы слабых электролитовHCN ⇄ H+ + CN –
Исходные концентрации: с
0
0
После диссоциации:
с - с с с
Н СN
αcαc
α c - закон
КД
HCN c(1 α) 1 α разбавления
Оствальда
Для слабых электролитов << 1, поэтому
1- 1, откуда:
К
2
α
Д
с
22
23.
Равновесие в системе осадок- растворBaSO4 (тв.ф.) ⇄ Ba2+(раствор) +SO42–(раствор)
2
K дисс
2
[Ba ][SO 4 ] ; К [BaSO ] = [Ba2+][SO 2-]
д
4
4
[BaSO 4 ]
ПР BaSO 4 = Ba2+ SO42– = 1,1•10-10 (250С).
ПР BaSO 4 a Ba 2 a SO 2
4
23
24.
В общем случае для соли KtaAnb ,диссоциирующей по схеме
KtaAnb ⇄ aKt b+ + b AnaПР = aKtb+ a b Ana- b;
ПР = aKt a b An b
Kt An > ПР- условие образования
осадка из раствора малорастворимого
соединения.
СаСО3 ⇄ Са2+ + СО32При добавлении Cа(OH)2 равновесие
смещается влево.
24
25.
Водородный показательрН,
гидролиз солей
25
26.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫН2О ⇄ Н+ + ОН–
H OH
1,8 10
Kд
H 2O
16
26
27.
1 л = 1000 г / 18 г = 55.56 моль/л.т.е. [H2O] = 55.56 моль/л.
H OH H O K
2
д
1,8 10
16
55,56 10
14
К Н2О = [H+][OH-] = 10 -14
27
28.
Нейтральная среда [H+] = [OH–] = 10–7Кислая среда [H+] > 10–7 > [OH–]
Щелочная среда [H+] < 10–7 < [OH–]
28
29.
рН lg H[H+] = 10–7 pH = – lg 10–7 = 7 – нейтральная
[H+] = 10–3 pH = – lg 10–3 = 3 – кислая
[H+] = 10–11 pH = – lg 10–11 = 11 – щелочная
Увеличение кислотности
рН 0
1
2 3 4
5 6
Нейтральная
среда
7
Увеличение щелочности
8
9 10
11 12 13
29
30.
Гидроксильный показательрОН lg OH
pOH = – lg [OH–]
[ОH–] = 10–7
pОH = – lg 10–7 = 7 – нейтральная
[ОH–] = 10–4
pОH = – lg 10–4 = 4 – щелочная
[ОH–] = 10–12 pОH = – lg 10–12 = 12 – кислая
30
31.
3132.
ГИДРОЛИЗ СОЛЕЙI тип гидролиза солей
CH3COONa + H2O ⇄ CH3COOH + NaOH
14
10
Кг
К д к ты
32
33.
II тип гидролиза солейNH4Cl + H2O ⇄ NH4OH + НCl
14
10
Кг
К д основания
33
34.
III тип гидролиза солейCH3COONH4 + H2O ⇄ CH3COOH + NH4OH
14
10
Кг
К д к ты К д основания
34
35.
35Соль образованная сильным основанием и
сильной кислотой гидролизу не подвергается
NaCl + H2O гидролиз не идет
36.
Взаимный гидролизГидролиз солей протекает по схемам:
FeCl3 Fe+3 + HOH ⇄ FeOH+2 + H+
Na2CO3 CO3-2 + HOH ⇄ HCO3– + OH–
37.
При сливании солей они нейтрализуются.2FeCl3 + 3Na2CO3 ⇄ 6NaCl + Fe2(CO3)3
Fe2(CO3)3 + 6H2O
2Fe(OH)3 + 3H2O + 3CO2
Получаем:
2FeCl3 + 3Na2CO3 + 3H2O
⇄ 6NaCl + 2Fe(OH)3 + 3H2O + 3CO2
37















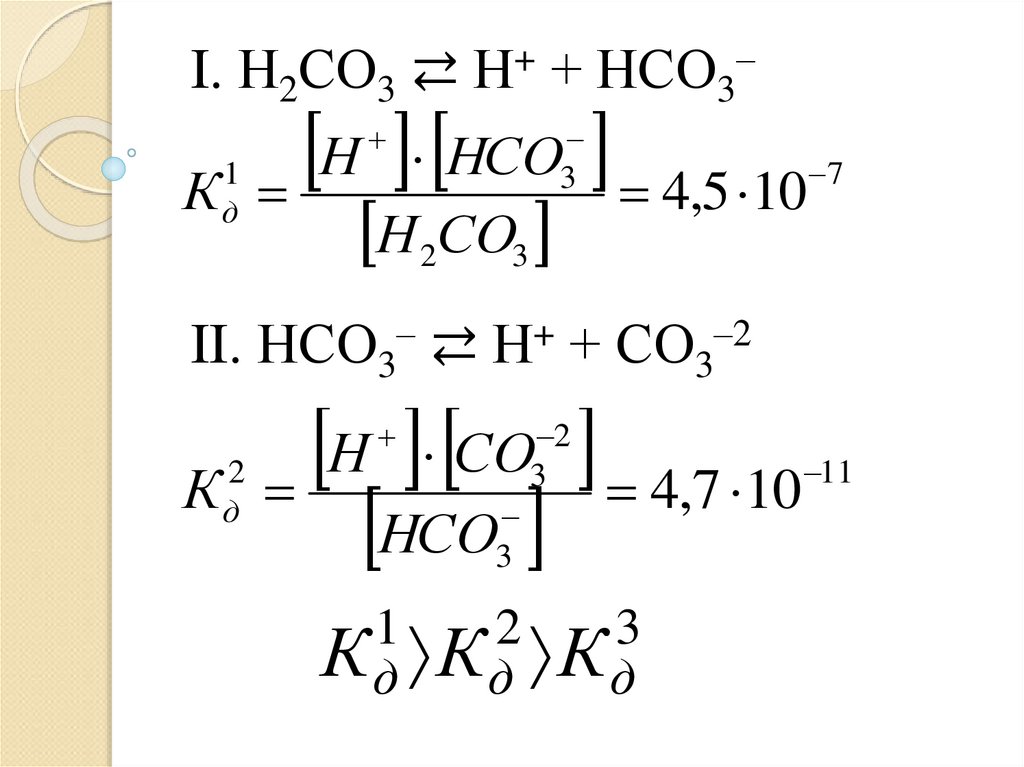





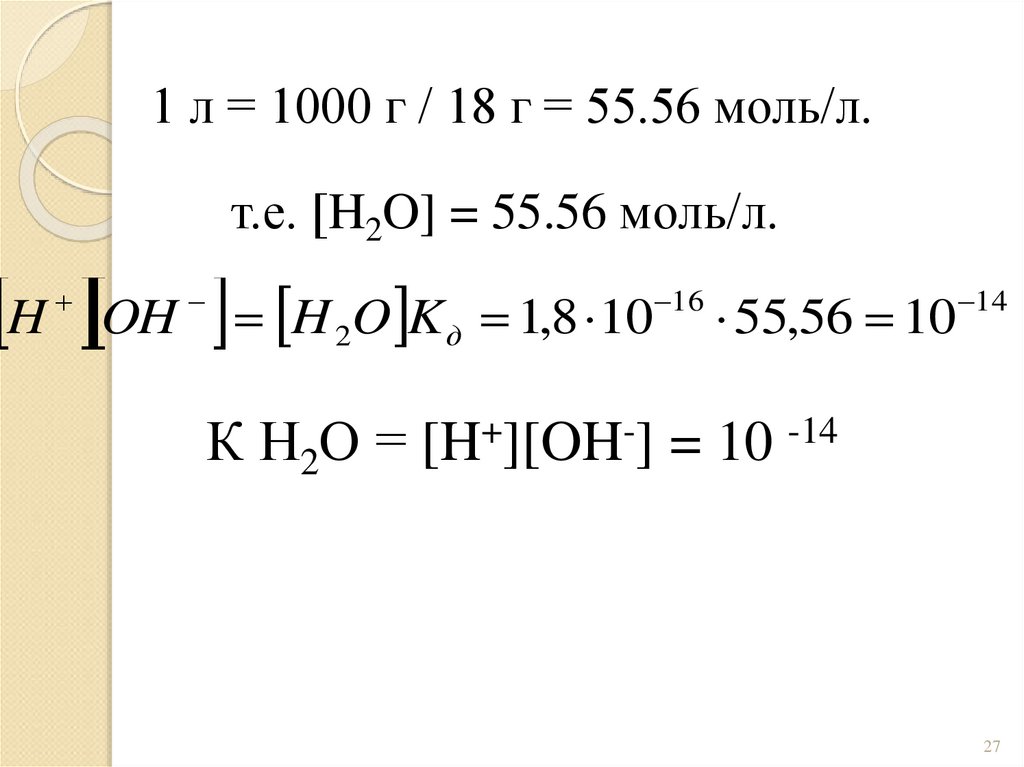










 Химия
Химия








