Похожие презентации:
Растворы. Лекция 7
1.
Тема №6РАСТВОРЫ
2.
Раствор – жидкая или твердая гомогенная система,состоящая из
компонентов
двух
или
более
ΔG < 0
S> 0
независимых
процесс
самопроизвольный
и необратимый
раствор
система достигает
равновесия
Отличительные свойства растворов:
1) от смесей – гомогенность
2) от химических соединений – переменность состава,
состав изменяется не скачками, а непрерывно.
3.
Газообразный р-рЖидкий р-р
воздух
морская вода
Твердый р-р
сплавы
4.
Раствор = растворитель + растворенное веществоРастворитель – вещество, находящееся в том же
агрегатном состоянии , что и раствор.
Растворенное вещество – находится в растворе в
меньшем количестве, относительно растворителя. Его
агрегатное состояние может отличаться от агрегатного
состояния раствора.
Водка - раствор спирта в воде
(содержание спирта 40%)
Медицинский спирт - раствор воды в спирте
(содержание спирта 96%)
5.
6.
7.
ЖИДКИЕ РАСТВОРЫКСl в воде
РbI2 в воде
8.
РАСТВОРИМОСТЬ ВЕЩЕСТВАРАСТВОРИМОСТЬ
или
КОЭФФИЦИЕНТ
РАСТВОРИМОСТИ (s) – определяется количеством
вещества в граммах, способного растворяться в 100 г
растворителя при данной температуре.
НЕНАСЫЩЕННЫЙ РАСТВОР- растворено вещества
меньше растворимости
ПЕРЕСЫЩЕННЫЙ РАСТВОР – растворено вещества
больше растворимости
9.
ВЛИЯНИЕ ПРИРОДЫ ВЕЩЕСТВА НА РАСТВОРИМОСТЬТип веществ
Хорошо растворимые
Растворимость при комнатной
температуре (20-25 0С)
Растворимость > 1 г на 100 г растворителя
H2SO4, NaOH, NaCl
Труднорастворимые
CaSO4, PbBr2, Sr(OH)2
Нерастворимые
алмаз,H2SiO3, SiO2
Растворимость 0.01-1.00 г на 100 г
растворителя
Растворимость < 0.01 г на 100 г
растворителя
Растворимость вещества тем выше, чем большим сходством
обладают его молекулы с молекулами растворителя:
Полярные молекулы веществ ( ионный или ковалентный полярный типы связи) –
хорошо растворимы в полярных растворителях (Кислоты, соли, щелочи
растворяются в H2O)
Неполярные вещества растворяются в неполярных растворителях (бензин легко
смешивается с CCl4)
10.
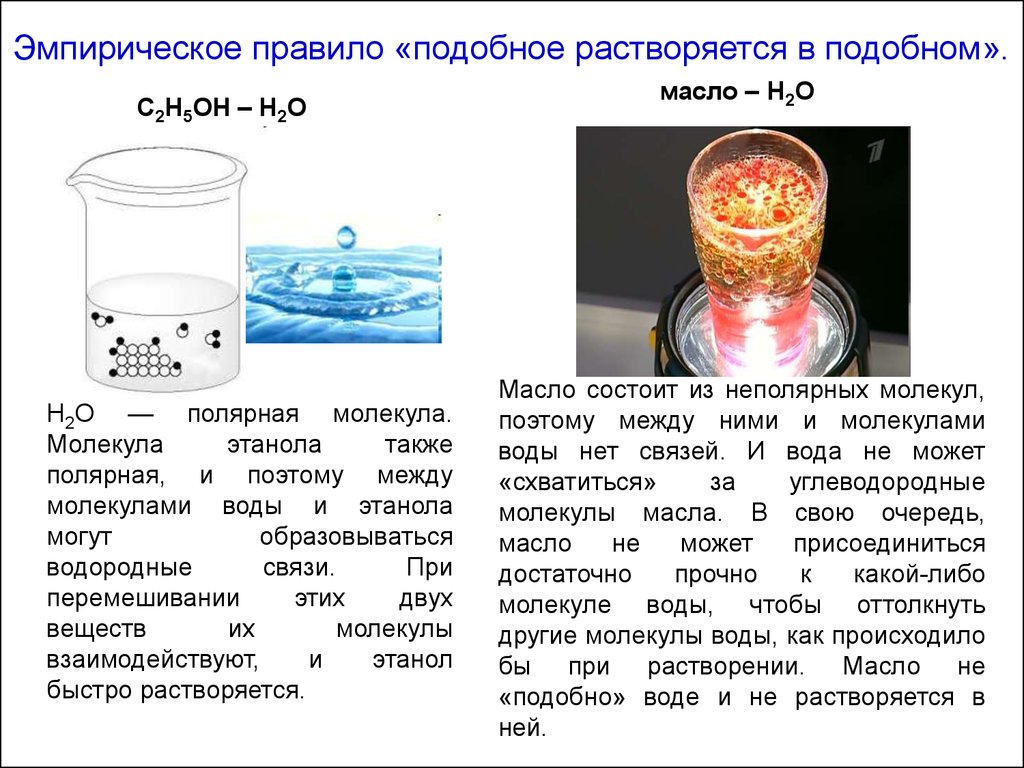
Эмпирическое правило «подобное растворяется в подобном».С2Н5ОН – Н2О
Н2О — полярная молекула.
Молекула
этанола
также
полярная, и поэтому между
молекулами воды и этанола
могут
образовываться
водородные
связи.
При
перемешивании
этих
двух
веществ
их
молекулы
взаимодействуют,
и
этанол
быстро растворяется.
масло – Н2О
Масло состоит из неполярных молекул,
поэтому между ними и молекулами
воды нет связей. И вода не может
«схватиться»
за
углеводородные
молекулы масла. В свою очередь,
масло
не
может
присоединиться
достаточно
прочно
к
какой-либо
молекуле воды, чтобы оттолкнуть
другие молекулы воды, как происходило
бы при растворении. Масло не
«подобно» воде и не растворяется в
ней.
11.
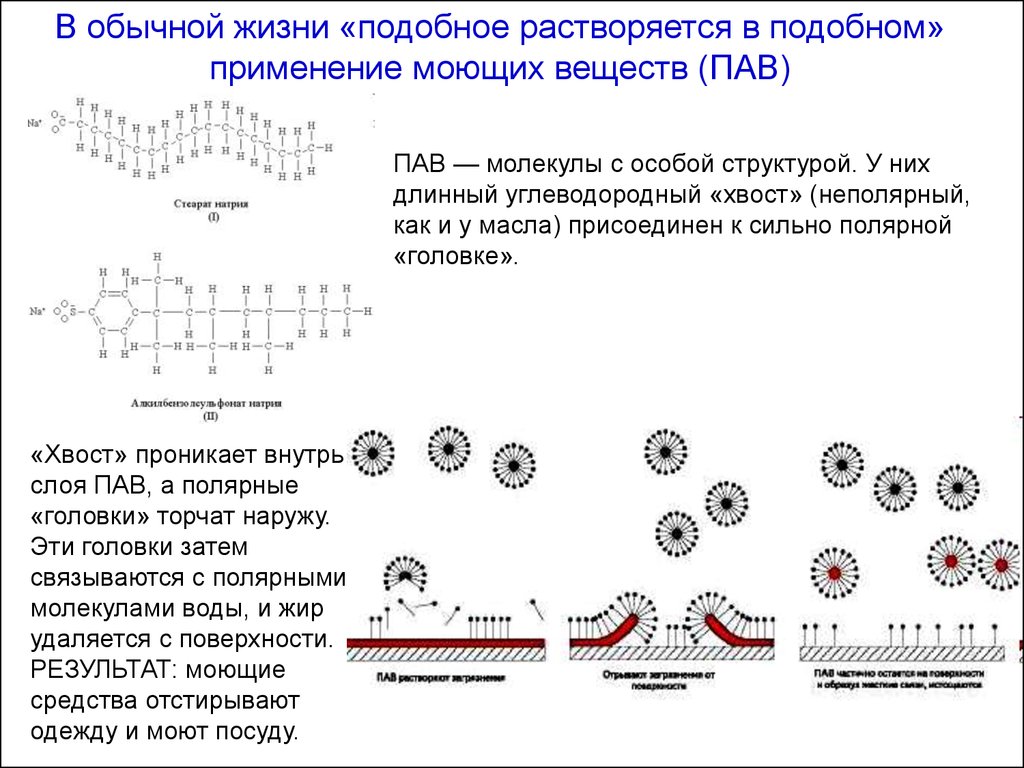
В обычной жизни «подобное растворяется в подобном»применение моющих веществ (ПАВ)
ПАВ — молекулы с особой структурой. У них
длинный углеводородный «хвост» (неполярный,
как и у масла) присоединен к сильно полярной
«головке».
«Хвост» проникает внутрь
слоя ПАВ, а полярные
«головки» торчат наружу.
Эти головки затем
связываются с полярными
молекулами воды, и жир
удаляется с поверхности.
РЕЗУЛЬТАТ: моющие
средства отстирывают
одежду и моют посуду.
12.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ НА РАСТВОРИМОСТЬ1.Растворимость жидкостей и твердых веществ обычно увеличивается при
повышении температуры, поскольку при этом возрастает энергия движения
(кинетическая энергия) молекул и уменьшается их взаимное притяжение.
2.Изменение давления мало влияет на растворимость жидкостей и твердых
веществ, так как объем при растворении меняется незначительно.
3. При повышении температуры растворимость газов снижается - кинетическая
энергия молекул возрастает, они быстрее движутся и легче "вырываются" из
растворителя.
4. Давление влияет на растворимость газов. Газ лучше растворяется при
увеличении давления.
Закон У.Генри ( 1803 г.): при постоянной температуре растворимость газа в
жидкости прямо пропорциональна его парциальному давлению над раствором
s K н р
s – массовая концентрация газа в насыщенном растворе
Кн- константа Генри (зависит от природы газа и
растворителя)
р - парциальное давление газа
13.
СЛЕДСТВИЕ: при одной и той же температуре-Повышение парциального давления газа приводит к поглощению (абсорбции)
газа раствором до тех пор пока концентрация газа в растворе не достигнет
нового равновесного значения
-Понижение парциального давления газа приведет к выделению части газа
(десорбции) из раствора
В ЖИЗНИ
Что заставляет O2
переходить в
венозную кровь, а
СО2 из венозной
крови в газовую
среду альвеол ?
Воздух
Состав,
объемные доли,
%
Парциальное
давление, кПа
О2
СО2
21
0.03
21.2
0.03
Выдыхаемый
16.3
4
16.5
4.05
Альвеолярный
14.2
5.2
14.4
5.25
8.0-8.7
6.1
Вдыхаемый
Венозная кровь
О2
СО2
О2 диффундирует в кровь
( в сторону пониженного
парц. давления)
СО2 диффундирует в
альвеолярное
пространство ( в сторону
пониженного парц.
давления)
14.
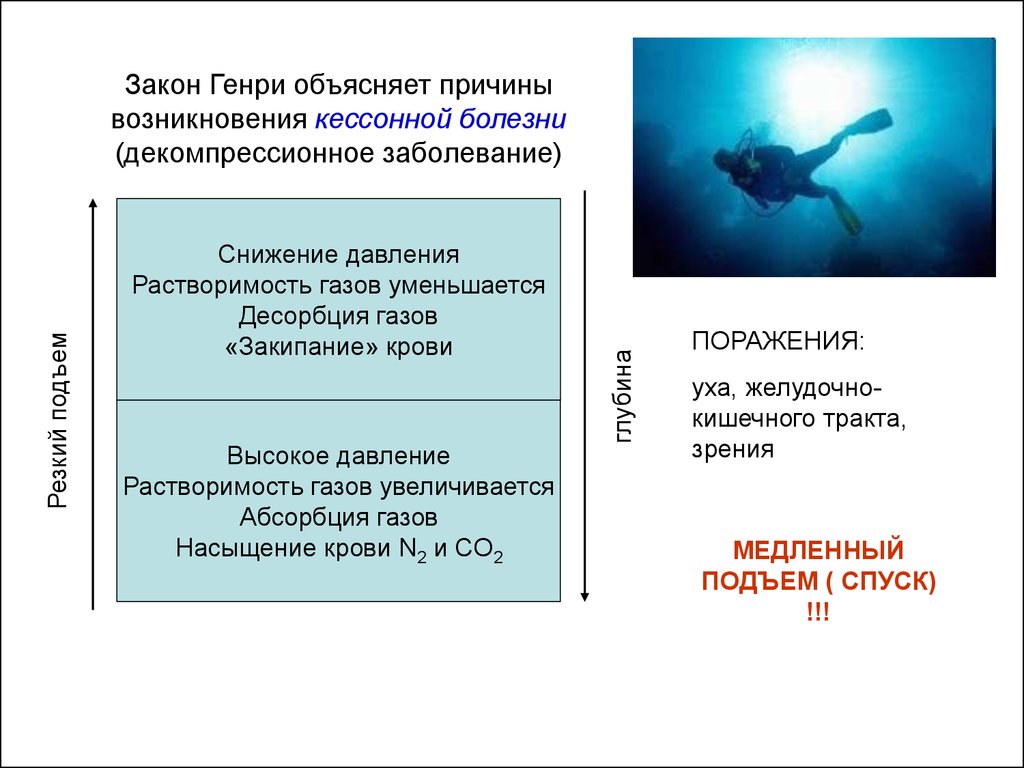
Снижение давленияРастворимость газов уменьшается
Десорбция газов
«Закипание» крови
Высокое давление
Растворимость газов увеличивается
Абсорбция газов
Насыщение крови N2 и CO2
глубина
Резкий подъем
Закон Генри объясняет причины
возникновения кессонной болезни
(декомпрессионное заболевание)
ПОРАЖЕНИЯ:
уха, желудочнокишечного тракта,
зрения
МЕДЛЕННЫЙ
ПОДЪЕМ ( СПУСК)
!!!
15.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИРАСТВОРОВ
m(X) – масса вещества , г.
16.
17.
Нормальность (нормальная концентрация) н(Х) – отношениеграмм-эквивалентов количества вещества к объему раствора.
n экв (X)
m(X)
н(Х)
,н
V
Э(Х) V
n – количество вещества Х, моль
m - масса вещества Х , г
V – объем раствора, л
Э – эквивалентная масса вещества Х, г×экв/ моль
Эоснования
Mrоснования
кол во[OH ]
Экислоты
Mrкислоты
кол во[H ]
Mrсоли
Эсоли
кол во[M] валентность[M]
18.
19.
ВЕЩЕСТВАЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
Растворы и расплавы
проводят электрический
ток
Растворы и расплавы не
проводят электрический
ток
Тип хим. связи: ионная,
ковалентная полярная
Тип хим. связи:
ковалентная неполярная
20.
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ21.
РАСТВОРЫИДЕАЛЬНЫЕ
РЕАЛЬНЫЕ
Растворы,
в
которых
не
никакого
взаимодействия
между
частицами
растворенного
вещества
и
растворителя.
Образование
идеальных
растворов не сопровождается
измененем энтропии
Чем больше разбавлен раствор, тем ближе его свойства к свойствам
идеального раствора
22.
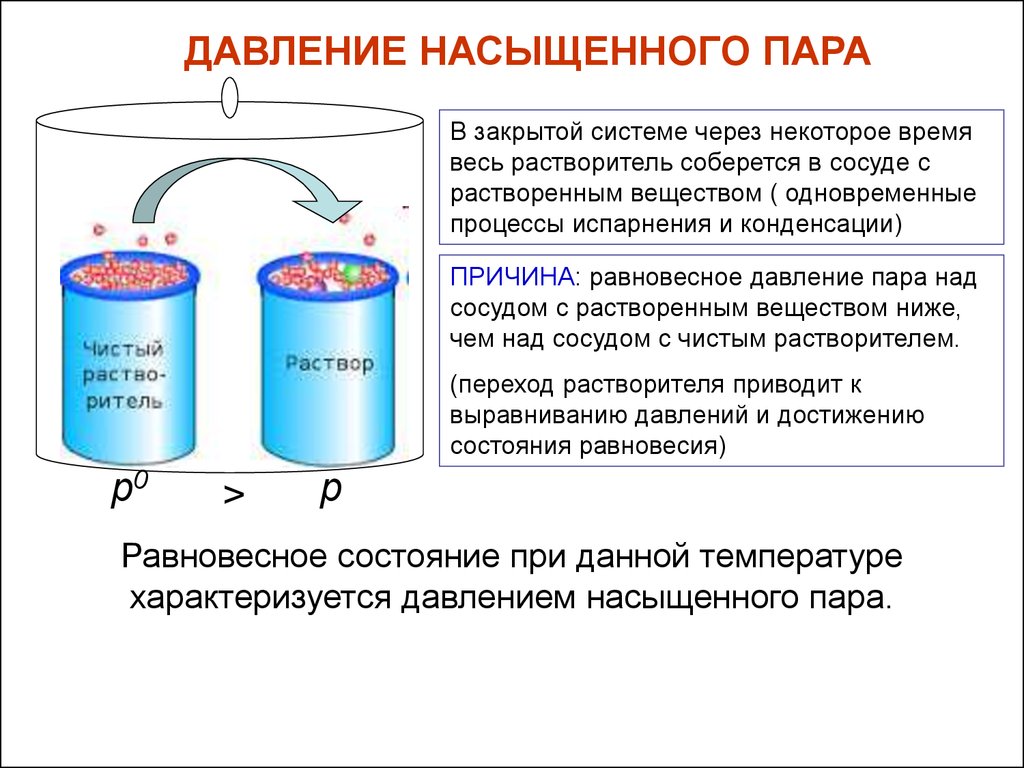
ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРАВ закрытой системе через некоторое время
весь растворитель соберется в сосуде с
растворенным веществом ( одновременные
процессы испарнения и конденсации)
ПРИЧИНА: равновесное давление пара над
сосудом с растворенным веществом ниже,
чем над сосудом с чистым растворителем.
(переход растворителя приводит к
выравниванию давлений и достижению
состояния равновесия)
р0
>
р
Равновесное состояние при данной температуре
характеризуется давлением насыщенного пара.
23.
Давление насыщенного пара описываетсяПЕРВЫМ ЗАКОНОМ Рауля
Первый закон Рауля (1882 г.) – относительное понижение давления пара
растворителя при образовании раствора прямо пропорционально мольной
доле растворенного вещества:
nв
p0 p
в
0
p
nв n р ля
χв – мольная доля растворенного вещества
p0 – давление пара над чистым растворителем
p – давление пара над раствором при той же температуре
n0 – число молей растворителя
n - число молей растворенного вещества
Давление пара растворителя над раствором зависит от природы
растворителя и мольной доли растворенного вещества и не
зависит от природы растворенного вещества
Применение: стакан с солью между оконными рамами предохранит
стекла от запотевания.
24.
ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРАТемпература кипения жидкости - это
температура,
при
которой
давление
насыщенного пара над жидкостью равно
внешнему давлению.
Температура кипения раствора.
• Известно, что давление насыщенного пара растворителя над
раствором меньше, чем давление насыщенного пара над чистым
растворителем.
Значит, чтобы давление насыщенного пара стало равным внешнему
давлению (условие закипания жидкости), раствор нужно нагреть до
более высокой температуры, чем чистый растворитель.
РЕЗУЛЬТАТ: температура кипения раствора (Т2) выше
температуры кипения чистого растворителя (Т1) на величину Δt:
Т2= Т1+ Δ t
25.
Повышение температуры кипения определяется поВТОРОМУ ЗАКОНУ Рауля:
повышение температуры кипения раствора прямо пропорционально
моляльной концентрации растворенного вещества
tкип
mв ва 1000
E Cm E
М в ва m р ля
где mв-ва– масса растворенного вещества (г),
Mв-ва– молярная масса растворенного вещества (г/моль),
mр-ля– масса растворителя (г),
Е– эбулиоскопическая константа (0С),
Е – равна повышению температуры кипения раствора при растворении
1 моль вещества в 1 кг растворителя. Величина Е зависит от природы
растворителя.
Для воды Е=0,52 0С∙моль-1.
26.
ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРАТемпература замерзания жидкости - это
температура, при которой давление насыщенного
пара над жидкостью равно давлению
насыщенного пара кристаллов жидкости (Ркр(ж) =
Рж).
Температура замерзания раствора.
• Если в равновесную систему лёд–вода (Ркр(тв)=Рж) ввести
растворимое вещество ( например сахар), то равновесие нарушится,
поскольку образовался раствор и давление насыщенного пара
понизится.
• Это нарушение связано с конденсацией избытка паров, протекающей с
выделением тепла.
• Чтобы восстановить равновесное состояние, необходимо в
соответствии с принципом Ле-Шателье понизить температуру на
величину Δ t.
Следовательно, температура замерзания раствора ниже
температуры замерзания (кристаллизации) чистого
растворителя.
27.
Понижение температуры замерзания определяется поВТОРОМУ ЗАКОНУ Рауля:
понижение температуры замерзания раствора прямо пропорционально
моляльной концентрации растворенного вещества, а именно:
mв ва 1000
t зам К Cm К
М в ва m р ля
где К – криоскопическая константа (0С), которая численно равна
понижению температуры замерзания при растворении 1 моль вещества в
1 кг растворителя.
Величина К зависит от природы растворителя.
Для воды К=1,86 0С∙моль-1.
Определение молекулярной массы по понижению температуры плавления при
известной массе растворенного вещества в 1000 г растворителя называется
Криоскопией. Метод предложил в 1885 г. французский физик и химик Франсуа
Мари Рауль
28.
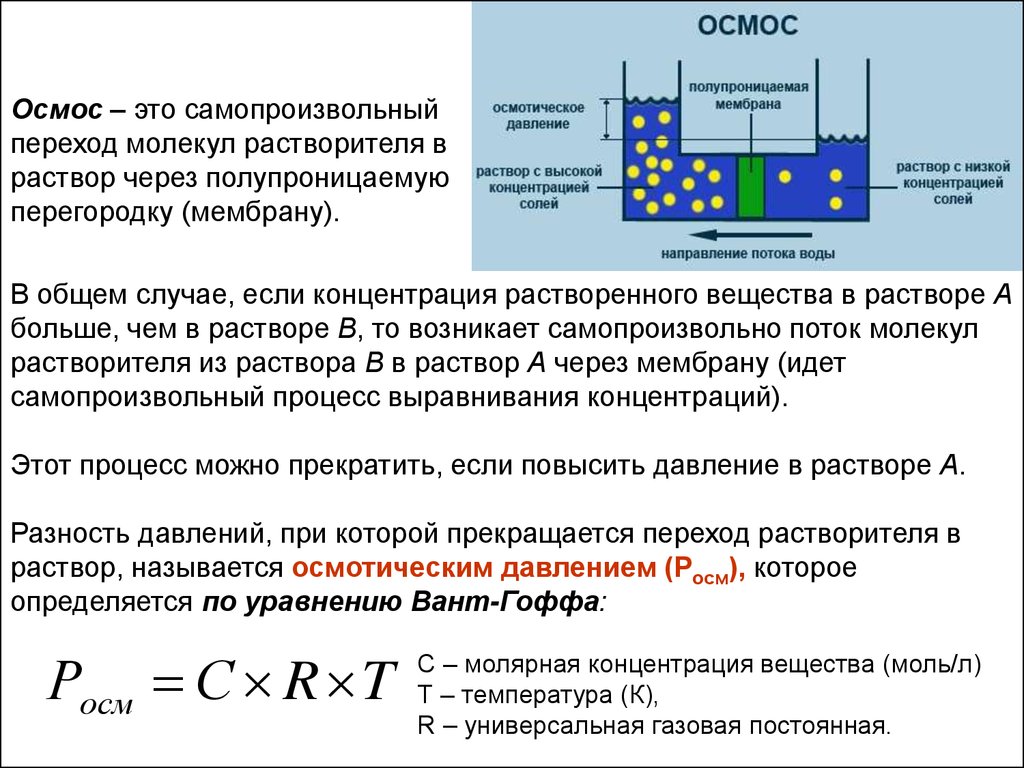
ОСМОС1.В сосуд с чистым растворителем
поместили емкость, в торце которой
закреплена полупроницаемая
мембрана
2.Полупроницаемая мембрана
пропускает молекулы растворителя и
не пропускает молекулы
растворенного вещества
3. В емкость налили раствор вещества в растворителе.
4. С течением времени происходит переход растворителя из сосуда в
емкость с раствором
5. РЕЗУЛЬТАТ: объем жидкости в емкости повысился
6. Когда разность давлений достигнет определенной величины переход
растворителя в раствор прекратиться
29.
Осмос – это самопроизвольныйпереход молекул растворителя в
раствор через полупроницаемую
перегородку (мембрану).
В общем случае, если концентрация растворенного вещества в растворе А
больше, чем в растворе В, то возникает самопроизвольно поток молекул
растворителя из раствора В в раствор А через мембрану (идет
самопроизвольный процесс выравнивания концентраций).
Этот процесс можно прекратить, если повысить давление в растворе А.
Разность давлений, при которой прекращается переход растворителя в
раствор, называется осмотическим давлением (Росм), которое
определяется по уравнению Вант-Гоффа:
Росм С R T
С – молярная концентрация вещества (моль/л)
Т – температура (К),
R – универсальная газовая постоянная.
30.
РАСТВОРЫ ЭЛЕКТРОЛИТОВПроцесс распада веществ на ионы называется
электролитическая диссоциация.
В общем виде: КА = К+ + А–.
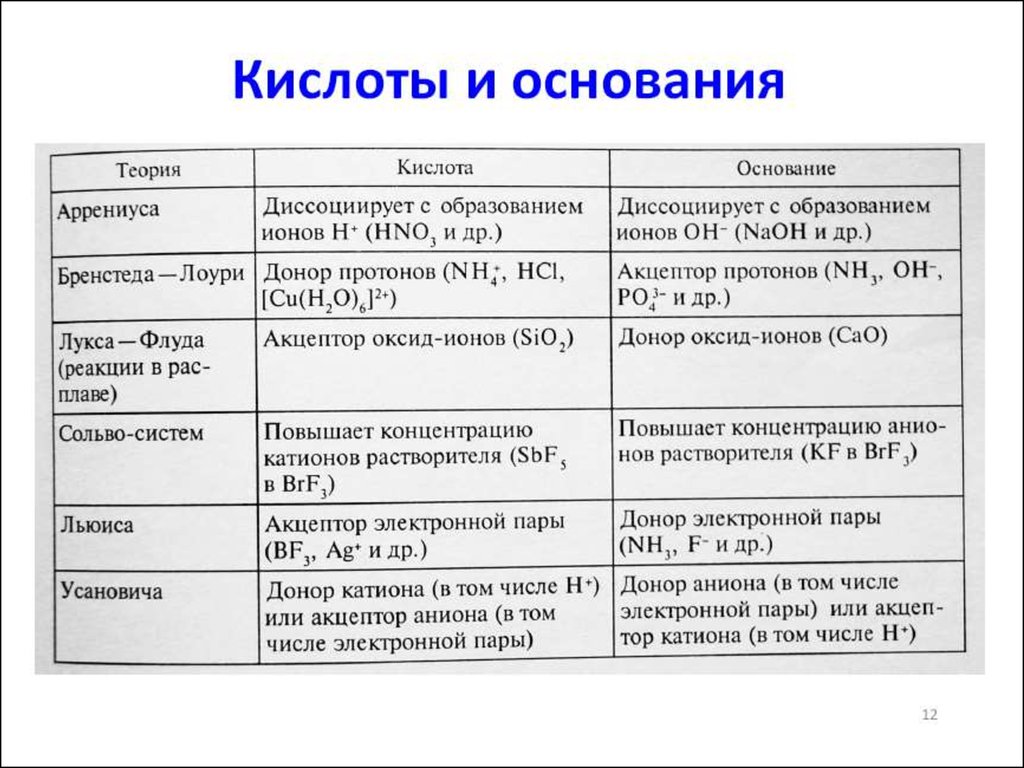
Основные положения ТЭД Аррениуса
1. Электролиты в растворе диссоциируют на ионы
Ион - атом или группа атомов, имеющая заряд
К+ - катионы; А- - анионы
31.
2. Ионы в растворе устойчивы и по свойствам резко отличаются от ихатомов.
NaCl = Na+ + Cl–
Частица
Электронная формула
Свойства
Na
1s22s22p63s1
(легко отдает 1 электрон)
Химически активен, окисляется на
воздухе, легко реагирует с водой
2Na + 2H2O → 2NaOH + H2↑
Na+
1s22s22p63s0
aналогичен Ne
устойчив, не окисляется
не имеет ни запаха, ни вкуса.
Cl
1s22s22p5
(легко присоединяет 1 электрон)
Cl2 – отравляющее вещество
Cl-
1s22s22p6
aналогичен Ne
безвреден
32.
3. Ионы в растворе перемещаются хаотично. Если враствор электролита опустить электроды и наложить
внешнее электрическое поле, то пойдет электрический
ток - ионы имеют направленное движение: катионы – к
катоду (–), анионы – к аноду (+).
4. Наряду с процессом диссоциации в растворе
электролита идет процесс ассоциации (моляризации),
т.е образование молекул из ионов.
диссоциация
NaCl
моляризация
Na+ + Cl–
33.
34.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ИОНЫХСОЕДИНЕНИЙ
aq
aq
NaClкр Na Сl
ИОН-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ С РАСТВОРИТЕЛЕМ:
1) Разрушение кристалла
2) Образование гидратированных ионов
35.
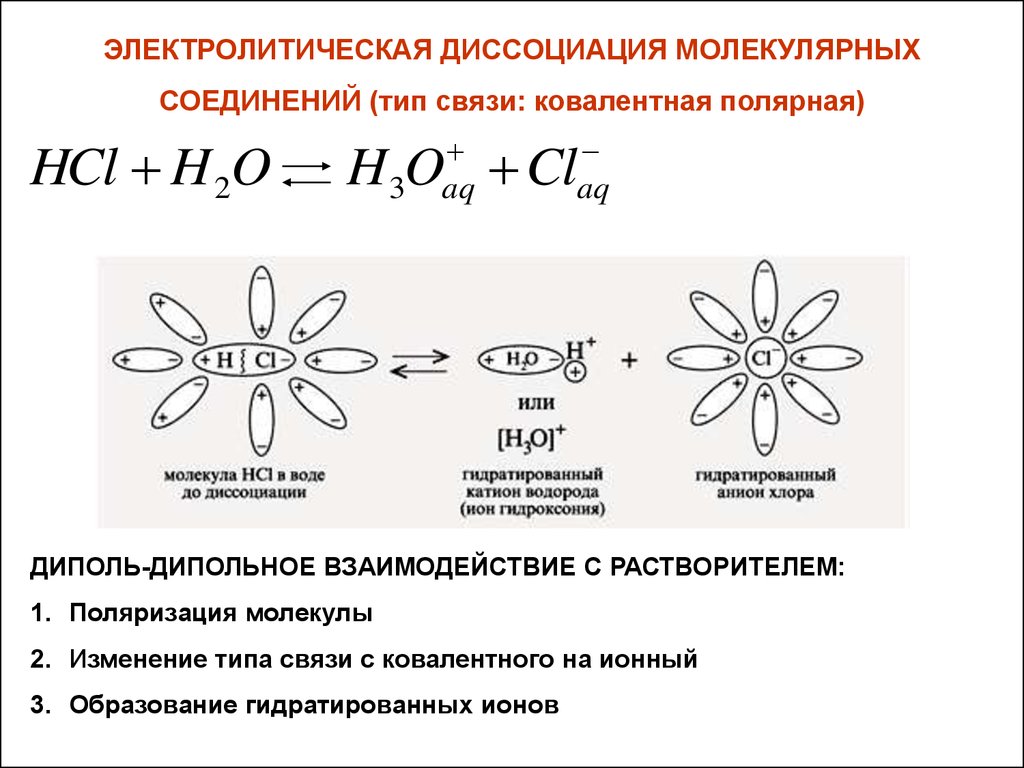
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ МОЛЕКУЛЯРНЫХСОЕДИНЕНИЙ (тип связи: ковалентная полярная)
aq
aq
HCl H 2O H3O Cl
ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ С РАСТВОРИТЕЛЕМ:
1. Поляризация молекулы
2. Изменение типа связи с ковалентного на ионный
3. Образование гидратированных ионов
36.
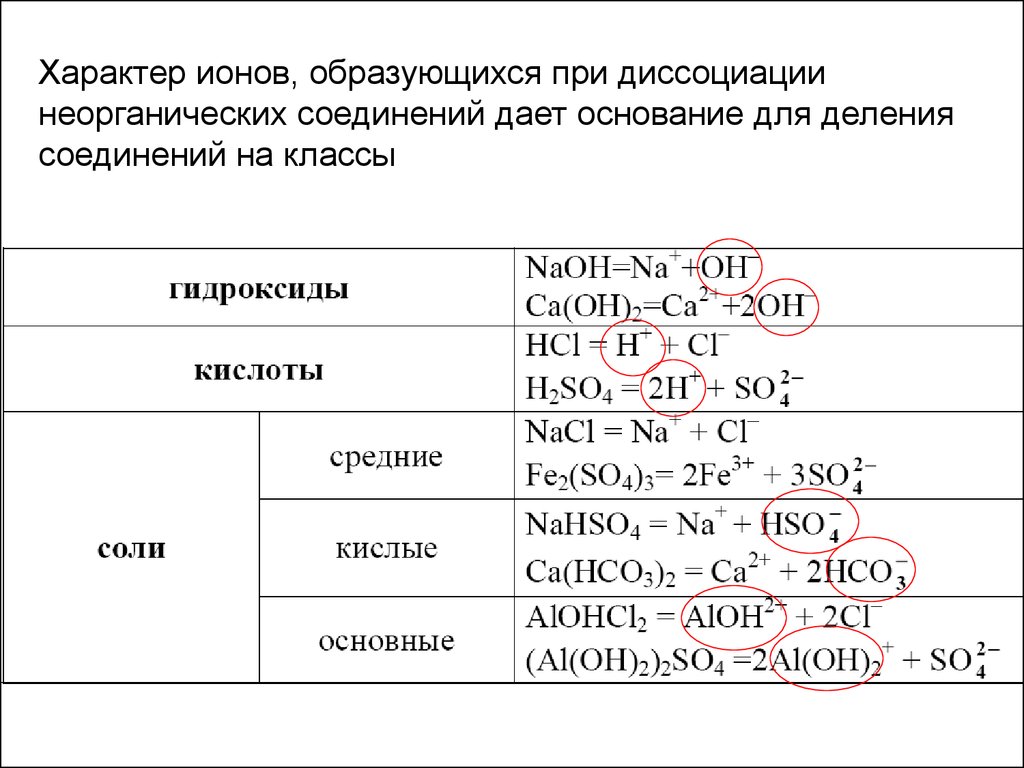
Характер ионов, образующихся при диссоциациинеорганических соединений дает основание для деления
соединений на классы
37.
СТЕПЕНЬ ДИССОЦИАЦИИСогласно теории Аррениуса, диссоциация электролитов – процесс
обратимый, поэтому в растворах электролитов наблюдается равновесие
между ионами и недиссоциированными молекулами.
Степень диссоциации (α): отношение
количества вещества молекул электролита,
распавшихся на ионы (n1, моль), к его
первоначальному (исходному) количеству
(n0, моль)
n1
100%
n0
СТЕПЕНЬ ДИССОЦИАЦИИ ЗАВИСИТ ОТ:
•Природы растворителя (чем более полярна молекула растворителя,
тем выше степень диссоциации)
•Температуры (электролитическая диссоциация-эндотермический
процесс, т.о. если Т↑, то α ↑; если Т↓, то α ↓
•Концентрации раствора ( чем больше разбавление раствора, тем
выше α )
38.
Сильныеэлектролиты
Электролиты средней
силы
Слабые
электролиты
α>30%
3%<α<30%
α<3%
HCl, HI, HBr, H2SO4, HF, LiOH, H3PO4
HNO3, HClO4
NaOH, KOH, RbOH,
CsOH,Ca(OH)2,
Ba(OH)2
Все
водорастворимые
соли
H2S, HNO2,
H3BO3
CH3COOH,
HCOOH
NH4OH,
Zn(OH)2,
Ni(OH)2
H2O
39.
ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТПри электролитической диссоциации в растворе увеличивается число
частиц растворенного вещества, т.е. увеличивается концентрация
частиц:
NaCl Na Cl
1моль 2 моль
Результат: коллигативные свойства электролитов отличаются от
аналогичных свойств неэлектролитов
Решение: в уравнения введен дополнительный множитель изотонический коэффициент Вант-Гоффа – i
Физический смысл изотонического коэффициента: i
показывает, во сколько раз увеличилось общее число
частиц в растворе в результате происшедшего частичного
или полного распада молекул на ионы.
40.
КОЛЛИГАТИВНЫЕ СВОЙСТВА растворов электролитов:mв ва 1000
nв
p0 p
t зам i К Cm i К
i
i
в
М в ва m р ля
p0
nв n р ля
Росм i С R T
tкип
mв ва 1000
i E Cm i E
М в ва m р ля
Существует математическая связь между
степенью диссоциации и изотоническим
коэффициентом:
i 1
k 1
где k – число ионов, образующихся при диссоциации одной молекулы
электролита.
Например,
для KCl=K+ + Cl- k=2,
для Al2(SO4)3=2Al3+ + 3SO42- k = 5
Для электролитов - α>0, i>1
Для неэлектролитов - α=0, i=1
41.
В растворах сильных электролитов ɑ ≈30%(ɑ =100% только в разбавленных растворах)
ПРИЧИНА: межионные взаимодействия в
растворах сильных электролитов
РЕЗУЛЬТАТ: «кажущаяся» концентрация ионов
ниже, чем теоретически вычисленная (исходя из
полной диссоциации )
ЧЕМ ВЫШЕ КОНЦЕНТРАЦИЯ РАСТВОРА
ЭЛЕКТРОЛИТА, ТЕМ БОЛЬШЕ ОТКЛОНЕНИЕ
КАЖУЩЕЙСЯ (экспериментальной) ɑкаж от истинной ɑ
42.
АКТИВНОСТЬ ИОНОВ (а)В сильных электролитах заменяет понятие
«концентрация»
а – отражает действительное состояние ионов в
растворе с учетом их взаимодействия с другими
частицами ( ионами, молекулами растворителя)
а f C
f – коэффициент активности
С - молярная концентрация электролита
Коэффициент активности (f) – является мерой отклонения
реального раствора электролита от идеального (бесконечно
разбавленного)
•Мало зависит от природы электролита
•Определяется ИОННОЙ СИЛОЙ раствора (I)
43.
ИОННАЯ СИЛА РАСТВОРА (I)величина, характеризующая силу электростатического
взаимодействия ионов в растворе электролита
-Не зависит от природы электролита
-Определяется концентрацией и зарядом ионов
1
2
I Ci Z i
2
44.
КОНСТАНТА ДИССОЦИАЦИИКонстанта электролитической
диссоциации КД– это константа
химического равновесия в растворе
электролита
КД
характеризует способность
электролита распадаться на ионы
KA K A
[ K ][ A ]
KД
[ KA]
КОНСТАНТА ДИССОЦИАЦИИ ЗАВИСИТ ОТ:
•Природы электролита
•Температуры
•От концентрации растворенного вещества (только для
слабых электролитов!!!)
45.
24
Na2 SO4 2 Na SO
2
2
4
[ Na ] [ SO ]
KД
[ Na 2 SO4 ]
a
KД
2
Na
aSO2
4
a Na 2 SO4
pK lg K
С
КД
1
2
К Д С
2
концентрационная
константа
термодинамическая
константа
Показатель константы
диссоциации константа
Закон разбавления Оствальда
(для слабых электролитов)
Для α<10%, КД<<10-5
46.
СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ[
H
][
H
PO
I
2
4]
H 3 PO4 H H 2PO4 K
7 10 3 сред.силы
[ H 3 PO4 ]
H 2 PO4 H HPO42
2
[
H
][
HPO
II
8
4 ]
K
6
10
слаб.
[ H 2 PO4 ]
HPO42 H PO43 K III
[ H ][ PO43 ]
14
2
10
оч.слаб.
2
[ HPO4 ]
3
3
[
H
]
[
PO
3
4 ]
H 3 PO4 3H PO 4 K общ
K I K II K III
[ H 3 PO4 ]
KI > KII > KIII
47.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.ПОКАЗАТЕЛЬ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА.
Вода является очень слабым электролитом.
Диссоциация воды протекает условно по уравнению :
H 2O H OH
устанавливается равновесие
[ H ][OH ]
KД
;
[ H 2O ]
K Д [ H 2O] [ H ][OH ]
K H 2O [ H ][OH ] 10 14
[ H ] [OH ] 10 14 10 7
const - ионное произведение воды
Нейтральная реакция среды
[ H ] [OH ]; [ H ] 10 7 моль / л, [OH ] 10 7 моль / л
[ H ] [OH ]; [ H ] 10 7 моль / л, [OH ] 10 7 моль / л
кислая
щелочная
48.
Прологарифмируем уравнение ионного произведения воды:lg[ H ] lg[ OH ] 14;
lg[ H ] lg[ OH ] 14
lg[ H ] pH
lg[ OH ] pOH
pH pOH 14
Показатель концентрации Н+
Показатель концентрации ОН-
В нейтральном растворе рН = рОН = 7.
В щелочной среде рН > 7, рОН < 7.
В кислых растворах рН < 7, рОН > 7.
49.
50.
БУФЕРНЫЕ РАСТВОРЫ- растворы, способные поддерживать рН раствора постоянным
при разбавлении или добавлении небольших количеств кслоты
или основания
1. Слабая кислота+ соль слабой кислоты CH3COOH+CH3COONa
Cкислоты
рН рК кисл lg
Ссоли
2. Слабое основание и его соль NH4OH + NH4Cl
Cоснования
рН 14 рК осн lg
Ссоли
3. Смесь солей многоосновных кислот Na2(HPO4) + Na(H2PO4)
Буферная емкость – определяется количеством вещества
(концентрацией) сильной кислоты или основания, которое
изменяет рН на 1
51.
Механизм поддержания рНВ системе два равновесных процесса:
СН 3СООН СН 3СОО Н
СН 3СООNa CH 3COO Na
РЕЗУЛЬТАТ: избыток CH3COO- подавляет диссоциацию СН3СООН ( по
принципу Ле-Шателье)
НСl CH 3COO CH 3COOH Cl
NaOH H Na H 2O
Na CH 3COO CH 3COONa
в системе
образуются
слабые
электролиты
52.
ИОННО-МОЛЕКЛЯРНЫЕ УРАВНЕНИЯ РЕАКЦИЙПротекание реакций в растворах электролитов описывается с помощью ,
ионно-молекулярных уравнений.
Правило составления уравнений: все малорастворимые, летучие
вещества и слабые электролиты записывают в виде молекул, а сильные,
легко растворимые – в виде ионов.
Не расписываются на ионы: газы, оксиды, нерастворимые соединения
Задание:
Составить ионно-молекулярные уравнения для реакции BaCl2 и Na2SO4 :
молекулярное уравнение
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl .
полное ионно-молекулярное уравнение
Ba 2 2Cl 2 Na SO42 BaSO4 2 Na 2Cl
сокращенное ионно-молекулярное уравнение:
Ba 2 SO42 BaSO4
53.
ГИДРОЛИЗвзаимодействие соли с водой, в результате, которого
образуется молекула или ион слабого электролита и
изменяется реакция среды
Протекание реакции гидролиза и кислотность водного раствора
соли зависят от природы соли
Zn SO4
Катион
слабого
основания
Zn(OH)2 +
Анион
сильной
кислоты
H2SO4
Na2 SO3
Катион
сильного
основания
NaOH
Анион
слабой
кислоты
+ H2SO3
54.
1. Соли, образованные сильными основаниями и сильнымикислотами, гидролизу не подвергаются
КNО3 + Н2О ≠
2. Соли, в состав которых входит катион сильного основания и анион
слабой кислоты, гидролизуются по I ступени с образованием слабой
кислоты или анион кислой соли, при гидролизе создают щелочную
среду (рН > 7),
K 2CO3 KOH KHCO3
2
3
3
2 K CO H 2O K OH K HCO
CO32 H 2O OH HCO3
Гидролиз
по аниону
рН>7
55.
3. Соли, в состав которых входит катион слабого основания и анионсильной кислоты гидролизуются по I ступени с образованием слабого
основания или катиона основной соли, при гидролизе создают кислую
среду (рН < 7)
СuCl2 H 2O HCl (CuOH )Cl
Cu 2 2Cl H 2O H Cl CuOH Cl
Cu 2 H 2O H CuOH
Гидролиз по
катиону
рН<7
56.
4. Соли, образованные слабыми основаниями и слабыми кислотами,подвергаются полному гидролизу, реакция водного раствора соли
близка к нейтральной.
Если слабые ионы однозарядные, так как в результате образуются два
слабых электролита:
СH 3COONH 4 H 2O CH 3COOH NH 4OH
CH 3COO NH 4 H 2O CH 3COOH NH 4OH
гидролиз
по Аниону и по Катиону
рН≈7
В случае, если ионы разнозарядные
:
(NН4)2S + Н2О → NН4HS + NН4ОH
NH4 + + S2– + Н2О→ NH4ОH + HS–
рН≤7
57.
Гидролиз карбонатов и сульфидов трехвалентных металлов (Fe(III),Al(III)) протекает необратимо:
Fe2 S3 H 2O Fe(OH )3 H 2 S
Al2 (CO3 )3 H 2O Al (OH )3 H 2CO3
H2O
CO2↑
58.
Смещение равновесия реакции гидролиза:1. Ввести в раствор соли кислоту (для связывания ОН-)
2. Ввести в раствор соли щелочь (для связывания Н+)
3. Ввести раствор другой соли , гидролиз которой приводит к накоплению Н+
для связывания ОН- или ОН- для связывания Н+
2 AlCl3 3Na 2 СО3 3H 2O 2 Al (OH )3 3H 2CO3 6 NaCl
Al 3 H 2 O H Al (OH ) 2
CO32 H 2O OH HCO3
H2O
CO2
4. Повышение температуры усиливает гидролиз соли, а понижение –
ослабляет (гидролиз – эндотермический процесс)
59.
СТЕПЕНЬ ГИДРОЛИЗАотношение числа
гидролизованных молекул
к общему числу молекул в
растворе
h
nгидр
nобщ
100%
Чем меньше концентрация соли, тем больше степень гидролиза (h).
! При разбавлении соли степь ее гидролиза возрастает
КОНСТАНТА ГИДРОЛИЗА
Определяет глубину протекания реакции гидролиза
h Cсоли
КГ
1 h
при h<<1
2
К Г h Cсоли
2
KГ
h
Ссоли
60.
Для соли слабого основания исильной кислоты
Для соли сильного основания
и слабой кислоты
Для соли слабого основания и
слабой кислоты
KГ
КГ
КГ
K H 2O
K Д ( основ ания)
К Н 2О
К Д ( кислоты)
К Н 2О
К Д ( осн) К Д ( кисл )
61.
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИСИСТЕМА: насыщенный раствор малорастворимого соединения,
находящийся в равновесии с твердой фазой
Km An( тв) mK
n
p p
m
p p
nA
Равновесие характеризует величина –
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ:
n m
m n
ПР ( К s) [ K ] [ A ]
Чем больше ПР, тем выше растворимость соединения
ПРИМЕР:
Сd (OH ) 2 Cd
2
2
2OH
2
ПРCd (OH ) 2 [Cd ][OH ]
62.
УСЛОВИЕ ВЫПАДЕНИЯ ОСАДКАn m
m n
ПРтабл < [ K ] [ A ]






















































 Химия
Химия








