Похожие презентации:
Получение оксидов
1.
2.
ПОЛУЧЕНИЕ ОКСИДОВ.1. Окисление простых веществ:
2Mg + O2 = 2MgO
C + O2 = CO2↑
2. Окисление сложных веществ:
2H2S + 3O2 = 2SO2↑ + 2H2O
3. Разложение солей кислородсодержащих кислот:
t
CaCO3 = CaO + CO2↑ (кроме карбонатов щелочных металлов!)
t
2Pb(NO3)2 = 2PbO + 4NO2↑ + O2↑
t
2AgNO3 = 2Ag + 2NO2↑ + O2↑
4. Разложение оснований (щёлочи не разлагаются!):
t
Cu(OH)2 = CuO↓ + H2O
5. Разложение кислородсодержащих кислот:
H2CO3 = CO2↑ + H2O
t
H2SO4 = SO3 + H2O
6. Взаимодействие кислот-окислителей (концентрированная серная и концентрированная и
разбавленная азотная кислоты) с металлами и некоторыми неметаллами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2H2O
Zn + 4HNO3(конц) = Zn(NO3)2 + 2NO2↑ + 2H2O
C + 4HNO3(разб) = CO2↑ + 4NO2↑ + 2H2O
3.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.1. Основные оксиды взаимодействуют с водой, образуя щёлочи, большинство
кислотных оксидов при взаимодействии с водой образуют кислоты (SiO2 c водой не
реагирует):
K2O + H2O = 2KOH
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
SO3 + H2O = H2SO4
Амфотерные оксиды с водой не взаимодействуют!
2. Основные и амфотерные оксиды при взаимодействии с кислотами образуют соль и
воду:
CuO + 2HCl = CuCl2 + H2O
CaO + H2SO4 = CaSO4 + H2O
ZnO + 2HCl = ZnCl2 + H2O
FeO + H2SO4 =FeSO4 + H2O
Кислотные оксиды с кислотами не взаимодействуют!
3. Кислотные оксиды при взаимодействии со щелочами образуют соль и воду:
CO2 + 2NaOH = Na2CO3 + H2O
SO3 + 2KOH = K2SO4 + H2O
4.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.4. Амфотерные оксиды при взаимодействии со щелочами в расплаве образуют
среднюю соль - «сухой» путь, а в растворе образуют комплексную соль, в которой
металл амфотерного оксида даст центральный атом комплексного иона «мокрый» путь:
t
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + Ca(OH)2 = Ca(AlO2)2 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + Ca(OH)2 + 3H2O = Сa[Al(OH)4]2
Основные оксиды с основаниями не взаимодействуют!
5. Основные и кислотные оксиды при взаимодействии образуют соли:
CaO + CO2 = CaCO3
CaO + N2O5 = Ca(NO3)2
Na2O + SO3 = Na2SO4
6. Амфотерные оксиды при взаимодействии с основными и кислотными оксидами
также образуют соли:
ZnO + CaO = CaZnO2
ZnO + SiO2 = ZnSiO3
Al2O3 + CaO = Ca(AlO2)2
5.
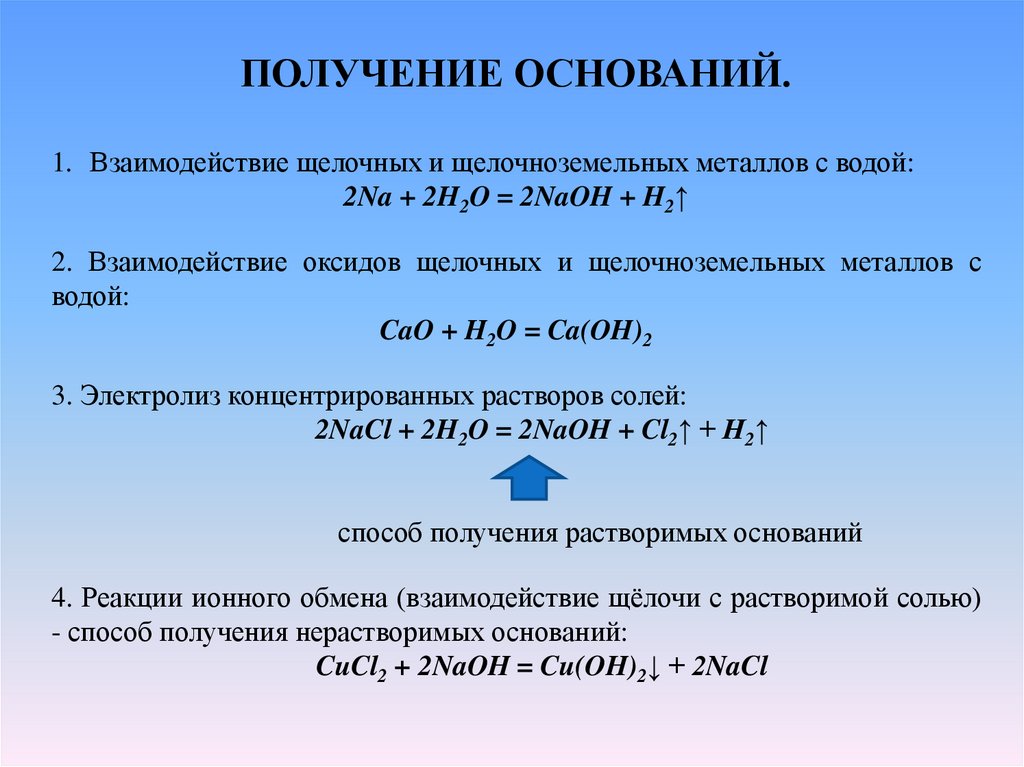
ПОЛУЧЕНИЕ ОСНОВАНИЙ.1. Взаимодействие щелочных и щелочноземельных металлов с водой:
2Na + 2H2O = 2NaOH + H2↑
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с
водой:
CaO + H2O = Ca(OH)2
3. Электролиз концентрированных растворов солей:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
способ получения растворимых оснований
4. Реакции ионного обмена (взаимодействие щёлочи с растворимой солью)
- способ получения нерастворимых оснований:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
6.
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ.1. Основания взаимодействуют с кислотами с образованием соли и воды
(реакция нейтрализации):
2KOH + H2SO4 = K2SO4 + 2H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
2. Основания взаимодействуют с солями:
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
NaOH + NH4NO3 = NaNO3 + NH3↑ + H2O
!Реакция протекает только в том случае, если образуется осадок,
выделяется аммиак (NH3)
!В такую реакцию вступают только щёлочи
3. Нерастворимые основания разлагаются при нагревании:
t
Cu(OH)2 = CuO↓ + H2O
7.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХГИДРОКСИДОВ.
1. Амфотерные гидроксиды взаимодействуют с кислотами:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Амфотерные гидроксиды взаимодействуют со щелочами:
а) сплавление («сухой» путь) - образуется средняя соль:
t
Zn(OH)2 + 2KOH = K2ZnO2 + 2H2O
б) в водном растворе - «мокрый» путь - образуется комплексная соль, в
которой металл амфотерного гидроксида даст центральный атом
комплексного иона:
Zn(OH)2 + 2KOH = K2[(ZnOH)4]






 Химия
Химия








