Похожие презентации:
Аммиак. Азот
1.
Азот2.
Азот – Элемент главнойподгруппы пятой группы
второго периода
периодической
системы химических
элементов Д. И.
Менделеева с
порядковым номером 7.
Обозначается
символом N (лат.
Nitrogenium).
Физические свойства:
газ без цвета, вкуса и
запаха. Формула – N2
3.
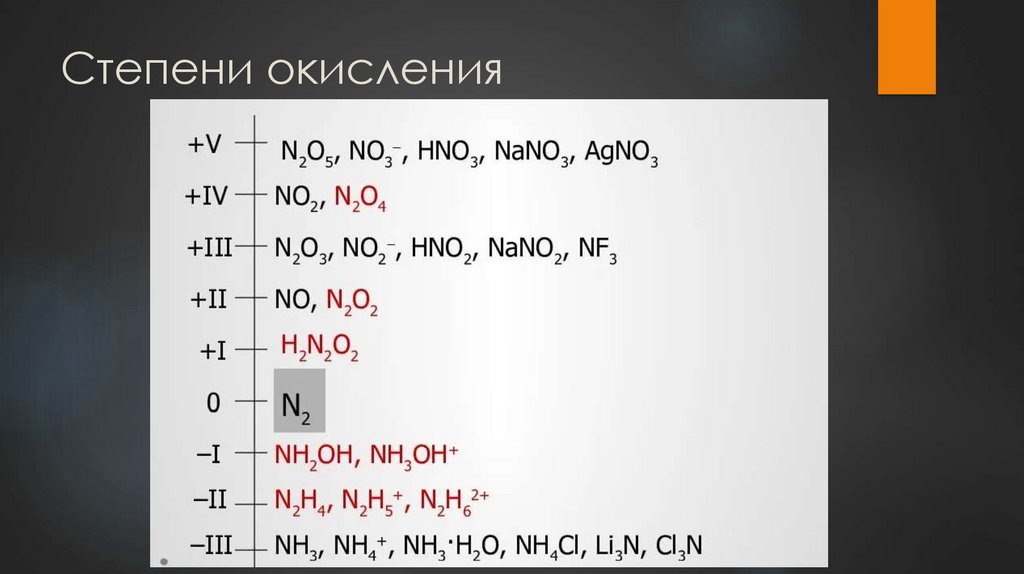
Степени окисления4.
Химические свойстваС металлами
На катализаторе
При
электричестве
Без нагрева:
N2 + 3H2 = 2NH3
N2 + O2 = 2NO
6Li + N2 = 2Li3N2
(Катализатор - Fe)
С нагревом:
3Mg + N2 =
Mg3N2(400°С)
2Al + N2 =
2AlN(900°С)
2Ti + N2 = 2TiN(800°С)
5.
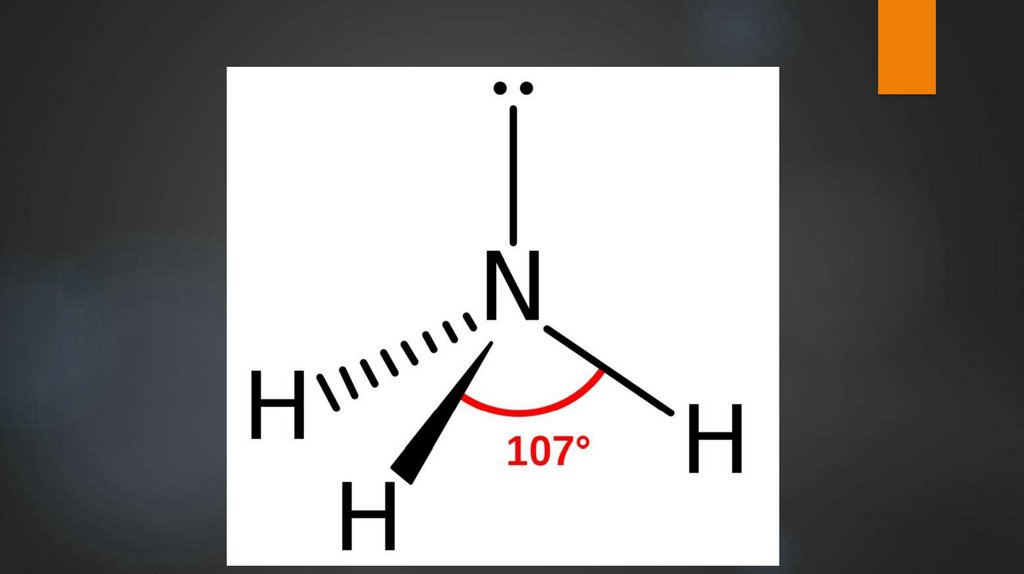
Аммиак6.
7.
8.
Физические свойства аммиакаБесцветный газ с резким запахом, почти в два раза
легче воздуха.
Ядовит, поэтому долго вдыхать его нельзя.
Хорошо растворим в воде:
25%
раствор называют аммиачной водой
10%
раствор называют нашатырным спиртом
9.
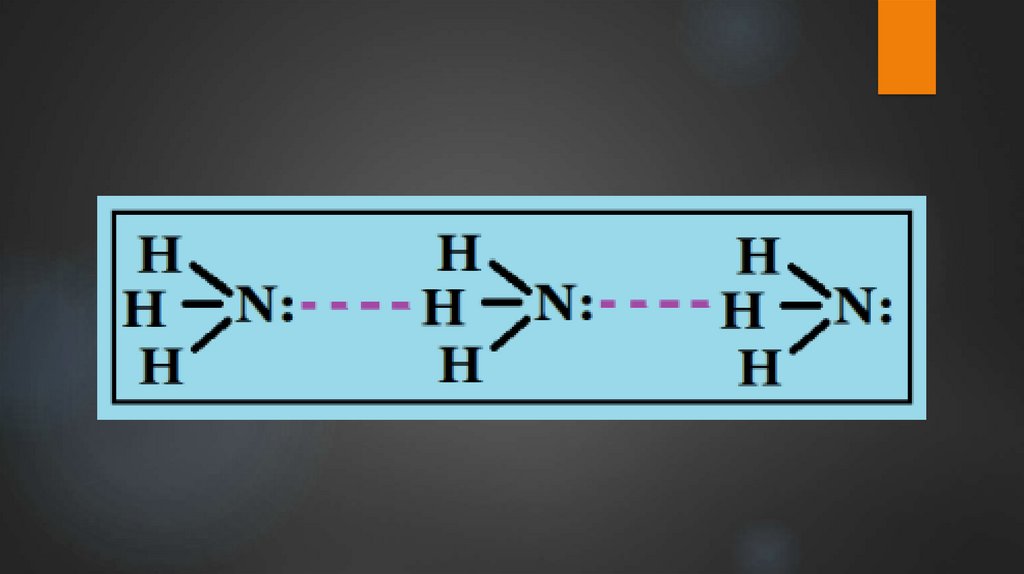
Химические свойства аммиакаВ водном растворе аммиак образует непрочное соединение –
гидрат аммиака NH3 • H2O, более известный как гидроксид
аммония NH4OH
Взаимодействует с кислотами, образуя соли аммония
Является сильным восстановителем
10.
Методы получения аммиакаНа производстве
N2 + 3H2 = 2NH3 (Катализатор Fe)
В лаборатории
Ca(OH)2 + 2NH4Cl = 2NH3 + CaCl
11.
Применение аммиакаВ промышленности
В быту
В медицине
В холодильных установках
Как чистящее средство
Для возбуждения дыхания
Для производства
минеральных удобрений
Как отбеливатель
Для стимуляции рвоты
Как удобрение
Для обработки рук
В виде примочек от укусов
насекомых
Как ингредиент различных
мазей
Для производства азотной
кислоты
Для получения взрывчатых
веществ
В производстве косметики
12.
Домашнее заданиеЗадача 1
Вычислите массу соли,
образовавшейся в результате
взаимодействия 5,4 г
хлороводорода с 5 л аммиака
(н. у.)
Задача 2
Вычислите объём аммиака
(н. у.), необходимого для полной
нейтрализации соляной кислоты
массой 231 г и массовой долей
НСl 17%.










 Химия
Химия








