Похожие презентации:
Металлическая химическая связь. Тема 2.5
1.
2.
1)2)
3)
Большинство имеет 1-3 электрона на внешнем
энергетическом уровне (исключения Sn, Pb – 4
электрона, Sb и Bi – 5 электронов, Po – 6
электронов).
Сравнительно большой радиус.
Имеют большое число свободных орбиталей.
3.
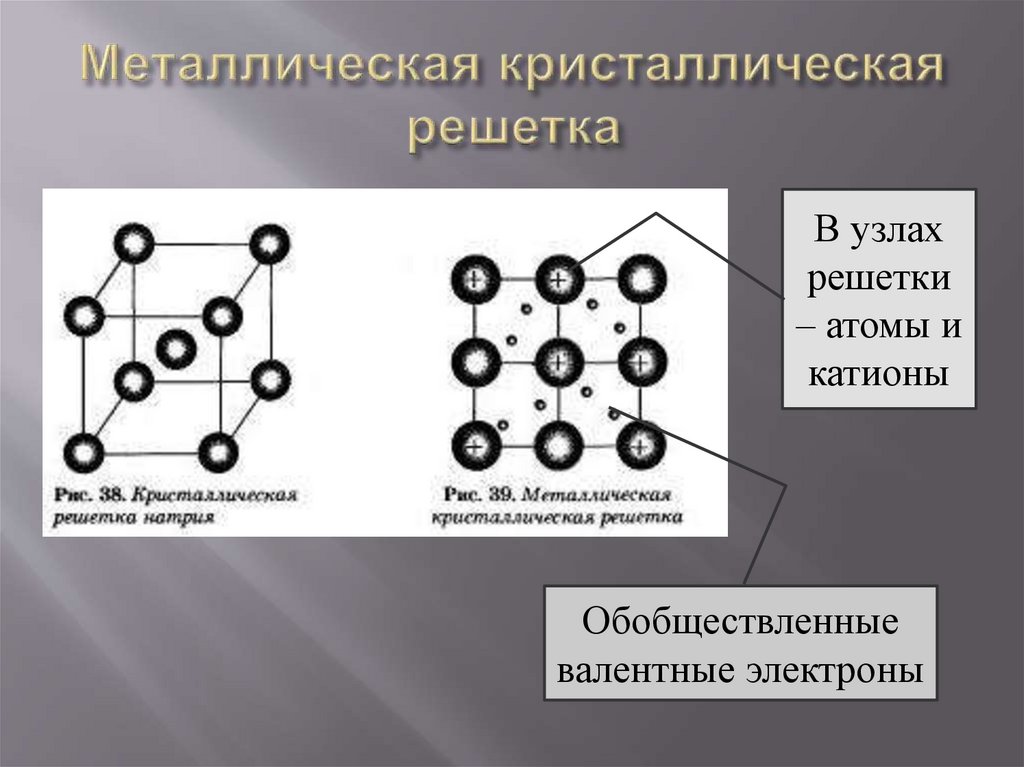
-это связь в металлах и сплавах между катионами
металлов,
расположенными
в
узлах
кристаллической
решетки,
которая
осуществляется обобществленными валентными
электронами.
Схема образования металлической связи:
4.
В узлахрешетки
– атомы и
катионы
Обобществленные
валентные электроны
5.
Металлическая кристаллическаярешетка и
металлическая химическая связь определяют все
наиболее характерные физические свойства
металлов:
- ковкость
- пластичность
- электропроводность
- теплопроводность
- металлический блеск
- способность к образованию сплавов.
6.
Важнейшее свойство металлов, выраженное в ихспособности
деформироваться
под
действием
механической нагрузки.
Объясняется тем, что под внешним воздействием одни
слои ионов в кристаллической решетке легко
смещаются относительно других без разрыва связи.
Наиболее пластичны золото, серебро и медь.
7.
способность проводить электрический ток.Обусловлена наличием в строении металлов совокупности
подвижных электронов, которые под действием
электрического поля приобретают направленное движение.
Лучшие проводники: Ag, Cu, Al
Худшие проводники: Mn, Pb, Hg, W.
-
8.
способность проводить энергию (теплоту) от болеенагретых частей тела к менее нагретым.
Объясняется высокой подвижностью электронов, которые,
сталкиваясь с колеблющимися в узлах решетки атомами и
ионами металлов, обмениваются с ними энергией.
С повышением температуры эти колебания ионов с
помощью электронов передаются другим ионам, и
температура тела быстро выравнивается.
-
9.
результат отражения световых лучей от гладкойметаллической поверхности.
Высокой световой отражательной способностью
обладают Hg, Ag, Pd, Al.
-
10.
Сплав - материал с металлическими свойствами,состоящий из двух или более компонентов, один из
которых обязательно металл.









 Химия
Химия








