Похожие презентации:
Азотная кислота
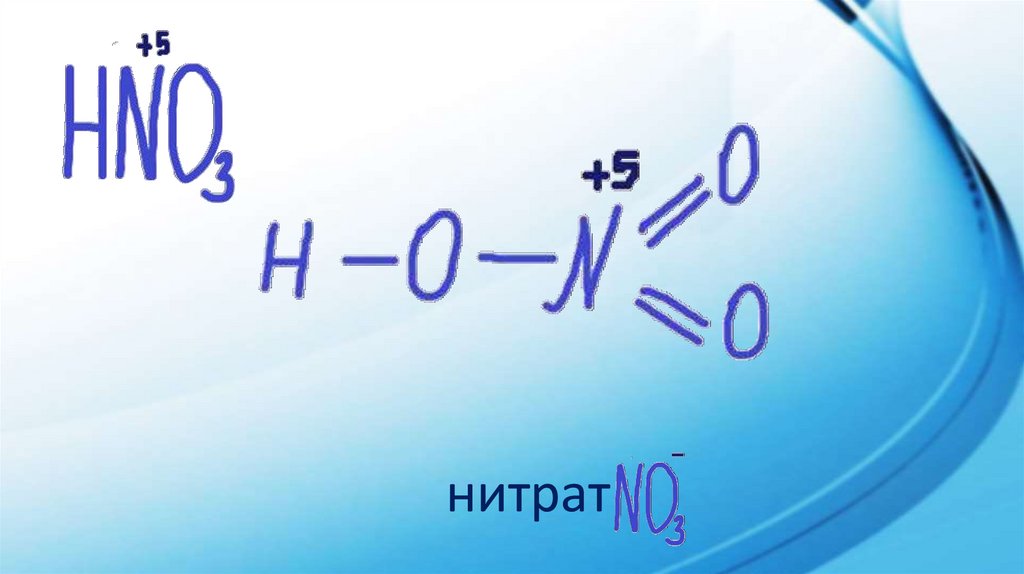
1.
2.
нитрат3.
Является сильной кислотой.Проявляет все свойства кислот:
- Реагирует с основаниями с образованием соли и воды;
- Реагирует с оксидами металлов (как основными, так и амфотерными)
с образованием соли и воды;
- Реагирует с солями более слабых кислот
- Реагирует с металлами.
Внимание!
Запишите уравнения реакций азотной кислоты:
- С гидроксидом алюминия;
- С оксидом железа(III);
- С карбонатом натрия.
Для реакции № 3 составьте сокращенное ионное уравнение.
4.
Специфическим свойством азотной кислоты является реакция с металлами.При взаимодействии азотной кислоты с металлами НИКОГДА не выделяется водород!!!
Это связано с тем, что азотная кислота – очень сильный окислитель.
Вместо водорода выделяются различные газообразные продукты, содержащие элемент
азот в разных степенях окисления.
Какой именно газ выделится, зависит от концентрации кислоты и от активности
металла, реагирующего с ней (то есть, от его положения в ряду напряжения).
5.
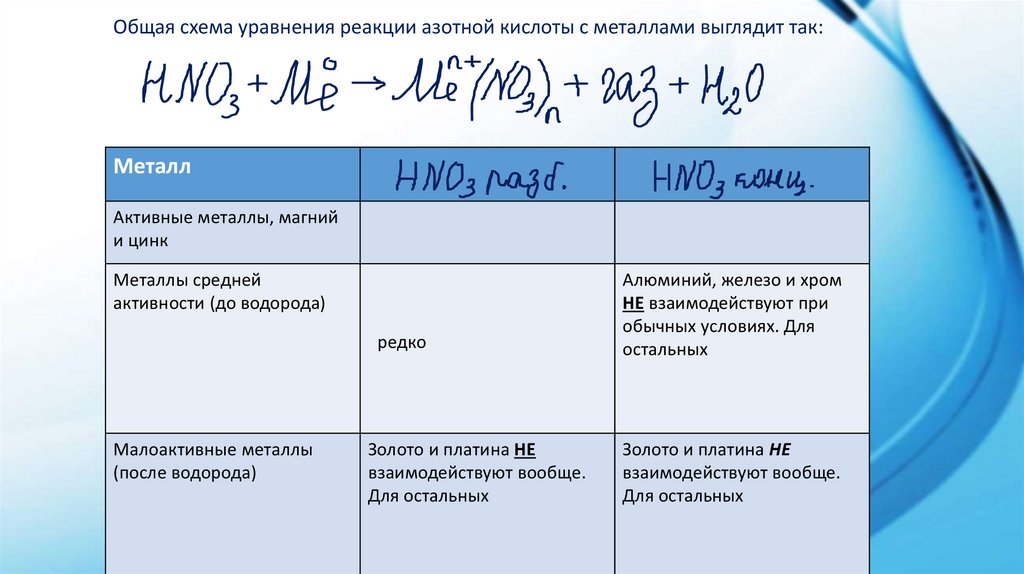
Общая схема уравнения реакции азотной кислоты с металлами выглядит так:Металл
Активные металлы, магний
и цинк
Металлы средней
активности (до водорода)
редко
Малоактивные металлы
(после водорода)
Золото и платина НЕ
взаимодействуют вообще.
Для остальных
Алюминий, железо и хром
НЕ взаимодействуют при
обычных условиях. Для
остальных
Золото и платина НЕ
взаимодействуют вообще.
Для остальных
6.
Внимание!Руководствуясь таблицей, приведенной на предыдущем слайде,
самостоятельно запишите реакции:
-
Разбавленная азотная кислота с цинком;
Разбавленная азотная кислота с алюминием;
Разбавленная азотная кислота с медью;
Концентрированная азотная кислота с ртутью.
Коэффициенты во всех реакциях расставьте методом электронного баланса.
Составьте электронную сетку, покажите переход электронов, укажите
окислитель и восстановитель.
При выполнении предстоящей контрольной работы следует иметь в
виду, что данные уравнения пишутся аналогично для цинка и магния,
для алюминия и железа, для меди и ртути.
7.
Производство азотной кислоты.1 стадия. Сжигание аммиака на катализаторе.
Это уравнение записано в теме «Аммиак».
2 стадия. Окисление оксида азота(II) до оксида азота(IV) кислородом.
Запишите это уравнение самостоятельно.
3 стадия. Растворение оксида азота(IV) в воде, обогащенной кислородом.
Рассмотрим оксид азота(IV). Это кислотный оксид, которому соответствуют сразу две кислоты:
азотная
и азотистая
Чтобы получить только азотную кислоту, необходимо добавить в воду кислород, то есть, окислитель:
Внимание! Самостоятельно расставьте коэффициенты в этом уравнении!
8.
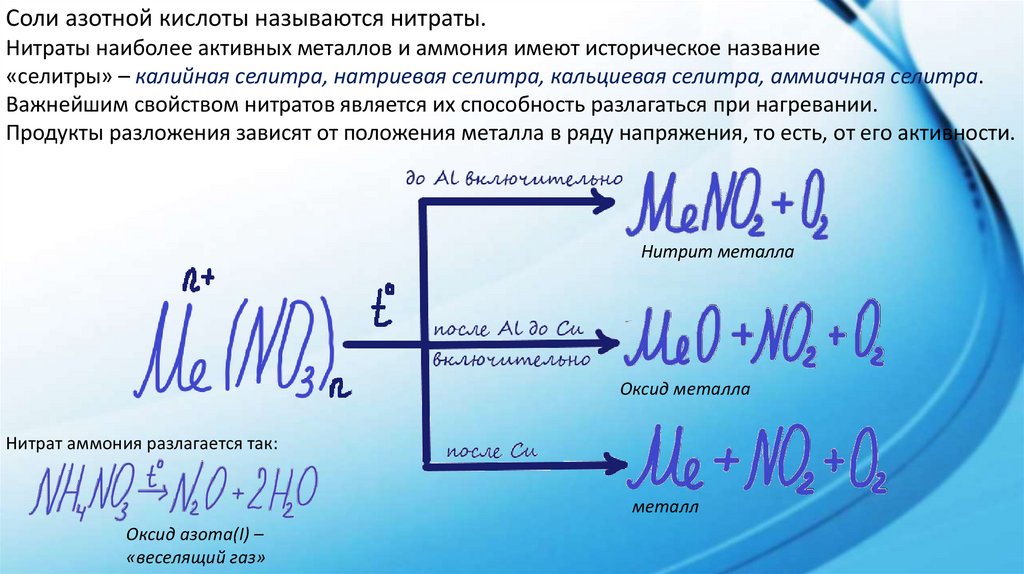
Соли азотной кислоты называются нитраты.Нитраты наиболее активных металлов и аммония имеют историческое название
«селитры» – калийная селитра, натриевая селитра, кальциевая селитра, аммиачная селитра.
Важнейшим свойством нитратов является их способность разлагаться при нагревании.
Продукты разложения зависят от положения металла в ряду напряжения, то есть, от его активности.
Нитрит металла
Оксид металла
Нитрат аммония разлагается так:
металл
Оксид азота(I) –
«веселящий газ»
9.
Внимание! Пользуясь схемой, приведенной на предыдущем слайде,запишите уравнения реакций разложения нитрата калия, нитрата меди и нитрата серебра.
Теперь понятно, почему избыток азотных удобрений в овощах
наносит вред организму человека – ведь нитраты калия и натрия,
даже при той температуре, которая наблюдается в организме,
способны разлагаться с образованием нитритов, которые и вызывают
пищевые отравления. Признаком избытка нитратов, к примеру, в помидорах
и арбузах являются крупные утолщения или прослойки белого цвета внутри мякоти.
Еще раз напоминаю:
Данная презентация является учебным материалом, и в ваших тетрадях
после изучения этого материала должен быть сформирован конспект урока,
включающий все уравнения, в том числе и написанные самостоятельно.
Вам необходимо прислать мне ВКонтакте фотографии страниц тетрадей с выполненным заданием.
Оценки будут выставлены в электронный журнал, и учтены при выведении оценок
за IV четверть.







 Химия
Химия








