Похожие презентации:
Структура и содержание КИМ-22
1.
2022Структура и содержание КИМ
ЕГЭ по химии в 2022 г.
Подходы к экспертному
оцениванию заданий
2.
2022Нормативные документы,
определяющие содержание КИМ ЕГЭ
Содержание КИМ ЕГЭ определяется на основе государственного
образовательного стандарта среднего общего образования (ФГОС) (приказ
Министерства образования и науки РФ от 17.05.2012 № 413 с изменениями,
внесенными приказами Минобр и науки РФ от 29.12.14 №1645, от
31.12.2015 №1578, от 29.06.2017 №613, приказами Минпрос РФ от
24.09.2020 № 519, от 11.12.2020 № 712) с учётом примерной основной
образовательной программы среднего общего образования (одобрена
решением федерального учебно-методического объединения по общему
образованию (протокол от 28.06.2016 №2/16з).
3.
2022Документы, регламентирующие
содержание и структуру КИМ ЕГЭ по химии
Кодификатор элементов содержания и требований к уровню
подготовки выпускников образовательных организаций для
проведения ЕГЭ по химии.
Спецификация контрольных измерительных материалов для
проведения в 2022 году государственной итоговой аттестации
по химии (ЕГЭ).
Демонстрационный вариант контрольных измерительных
материалов ЕГЭ 2022 года по химии.
4.
Кодификатор2022
В кодификаторе перечислены элементы содержания курса химии
— ведущие понятия, основные закономерности, фактологические
сведения о веществах и реакциях, усвоение которых будет
обязательно проверяться на экзамене. В кодификатор не
включены требования к результатам освоения программы и
элементы содержания, достижение которых не может быть
проверено в рамках ГИА.
Состоит из двух разделов:
Раздел 1. Перечень требований к уровню подготовки, проверяемых
на ЕГЭ по химии.
Раздел 2. Перечень элементов содержания, проверяемых на ЕГЭ по
химии.
5.
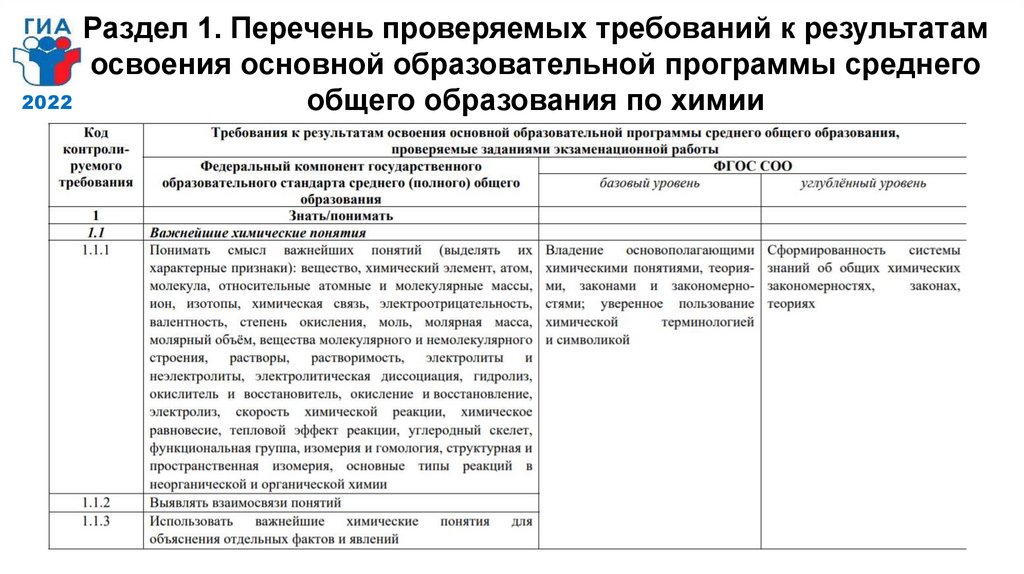
2022Раздел 1. Перечень проверяемых требований к результатам
освоения основной образовательной программы среднего
общего образования по химии
6.
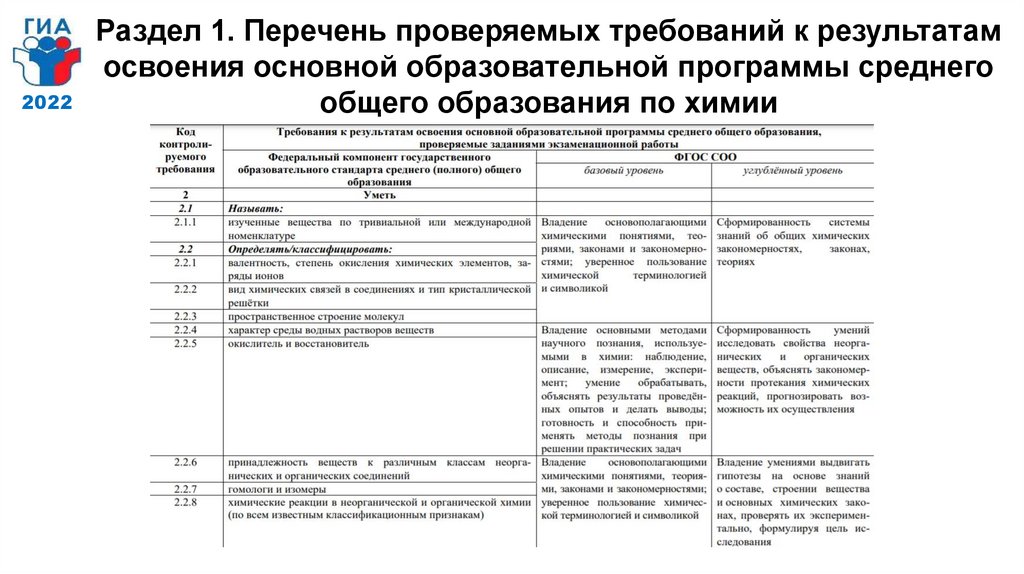
2022Раздел 1. Перечень проверяемых требований к результатам
освоения основной образовательной программы среднего
общего образования по химии
7.
2022Раздел 2.
Перечень элементов содержания, проверяемых на едином
государственном экзамене по химии
8.
2022Раздел 2.
Перечень элементов содержания, проверяемых на едином
государственном экзамене по химии
9.
2022Раздел 2.
Перечень элементов содержания, проверяемых на едином
государственном экзамене по химии
10.
2022Спецификация
контрольных
измерительных
материалов для проведения в 2022 году ЕГЭ по
химии
Содержит информацию о назначении экзаменационной работы,
изменениях в ее содержании и структуре;
Характеризует структуру и содержание экзаменационной работы;
Характеризует многообразие форм заданий, включенных в
варианты и систему оценивания;
Описаны изменения, внесенные в КИМ ГИА текущего года;
Названы условия проведения экзамена, разрешенное для
использования оборудование и справочные материалы;
Включает обобщенный план экзаменационного варианта.
11.
Обобщённый план экзаменационного варианта2022
Для каждой позиции в плане указаны:
проверяемые элементы содержания и их коды по
кодификатору;
коды требований к уровню подготовки;
уровень сложности задания;
максимальный балл за выполнение каждого задания;
примерное время выполнения задания (мин.)
12.
Демонстрационный вариант 2022 г.2022
Позволяет получить представление о том, сколько заданий
в экзаменационном варианте, какие виды заданий
включаются в работу, каков уровень сложности заданий,
какие требования предъявляются к записи ответов на
задания.
«При ознакомлении с Демонстрационным вариантом
следует иметь в виду, что задания, включённые в
демонстрационный вариант, не отражают всех элементов
содержания, которые будут проверяться с помощью
вариантов КИМ в 2022 году (см. обобщенный план
экзаменационного вариант).
13.
Демонстрационный вариант 2022 г.2021
В демонстрационном варианте представлены конкретные
примеры заданий, не исчерпывающие всего многообразия
возможных формулировок заданий на каждой позиции варианта
экзаменационной работы.
В демонстрационном варианте представлено по несколько
примеров заданий на некоторые позиции экзаменационной
работы. В реальных вариантах экзаменационной работы на
каждую позицию будет предложено только одно задание.
Приведённые критерии оценки выполнения заданий с
развёрнутым ответом, включённые в этот вариант, дают
представление о требованиях к полноте и правильности записи
развёрнутого ответа.
14.
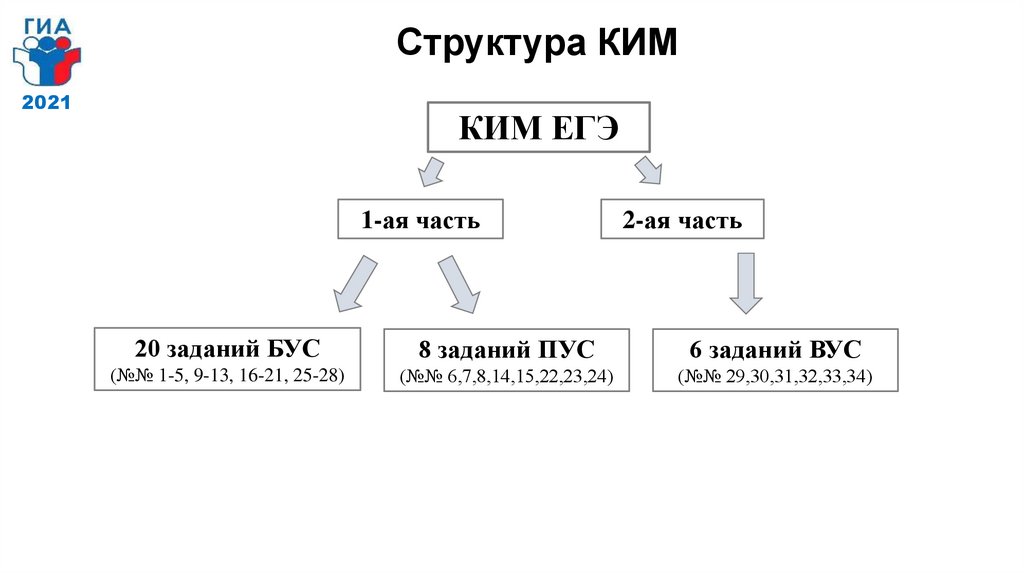
Структура КИМ2021
КИМ ЕГЭ
1-ая часть
2-ая часть
20 заданий БУС
8 заданий ПУС
6 заданий ВУС
(№№ 1-5, 9-13, 16-21, 25-28)
(№№ 6,7,8,14,15,22,23,24)
(№№ 29,30,31,32,33,34)
15.
2022Подходы к отбору
содержания заданий части 2
1) значимость проверяемого материала для общеобразовательной
подготовки выпускников средней школы;
2) деятельностная и практико-ориентированная направленность;
3) метапредметная составляющая заданий;
4) высокая дифференцирующая способность заданий: по
содержательнию и умениями;
5) вариативность в решении заданий (творческая составляющая), т.е.
уход от единообразия в решениях.
16.
2022Особенности заданий части 2
КИМ ЕГЭ по химии
В системе КИМ ЕГЭ заданиям с развёрнутым ответом отводится
центральная роль в определении уровня подготовки наиболее
подготовленных выпускников.
Задания с развернутым ответом предусматривают комплексную
проверку нескольких (двух и более) элементов содержания и
умений из различных разделов курса химии.
Комбинирование проверяемых элементов содержания и умений
является их важнейшей особенностью этих заданиях.
17.
Направленность заданий с развёрнутым ответом2022
Выполнение заданий с развернутым ответом требует от выпускника:
прочных системных теоретических знаний из различных разделов
курса химии;
сформированных умений применять эти знания в различных учебных
ситуациях;
последовательно и логично выстраивать ответ, устанавливать
причинно-следственные связи, делать выводы и заключения;
приводить аргументы (элементы решения) в пользу высказанной точки
зрения;
преобразовывать информацию из текстовой в формульную систему и
т.п.
18.
2022Задания с развёрнутым ответом проверяют
умения:
– объяснять обусловленность свойств и применения веществ их
составом и строением, характер взаимного влияния атомов в
молекулах органических соединений, взаимосвязь неорганических и
органических веществ, сущность и закономерность протекания
изученных типов реакций;
– проводить расчёты указанных физических величин по
представленным в условии задания данным, а также
комбинированные расчёты по уравнениям химических реакций.
19.
2022Инструкция перед критериями
оценивания части 2
При
наличии
уравнений
химических
реакций,
отражающих
дополнительные/альтернативные
химические
превращения,
не
противоречащие
условиям заданий, а также соответствующих им
расчётов (в заданиях 33 и 34), эксперт оценивает
правильность представленного экзаменуемым варианта
решения в соответствии со шкалой и критериями
оценивания.
20.
Оценивание заданий с РО2022
По результатам первой и второй проверок эксперты независимо друг от друга
выставляют баллы за каждый ответ на задания экзаменационной работы ЕГЭ
с развёрнутым ответом.
В случае существенного расхождения в баллах, выставленных двумя
экспертами, назначается третья проверка. Существенное расхождение в
баллах определено в критериях оценивания по соответствующему учебному
предмету.
Эксперту,
осуществляющему
третью
проверку,
предоставляется
информация о баллах, выставленных экспертами, ранее проверявшими
экзаменационную работу».
Существенным считается расхождение в 2 или более балла между
баллами, выставленными экспертами за выполнение любого из заданий 29–
34. Третий эксперт проверяет только те ответы на задания, которые
вызвали столь существенное расхождение.
21.
2022Особенности работы экспертов ПК при
проверке ответов экзаменуемых
1. При проверке заданий с РО эксперт руководствуется
стандартизированными материалами, в которых представлены:
критерии и шкалы оценивания выполнения заданий, а также
варианты развёрнутых ответов на каждое из заданий части 2
экзаменационной работы.
2. Проверка и оценивание выполнения заданий с развернутым
ответом осуществляется на основе поэлементного анализа
ответов экзаменуемых, который предполагает установление
наличия в ответах экзаменуемых каждого из элементов ответа,
обозначенного в критериях оценивания.
3. Проверка осуществляется по линиям экзаменационной работы.
22.
2022Основные компоненты в работе экспертов,
влияющие на процент расхождений при
оценивании ответов выпускников
умение работать по
критериев оценивания;
применению
заданных
готовность брать ответственность при принятии
решений в нестандартных ситуациях;
готовность выполнять решения, выработанные
(утвержденные) на этапе до проверки;
знание рекомендаций по оцениванию, изложенных в
«Памятке для экспертов»
23.
Задание 292022
Условие задания предполагает отбор веществ из
приведенного перечня, составление молекулярного
уравнения ОВР и электронного баланса.
Правильность выбора веществ отражается
составление молекулярного уравнения реакции.
через
Понимание
сути
протекающего
ОВ
процесса
отражается
посредством
записи
электронного
(электронно-ионного) баланса.
Задание максимально оценивается в 2 балла.
24.
Задание 29ЭЛЕМЕНТЫ СОДЕРЖАНИЯ
ПРОВЕРЯЕМЫЕ УМЕНИЯ
Реакции окислительновосстановительные.
определять степень окисления химических
элементов, окислитель и восстановитель
Коррозия
металлов и способы защиты от
нее
прогнозировать продукты окислительновосстановительных
реакций, в том числе с учетом характера среды
(кислой, щелочной,
нейтральной), концентрации реагентов
составлять уравнения окислительновосстановительных реакций
составлять электронный баланс, на его основе
расставлять коэффициенты в уравнениях реакций
25.
Задание 29Рекомендации по оцениванию отдельных элементов ответа и решению
возможных проблем при оценивании:
• в качестве исходных веществ (окислителя и
восстановителя) могут быть
использованы только вещества из предложенного списка (вода используется в
качестве среды протекания реакций)
• реакции разложения сложных веществ не могут быть приняты в качестве
верного ответа, так как по условию задания требуется выбрать «вещества,
между которыми….»
• реакции диспропорционирования, которые протекают с участием среды (раствора
щелочи или кислоты), должны приниматься как возможный вариант ответа.
26.
27.
Критерии оценивания задания 2928.
Задание 29Ставится 1 балл за элемент 2 ответа при условии, если:
• правильно указаны степени окисления элемента-окислителя и
элементавосстановителя, участвующих в процессах окисления и восстановления, указаны
(знаками + и –) процессы принятия и отдачи электронов;
• электронный баланс можно считать составленным верно в случае, если любым
способом будет показано, что число отданных восстановителем электронов, равно
числу электронов, принимаемых окислителем: это могут быть коэффициенты в
уравнении реакции; могут быть указаны множители за вертикальной чертой; может
присутствовать словесная запись о числе отданных и присоединённых электронов;
может быть использован метод полуреакций (электронно-ионный баланс);
• указан окислитель и восстановитель ЛЮБЫМ СПОСОБОМ;
• если приведено несколько вариантов ответа, то проверяется только первый из них.
29.
ВОЗМОЖНЫ ВАРИАНТЫ…:
1) KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
2) KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH
3) KMnO4 + H2O2 → MnO2 + O2 + KOH + H2O
4) H2O2 + Na2SO3 → Na2SO4 + H2O
Внимание на соответствие ответа экзаменуемого
условию задания!
Условию задания – изменение цвета раствора, осадок или газ
не выделялся - соответствует только уравнение реакции 1.
30.
Запись электронного балансаK2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + …
Допустимы
записи:
2Cr+6 + 6ē → 2Cr+3
1
2Br-1 - 2ē → Br2
3
или
Cr+6 + 3ē → Cr+3
Br- - ē → Br0
1
3
или
2Cr+6 + 6ē → 2Cr+3 1
2Br- - 2ē → 2Br
3
(Запись степени окисления «-» допустима)
Недопустима запись:
+6
Cr2 + 6ē → 2Cr+3
Количество
принятых и
отданных
электронов
может быть
указано над
стрелкой.
31.
Обозначение степени окисленияТакие обозначения степеней окисления как N5+ и N4+
(сначала цифра, затем знак) считаются неверными.
Исключение: у ионов металлов степень окисления равна
заряду иона, поэтому такую как запись как
Mg2+ + 2e = Mg0
следует считать верной (можно рассматривать как элемент
электронно-ионного баланса)
1 балл
32.
Дополнительныерекомендации,
которые
учитывать в случае проблемных ситуаций
необходимо
• степень окисления 0 может не указываться экзаменуемым;
• если степень окисления не указана, то считать её равной 0;
• считать верными записи, подобные следующим «Cl-1», «Cl-» ,
«2Cr3+», «Cr+6», которые экзаменуемый использовал при указании
степени окисления;
• считать неверными записи, подобные следующим «N23–», «Cr26+»
(или «N2–3» «Cr2 +6»)
наличие в ответе экзаменуемого взаимоисключающих суждений
или обозначений следует рассматривать как факт
несформированности умения применять данные знания
(например, знаки «+» и «–» в записи электронного баланса не
соответствуют природе окислителя или восстановителя).
33.
Примечание 1: Если допущены грубые ошибки в составленииуравнения реакции:
• использованы вещества не из предложенного перечня,
• предложенное уравнение не соответствует условию задания;
•нарушена логика ОВР , то второй элемент ответа (электронный
баланс) не рассматривается и не оценивается, например:
Примечание 2: второй элемент ответа (электронный баланс)
рассматривается и оценивается если:
• первый элемент ответа оценен1 баллом;
•первый элемент ответа не может быть оценен 1 баллом из-за
незначительных ошибок, таких как пропуск 1-2 коэффициентов
34.
Пример 1Задание 29
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид серебра(I),
азотная кислота, перманганат калия, сульфат аммония, ацетат стронция, нитрат железа(III).
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно- восстановительная реакция
между которыми сопровождается выделением бурого газа. Образования простого вещества в
ходе данной реакции не
происходит. Запишите уравнение только одной из возможных окислительновосстановительных реакций. Составьте электронный баланс, укажите
окислитель и
восстановитель.
35.
Пример 1а2
36.
Пример 1б37.
Пример 1в38.
Пример 1гЗадание 29
39.
Задание 30ЭЛЕМЕНТЫ СОДЕРЖАНИЯ
ПРОВЕРЯЕМЫЕ УМЕНИЯ
Электролитическая диссоциация
электролитов в водных
растворах. Сильные и слабые
электролиты
Объяснять сущность реакций
ионного обмена
Реакции ионного обмена
Выбирать вещества-электролиты
из предложенного списка в
соответствии с условием задания
Записывать реакции ионного
обмена в молекулярном и
ионном виде
40.
Задание 30Ионные уравнения реакций отражают суть тех изменений, которые
происходят при взаимодействии веществ − электролитов
Реакции в растворах электролитов идут практически до конца в том случае,
если происходит связывание исходных ионов с образованием:
− слабого электролита,
− осадка малорастворимоговещества,
− газообразного продукта.
В ионном уравнении реакции хорошо растворимые сильные электролиты
записывают в виде соответствующих ионов, а слабые электролиты,
нерастворимые вещества и газы − в молекулярном виде.
В сокращённом ионном уравнении
коэффициенты не допускаются.
дробные
или
удвоенные
41.
Задание 30Степень диссоциации слабых электролитов в разбавленных
водных растворах не превышает, как правило, 10-20%,
например:
Слабый
электролит
α, %
(С = 0,1М)
H2SO3
20
HF
8
HNO2
4
NH3·H2O
1,4
CH3COOH
1,4
H2CO3
0.2
H2S
0,07
42.
В качестве исходных веществ должны быть выбранырастворимые в воде соли (исключение – взаимодействие
нерастворимых карбонатов с кислотами).
Реакции образования гидроксокомплексов при взаимодействии
растворов щелочей и растворимых солей цинка и алюминия также
можно отнести к реакциям ионного обмена:
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Zn2+ + SO42- + 4Na+ + 4OH- = 2Na+ + [Zn(OH)4] 2-+ 2Na+ +SO42Zn2+ + 4OH- = [Zn(OH)4]2-
43.
Некоторые особые случаи! В случае H2SO4 возможны записи, как 2H+ + SO42- ,
! В случае H3PO4 возможны записи,
так и
H+ и HSO4-
как H+ + H2PO4-, так и H3PO4
Кислые соли диссоциируют ступенчато, например:
NaHSO3 → Na+ + HSO−3
HSO − ⇆ H+ + SO
3
2−
(первая ступень)
(вторая ступень).
3
В ионном уравнении используется записи типа
Na+ + HSO3−
! В случае гидросульфатов возможны записи типа
как Na+ + H+ + SO42,
так и Na+ и HSO4-
! При взаимодействии солей аммония со щелочами допустимы записи
NH3∙H2O, NH3 + H2O (нежелательно NH4OH)
44.
Задание 3029, 30
Для выполнения заданий 30,
31 используйте следующий перечень веществ:
сульфид серебра(I), азотная кислота, перманганат калия, сульфат аммония,
ацетат стронция, нитрат железа(III). Допустимо использование водных
растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена
между которыми сопровождается образованием осадка. Запишите
молекулярное, полное и сокращённое ионное уравнения только одной из
возможных реакций.
45.
Пример 1146.
Задание 312022
В модель задания 31, проверяющего сформированность умения
составлять уравнения реакций отражающих взаимосвязь
веществ различных классов неорганических веществ по
описанию изменений, происходящих с ними (мысленный
эксперимент), изменений не внесено.
Максимальное число баллов за правильное выполнение
задания 31 равно 4.
47.
Элементысодержания, проверяемые заданием
© все пр
48.
Необходимо проявить умение составлять уравненияреакций, соответствующих всем типам взаимодействия
неорганических веществ:
кислотно-основное взаимодействие;
• реакции ионного обмена;
окислительно-восстановительные реакции;
комплексообразование (на примере гидроксокомплексов
цинка и алюминия);
гидролиз (бинарных соединений, совместный гидролиз);
электролиз расплавов и растворов солей, оксида
алюминия.
49.
50.
Выдержки из «Рекомендации по оцениваниюотдельныхэлементов ответа…»
Каждый из четырёх элементов ответа считать верным если:
- правильно записаны все формулы веществ − участников реакции;
- указаны все коэффициенты (допустимо использование дробных и удвоенных
коэффициентов);
Примечание. При составлении уравнения реакции экзаменуемый может:
- не указывать условие ее проведения (прокаливание,
катализатор), так как они указаны в условии задания;
- не использовать обозначения осадка «↓» или газа «↑»
51.
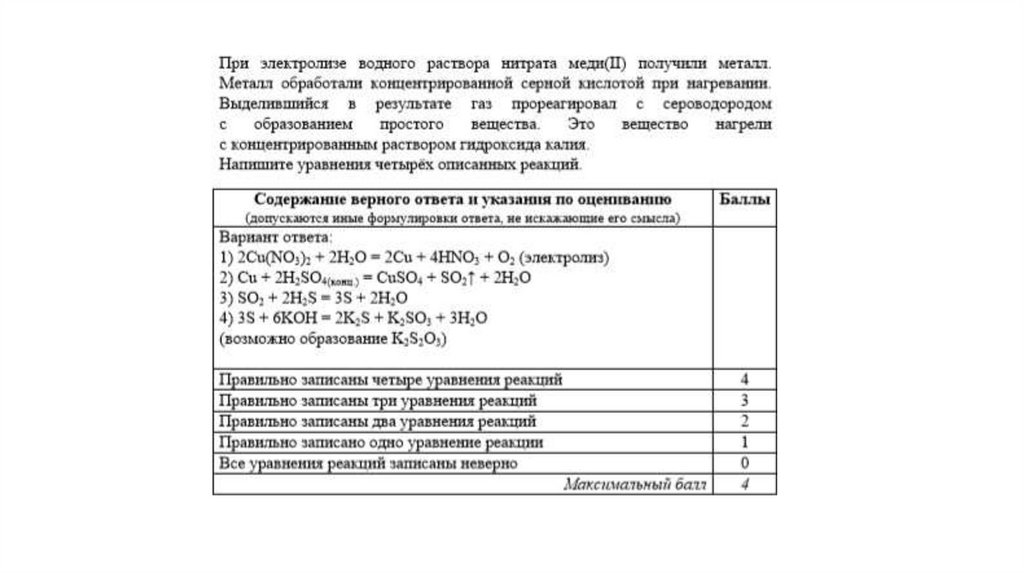
Задание 31Нитрат меди (II) прокалили. Образовавшуюся при этом смесь газов
пропустили через воду, при этом образовалась кислота. В горячий
концентрированный раствор этой кислоты поместили оксид железа(II).
Образовавшуюся соль железа выделили и поместили в раствор карбоната
калия.
Напишите уравнения четырёх описанных реакций.
Вариант ответа:
Написаны четыре уравнения описанныхреакций:
1) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
2) 4NO2 + O2 + 2H2O = 4HNO3
3) FeO + 4HNO3(конц.) = Fe(NO3)3 + NO2 + 2H2O
4) 2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
52.
53.
54.
55.
© все права защищены56.
57.
Задание 322022
В формулировку задания 32, направленного на проверку
сформированности умения составлять уравнения реакций,
отражающих взаимосвязь органических соединений различных
классов в соответствии со схемой превращений, изменений не
внесено.
Максимальное число баллов за правильное выполнение
задания 32 равно 5.
58.
Задание 32Проверяемые ведущие элементы содержания
• генетическая взаимосвязь органических веществ
• характерные химические свойства органических веществ различных
классов
Проверяемые умения (виды деятельности)
Подтверждать существование генетической взаимосвязи между веществами
различных классов путём составления уравнений соответствующих реакций с
учётом заданных условий их проведения
59.
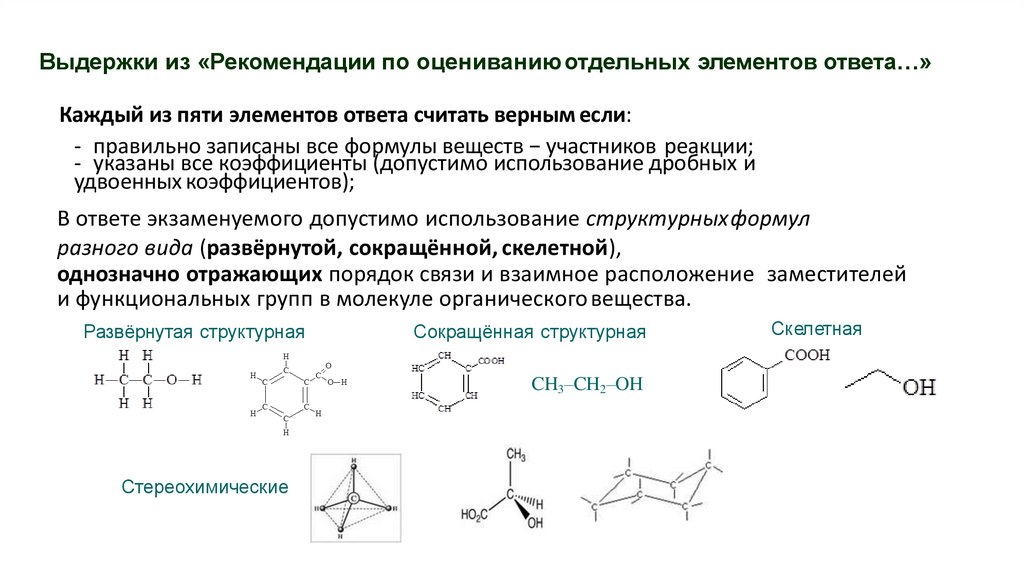
Выдержки из «Рекомендации по оцениваниюотдельных элементов ответа…»Каждый из пяти элементов ответа считать верным если:
- правильно записаны все формулы веществ − участников реакции;
- указаны все коэффициенты (допустимо использование дробных и
удвоенных коэффициентов);
В ответе экзаменуемого допустимо использование структурныхформул
разного вида (развёрнутой, сокращённой, скелетной),
однозначно отражающих порядок связи и взаимное расположение заместителей
и функциональных групп в молекуле органического вещества.
Развёрнутая структурная
Сокращённая структурная
CH3–CH2–OH
Стереохимические
Скелетная
60.
Допустимо использование молекулярных формул для простейших• представителей гомологических рядов:
• CH4, C2H2, C6H6, C2H5OH, CH2O, С6Н12О6 и др.
• Допустимо использование формул, однозначно отражающих строение
вещества:CН3СНО, CН3СО2H, CH3CH(OH)CH3, С6Н5–СООН
Недопустимо: CH3–C6H4–COOH или C6H4(NO2)OH, C6H5C2H4Cl
При записи уравнения химической реакции экзаменуемый может:
-
не использовать обозначенияосадка «↓» или газа «↑»;
не указывать условие её проведения (прокаливание, катализатор), так как условием
заданияэто не предусмотрено.
Элемент ответа считать ошибочным в случае если в ответе учащегося указаны
условия проведения конкретной реакции, которые не соответствуют протеканию данной
реакции с образованием записанных продуктов
-
61.
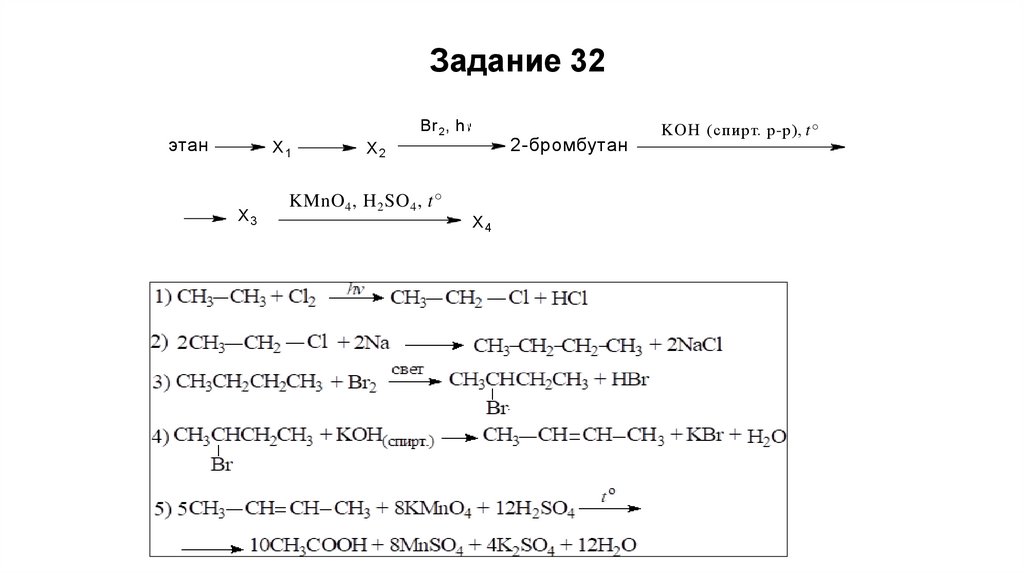
Задание 32Br 2 , h
этан
X1
X3
2-бромбутан
X2
KMnO 4 , H 2 SO 4 , t°
X4
KOH (спирт. р-р), t°
62.
63.
64.
65.
66.
67.
68.
Задание 332022
Предусматривает проверку умений осуществлять следующие
виды расчетов:
Расчёты с использованием понятий «растворимость», «массовая
доля вещества в растворе».
Расчёты массы (объёма, количества вещества) продуктов
реакции, если одно из веществ дано в избытке (имеет примеси).
Расчёты массы (объёма, количества вещества) продукта реакции,
если одно из веществ дано в виде раствора с определённой
массовой долей растворенного вещества
Расчёты массовой или объёмной доли выхода продукта реакции
от теоретически возможного.
Расчёты массовой доли (массы) химического соединения в смеси.
69.
Задание 33Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано
в избытке. Расчёты с использованием понятия «массовая доля вещества в растворе».
Расчёты массовой доли (массы) химического соединения в смеси.
Критерии оценивания, в которых обозначены элементы ответа
Ответ правильный и полный:
в ответе правильно записаны все уравнения реакций, соответствующих условию
задания;
правильно произведены вычисления, в которых использованы необходимые
физические величины, заданные в условии задания;
•продемонстрирована и логически обоснована последовательность использования во
взаимосвязи физических величин, на основании которых проводятся расчёты;
• в соответствии с условием задания определена искомая физическая величина.
70.
Задание 33Рекомендации по оцениванию отдельных элементов ответа и
решению возможных проблемных ситуаций
• 1. Ставится 1 балл за наличие в ответе всех правильно записанных
уравнений реакций, соответствующих условию задания.
правильно записаны формулы всех веществ, участвующих в реакции;
указаны все коэффициенты (при этом допустимо использование
дробных и удвоенных коэффициентов).
• Дополнительные рекомендации, которые необходимо учитывать в случае
проблемных ситуаций:
• −
если допущена ошибка хотя бы в одном из уравнений реакций, даже
при условии, что она не влияет на ход дальнейших вычислений, то за
• этот элементответа выставляется 0 баллов.
71.
2.Ставится 1 балл за наличие в ответе правильно произведённыхвычислений, в которых используются необходимые физические
величины, заданные в условии задания.
3.Ставится 1 балл, если в ответе экзаменуемого
продемонстрирована и логически обоснована последовательность
использования во взаимосвязи физических величин, на основании
которых проводятся расчёты.
Иными словами, отражены все необходимые этапы расчётов с указанием
пропорциональной зависимости между количеством (массой, объёмом)
реагирующих веществ.
Вычисление молярной массы веществ можно не приводить.
72.
4. Ставится 1 балл, если в ответе экзаменуемого в соответствии сусловием задания определена искомая физическая величина:
− выбран верный способ для нахождения искомой физической величины;
− правильно определены «промежуточные» физические величины,
необходимые для её нахождения.
Дополнительные рекомендации, которые необходимо учитывать в случае
проблемных ситуаций.
В случае наличия в ответе экзаменуемого ошибок в вычислениях (не более
трёх), которые привели к неверному ответу, оценка за выполнение задания
снижается только на 1 балл.
В случае если в ответе экзаменуемого не указаны единицы измерения
искомых физических величин (более четырёх), то оценка за выполнение
задания снижаетсяна 1 балл.
73.
При оценивании выполнения задания принимается вовнимание тот факт, что экзаменуемый может использовать
свой алгоритмрешения задачи, отличный от
предложенного вариантаответа
74.
Задание 33Растворимость безводного хлорида кальция при некоторой
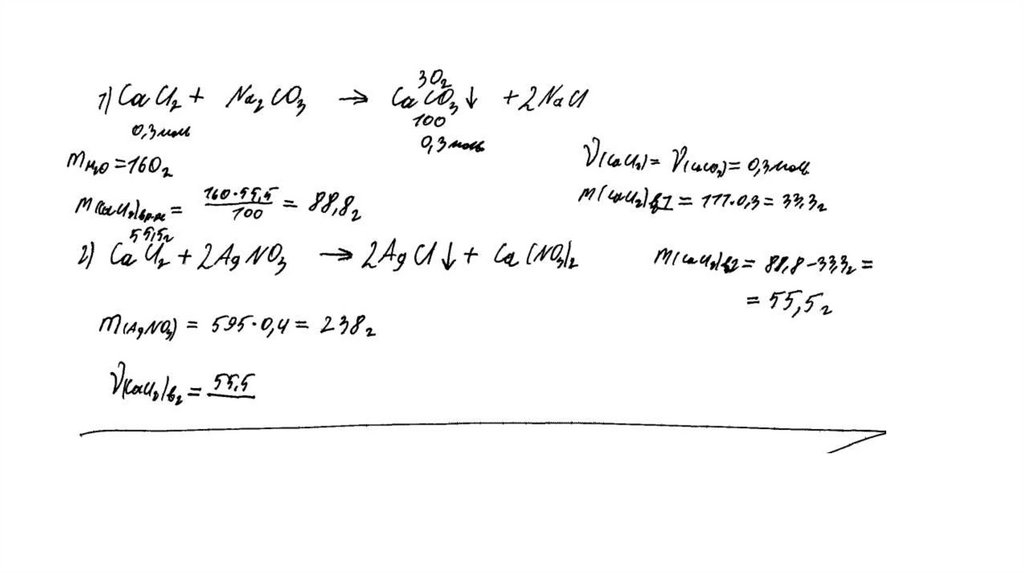
температуре составляет 55,5 г на 100 г воды. Насыщенный
раствор, приготовленный при этой температуре добавлением
необходимого количества хлорида кальция к 160 мл воды, разлили
на две колбы. В первую колбу добавили избыток раствора
карбоната натрия. При этом выпал осадок массой 30 г. Во вторую
колбу добавили 595 г 40%-ного раствора нитрата серебра.
Определите
массовую долю нитрата серебра в растворе,
образовавшемся во второй колбе. В ответе запишите уравнения
реакций, которые указаны в условии задачи, и приведите все
необходимые вычисления (указывайте единицы измерения
искомых физических величин).
75.
CaCl2 + Na2CO3 = CaCO3↓ + 2NaClCaCl2 + 2AgNO3 = 2AgCl↓+ Ca(NO3)2
Рассчитаны количество вещества
реагентов и продуктов реакций:
m(CaCl2) = 55,5 ∙ 160 /100 = 88,8 г
n(CaCl2) = 88,8 / 111 = 0,8 моль
n(CaCO3) = 30 / 100 = 0,3 моль
n1(CaCl2) = n(CaCO3 ) = 0,3 моль
n2(CaCl2) = 0,8 – 0,3 = 0,5 моль
m (AgNO3) = 595 ∙ 0,4 = 238 г
n(AgNO3) = 238 / 170 = 1,4 моль – избыток
n(AgNO3 осталось) = 1,4 – 1 = 0,4 моль
m(AgNO3 осталось) = 0,4 ∙ 170 = 68 г
n(AgCl ) = n2(CaCl2) = 1 моль
m(AgCl) = 143,5 г
Вычислена массовая доля нитрата серебра в
растворе:
m2(р-ра CaCl 2 ) = (160 + 88,8 ) ∙ 0,5 / 0,8 = 155,5 г
m2(конечного р-ра) = 155,5 + 595 – 143,5 = 607 г
(AgNO3) = 68 / 607 = 0,112, или 11,2%
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
Задание 342022
Задание 34 предусматривает проверку умения находить
молекулярную и структурную формулу органического вещества.
Знание свойств органических веществ проверяется написанием
уравнения реакции, характерной для вещества с найденной
формулой.
Задание максимально оценивается в 3 балла.
91.
Задание 34Установление молекулярной и структурной формулы вещества
Ответ правильный и полный:
• правильно произведены вычисления, необходимые для
установления
молекулярной формулы вещества и записана молекулярная формула вещества;
• записана структурная формула органического вещества, которая отражает
порядок связи и взаимное расположение заместителей и функциональных групп
в молекуле в соответствиис условием задания;
• с использованием структурных формул органических веществ записано
уравнение реакции, на которую даётся указание в условии задания.
92.
1.Ставится 1 балл за определение молекулярной формулы вещества наосновании приведённых необходимых правильных вычислений.
Ответ должен содержать расчёты, подтверждающие соответствие приведённой
молекулярной формулы условиямзадачи.
2.Ставится 1 балл при наличии записи структурной формулы вещества,
которая отражает порядок связи и взаимное расположение заместителей
и функциональных
групп
в
молекуле
органического
вещества
в
соответствии с условием задания.
При условии, если структурная формула органического вещества не записана как
отдельный элемент ответа, а присутствует лишь в уравнении реакции (в
последнем элементе ответа) и составлена правильно, то этот элемент ответа
считается выполненным и выставляется 1 балл за «структурную формулу».
93.
3. Ставится 1 балл при наличии записи уравнения реакции, на которую даётсяуказание в условии задания:
правильнозаписаныформулы всех веществ, участвующих в реакции,при этом
использованы
структурные формулы разного вида (развёрнутая,
сокращённая, скелетная), которые однозначно отражают порядок связи и взаимное
расположение заместителей и функциональных групп в молекуле органического
вещества
указаны все коэффициенты (при этом допустимо использованиедробных и
удвоенных коэффициентов)
в уравнении реакции записаны формулы тех веществ, которые соответствуют
условию задания, или являются продуктами реакций, протекающих при заданных
условиях
Допустимо использование молекулярных формул для простейших представителей
гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O и т.д.,).
94.
Органическое вещество содержит 3,41% водорода, 34,09% углерода,36,36% кислорода и 26,14% натрия по массе. Известно, что при
нагревании этого вещества с избытком гидроксида натрия
образуется предельный углеводород.
На основании данных условия задания:
1)проведите необходимые вычисления (указывайте единицы измерения
физических величин) и установите молекулярную формулу исходного
вещества;
2)составьте возможную структурную формулу исходного вещества,
которая однозначно отражает порядок связи атомов в его молекуле;
3)напишите уравнение реакции, протекающей при нагревании
исходного вещества с избытком гидроксида натрия.
95.
Общая формула соли – CxHyOzNamx : y : z : m = 34,09 / 12 : 3,41 / 1 : 36,36 / 16 : 26,14 / 23
Установлено соотношение числа атомов C, H, O и Na в соединении:
x : y : z : m = 2,84 : 3,41 : 2,27 : 1,14 = 2,5 : 3 : 2 : 1 = 5 : 6 : 4 : 2
Молекулярная формула вещества – C5H6O4Na2
Составлена структурная формула вещества:
O
O
C
CH2 CH2
CH2 C
NaO
ONa
Написано уравнение реакции, протекающей при нагревании вещества с NaOH:
O
O
C
NaO
CH2 CH2
CH2
C
+ 2NaOH
ONa
H3C
CH2 CH3
+ 2Na2CO3

































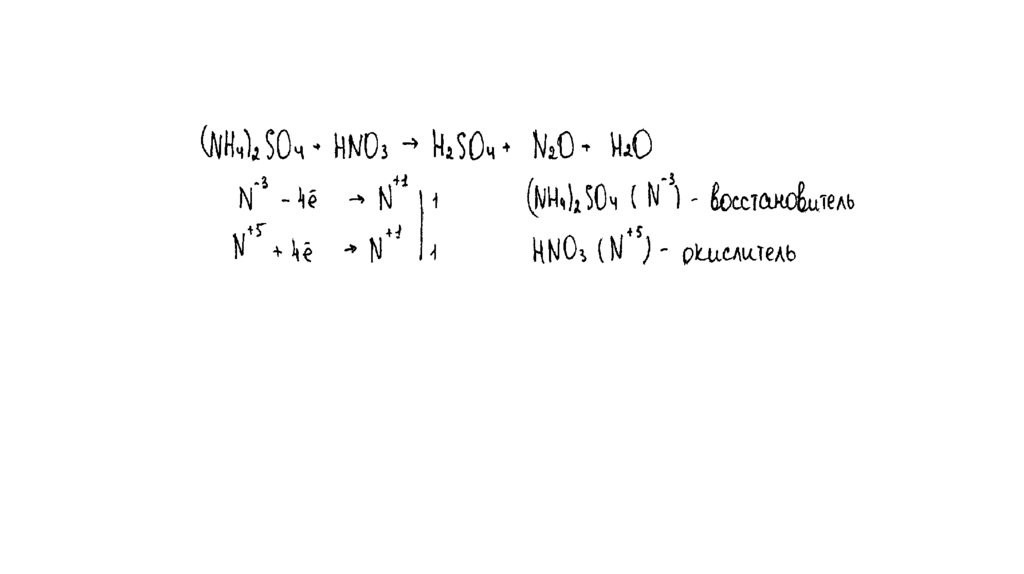







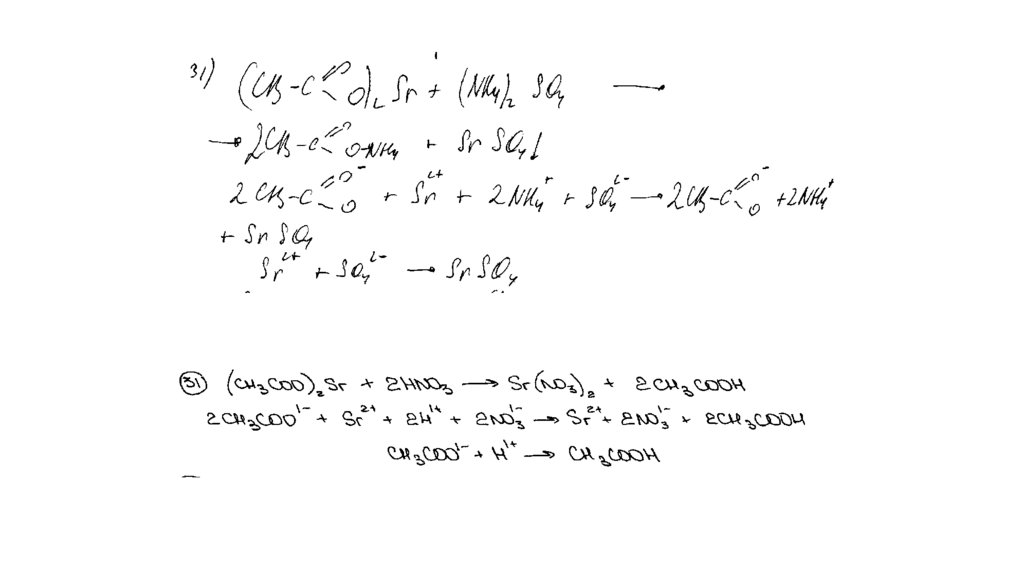





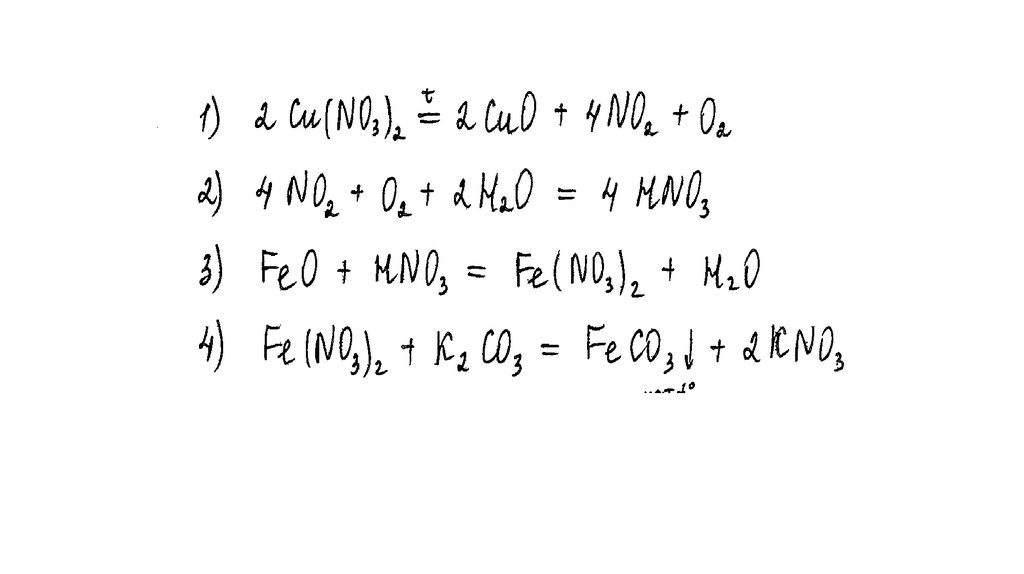
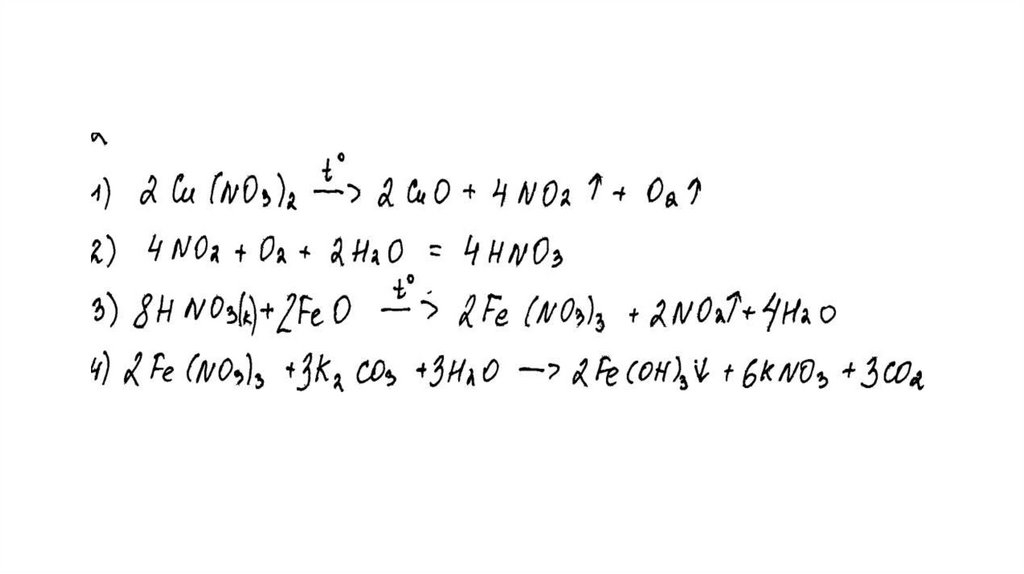
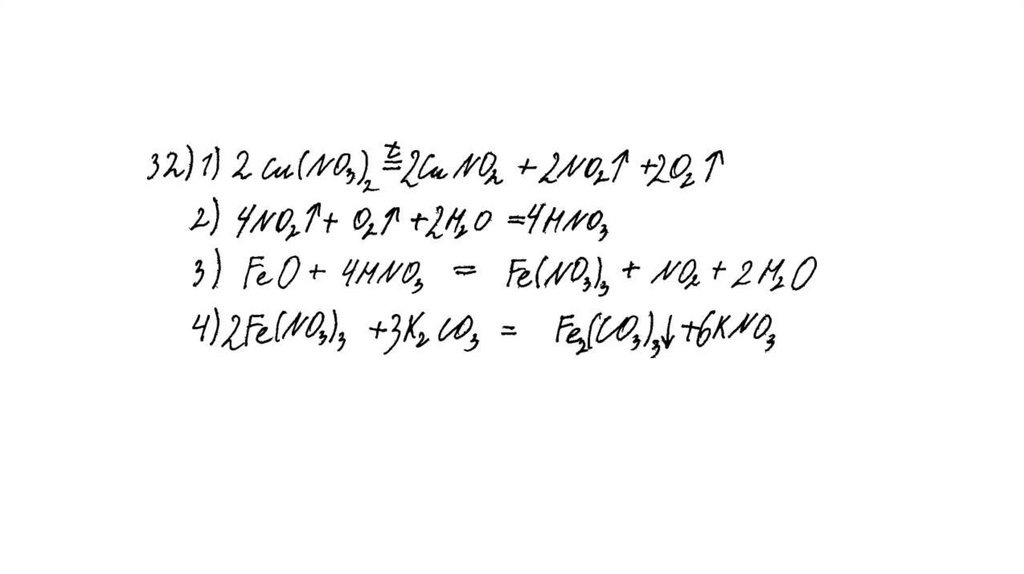
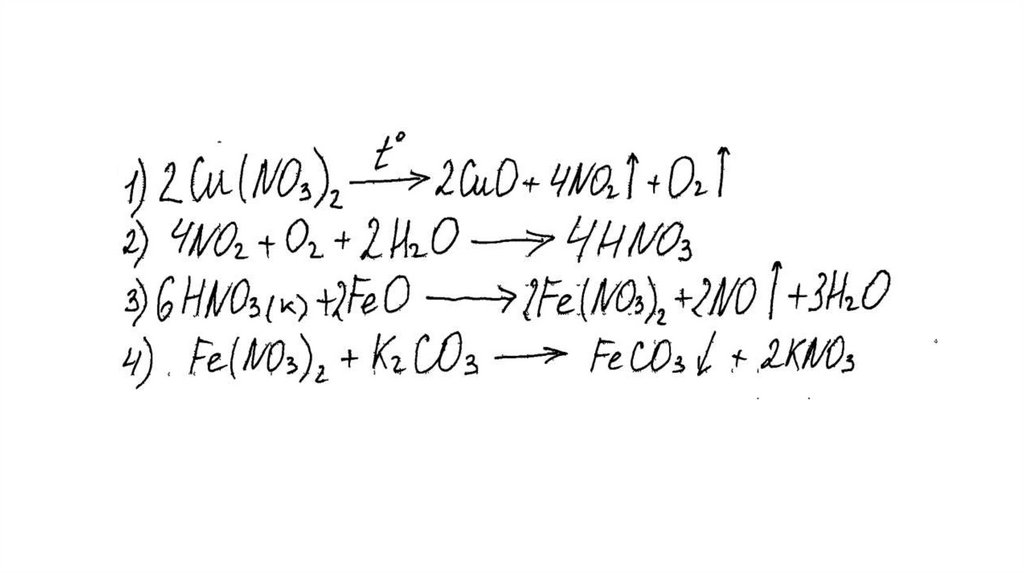
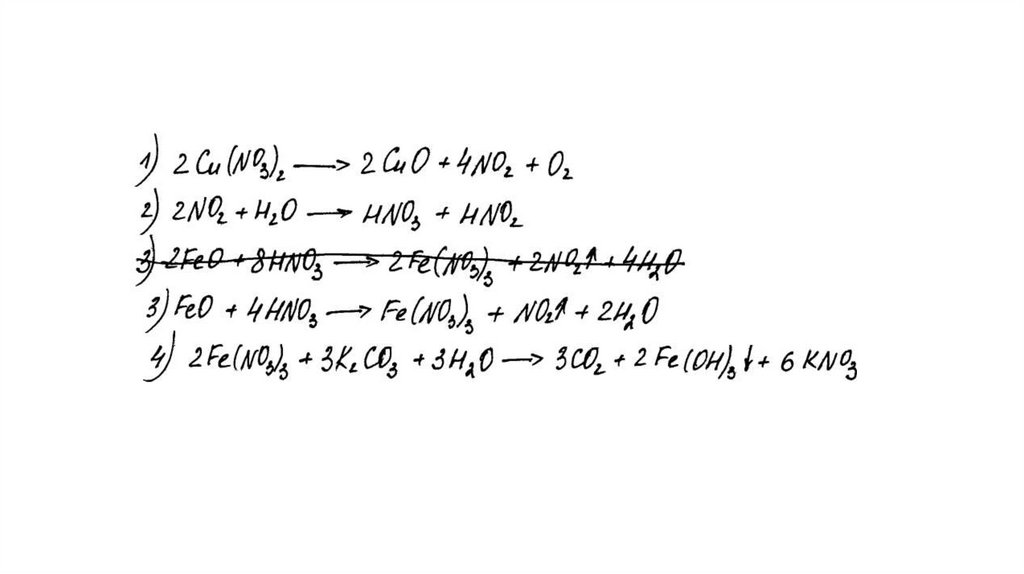



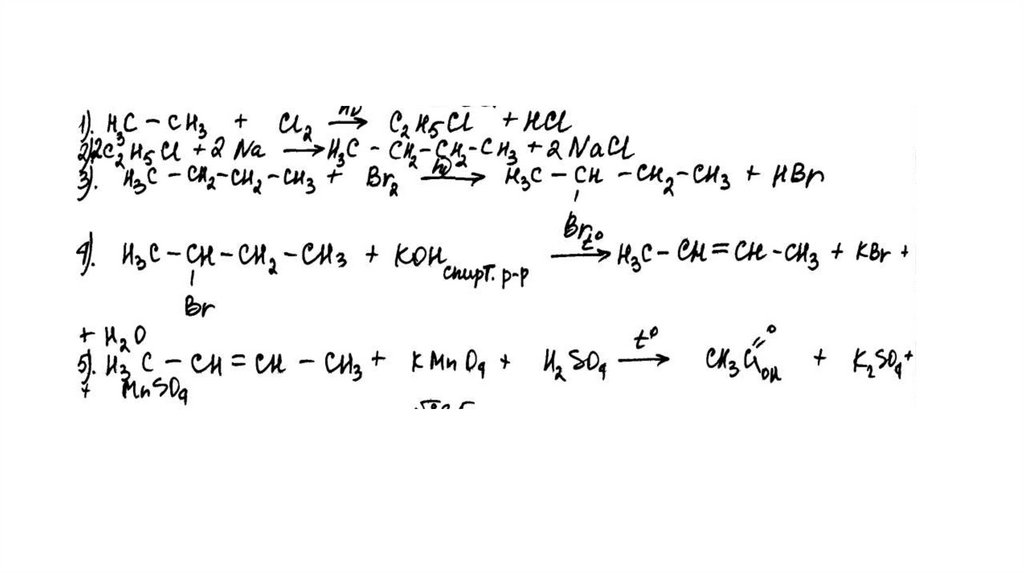



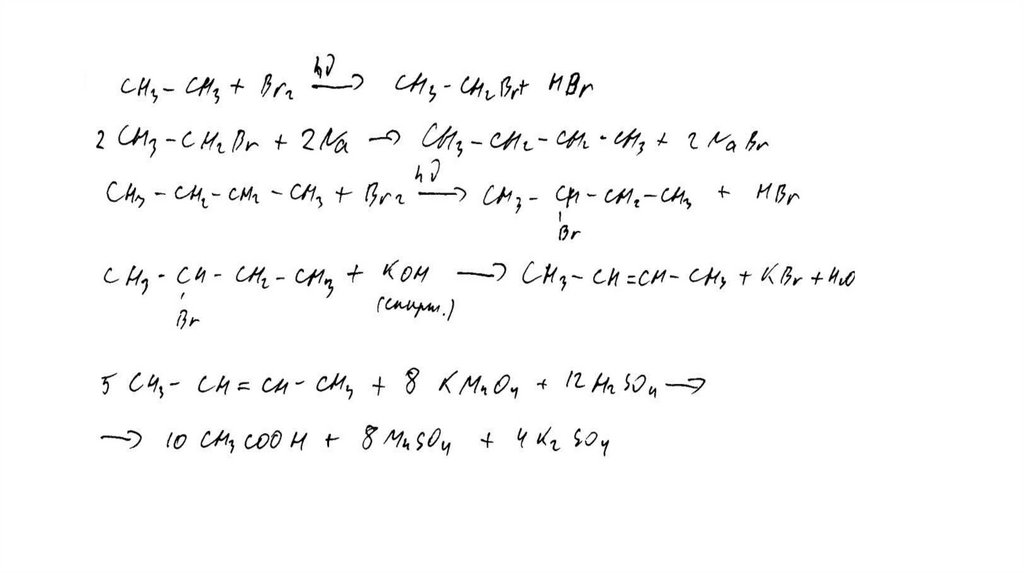
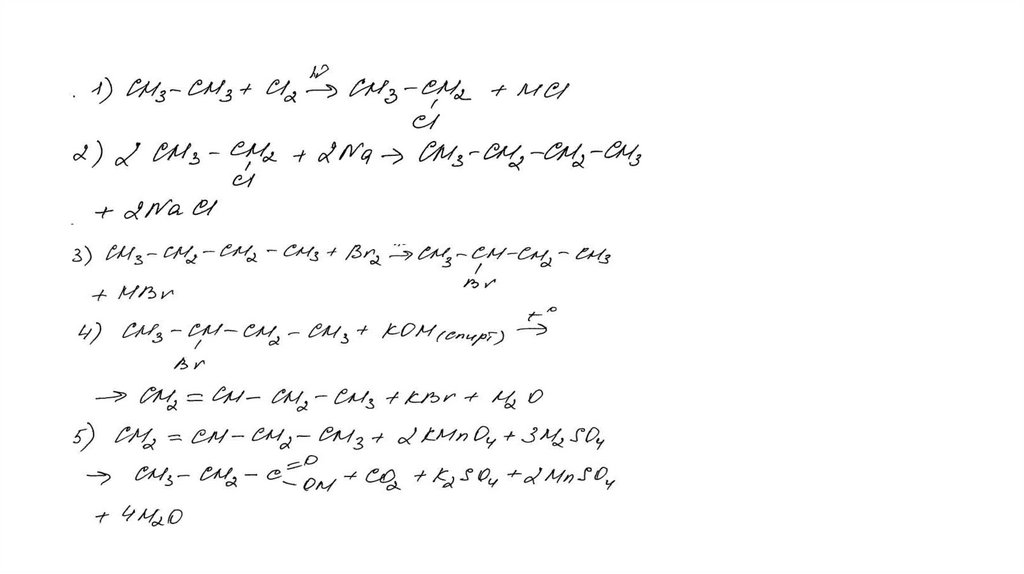










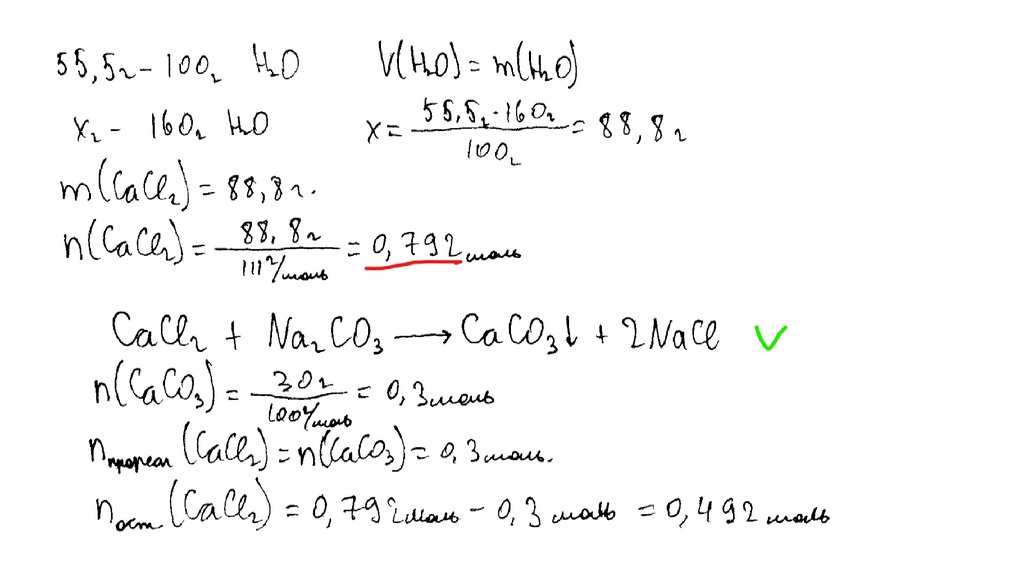

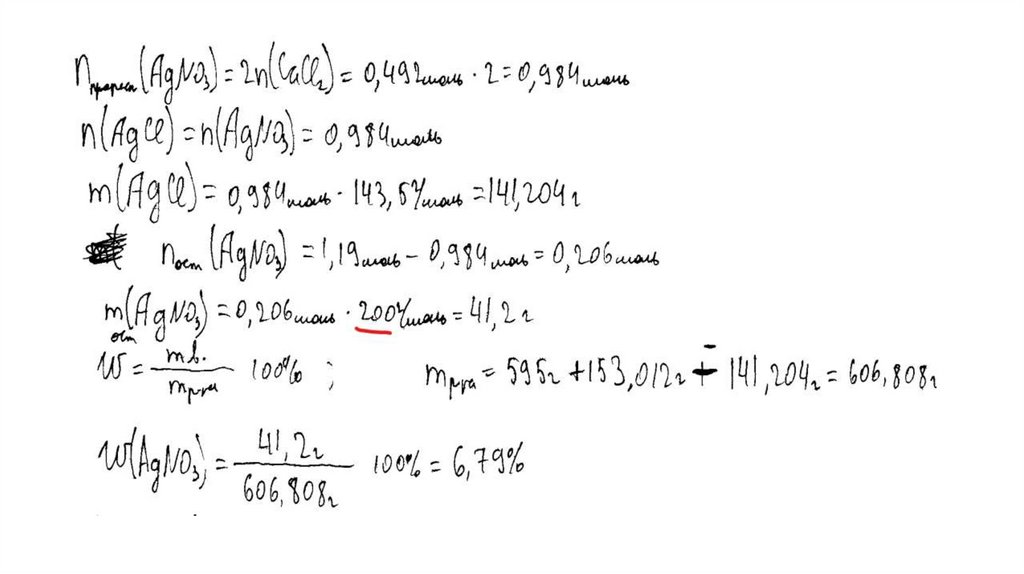
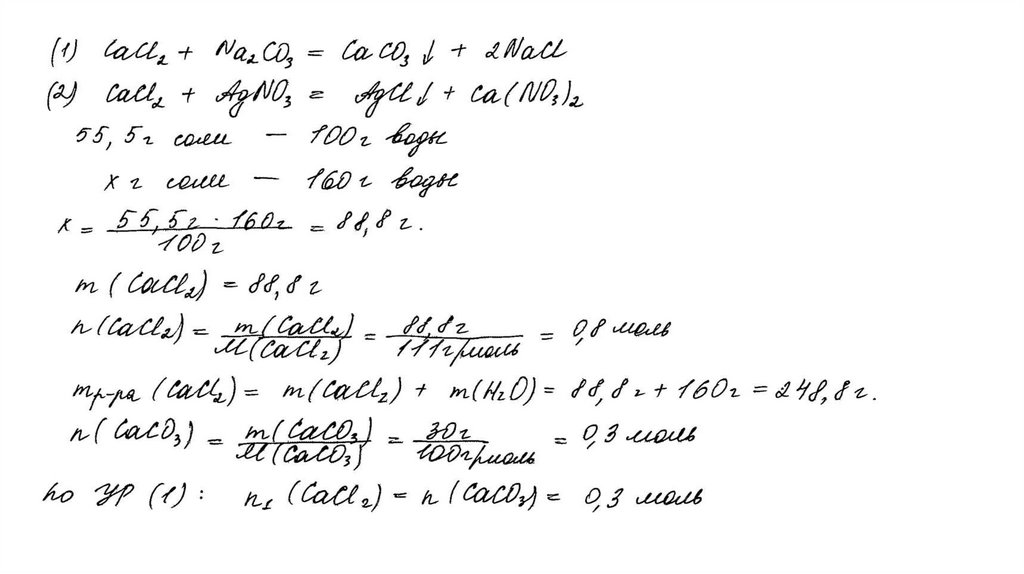


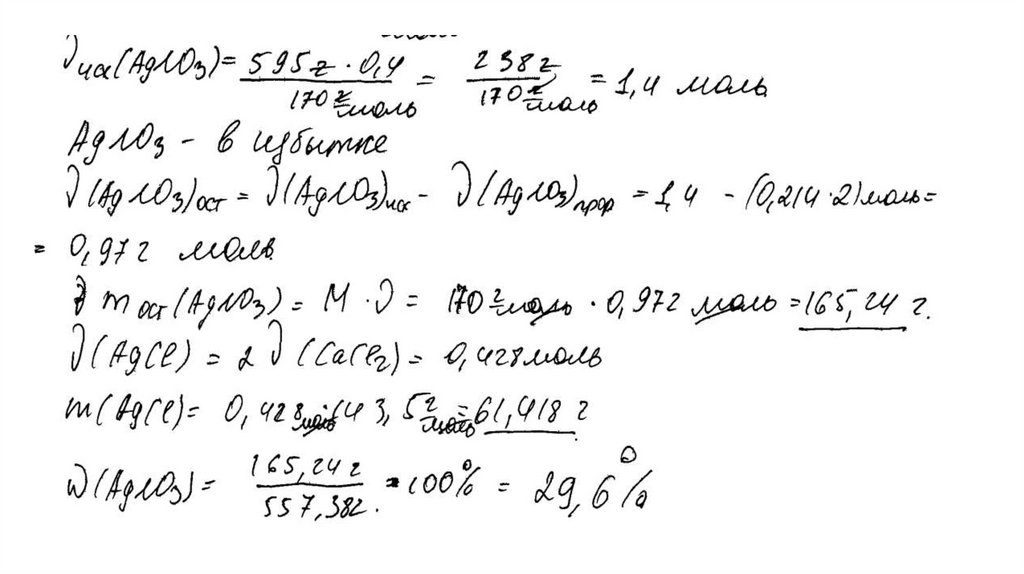
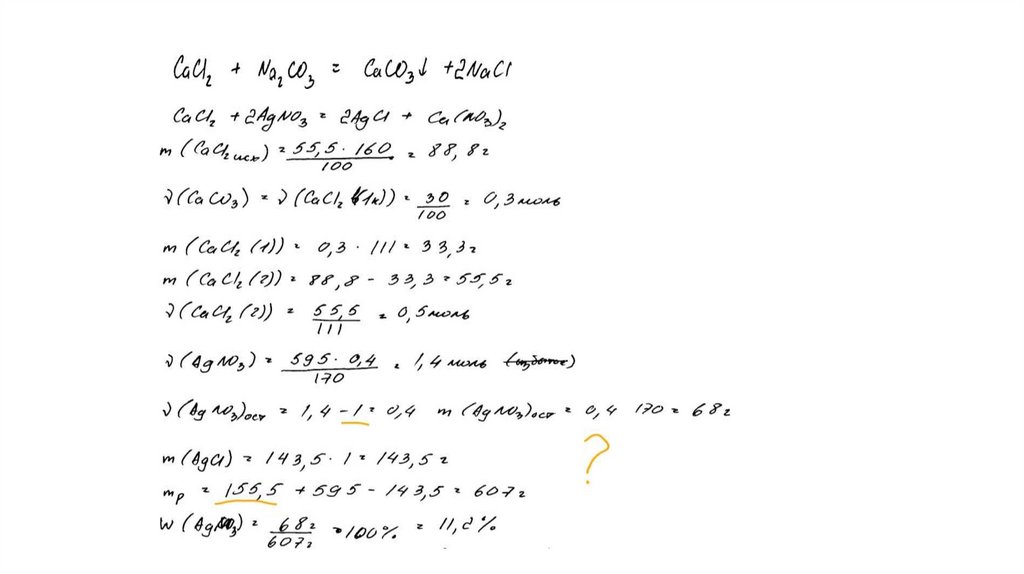

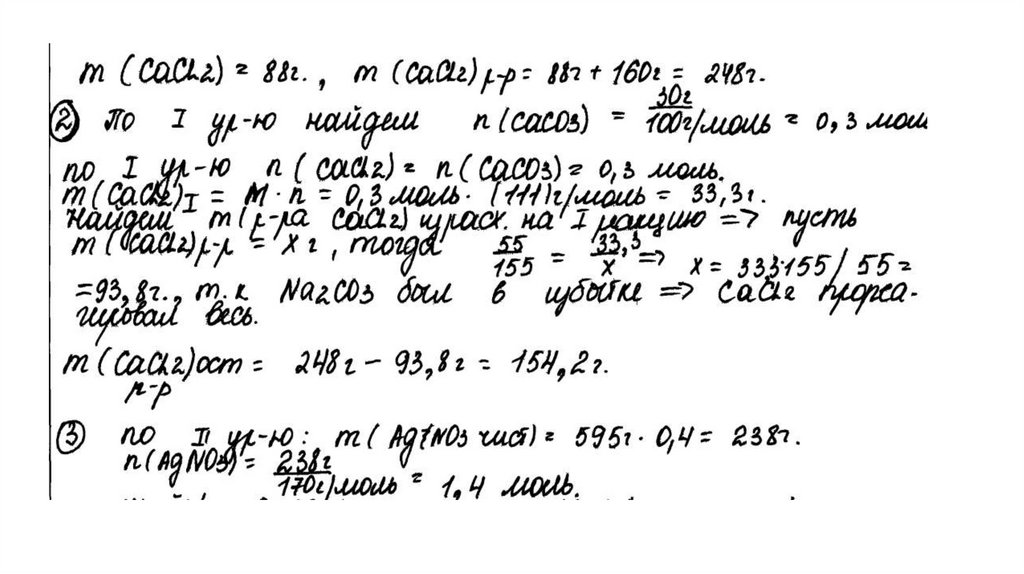








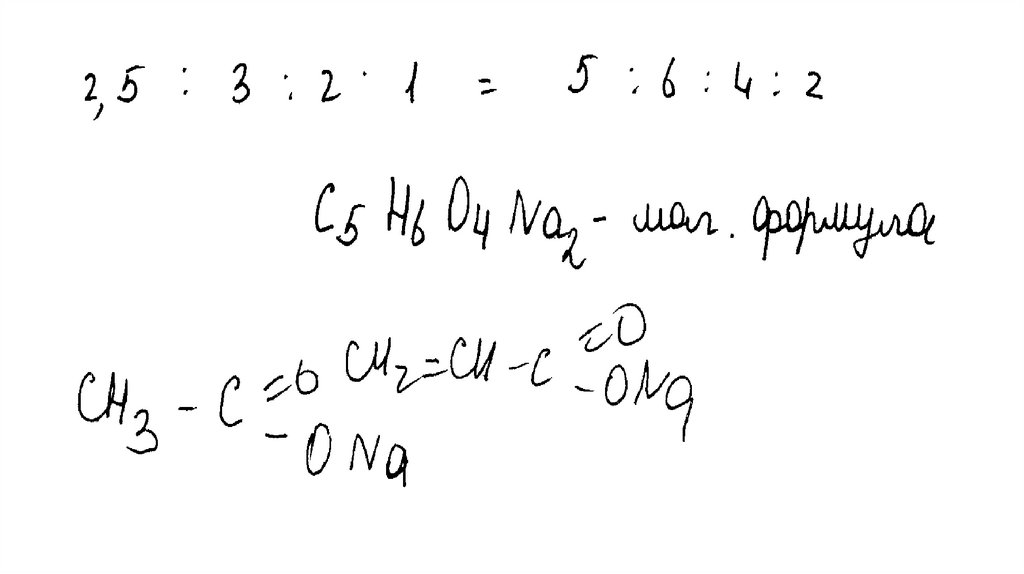
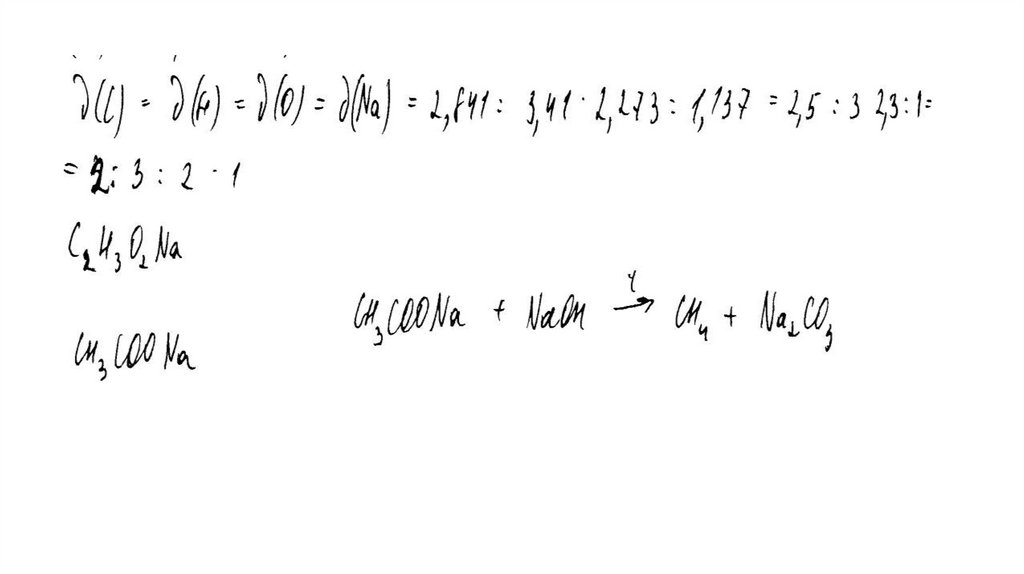
 Химия
Химия








