Похожие презентации:
Анализ трудных вопросов ЕГЭ по химии 2023 год
1.
АНАЛИЗ ТРУДНЫХВОПРОСОВ ЕГЭ
по химии 2023 год
Учитель химии МКОУ СОШ №1
Бондаренко В.В.
мо учителей химии
март 2023
2.
«Чтобы избегать ошибок, надонабираться опыта; чтобы
набираться опыта, надо делать
ошибки»
Лоуренс Джонсон Питер
канадско–американский психолог, педагог
3.
ЕГЭ по химии не является обязательным для сдачи на выпускныхэкзаменах в школе.
Его нужно будет сдавать для поступления в вузы по следующим
направлениям:
• химия и химическая технология,
• медицина,
• строительство,
• биотехнология
• и другие.
В 2023 году ЕГЭ по химии предположительно будут сдавать около 15%
выпускников.
В прошлом сезоне из 701 000 участников ГИА предмет выбрали 95
000 человек.
Это говорит о том, что ЕГЭ по химии выбирают осознанно, а значит и
подготовка к экзамену осуществляется более качественно и 2023 год
не станет исключением
4.
Неизменными для предмета «химия» в 2023 году останутсятакие основные факты: время на выполнение работы – 210
мин (3,5 часа);
КИМ состоит из 2-х частей;
• общее количество вопросов – 34 шт.;
• максимальный балл – 56 ПБ;
разрешенные материалы:
• таблица Менделеева, таблица растворимости солей,
• электрохимический ряд напряжений металлов.
на экзамене разрешено использовать непрограммируемый
калькулятор
5.
Изменения 2023 годаНовый вариант будет отличаться от
билетов 2022 года такими позициями:
Задание
Изменение
№ 9, 12, 16 уровень сложности изменен на
«повышенный»
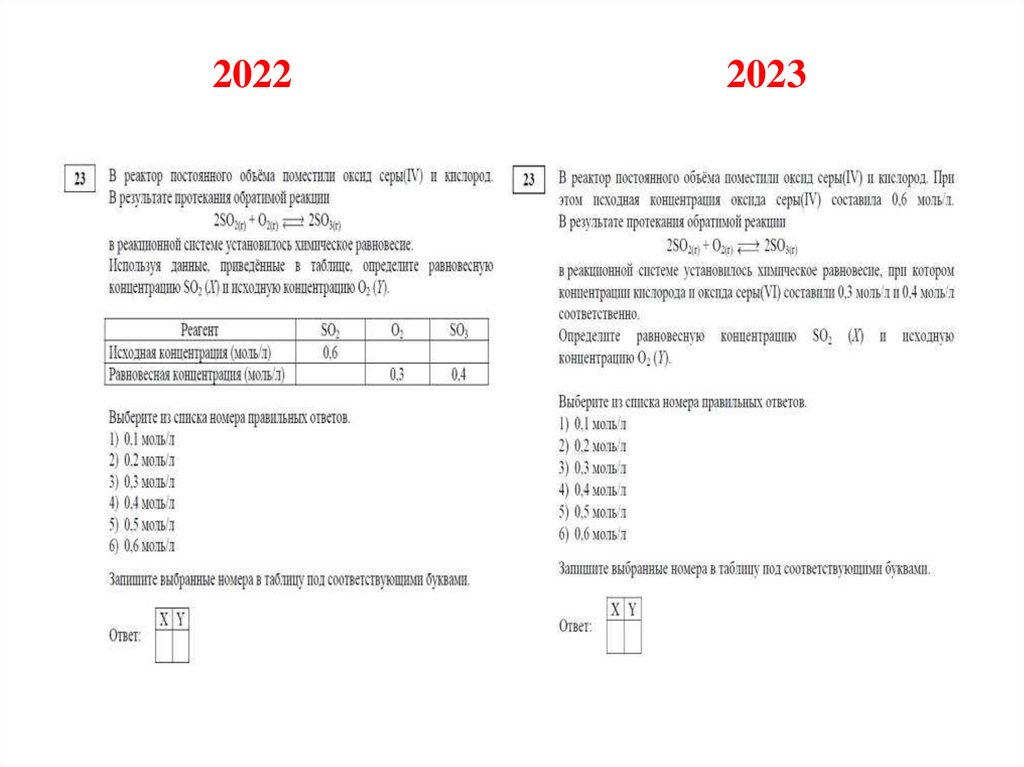
№ 23
вместо табличного формата
представления данных в задаче на
расчет концентрации веществ будет
использован классический текстовый
№ 33 и 34
поменяли местами
6.
Структура КИМовВ экзаменационной работе выпускникам
будет предложено 34 вопроса, среди которых
встретятся задания различного уровня
сложности:
Уровень
сложности
Кол-во Вопросы
базовый
17 шт.
№ 1–5, 10, 11, 13, 17–21,
25–28
повышенный
11 шт.
№ 6–9, 12, 14–16, 22–24
высокий
6 шт.
№ 29–34
7.
КИМ разделен на I и II часть:Часть
Ответ
Iч
II ч
краткий
развернутый
Кол-во
вопросов
28
6
Экзаменационная работа будет проверять знания и
умения выпускника по всем темам школьного
курса:
теоретическая основа химии;
химические реакции;
органические и неорганические вещества;
методы познания;
уравнения реакций (расчеты по формулам).
8.
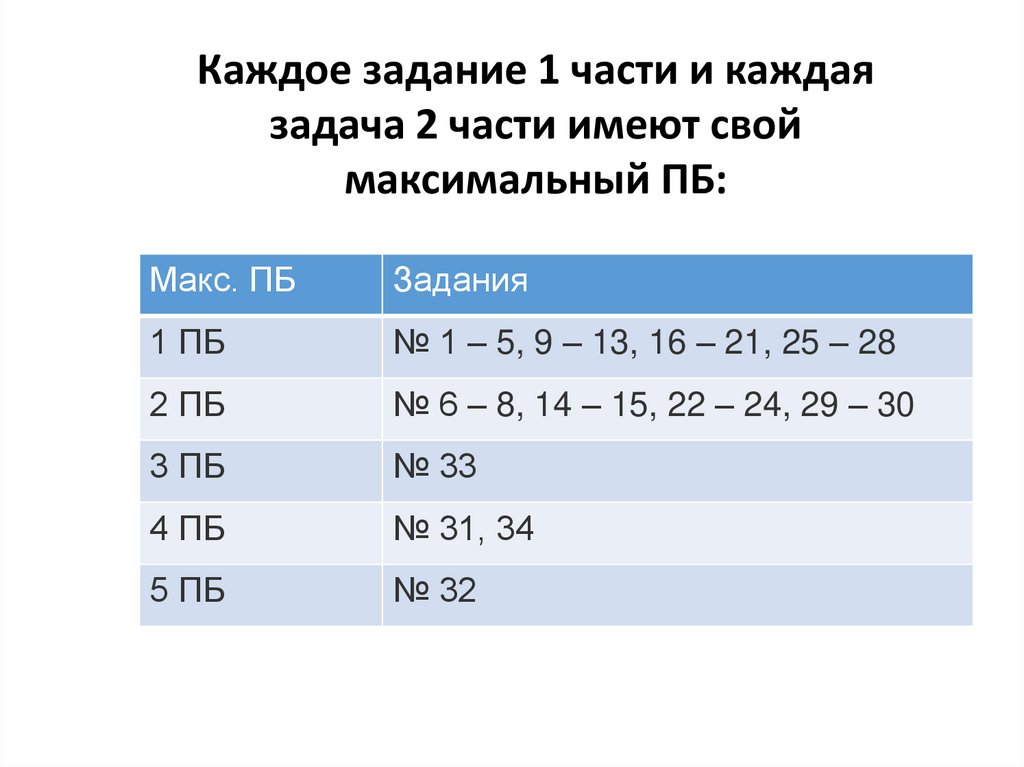
Каждое задание 1 части и каждаязадача 2 части имеют свой
максимальный ПБ:
Макс. ПБ
Задания
1 ПБ
№ 1 – 5, 9 – 13, 16 – 21, 25 – 28
2 ПБ
№ 6 – 8, 14 – 15, 22 – 24, 29 – 30
3 ПБ
№ 33
4 ПБ
№ 31, 34
5 ПБ
№ 32
9.
Анализ результатов выполнения заданий с выборомответа (часть 1)
• Прогнозирование возможности реакции между
веществами, трудности при выполнении заданий, в
которых употреблялось отрицание.
• Неумение выпускников устанавливать причинноследственные связи между принадлежностью
вещества к определенному классу соединений и его
химическими свойствами.
• Плохая ориентация в принципах номенклатуры
веществ и в соотнесении названия с формулой или
классом соединений. Общей тенденцией можно
считать низкий уровень владения участниками
экзамена номенклатурой органических веществ.
10.
Анализ результатов выполнения заданий с краткимответом (часть 1)
• Недостаточный уровень знаний механизмов
реакций в органической химии. Традиционно
сложными для выпускников остаются вопросы,
связанные с устойчивостью карбокатионов.
• Незнание одного из основных правил – правило
В.В.Марковникова, а также неумение
прогнозировать результат реакции.
• Уровень освоения стандарта образования,
связанный с химическими свойствами органических
веществ, как показали результаты экзамена, низкий.
11.
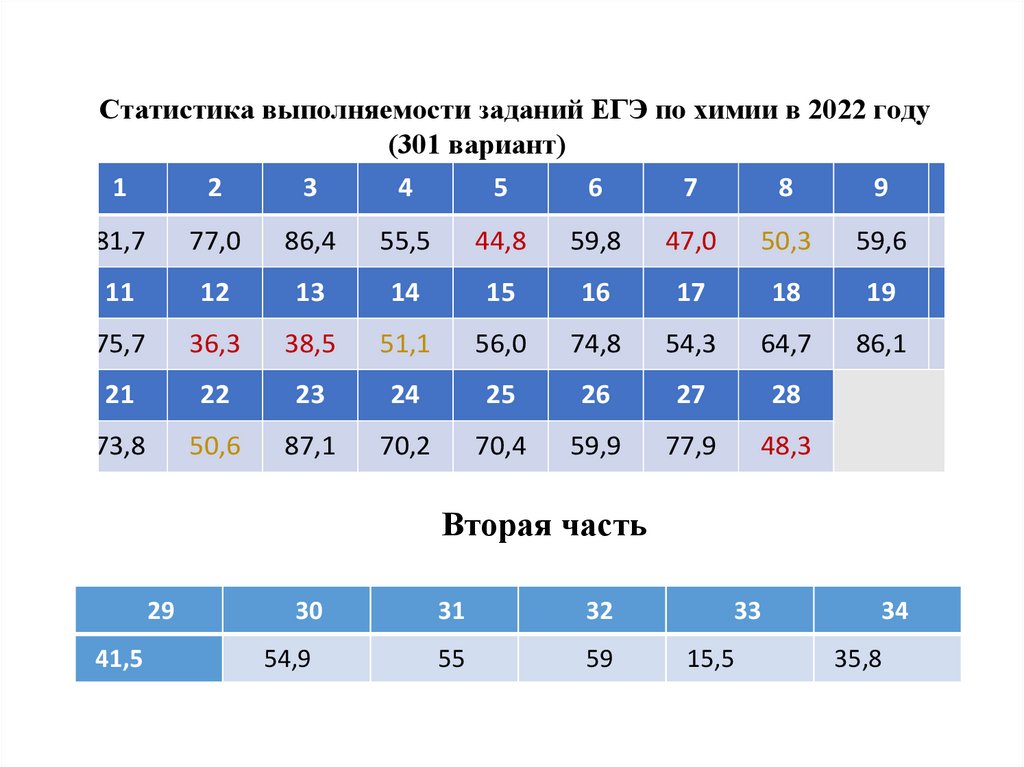
Статистика выполняемости заданий ЕГЭ по химии в 2022 году(301 вариант)
1
2
3
4
5
6
7
8
9
10
81,7
77,0
86,4
55,5
44,8
59,8
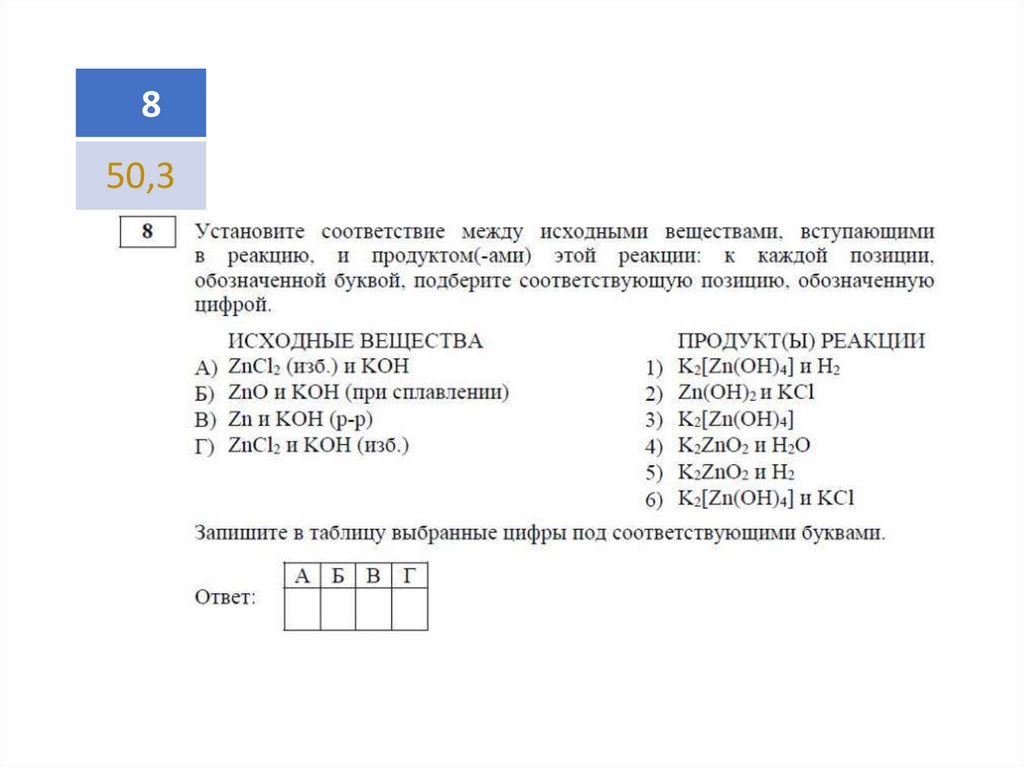
47,0
50,3
59,6
68,5
11
12
13
14
15
16
17
18
19
20
75,7
36,3
38,5
51,1
56,0
74,8
54,3
64,7
86,1
94,0
21
22
23
24
25
26
27
28
73,8
50,6
87,1
70,2
70,4
59,9
77,9
48,3
Вторая часть
29
41,5
30
31
32
54,9
55
59
33
15,5
34
35,8
12.
544,8
13.
544,8
14.
747,0
15.
747,0
16.
850,3
17.
850,3
18.
1236,3
19.
1236,3
20.
1338,5
21.
2250,6
22.
2848,3
23.
Изменения 2023 года24.
20222023
25.
1. В заданиях 32, проверяющих умения составлять уравненияхимических реакций, которые отражают генетическую связь
между классами органических веществ (цепочка превращений),
стрелочки, соединяющие формулы или обозначения веществ,
могут быть направлены в обоих направлениях.
2. В условиях заданий 32 (схемы превращений органических
веществ) могут быть использованы не только последовательные
превращения органических веществ, но и «разнонаправленные»
превращения одного из веществ, указанного в схеме
превращений.
3. В условиях заданий (32 и 33) могут быть использованы скелетные
формулы органических веществ.
26.
27.
Задание 29(составление ОВР из веществ предложенного списка)
• электронный баланс можно считать составленным верно в случае, если любым
способом будет показано, что число отданных восстановителем электронов,
равно числу электронов, принимаемых окислителем:
это могут быть коэффициенты в уравнении реакции;
могут быть указаны множители за вертикальной чертой;
может
присутствовать словесная запись о числе отданных и
присоединённых электронов;
может быть использован метод полуреакций (электронно-ионный баланс);
• указан окислитель и восстановитель ЛЮБЫМ СПОСОБОМ;
• если приведено несколько вариантов ответа, то проверяется только первый из
них.
(Запись степени окисления «-» допустима)
28.
Запись электронного балансаK2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + …
Допустимы записи:
2Cr+6 + 6ē → 2Cr+3
1
2Br-1 - 2ē → Br2
3
или
Cr+6 + 3ē → Cr+3 1
3
Br- - ē → Br0
или
2Cr+6 + 6ē → 2Cr+3 1
2Br- - 2ē → 2Br
3
Количество принятых и
отданных электронов
может быть указано над
стрелкой.
29.
Обозначение степени окисленияТакие обозначения степеней окисления как N5+ и N4+
(сначала цифра, затем знак) считаются неверными.
Исключение: у ионов
металлов степень
окисления равна заряду иона, поэтому такую как
запись как
Mg2+ + 2e = Mg0
следует считать верной (можно рассматривать как
элемент электронно-ионного баланса)
• степень окисления 0 может не указываться экзаменуемым;
• если степень окисления не указана, то считать её равной 0;
• считать верными записи, подобные следующим «Cl-1», «Cl-» ,
«2Cr3+», «Cr+6», которые экзаменуемый использовал при указании
степени окисления;
• считать неверными записи, подобные следующим «N23–», «Cr26+»
30.
Задание 30(составление РИО из веществ предложенного списка)
Ионные уравнения реакций отражают суть тех изменений, которые
происходят при взаимодействии веществ − электролитов
Реакции в растворах электролитов идут практически до конца в
том случае, если происходит связывание исходных ионов с
образованием:
−слабого электролита,
−осадка малорастворимого вещества,
−газообразного продукта.
В ионном уравнении реакции хорошо растворимые сильные электролиты записывают
в виде соответствующих ионов, а слабые электролиты, нерастворимые вещества и
газы − в молекулярном виде.
В сокращённом ионном уравнении дробные или удвоенные
коэффициенты не допускаются.
31.
Задание 30Степень диссоциации слабых электролитов в разбавленных
водных растворах не превышает, как правило, 10-20%,
например:
Слабый электролит
α, % (С = 0,1М)
H2SO3
20
HF
8
HNO2
4
NH3·H2O
1,4
CH3COOH
1,4
H2CO3
0.2
H2S
0,07
32.
В качестве исходных веществ должны бытьвыбраны
растворимые в воде соли
(исключение
–
взаимодействие
нерастворимых карбонатов с кислотами).
Реакции образования гидроксокомплексов при взаимодействии
растворов щелочей и растворимых солей цинка и алюминия также
можно отнести к реакциям ионного обмена:
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Zn2+ + SO42- + 4Na+ + 4OH- = 2Na+ + [Zn(OH)4] 2-+ 2Na+ +SO42-
Zn2+ + 4OH- = [Zn(OH)4]2-
33.
Некоторые особые случаи! В случае H2SO4 возможны записи, как 2H+ + SO42- ,
так и H+ и HSO4-
! В случае H3PO4 возможны записи, как H+ + H2PO4-, так
и H3PO4
Кислые соли диссоциируют ступенчато, например:
NaHSO3 → Na+ + HSO3 −
HSO 3− ⇆ H+ + SO 32−
(первая ступень)
(вторая ступень).
В ионном уравнении используется записи типа
Na+ + HSO3−
! В случае гидросульфатов возможны записи типа как Na+ + H+ + SO42,
так и Na+ и HSO4-
! При взаимодействии солей аммония со щелочами допустимы записи NH3∙H2O,
NH3 + H2O (нежелательно NH4OH)
34.
Задание 31составлять уравнения реакций отражающих взаимосвязь
веществ различных классов неорганических веществ по
описанию изменений, происходящих с ними
Каждый из четырёх элементов ответа считать
верным если:
-правильно записаны все формулы веществ − участников
реакции;
-указаны все коэффициенты (допустимо использование
дробных и удвоенных коэффициентов);
Примечание. При составлении уравнения реакции
экзаменуемый может:
- не указывать условие ее проведения (прокаливание,
катализатор), так как они указаны в условии задания;
- не использовать обозначения осадка «↓» или газа «↑»
35.
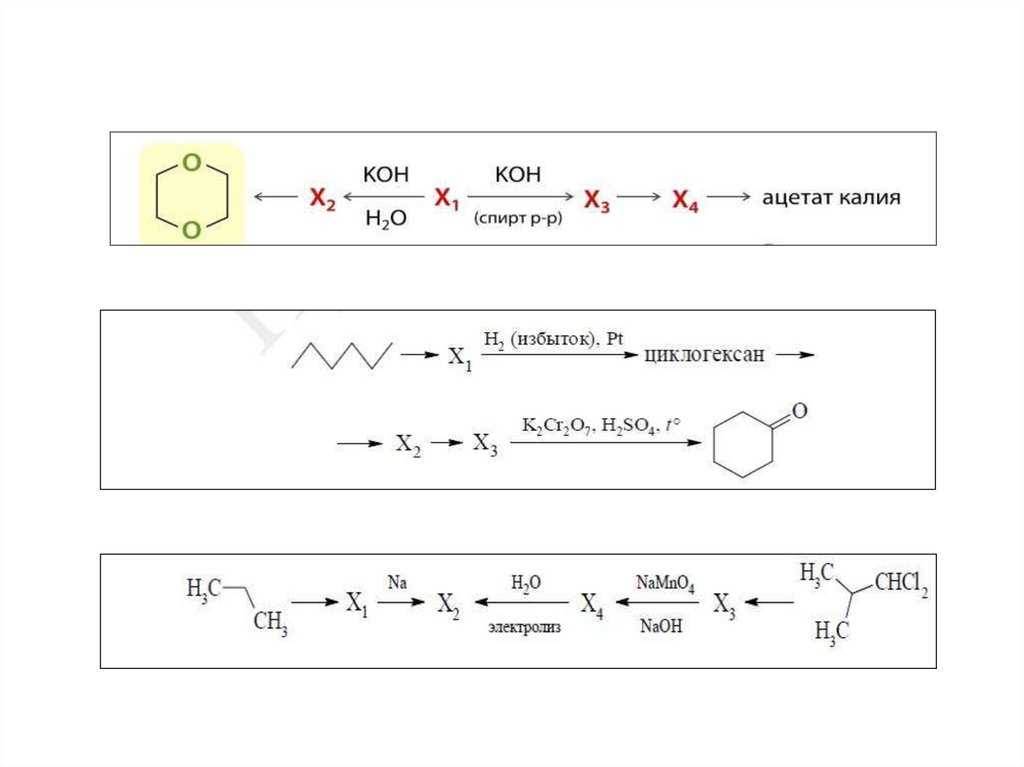
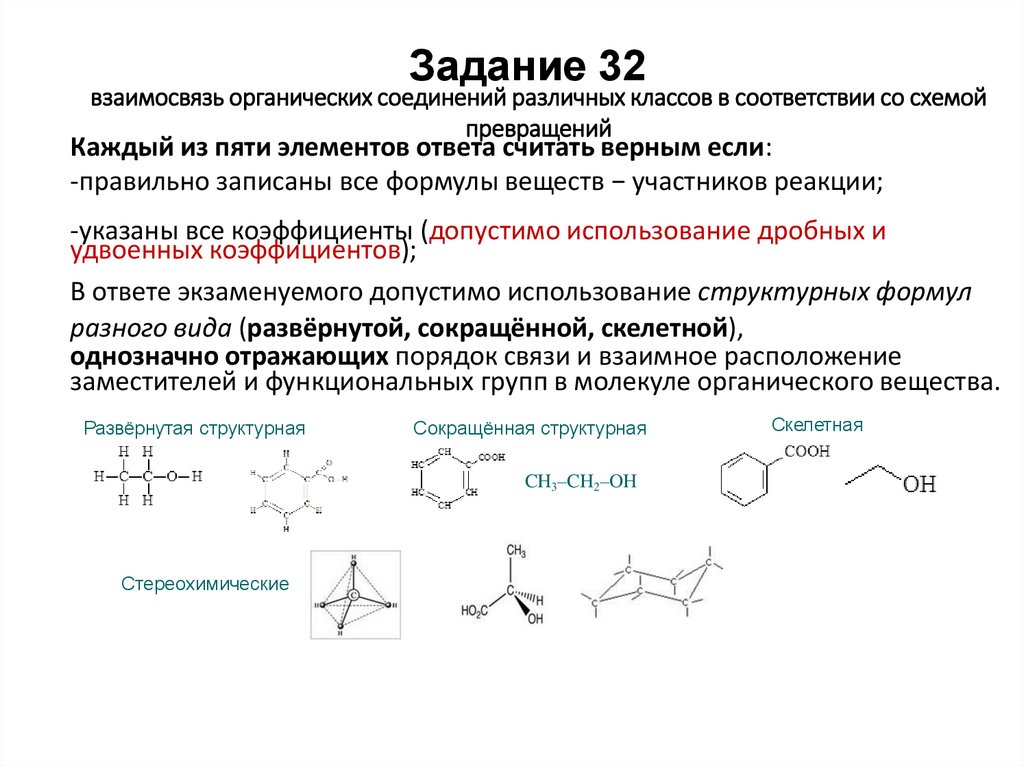
Задание 32взаимосвязь органических соединений различных классов в соответствии со схемой
превращений
Каждый из пяти элементов ответа считать верным если:
-правильно записаны все формулы веществ − участников реакции;
-указаны все коэффициенты (допустимо использование дробных и
удвоенных коэффициентов);
В ответе экзаменуемого допустимо использование структурных формул
разного вида (развёрнутой, сокращённой, скелетной),
однозначно отражающих порядок связи и взаимное расположение
заместителей и функциональных групп в молекуле органического вещества.
Развёрнутая структурная
Сокращённая структурная
CH3–CH2–OH
Стереохимические
Скелетная
36.
Допустимо использование молекулярных формул для простейших• представителей гомологических рядов:
• CH4, C2H2, C6H6, C2H5OH, CH2O, С6Н12О6 и др.
• Допустимо использование формул, однозначно отражающих
строение вещества:CН3СНО, CН3СО2H, CH3CH(OH)CH3, С6Н5–СООН
Недопустимо: CH3–C6H4–COOH или C6H4(NO2)OH, C6H5C2H4Cl
При записи уравнения химической реакции экзаменуемый может:
-не использовать обозначения осадка «↓» или газа «↑»;
- не указывать условие её проведения (прокаливание, катализатор),
так как условием задания это не предусмотрено.
Элемент ответа считать ошибочным в случае если в ответе учащегося
указаны условия проведения конкретной реакции, которые не
соответствуют протеканию данной реакции с образованием записанных
продуктов
37.
Задание 33Установление молекулярной и структурной формулы вещества
При условии, если структурная формула органического вещества
не записана как отдельный элемент ответа, а присутствует лишь в
уравнении реакции (в последнем элементе ответа) и составлена
правильно, то этот элемент ответа считается выполненным и
выставляется 1 балл за «структурную формулу».
Задание 34
Расчёты массы (объёма, количества вещества) продуктов реакции, если
одно из веществ дано в избытке. Расчёты с использованием понятия
«массовая доля вещества в растворе». Расчёты массовой доли (массы)
химического соединения в смеси
• допустимо использование дробных и удвоенных
коэффициентов)
• если допущена ошибка хотя бы в одном из уравнений
реакций, даже при условии, что она не влияет на ход
дальнейших вычислений, то за этот элемент ответа
выставляется 0 баллов.































 Химия
Химия








