Похожие презентации:
Азот
1.
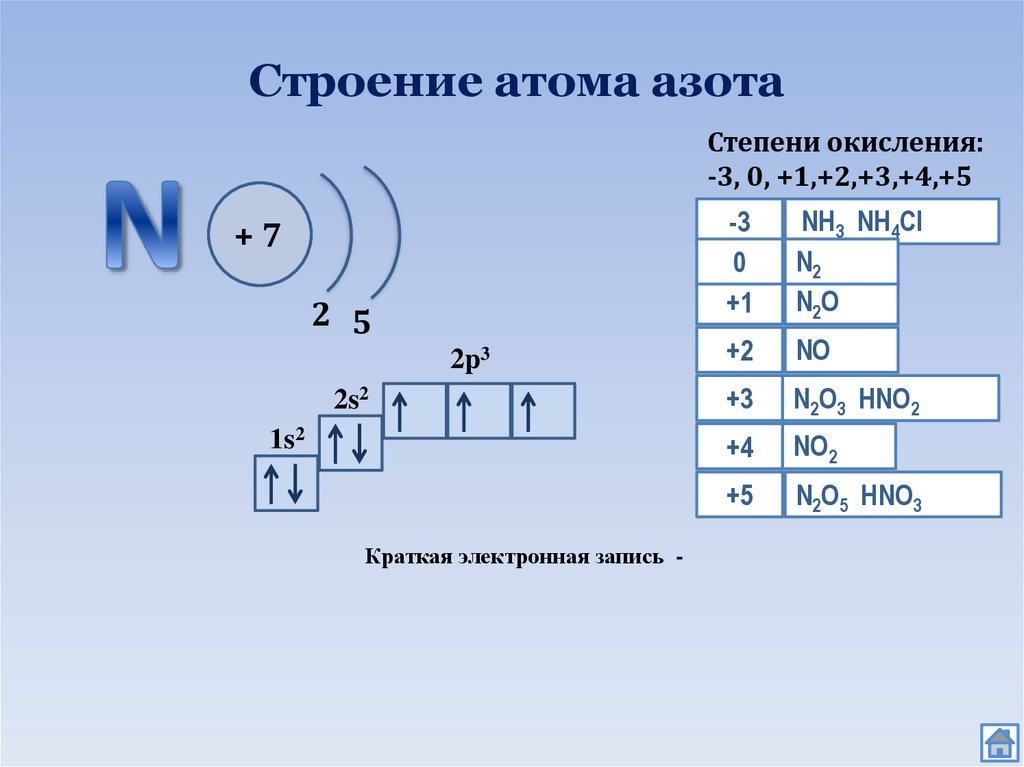
2. Строение атома азота
Степени окисления:-3, 0, +1,+2,+3,+4,+5
+7
2 5
2p3
2s2
1s2
Краткая электронная запись -
-3
0
+1
NH3 NH4Сl
N2
N2 О
+2
NО
+3
N2О3 HNO2
+4
NО2
+5
N2О5 HNO3
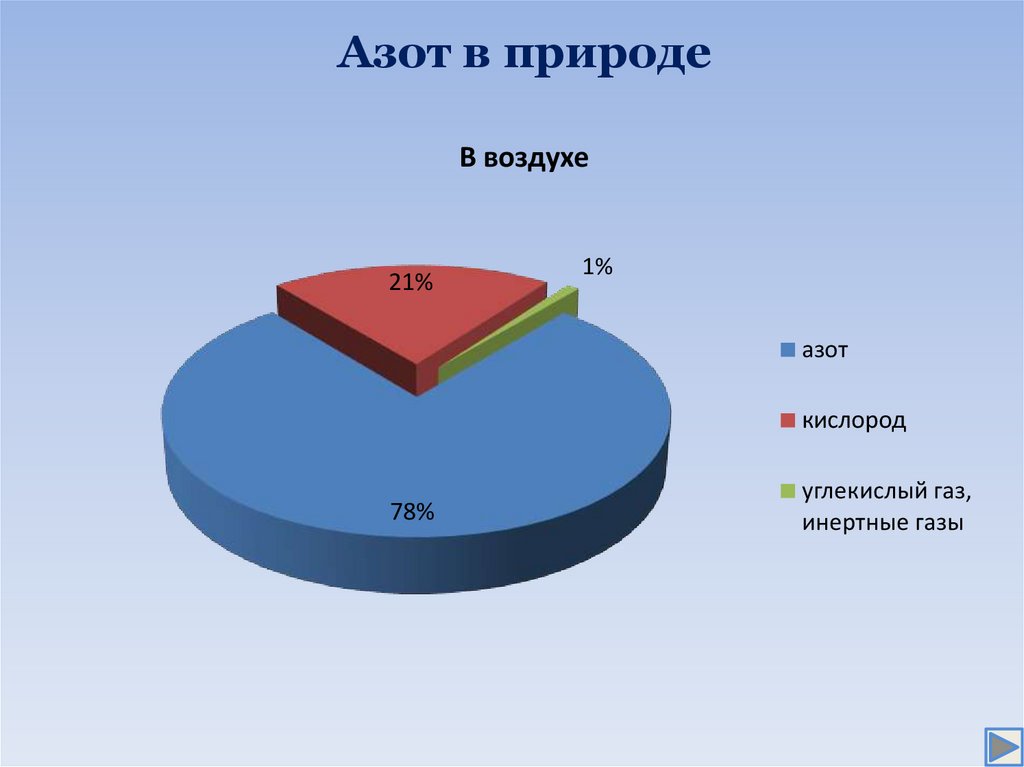
3. Азот в природе
В воздухе21%
1%
азот
кислород
78%
углекислый газ,
инертные газы
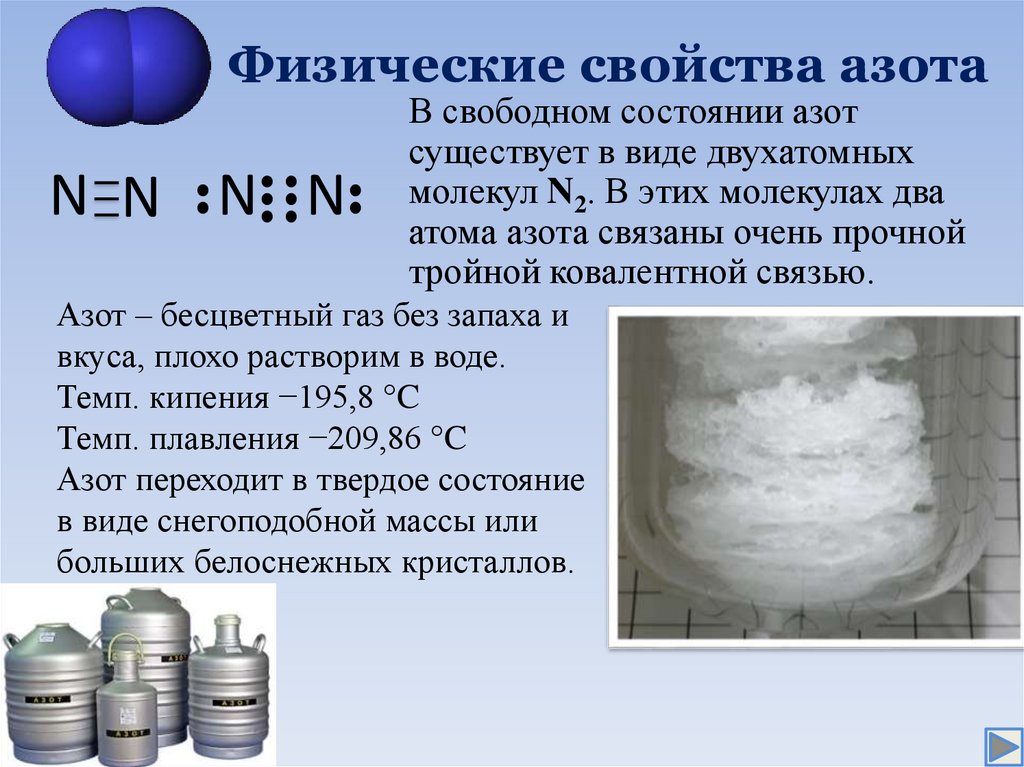
4. Физические свойства азота
N N N NВ свободном состоянии азот
существует в виде двухатомных
молекул N2. В этих молекулах два
атома азота связаны очень прочной
тройной ковалентной связью.
Азот – бесцветный газ без запаха и
вкуса, плохо растворим в воде.
Темп. кипения −195,8 °C
Темп. плавления −209,86 °C
Азот переходит в твердое состояние
в виде снегоподобной массы или
больших белоснежных кристаллов.
5. Химические свойства азота
1. При обычных условиях азот взаимодействует только с литием,образуя нитрид лития:
6Li+ N2 = 2Li3N
С другими металлами он реагирует только при нагревании.
2. При высоких температурах, давлении и в присутствии
катализатора азот реагирует с водородом, образуя аммиак:
N2 + 3H2 = 2NH3
3. При температуре электрической дуги (2000 - 4000 0С) он
соединяется с кислородом, образуя оксид азота (II):
N2 + O2 = 2NO – Q
Задание: составьте формулы соединений N с Li, Са, Al, Mg
6. ПРИМЕНЕНИЕ
Получение аммиака
Создание инертной среды
Создание низких температур
В охладительных системах
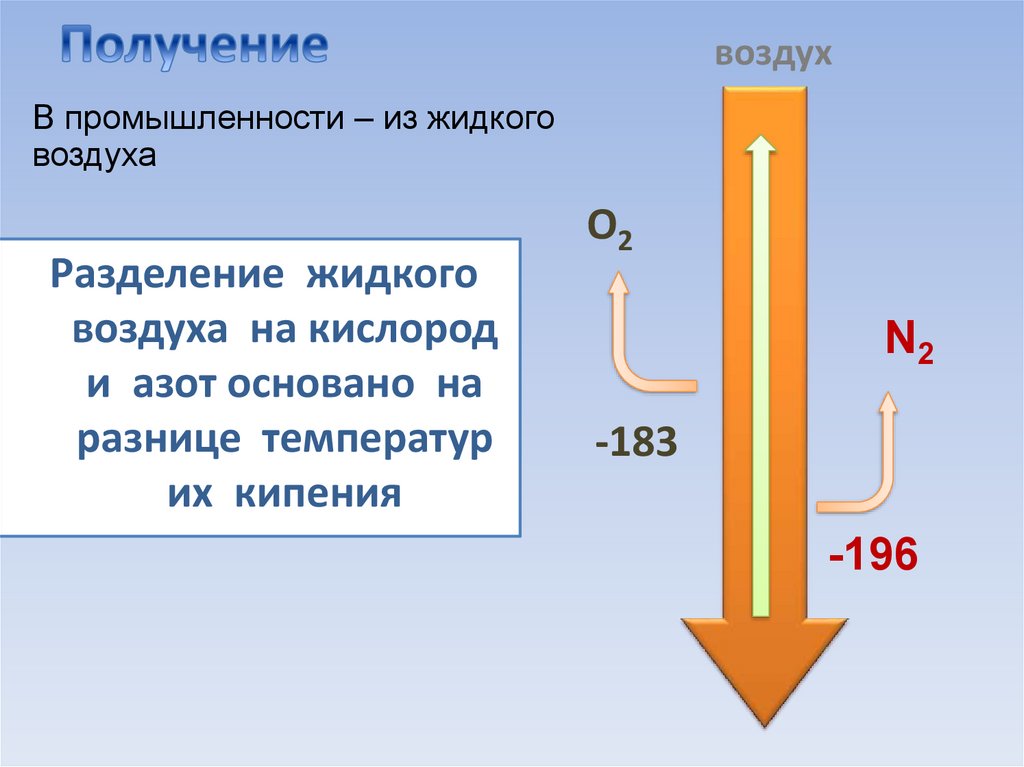
7. Получение
воздухВ промышленности – из жидкого
воздуха
Разделение жидкого
воздуха на кислород
и азот основано на
разнице температур
их кипения
O2
N2
-183
-196
8. Получение в лаборатории
2. Разложение нитрита аммонияNH4NO2 N2 + 2H2O
3. Взаимодействие аммиака с оксидом меди (II)
2NH3 + 3CuO N2 + 3Cu + 3H2O
4. Горение аммиака
4NH3 + 3O2 2N2 + 6H2O
9. Вопросы для самоконтроля
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
Газ без цвета , вкуса и запаха
Молекула двухатомна
Содержание в воздухе 78 %
В лаборатории получают разложением KMnO4
и H2O2
В промышленности – из жидкого воздуха
Химически малоактивен
Взаимодействует почти со всеми простыми
веществами
С ним связаны процессы дыхания и
фотосинтеза
Является составной частью белков
Участвует в круговороте веществ в природе
10. Вставьте пропущенные слова
В периодической системе Д.И. Менделеева азотрасположен в 2 периоде, V группе, главной
подгруппе. Его порядковый номер 7 , относительная
атомная масса 14 .
В соединениях азот проявляет степени окисления
+5, +4, +3, +2, +1, -3 . Число протонов в атоме азота 7 ,
электронов 7 , нейтронов 7 , заряд ядра +7 ,
электронная формула 1s22s22p3 Формула высшего
оксида N2O5 , его характер кислотный , формула
азотной кислоты НNО3 , формула летучего
водородного соединения NН3 .
11. Распределите соединения азота по классам неорганических соединений
Оксидыневерно
NH
Кислоты
неверно
NO
Соли
неверно
NO
неверно
верно
верно
неверно
NaNO
верно
HNO
неверно
NH
верно
неверно
N2O5
верно
Al(NO
2) 3
верно
NO
неверно)
Fe(NO
3 2
верно
LiNO
3
HNO3
3
N2O5
неверно
HNO
2
2
3
HNO2
3
неверно
NO
2
2
KNO3
3
3
неверно
NO
2
5
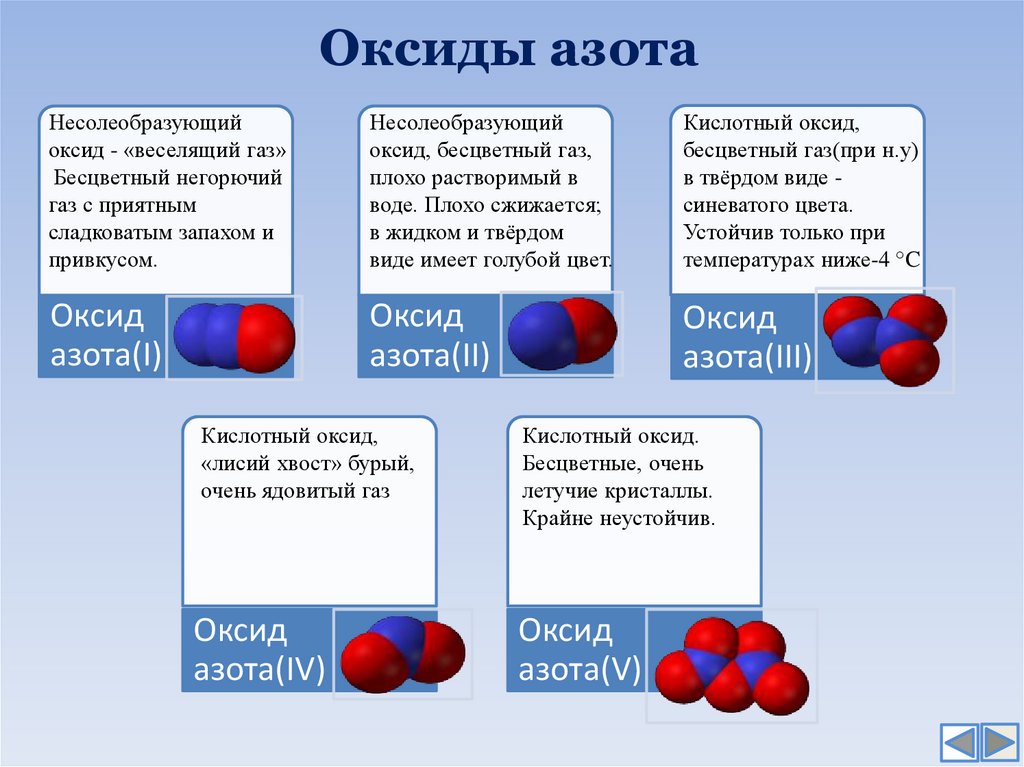
12. Оксиды азота
Несолеобразующийоксид - «веселящий газ»
Бесцветный негорючий
газ с приятным
сладковатым запахом и
привкусом.
Несолеобразующий
оксид, бесцветный газ,
плохо растворимый в
воде. Плохо сжижается;
в жидком и твёрдом
виде имеет голубой цвет.
Кислотный оксид,
бесцветный газ(при н.у)
в твёрдом виде синеватого цвета.
Устойчив только при
температурах ниже-4 °C
Оксид
азота(I)
Оксид
азота(II)
Оксид
азота(III)
Кислотный оксид,
«лисий хвост» бурый,
очень ядовитый газ
Оксид
азота(IV)
Кислотный оксид.
Бесцветные, очень
летучие кристаллы.
Крайне неустойчив.
Оксид
азота(V)







 Химия
Химия








