Похожие презентации:
Промышленное получение аммиака
1.
Промышленное получение аммиакаПрезентацию выполнила:
Студентка 12 группы
Монахова Е.Ю.
2.
Что такое аммиак?• Аммиак — NH3, нитрид водорода, при нормальных условиях —
бесцветный газ с резким характерным запахом
(запах нашатырного спирта), почти вдвое легче воздуха, очень
ядовит. Растворимость NH3 в воде чрезвычайно велика — около
1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
• М (NH3) = 17 г/моль
• Нашатырный спирт – 10%-ный раствор аммиака
3.
Открытие аммиака• Аммиак был открыт Дж.
Пристли в 1774г. и назван им
щелочным воздухом или
газом. Твердый аммиак бесцветные кристаллы с
кубической решеткой (а =
=0,515 нм, 2 = 4, пространств,
группа Р213). Жидкий
аммиак растворяет щелочные
и щел.-зем. металлы, Al, Eu,
Yb, P, S, I, мн.
интерметаллиды.
4.
Фриц Габер и Карл Бош• Синтез аммиака – процесс связывания азота, который впервые
осуществил известный немецкий химик - неорганик Фриц Габер
в 1908 г.
• Ф.Габер и К.Бош создали циркуляционную схему синтеза
аммиака под давлением. В 1913 г. в Германии заработала первая
промышленная установка. За разработку процесса синтеза
аммиака Габеру и Бошу в 1918 г. была присуждена Нобелевская
премия.
• Фриц Габер (1868-1934 гг.)
Карл Бош (1874-1940 гг.)
5.
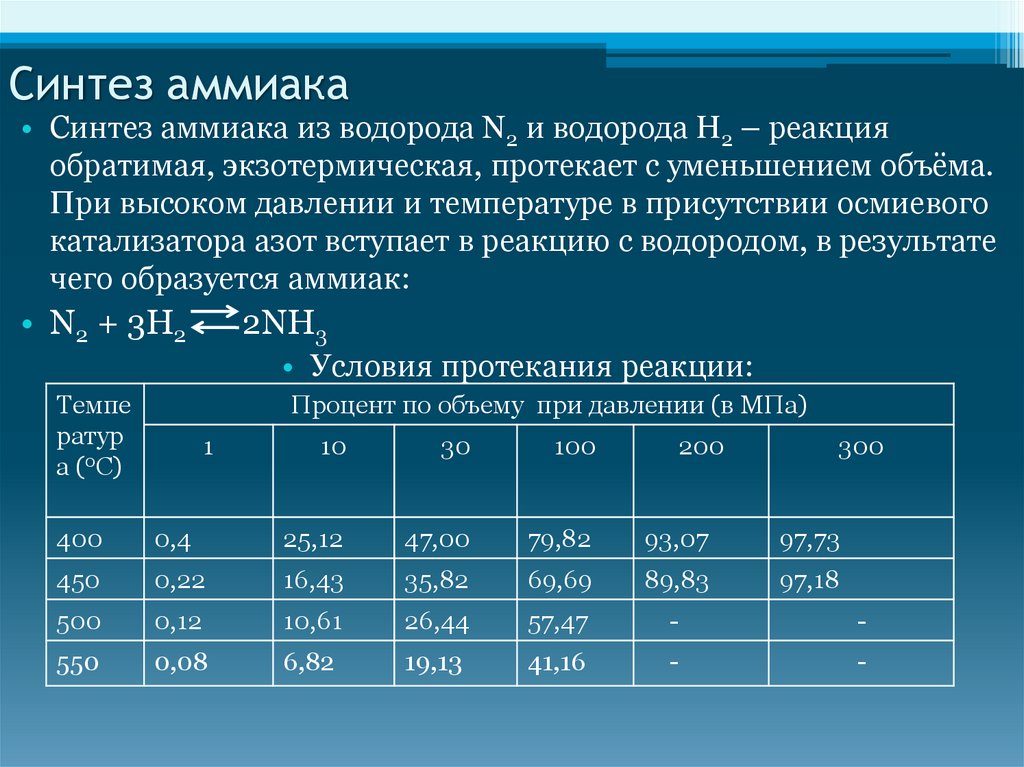
Синтез аммиака• Синтез аммиака из водорода N2 и водорода H2 – реакция
обратимая, экзотермическая, протекает с уменьшением объёма.
При высоком давлении и температуре в присутствии осмиевого
катализатора азот вступает в реакцию с водородом, в результате
чего образуется аммиак:
• N2 + 3H2
2NH3
• Условия протекания реакции:
Процент по объему при давлении (в МПа)
Темпе
ратур
а (0С)
1
10
30
100
200
300
400
0,4
25,12
47,00
79,82
93,07
97,73
450
0,22
16,43
35,82
69,69
89,83
97,18
500
0,12
10,61
26,44
57,47
-
-
550
0,08
6,82
19,13
41,16
-
-
6.
7.
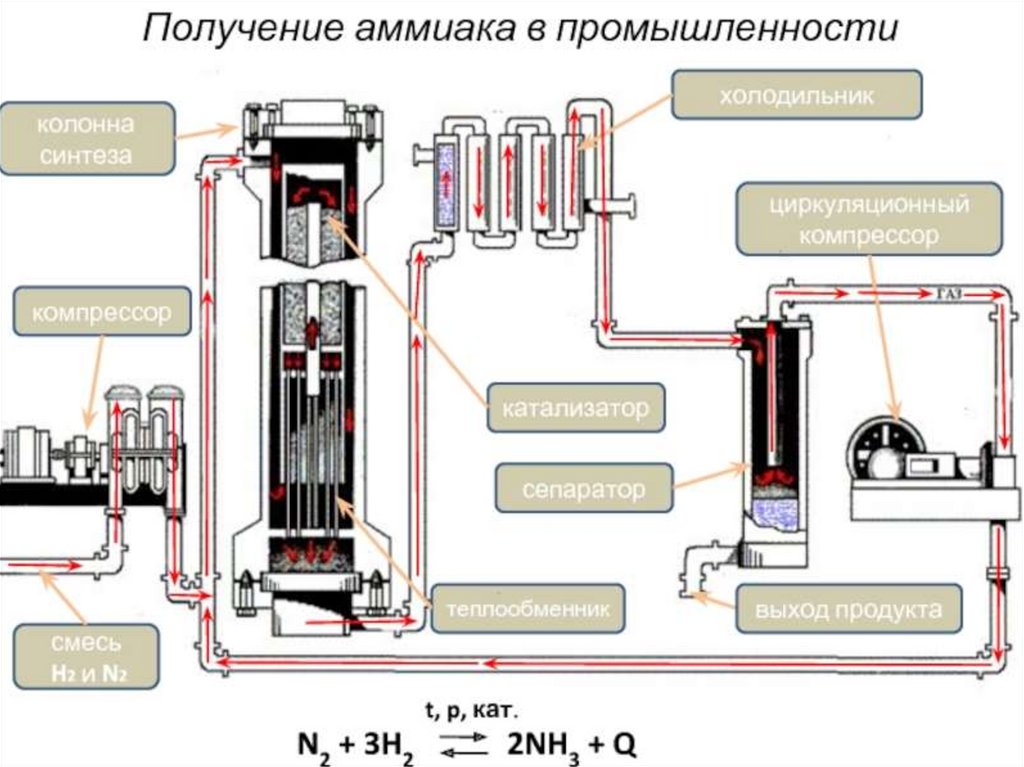
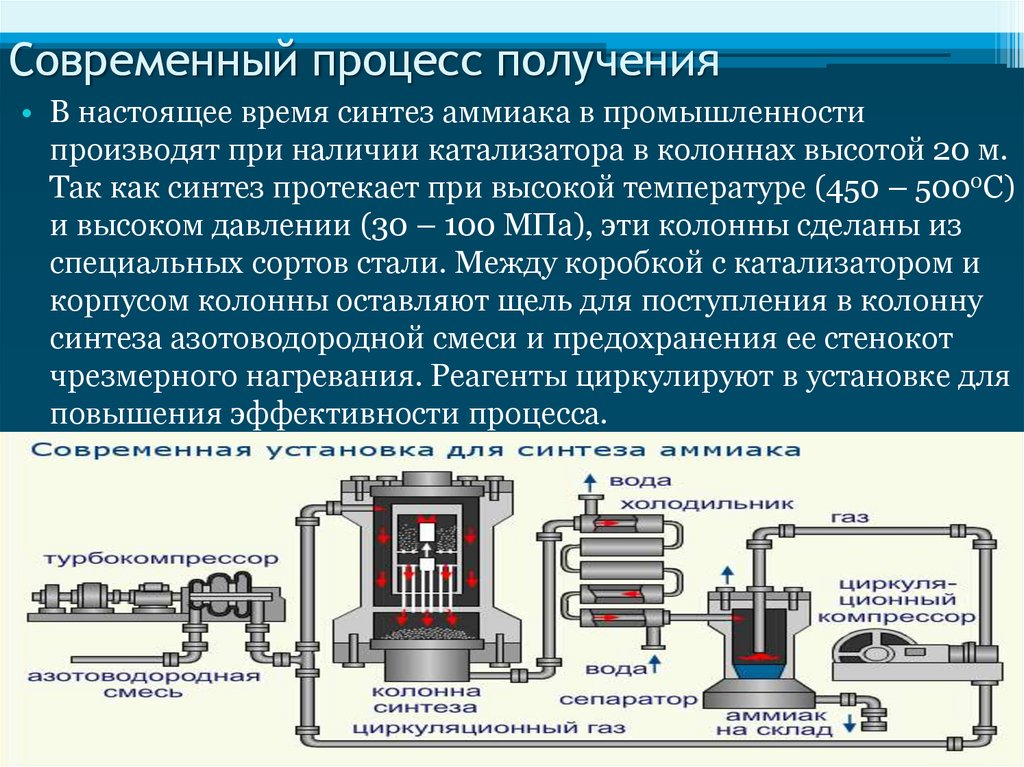
Современный процесс получения• В настоящее время синтез аммиака в промышленности
производят при наличии катализатора в колоннах высотой 20 м.
Так как синтез протекает при высокой температуре (450 – 5000С)
и высоком давлении (30 – 100 МПа), эти колонны сделаны из
специальных сортов стали. Между коробкой с катализатором и
корпусом колонны оставляют щель для поступления в колонну
синтеза азотоводородной смеси и предохранения ее стенокот
чрезмерного нагревания. Реагенты циркулируют в установке для
повышения эффективности процесса.
8.
Итоги исследований• В результате исследований Ф. Габеру удалось обобщить сведения
об этой реакции и подобрать условия для ее промышленного
проведения.
• Массовое производство аммиака началось в канун первой
мировой войны благодаря К. Бошу, химику – технологу
предприятия «BASF». На первых установках синтез проводили
под давлением 20 МПа, при температуре 5000C на осмиевом (Оs)
катализаторе. А чтобы повысить выход аммиака, было
предложено возвращать не прореагировавшею азотоводородную
смесь обратно в реакционный аппарат.
Установка для промышленного
производства аммиака,
разработанная Ф. Габером и К.
Бошем.
9.
Действие аммиака на организм• Аммиак сильно раздражает слизистые
оболочки уже при 0,5%-ном содержании
его в воздухе. Острое отравление
аммиаком вызывает поражения глаз и
дыхательных путей, одышку и
воспаление лёгких. Средствами первой
помощи служат свежий воздух,
обильное промывание глаз водой,
вдыхание водяного пара. Предельно
допустимой концентрацией NH3 в
воздухе производственных помещений
считается 0,02 мг/л. Смеси аммиака с
воздухом, содержащие от 16 до 28
объёмных процента аммиака
взрывоопасны
10.
Использование аммиака в медицине• Медики используют водные
растворы аммиака
(нашатырный спирт) в
повседневной практике: ватка,
смоченная в нашатырном
спирте, выводит человека из
обморочного состояния. Для
человека аммиак в такой дозе
не опасен.
Тем не менее этот газ
токсичен. К счастью, человек
способен почувствовать запах
аммиака в воздухе уже в
ничтожной концентрации –
0,0005 мг/л, когда еще нет
большой опасности для
здоровья.
11.
Вывод• В настоящее время аммиак – основное сырье для получения
азотсодержащих веществ, применяемых в промышленности,
сельском хозяйстве и быту. На основе аммиака производят все
соединения азота, используемые в качестве целевых продуктов и
полупродуктов неорганической и органической технологии.
• Производство аммиака не загрязняет окружающую среду: все
аппараты максимально герметичны, используется энергия
экзотермической реакции, процесс непрерывен и полностью
автоматизирован.








 Химия
Химия








