Похожие презентации:
Углеводы. Моносахариды. Важнейшие представители
1.
Углеводы:моносахарид
Важнейшие
ы.
представители
2.
Углеводы —это органические вещества,
содержащие карбонильную
группу и несколько
гидроксильных групп.
Углеводы
3.
ШмидтКарл Эрнст Генрих
(1822–1894 гг.)
Название «углеводы»
происходит от слов «гидраты
углерода».
Впервые было предложено в 1844
году
К. Шмидтом.
4.
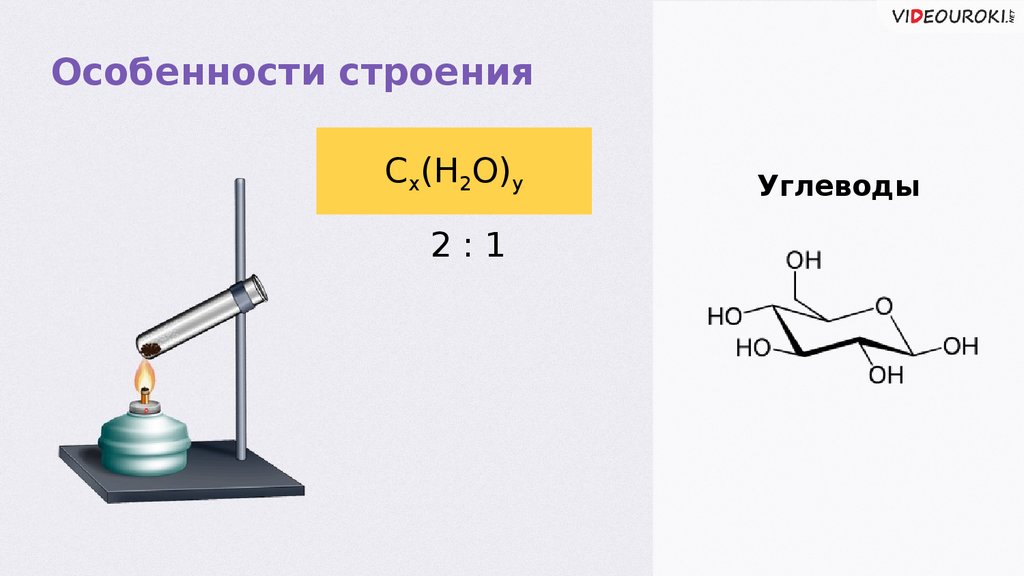
Особенности строенияCx(H2O)y
2:1
Углеводы
5.
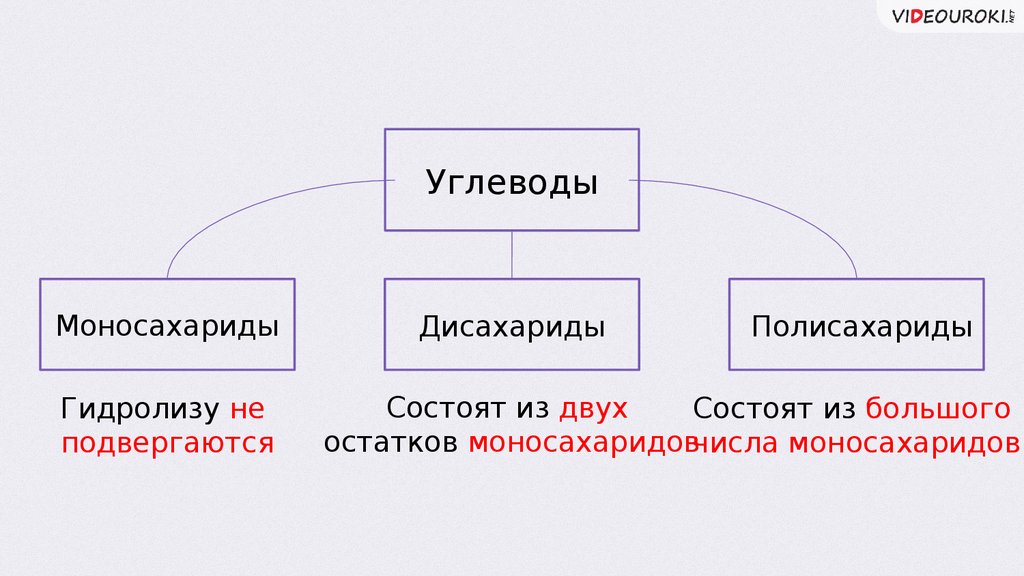
УглеводыМоносахариды
Гидролизу не
подвергаются
Дисахариды
Полисахариды
Состоят из двух
Состоят из большого
остатков моносахаридовчисла моносахаридов
6.
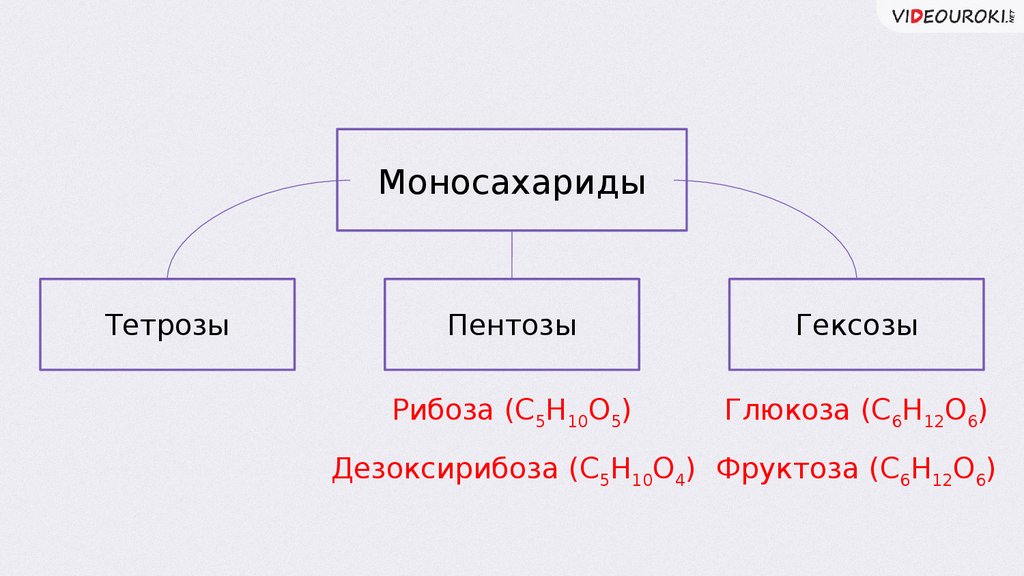
МоносахаридыТетрозы
Пентозы
Гексозы
Рибоза (С5Н10О5)
Глюкоза (С6Н12О6)
Дезоксирибоза (С5Н10О4) Фруктоза (С6Н12О6)
7.
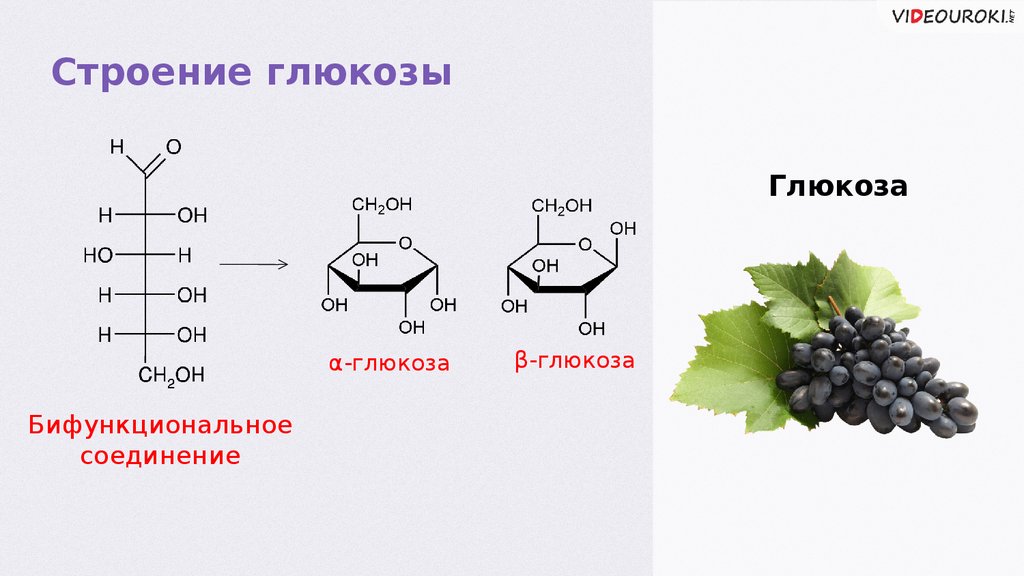
Строение глюкозыГлюкоза
α-глюкозаглюкоза
Бифункциональное
соединение
β-глюкозаглюкоза
8.
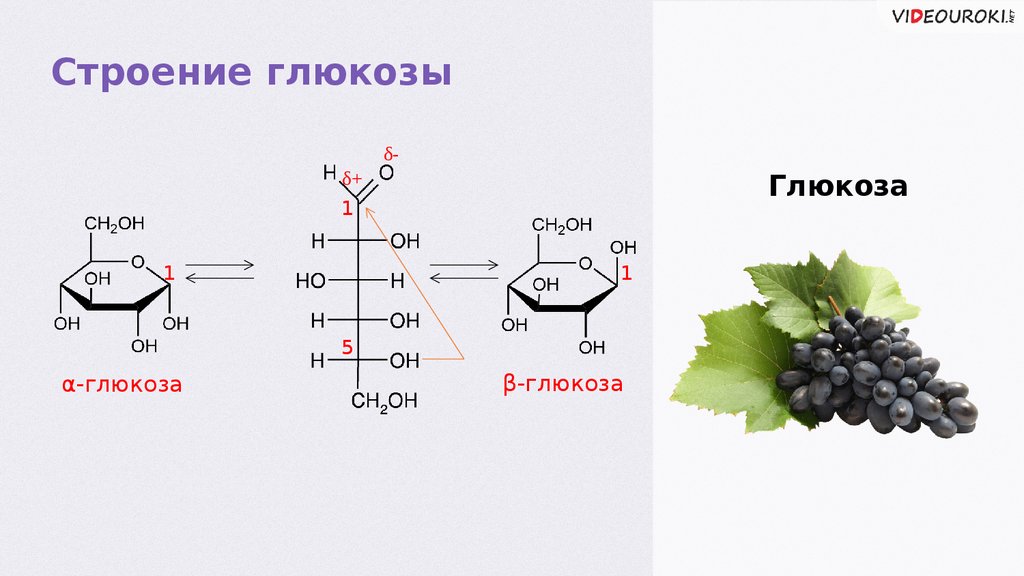
Строение глюкозыδδ+
Глюкоза
1
1
1
5
α-глюкозаглюкоза
β-глюкозаглюкоза
9.
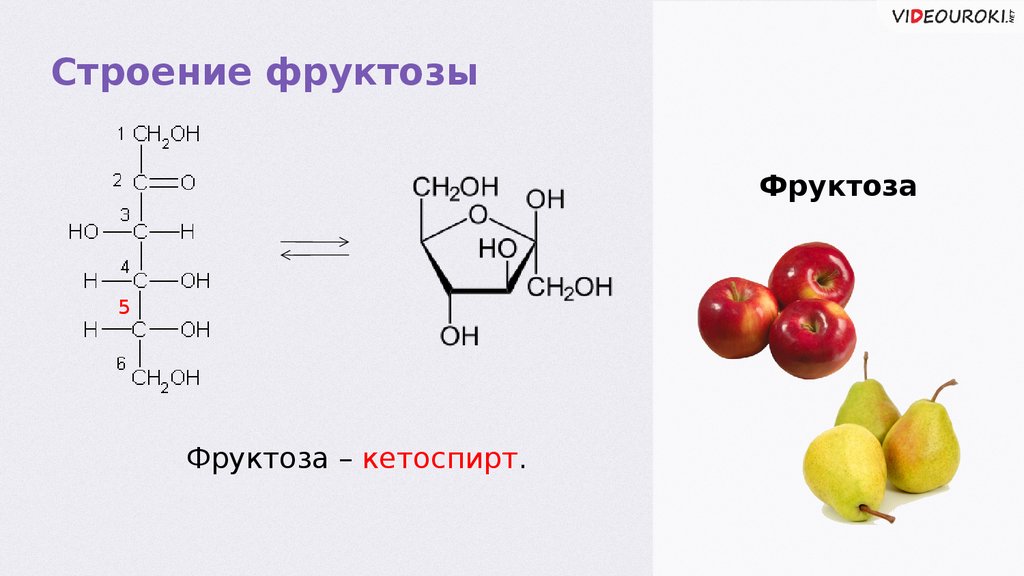
Строение фруктозыФруктоза
5
Фруктоза – кетоспирт.
10.
Физические свойства глюкозыГлюкоза:
бесцветное кристаллическое
вещество;
хорошо растворима в воде;
сладкая на вкус.
Глюкоза
11.
Глюкозасодержится в плодах
и цветах,
листьях и корнях.
12.
Много глюкозыв соке винограда
и спелых фруктах.
13.
Мёд состоит изсмеси глюкозы и фруктозы.
14.
В крови человекамассовая доля глюкозы
составляет 0,1 %.
15.
При сахарном диабетеглюкоза содержится
в крови, моче в
повышенной концентрации.
16.
Физические свойства фруктозыФруктоза:
безводные кристаллы;
кристаллы имеют форму игл;
легко растворяется в воде и
спирте.
Фруктоза
17.
Фруктоза и глюкозасодержатся
в сладких фруктах, мёде.
18.
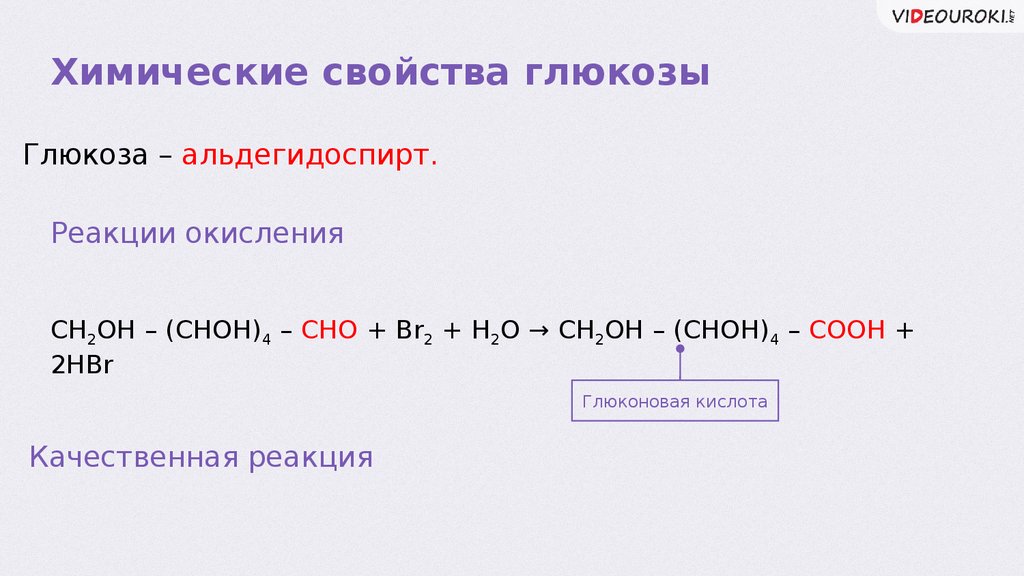
Химические свойства глюкозыГлюкоза – альдегидоспирт.
Реакции окисления
CH2OH – (CHOH)4 – CHO + Br2 + H2O → CH2OH – (CHOH)4 – COOH +
2HBr
Глюконовая кислота
Качественная реакция
19.
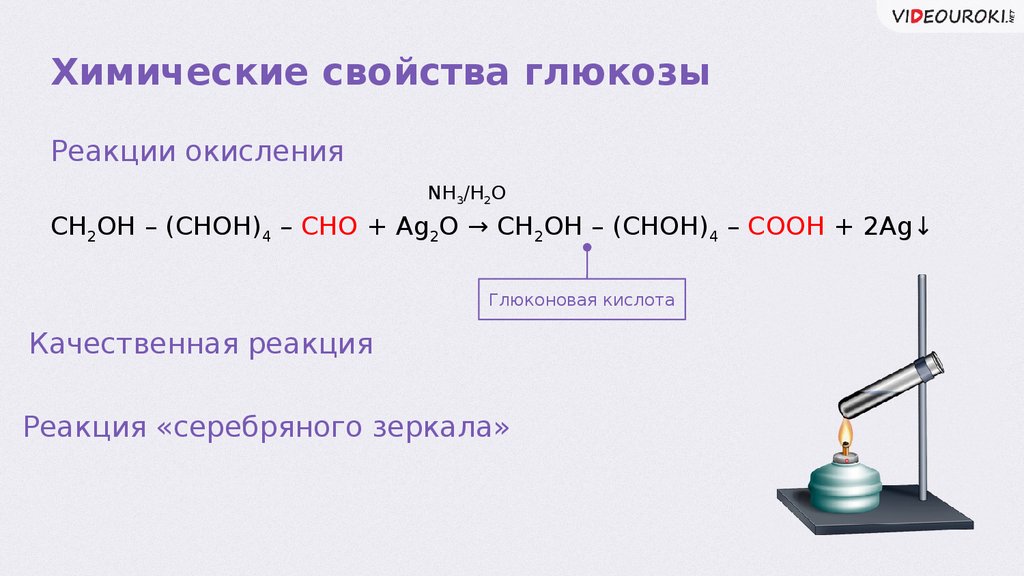
Химические свойства глюкозыРеакции окисления
NH3/H2O
CH2OH – (CHOH)4 – CHO + Ag2O → CH2OH – (CHOH)4 – COOH + 2Ag↓
Глюконовая кислота
Качественная реакция
Реакция «серебряного зеркала»
20.
Химические свойства глюкозыКак многоатомный спирт
Качественная реакция
21.
Химические свойства глюкозыКак альдегид
CH2OH – (CHOH)4 – CHO + Cu(OH)2 CH2OH – (CHOH)4 – COOH +
+ Cu2O↓ + 2H2O
Глюконовая кислота
Качественная реакция
22.
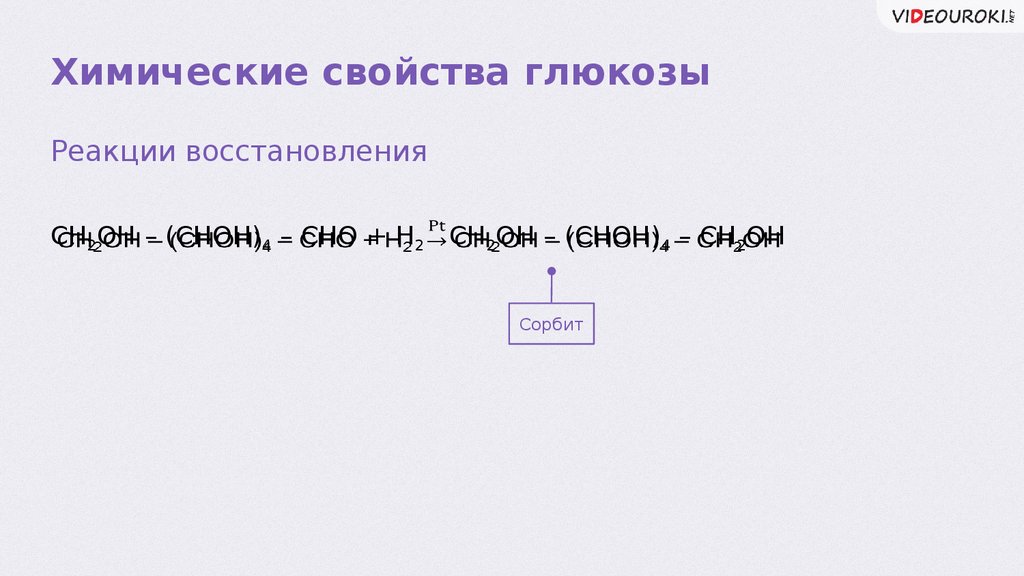
Химические свойства глюкозыРеакции восстановления
CH2OH – (CHOH)4 – CHO + Н2 CH2OH – (CHOH)4 – CH2OH
Сорбит
23.
Химические свойства глюкозыРеакции брожения
Спиртовое брожение
С6Н12О6 2С2Н5ОН + 2СО2↑
Этанол
Молочнокислое брожение
С6Н12О6 → 2Н3С – СН – СООН
|
Молочная кислота
ОН
24.
Молочнокислое брожениевызвано бактериями
рода Lactobacillus.
25.
Молочнокислое брожениеиспользуется для получения
простокваши, кефира,
творога, сметаны,
сыра, молочной кислоты.
26.
Применение молочной кислотыКвашение
капусты
Силосование кормов
27.
Применение молочной кислотыТекстильная
промышленность
Кожевенная
промышленность
28.
Химические свойства глюкозыРеакции брожения
Спиртовое брожение
С6Н12О6 2С2Н5ОН + 2СО2↑
Этанол
Молочнокислое брожение
Маслянокислое брожение
C6H12O6 → C3H7COOH +
+ 2H2↑ + 2CO2↑
С6Н12О6 → 2Н3С – СН – СООН
|
Молочная кислота
ОН
Масляная кислота
29.
Получение глюкозыПроцесс фотосинтеза
6СО2 + 6Н2О С6Н12О6 + 6О2↑
Глюкоза
30.
БутлеровАлександр Михайлович
(1828–1886 гг.)
Осуществил синтез глюкозы из
муравьиного альдегида в 1861
году.
Ca(OH)2
6Н – СОН → С6Н12О6
31.
Получение глюкозыВ промышленности
Гидролиз крахмала
H2SO4, t
(C6H10O5)n + nH2O → nC6H12O6
Глюкоза
32.
Применение глюкозыКак
энергетический
продукт
Питательное
вещество в
медицине
Получение
аскорбиновой
кислоты
33.
Применение глюкозыПолучение
сорбита
Получение
биополимеров
В кондитерском
деле
34.
Применение глюкозыИзготовление
зеркал
Изготовление
ёлочных
украшений
В текстильной
промышленности
35.
• Молекула глюкозы содержит альдегиднуюгруппу и пять гидроксильных групп.
• Глюкоза образует линейную и циклическую
формы.
• Изомером глюкозы является фруктоза.
• Для глюкозы характерны реакции окисления,
восстановления, брожения.
• В промышленности глюкозу получают
кислотным гидролизом из крахмала.
• Глюкоза имеет широкое применение.




















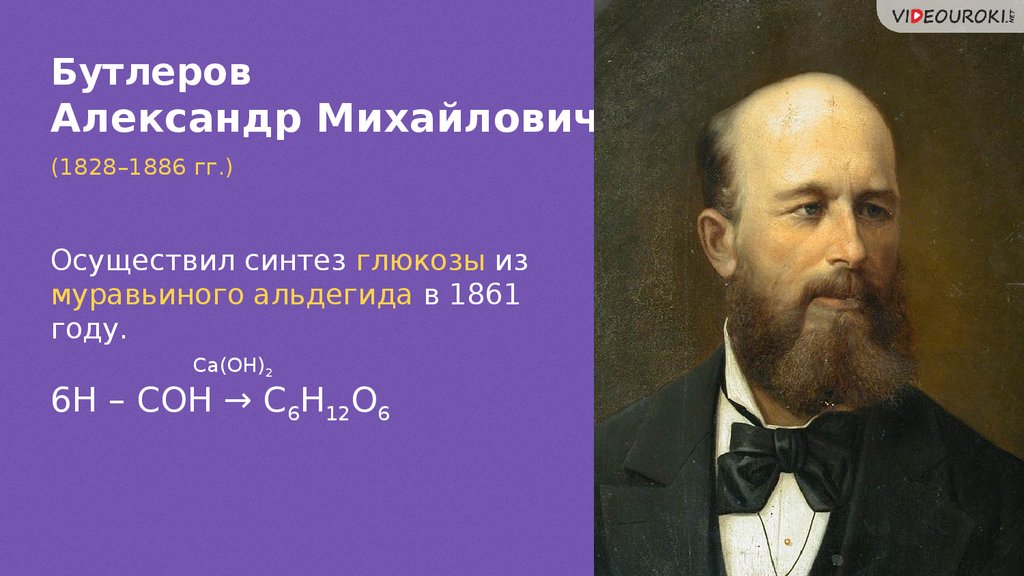





 Биология
Биология