Похожие презентации:
Окислительно-восстановительные реакции
1.
Окислительно –восстановительные
Реакции
2.
ЗАКРЕПЛЕНИЕИЗУЧЕННОГО
МАТЕРИАЛА
Выполним задание « Найди
родственников»
Из перечня формул составьте
генетический ряд.(вопросы…)
Ca(OH)2, CI2, HCI, Ca, P, CaCO3,
NaOH, CaO, CO2
Решим…
3.
Общий вывод:Признаки которые характеризуют
генетический ряд:
1. Вещества разных классов;
2. Разные вещества образованные одним
химическим элементом, т.е.
представляют собой разные формы
существование одного элемента;
3. Разные вещества одного химического
элемента связаны
взаимопревращениями.
4.
Вспомним …1.Валентность.
2.Степень окисления.
3.Восстановитель.
4.Окислитель.
5.Типы химических
реакций.
5.
Окислительно –восстановительные
Реакции
6.
Цель урока:1.Сформировать понятие об
окислительновосстановительных реакциях.
2.Научиться уравнивать записи
ОВР
методом электронного баланса.
7.
ХИМИЧЕСКИЕ РЕАКЦИИ(по изменению степени окисления элементов,
образующих реагенты и продукты)
Окислительновосстановительные
+1 -1
0
+2 -1
0
2HCl + Zn = ZnCl2 + H2
Без изменения
степени
+1 +5 -2
+1-1
+1 -1
+1+5 -2
AgNO3 +окисления
HCl = AgCl + HNO3
8.
ХИМИЧЕСКИЕ РЕАКЦИИ,В РЕЗУЛЬТАТЕ КОТОРЫХ
ПРОИСХОДИТ ИЗМЕНЕНИЕ
СТЕПЕНЕЙ ОКИСЛЕНИЯ
АТОМОВ ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ ИЛИ ИОНОВ,
ОБРАЗУЮЩИХ
РЕАГИРУЮЩИЕ ВЕЩЕСТВА.
9. Окислительно-восстановительные реакции
Ar0Ar +18 ) ) )
2 8 8
Ca0 +20
S0 +16
) ) ) )
2 8 8 2
атом
) ) )
2 8 6
атом
Ca2+ +20 ) ) )
2 8 8
ион
S2- +16 ) ) )
2 8 8
ион
Ca0 + S0 => Ca+2S-2
Ca0 - 2 e => Ca 2+
S0 + 2e = S2-
10.
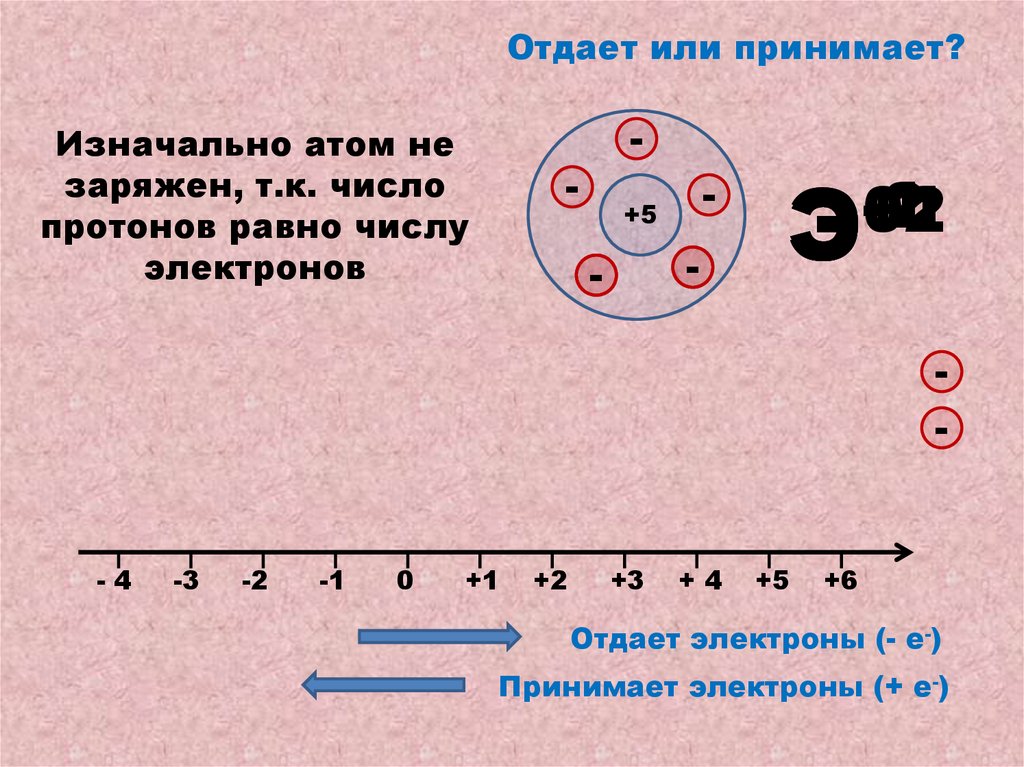
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
11.
Отдает или принимает?+ 6 e-
S+6 S0
восстановление
S+6 S-2
восстановление
+ 8 e- 2 e-
S+4 S+6
окисление
- 6 e-
S-2 S+4
- 2 e-
окисление
Cu0 Cu+2
+ 8 e-
C+4 C- 4
- 6 e-
C- 4 C+2
- 4 e-
C0 C+4
окисление
восстановление
окисление
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает епринимает е-
12. Восстановление – процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижаетсяCl0 + 1e → Cl-1
атом хлора
Cu+2 + 2e → Cu0
ион хлора
S0 + 2e → S-2
атом серы
ион серы
ион меди
атом меди
Fe+3 + 3e→ Fe0
ион железа
атом железа
Fe+3 + 1e → Fe+2
ион железа(III)
ион железа(II)
Sn+4 +2e → Sn+2
ион олова(IV)
ион олова(II)
13.
Cl0 + 1e → Cl-1атом хлора
ион хлора
Cu+2 + 2e → Cu0
ион меди
атом меди
Fe+3 + 1e → Fe+2
ион железа(III)
ион железа(II)
Атомы, ионы или молекулы,
принимающие
электроны, называют
окислителями
14. Окисление- процесс отдачи электронов атомами, ионами или молекулами.
Степень окисления при этом повышаетсяNa0 – 1e → Na+1
атом натрия
ион натрия
Cl-1 -1e → Cl0
хлорид-ион
Cu+1 -1e → Cu+2
ион меди(I)
ион меди(II)
атом хлора
15.
0 0– 3e → Al+3Al
Al – 3e → Al+3
атом
атом
алюминия
ион ион
алюминия
алюминия
S-2
алюминия
- 2e →
молекулы, отдающие
S0
S - 2e атом
→ серы
S0
-2
сульфид-ион
сульфид-ион
Атомы, ионы или
атом серы
электроны, называют
восстановителями
Fe+2 – 1e → Fe+3
ион
+2
железа(II)
Fe
ион
железа(III)
– 1e → Fe+3
ион
железа(II)
ион
железа(III)
16.
17. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления
18. Электронный баланс
Число электронов,отдаваемых
восстановителем
=
Число электронов,
принимаемых
окислителем
19. Метод электронного баланса
1. Над символом каждого элемента напишитеего степень окисления (СО)
0
-1 +5 -2
-1 +6 -2
+4 -2
+1 -2
S + HNO3 → H2SO4 + NO2 + H2O
20. 0 -1 +5 -2 -1 +6 -2 +4 -2 +1 -2 S + HNO3 → H2SO4 + NO2 + H2O
2. Найдите элемент, атомы которого понижают СО.Определите число принятых атомом электронов.
+5
+4
N + 1e → N
3. Найдите элемент, атомы которого повышают СО.
Определите число отданных атомом электронов.
0
+6
S – 6e → S
21.
4. Сравните число отданных и принятых электронов.Если они не равны, подберите множители к
схемам процессов окисления и восстановления
так, чтобы при умножении на них эти числа стали
равны.
+5
+4
N + 1e → N
окислитель
0
+6
S – 6e → S
восстановитель
6 (восстановление)
1(окисление)
22.
5. Перенесите основные коэффициенты вуравнение реакции. В дальнейшем их
изменять нельзя!
Подберите остальные коэффициенты.
+5
+4
N + 1e → N
0
6
коэффициенты
+6
S – 6e → S
1
S + HNO
6 3 → H2SO4 + NO26+ 2H2O
23.
Восстановителями могутбыть
Окислителями могут
быть
Простые веществаметаллы.
Сложные вещества восстановители, если
в их состав входит
атом элемента в
минимальной степени
окисления .
Например:
H+12S-2 ; N-3H+13
Простые вещества –
неметаллы - только
кислород и фтор
(кроме реакции кислорода
с фтором):
Сложные веществаокислители, если в их
состав входит атом
элемента в максимальной
степени окисления.
Например:
H+1N+5O-23; H+12S+6O-24
24.
План составления окислительно восстановительной реакции1. Записываем схему химической реакции
Ca + O2
2. Расставляем степени окисления атомов,
участвующих в химической реакции
Ca0 + O20
Ca2+O2-
3.Находим атомы, которые изменяют свою
степень окисления
Ca0 и O20
Далее
25.
4.Составляем электронный баланс,записываяпроцесс отдачи и присоединения электронов
Ca0 – 2e- = Ca2+
O20 + 4e- = 2O25.
Ca0– 2e-=Ca2+ 4
O20 + 4e- = 2O2- 2
2
восстановитель
1
окислитель
6. Расставляем цифры, полученные в электронном
балансе в химическое уравнение
2Ca + O2= 2CaO
26.
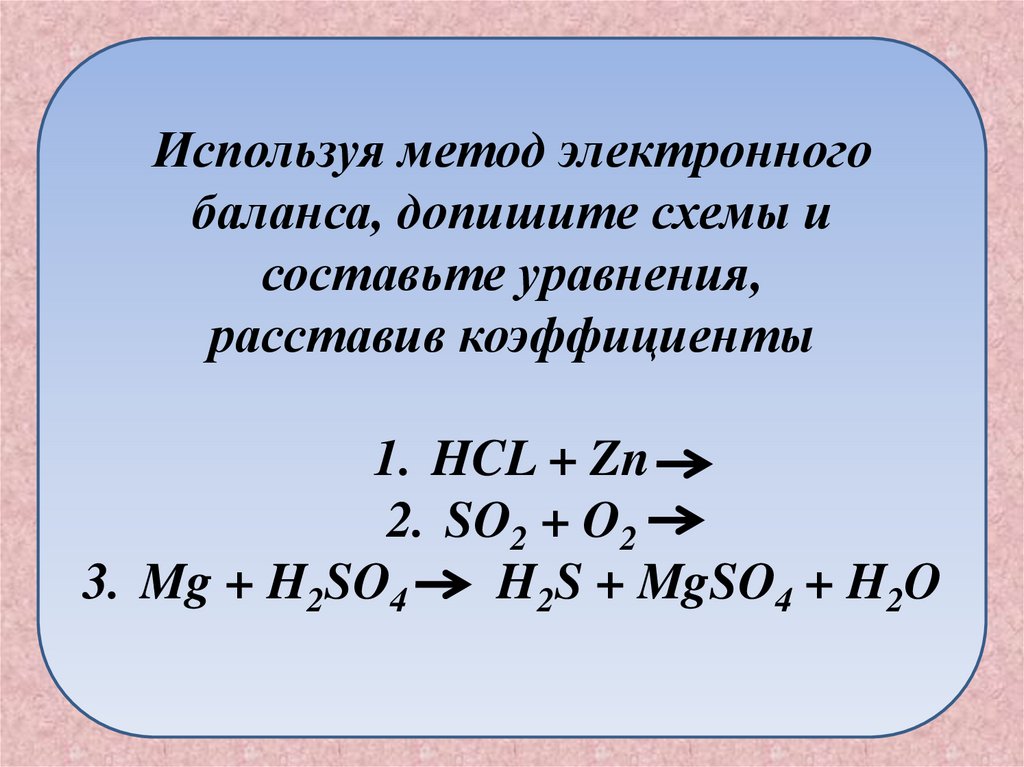
Используя метод электронногобаланса, допишите схемы и
составьте уравнения,
расставив коэффициенты
1. HCL + Zn
2. SO2 + O2
3. Mg + H2SO4
H2S + MgSO4 + H2O
27.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
2Cl-1
+5 e- 2 e-
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
5
окисление
10
28. Не задано
Домашнее задание:НЕ ЗАДАНО


























 Химия
Химия








