Похожие презентации:
Окислительно-восстановительные реакции
1. Тема урока : "Окислительно-восстановительные реакции"
• « Кто-то теряет, а кто-тонаходит.»
2. Окислительно-восстановительные реакции
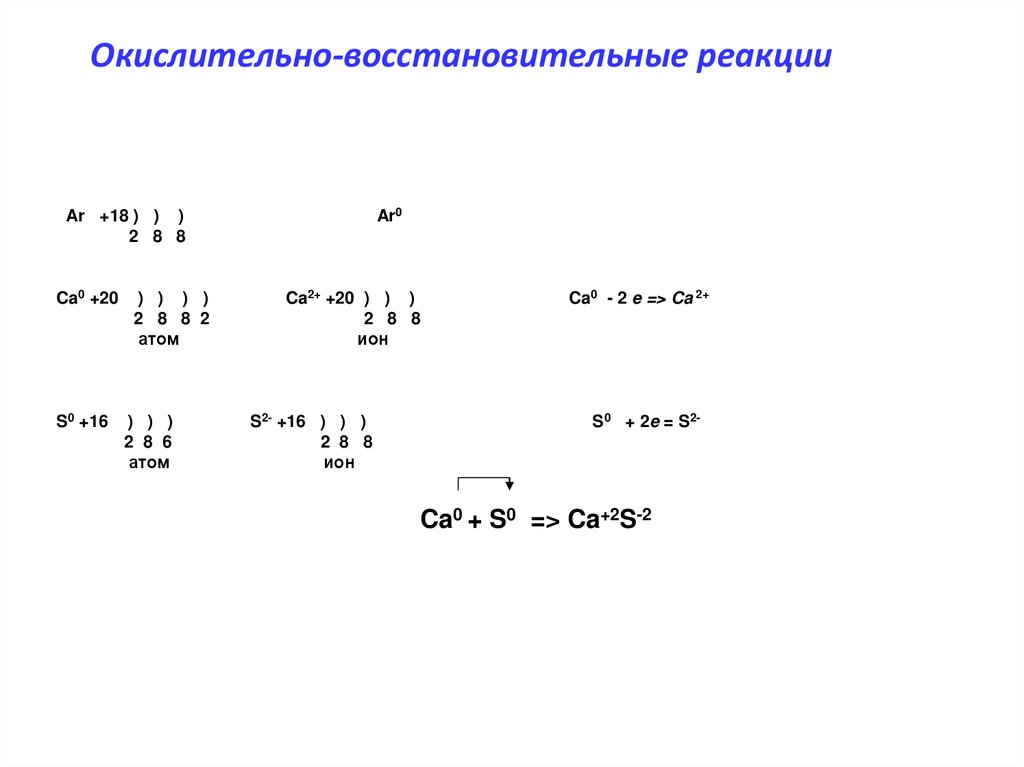
Ar0Ar +18 ) ) )
2 8 8
Ca0 +20
) ) ) )
2 8 8 2
атом
S0 +16
) ) )
2 8 6
атом
Ca2+ +20 ) ) )
2 8 8
ион
S2- +16 ) ) )
2 8 8
ион
Ca0 - 2 e => Ca 2+
S 0 + 2e = S2-
Ca0 + S0 => Ca+2S-2
3.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1
-1
+1 -2 +1
+1
-1
+1
-2
HCl + NaOH = NaCl + H2O
+1
-1
0
+2
-1
0
Окислительновосстановительная
2
реакция
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
4.
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200H+
Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
5.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
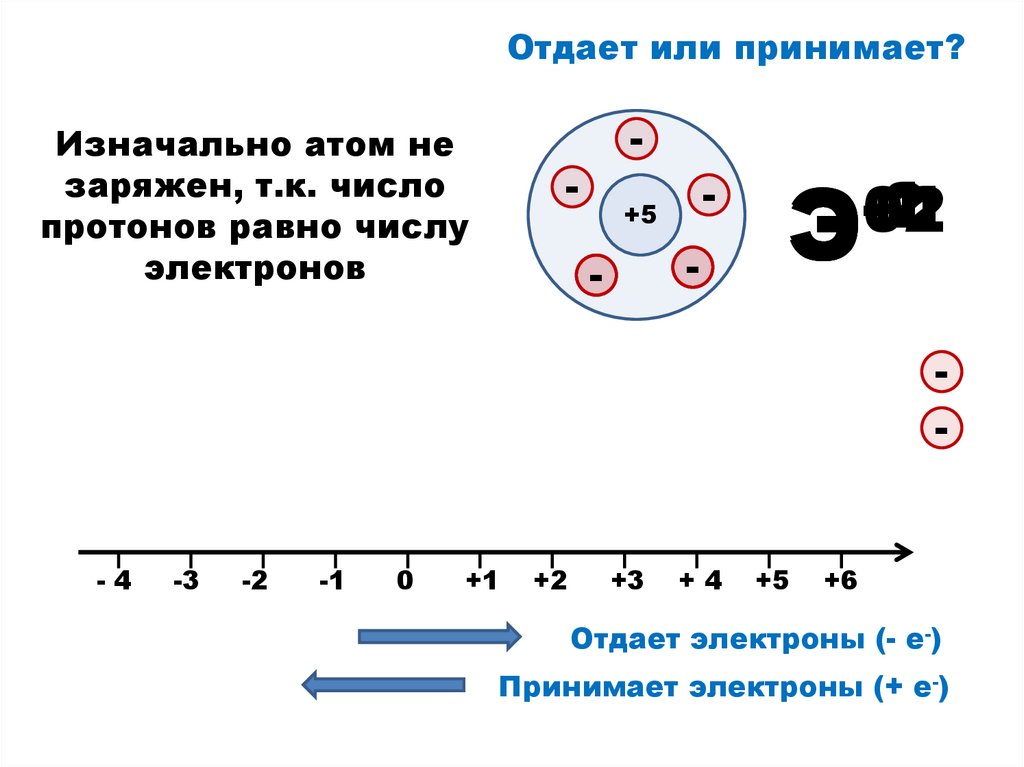
6.
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
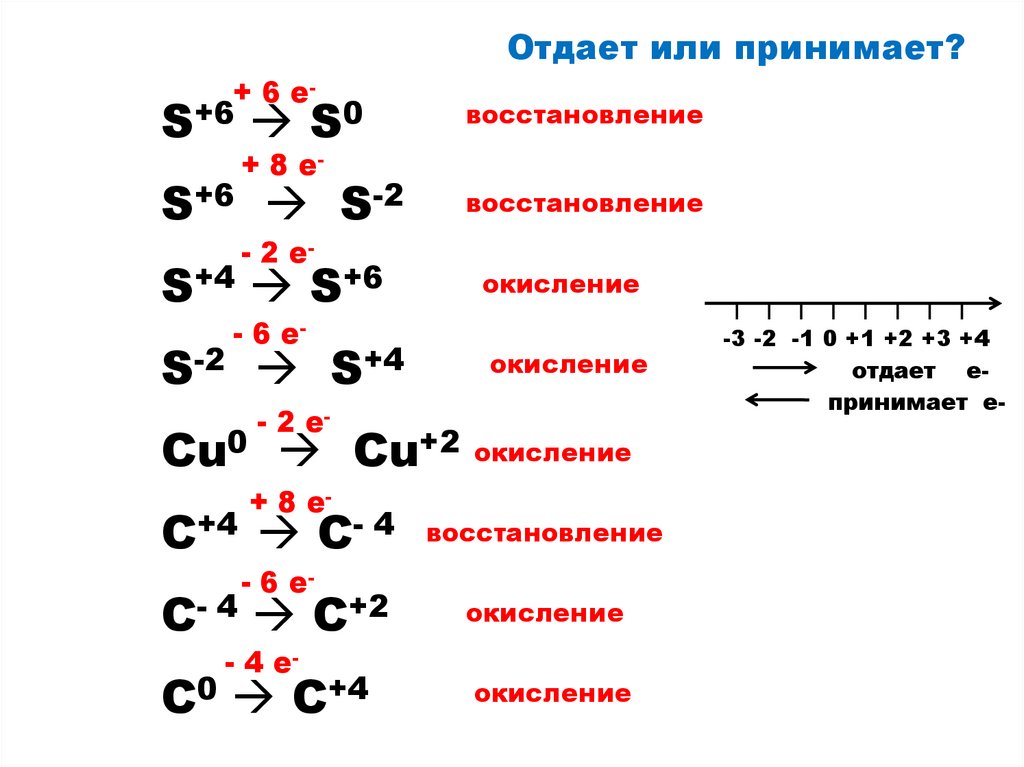
7.
Отдает или принимает?+ 6 e-
S+6 S0
восстановление
S+6 S-2
восстановление
+ 8 e- 2 e-
S+4 S+6
- 6 e-
S-2 S+4
окисление
окисление
- 2 e-
Cu0 Cu+2 окисление
+ 8 e-
C+4 C- 4
- 6 e-
C- 4 C+2
- 4 e-
C0 C+4
восстановление
окисление
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает епринимает е-
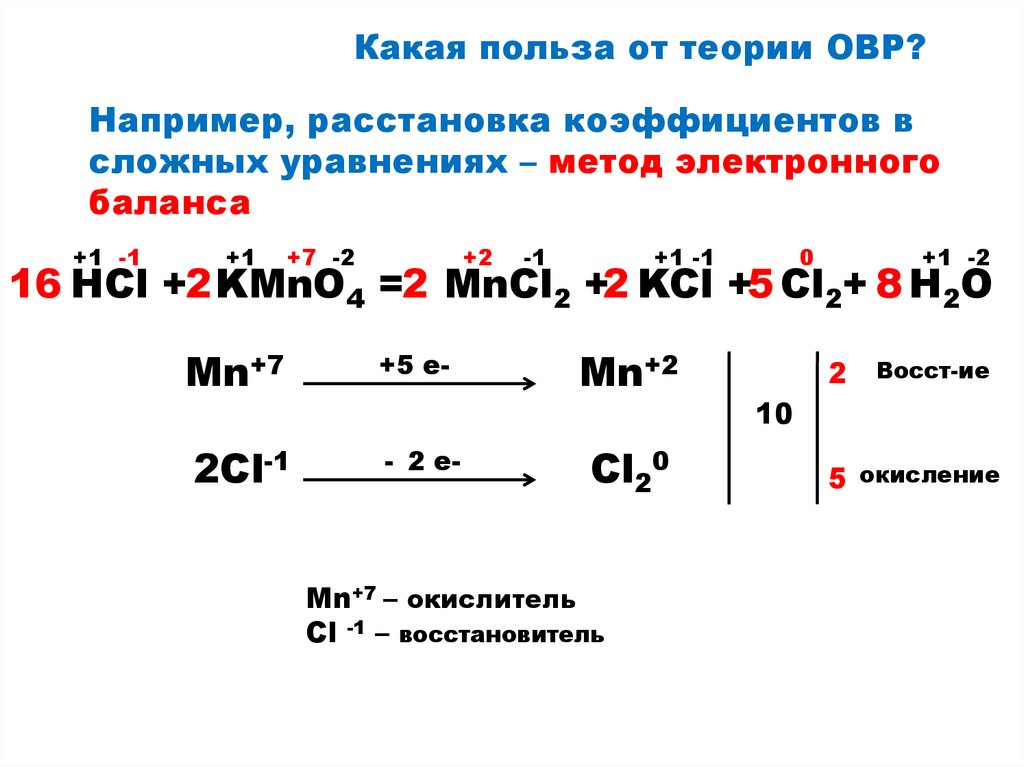
8.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5 e-
2Cl-1
- 2 e-
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
10
5 окисление
9.
Расставьте коэффициентыметодом электронного баланса.
Al + MnO2 = Al2O3 + Mn
Fe2O3 + Zn = ZnO + Fe
Mg + H2SO4 = MgSO4 + H2S + H2O
Cu + HNO3 = Cu(NO3)2+ NO + H2O
KI + FeCl3 = l2 + KCl + FeCl2
Cr2O3 + K2CO3 + O2 = K2CrO4 + CO2
10.
11.
Выяснить, какокислительновосстановительные реакции
применяются в быту.
12.
Вы пролили йод на белую салфетку. Хлорная известьи персоль не обесцветят пятно йода. Вывести пятно
помогут восстановители, например водный раствор
сульфита натрия
I2+Na2SO3+2NaOH=2NaI+Na2SO4+H2O.
Однако знайте, что через несколько дней пятно
исчезнет благодаря постепенной сублимации йода.
13.
При обработке персолью отбеливаниепроисходит за счет окисления
загрязнений
2H2O2=2H2O+O2.
Для того чтобы образующийся
кислород не улетучивался
из емкости, лучше
держать ее
закрытой.
14.
С помощью пероксида водорода реставрируютстаринные картины. Промывая пероксидом
водорода старые картины, сульфид
переводят в белый сульфат:
PbS+4H2O2=PbSO4+4H2O.
Картины обновляются –
становятся вновь
яркими.
15.
Мы часто сталкиваемся с окислительновосстановительными реакциями в быту:• при избавлении от пятен йода на ткани;
• при стирке изделий из натуральной шерсти;
• при удалении пятен от кофе, чая, фруктов;
• при очищении ткани от загрязнений;
• при полоскании горла и промывания ран.
16. Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель
• Li0 + O20 => Li2O• C0 + O20 => CO2
• H02 + O20 => H2O
17. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР
• СаСО3 => СаО + СО2• KMnO4 => K2 MnО4 + MnО2 + О2
• CuS + О2 => СuО + SО2
18. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР Определите окислитель, восстановитель
• 1)С-4Н4+1 + 2О20 => C+4О2-2 + 2H2+1О-2-8e
• С-4 C+4 - восстановитель -(окисляется )
4|1
+4e
• О20 2О-2 - окислитель -(восстанавливается ) 8 |2
19. Домашнее задание:
Параграф 43, вопросы письменно 1,3,7
Предложите на звание «чуда» примеры
из цикла наук предметов
естественнонаучного цикла.
20. Рефлексия
• Я сегодня узнал…• Я удивился…
• Теперь я умею…
• Я хотел бы…
• Я смог…
• Я научился…
• Урок мне дал дляжизни…
















 Химия
Химия








