Похожие презентации:
Карбоновые кислоты. Лекция 7
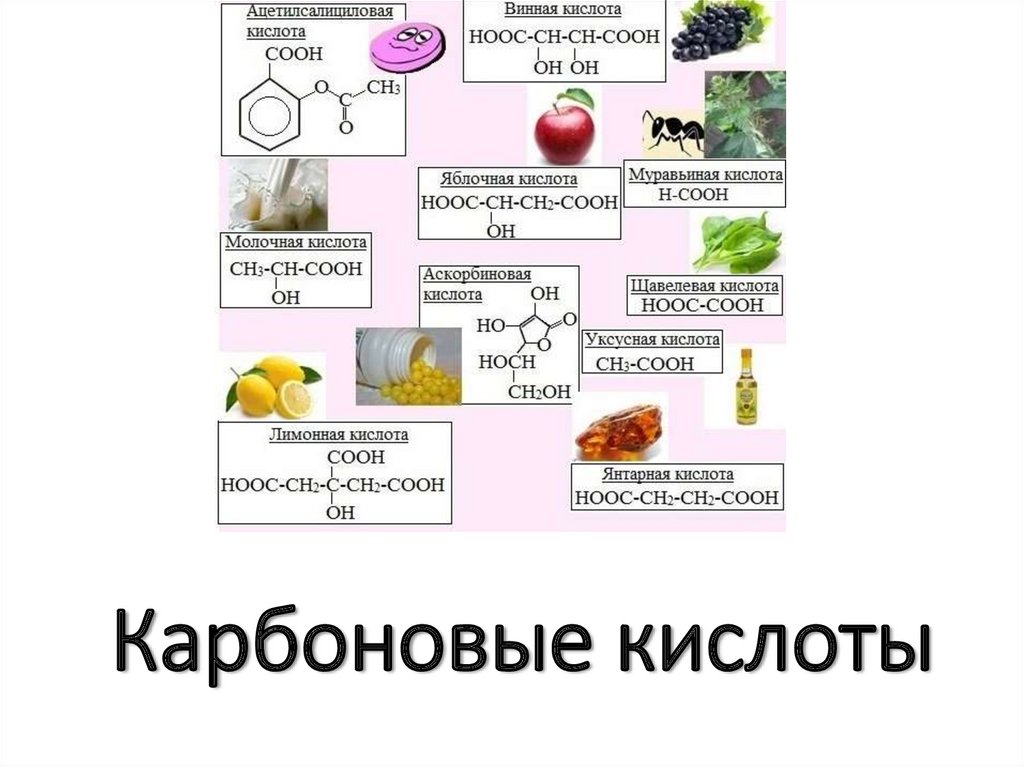
1. Карбоновые кислоты
2.
• Карбоновые кислоты – класс органическихсоединений, молекулы которых содержат одну
или несколько функциональных карбоксильных
групп COOH
• Для карбоновых кислот характерна изомерия
• углеродного скелета,
• положения функциональной группы,
• в случае наличия ассиметрического атома
углерода – оптическая изомерия
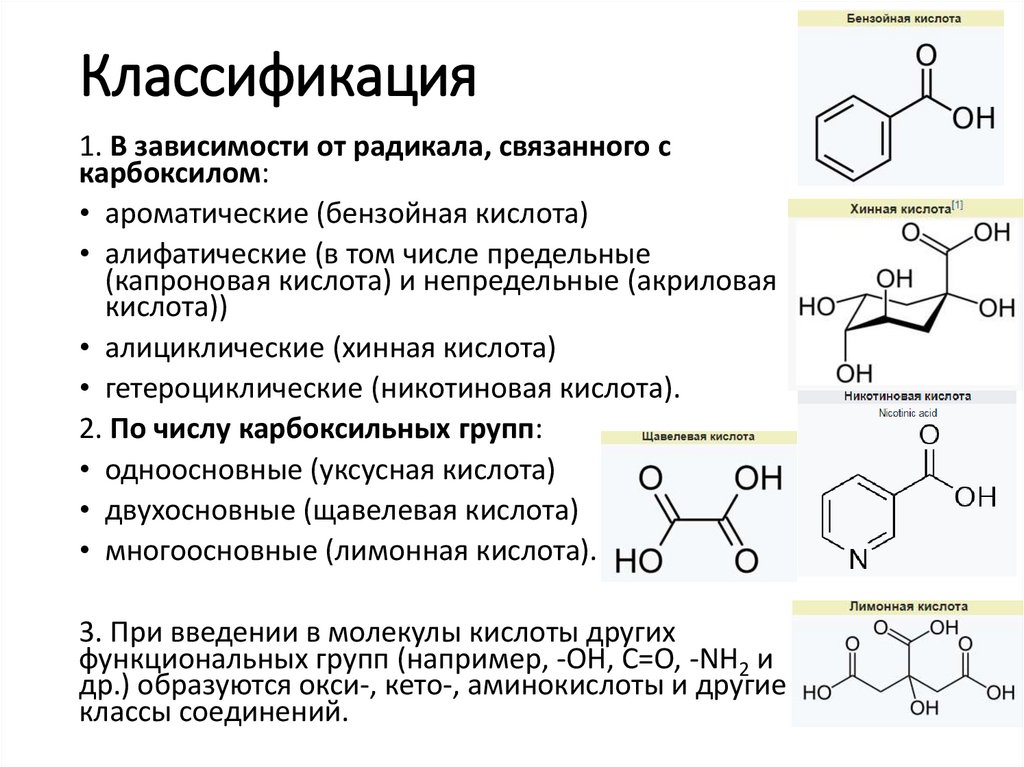
3. Классификация
1. В зависимости от радикала, связанного скарбоксилом:
• ароматические (бензойная кислота)
• алифатические (в том числе предельные
(капроновая кислота) и непредельные (акриловая
кислота))
• алициклические (хинная кислота)
• гетероциклические (никотиновая кислота).
2. По числу карбоксильных групп:
• одноосновные (уксусная кислота)
• двухосновные (щавелевая кислота)
• многоосновные (лимонная кислота).
3. При введении в молекулы кислоты других
функциональных групп (например, -ОН, C=O, -NH2 и
др.) образуются окси-, кето-, аминокислоты и другие
классы соединений.
4. История открытия
• Уксусная кислота знакома людям с древности.Получение при сухой перегонке (нагревании
без доступа воздуха) древесины описано в
сочинениях Иоанна Глаубера и Роберта Бойля.
• Однако природа этого вещества не была
известна до XIX века. Ещё в XVIII веке брожение
объясняли соединением кислых и горючих
начал вина.
• Лишь в 1814 году Якоб Берцелиус определил
состав уксусной кислоты, а в 1845 году
немецкий химик Адольф Вильгельм Герман
Кольбе осуществил её полный синтез из угля.
• Муравьиную кислоту впервые получил в 1670
году английский естествоиспытатель Джон Рэй,
нагревая муравьёв в перегонной колбе
5. Нахождение в природе
• Муравьиная кислота содержится в выделениях муравьёв, крапиве,пчелином яде, сосновой хвое, уксусная кислота — продукт
уксуснокислого брожения.
• Масляная кислота образуется при прогоркании сливочного масла.
• Валериановая кислота есть в валериановом корне.
• Капроновая, каприловая и каприновая кислоты получили своё
название из-за того что содержатся в козьем молоке (лат. capra —
коза).
• Пальмитиновую кислоту легче всего выделить из пальмового
масла, выжимаемого из ядер кокосового ореха.
• Щавелевая кислота содержится в щавеле, а также в ревене.
• Фумаровая кислота (от лат. fumus — дым) была обнаружена в
растении Fumaria officinalis (дымянка), которое в античные времена
сжигали, чтобы дымом отогнать злых духов.
• Молочная кислота образуется при молочнокислом брожении
сахаров (при прокисании молока и брожении вина и пива)
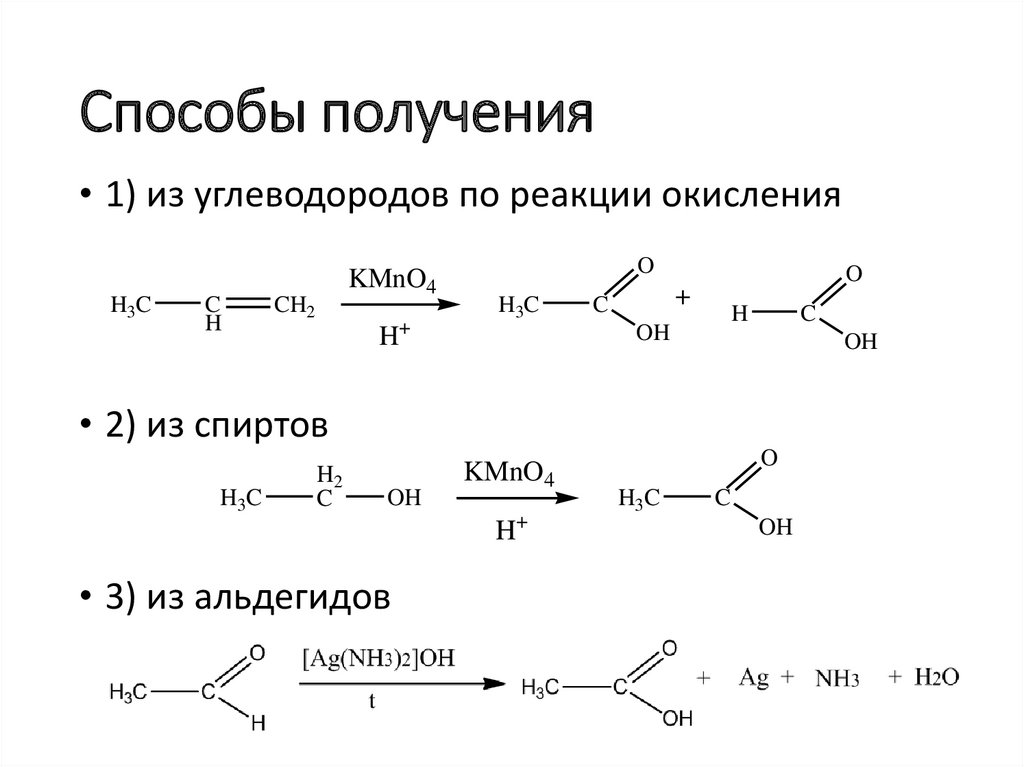
6. Способы получения
• 1) из углеводородов по реакции окисленияH3C
C
H
KMnO4
CH2
+
O
H3C
O
+
C
H
OH
H
C
OH
• 2) из спиртов
H3C
H2
C
OH
• 3) из альдегидов
KMnO4
H+
O
H3C
C
OH
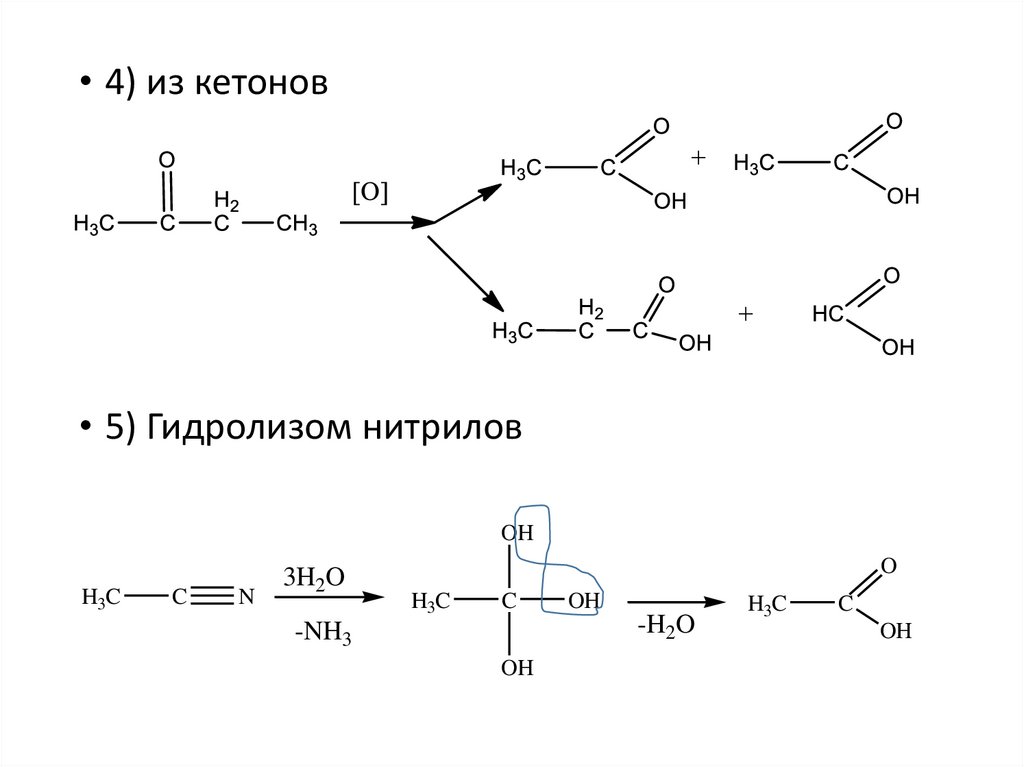
7.
• 4) из кетонов• 5) Гидролизом нитрилов
OH
H3C
C
N
3H2O
O
H3C
C
OH
-H2O
-NH3
OH
H3C
C
OH
8.
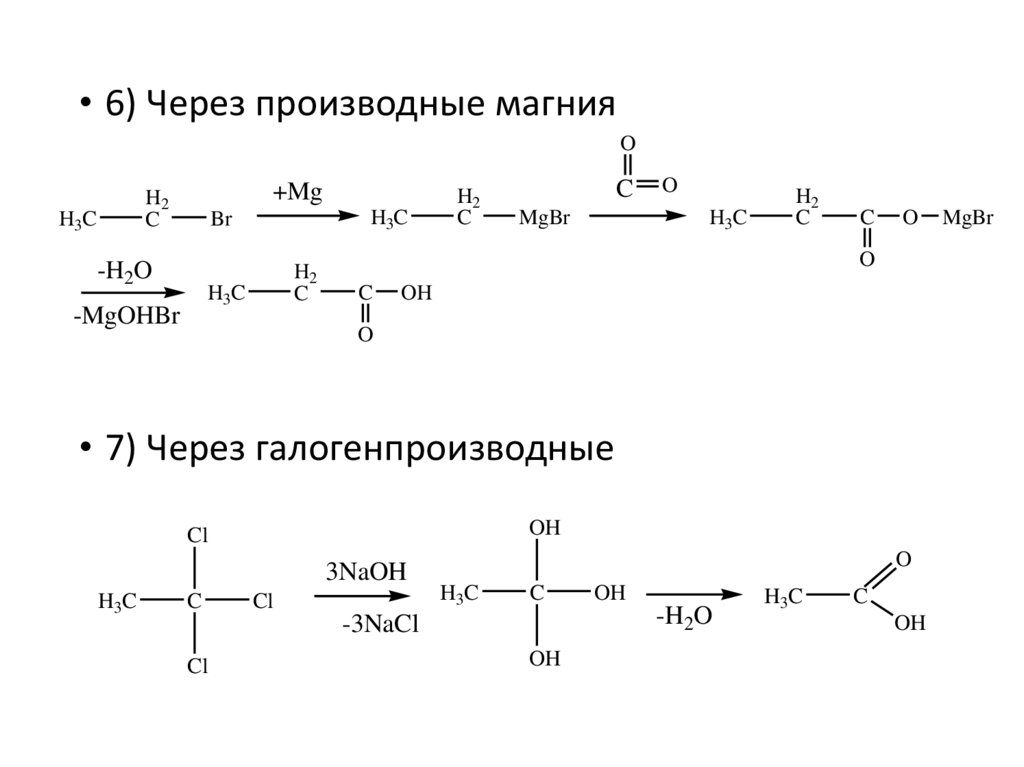
• 6) Через производные магнияO
+Mg
H2
C
H3C
H3C
Br
-H2O
H2
C
H3C
-MgOHBr
H2
C
C
MgBr
O
H3C
H2
C
C
O
O
C
OH
O
• 7) Через галогенпроизводные
OH
Cl
3NaOH
H3C
C
Cl
O
H3C
C
-H2O
-3NaCl
Cl
OH
OH
H3C
C
OH
MgBr
9.
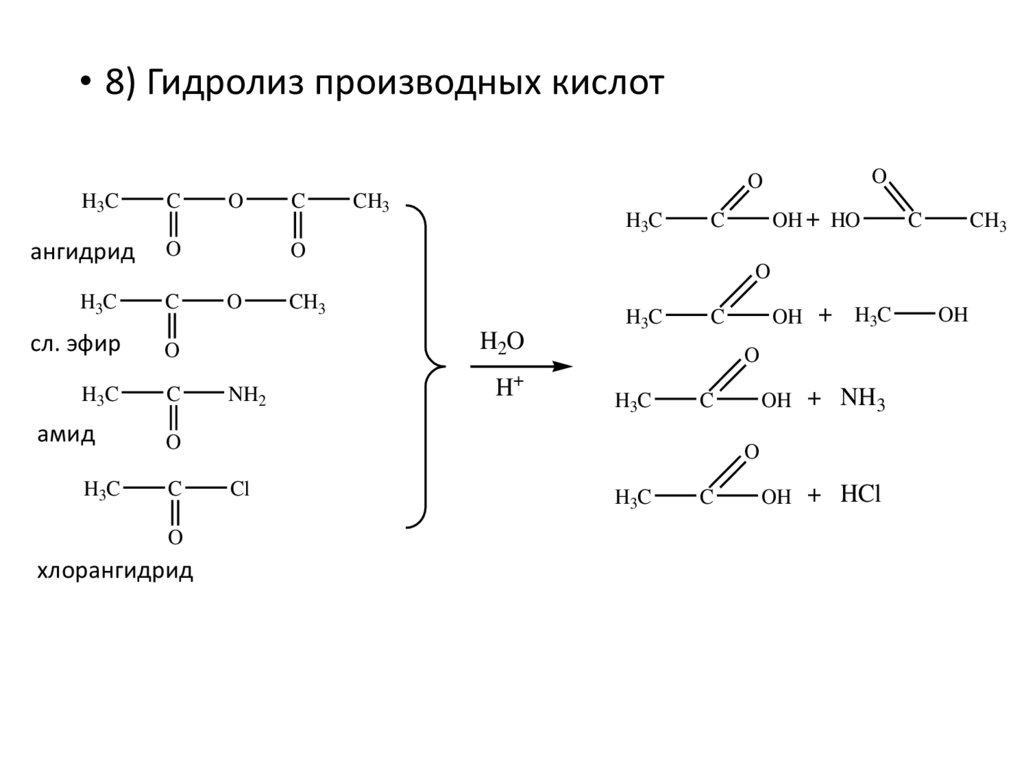
• 8) Гидролиз производных кислотH3C
ангидрид
C
O
C
сл. эфир
O
H3C
C
H3C
C
CH3
H3C
OH + HO
C
C
CH3
O
O
H3C
амид
O
O
O
O
CH3
H2O
NH2
H+
H3C
O
хлорангидрид
H3C
O
H3C
OH + NH3
C
O
C
OH +
C
O
Cl
H3C
C
OH + HCl
OH
10.
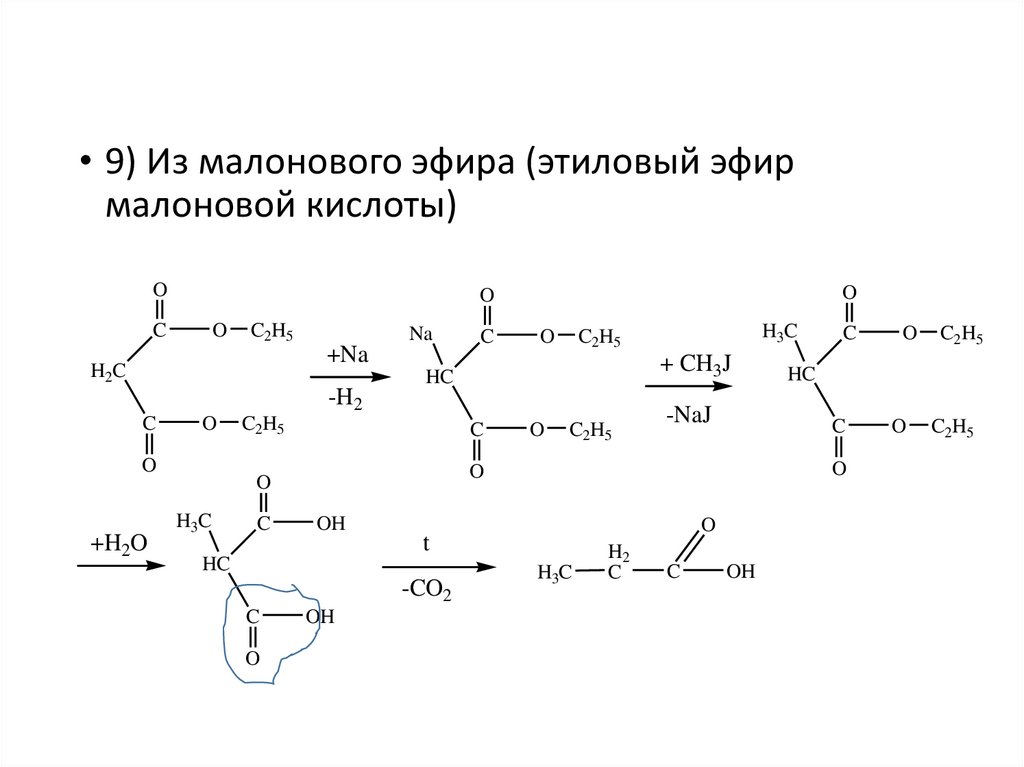
• 9) Из малонового эфира (этиловый эфирмалоновой кислоты)
O
O
O
C
O
C2H5
Na
+Na
H2C
C
O
+ CH3J
HC
-H2
C
O
O
+H2O
C2H5
C
C
OH
-CO2
O
C2H5
-NaJ
OH
C
C
O
H3C
H2
C
C
OH
O
C2H5
HC
O
t
HC
C
O
O
O
H3C
H3C
C2H5
O
C2H5
11. Физические свойства карбоновых кислот
1) Карбоновые кислоты обладают повышеннойтемпературой кипения и плавления, т.к. молекулы
образуют ассоциаты:
12.
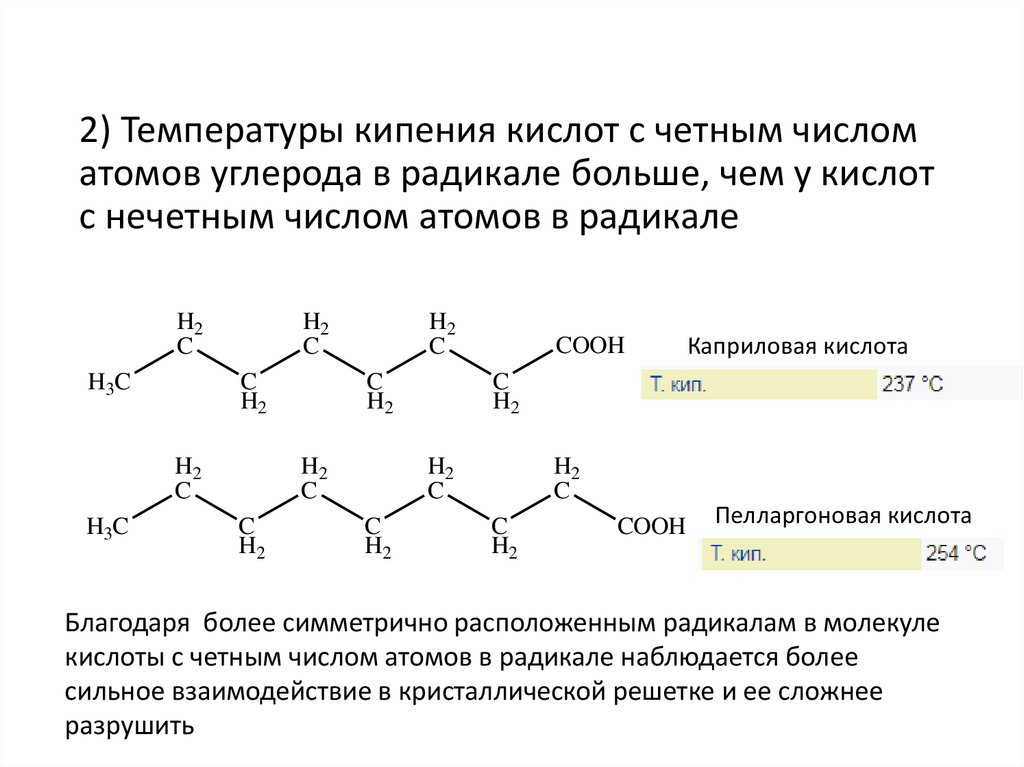
2) Температуры кипения кислот с четным числоматомов углерода в радикале больше, чем у кислот
с нечетным числом атомов в радикале
H2
C
H3C
H2
C
C
H2
H2
C
H3C
H2
C
C
H2
H2
C
C
H2
COOH
C
H2
H2
C
C
H2
Каприловая кислота
H2
C
C
H2
COOH
Пелларгоновая кислота
Благодаря более симметрично расположенным радикалам в молекуле
кислоты с четным числом атомов в радикале наблюдается более
сильное взаимодействие в кристаллической решетке и ее сложнее
разрушить
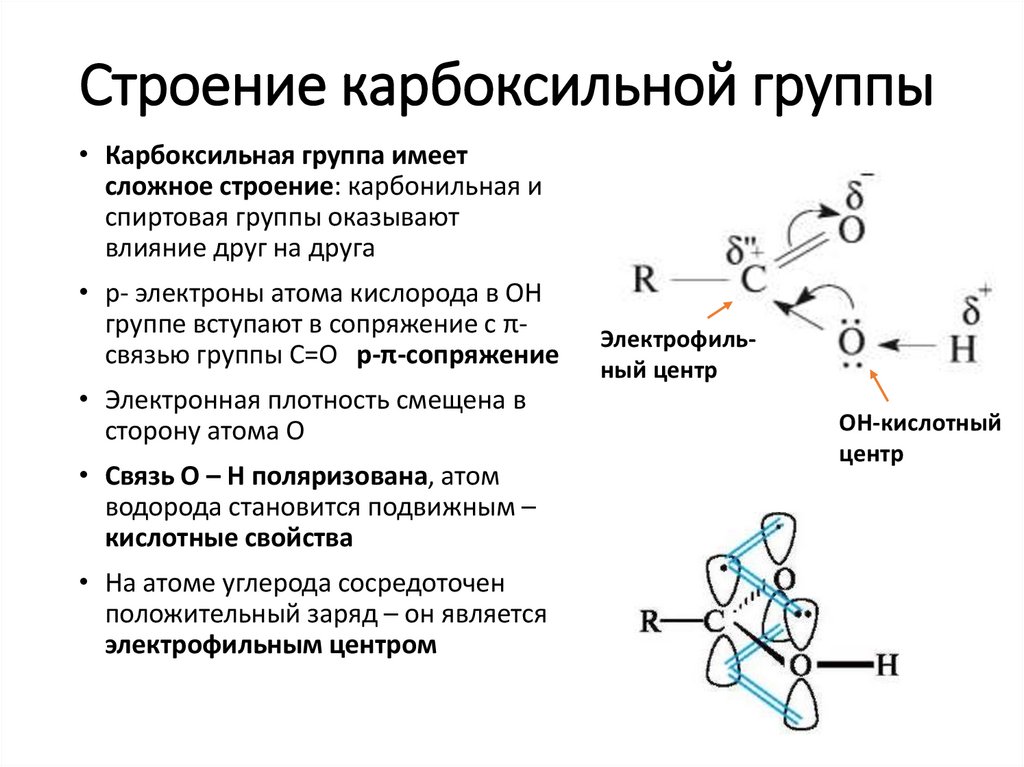
13. Строение карбоксильной группы
• Карбоксильная группа имеетсложное строение: карбонильная и
спиртовая группы оказывают
влияние друг на друга
• р- электроны атома кислорода в ОН
группе вступают в сопряжение с πсвязью группы С=О р-π-сопряжение
• Электронная плотность смещена в
сторону атома О
• Связь О – Н поляризована, атом
водорода становится подвижным –
кислотные свойства
• На атоме углерода сосредоточен
положительный заряд – он является
электрофильным центром
Электрофильный центр
ОH-кислотный
центр
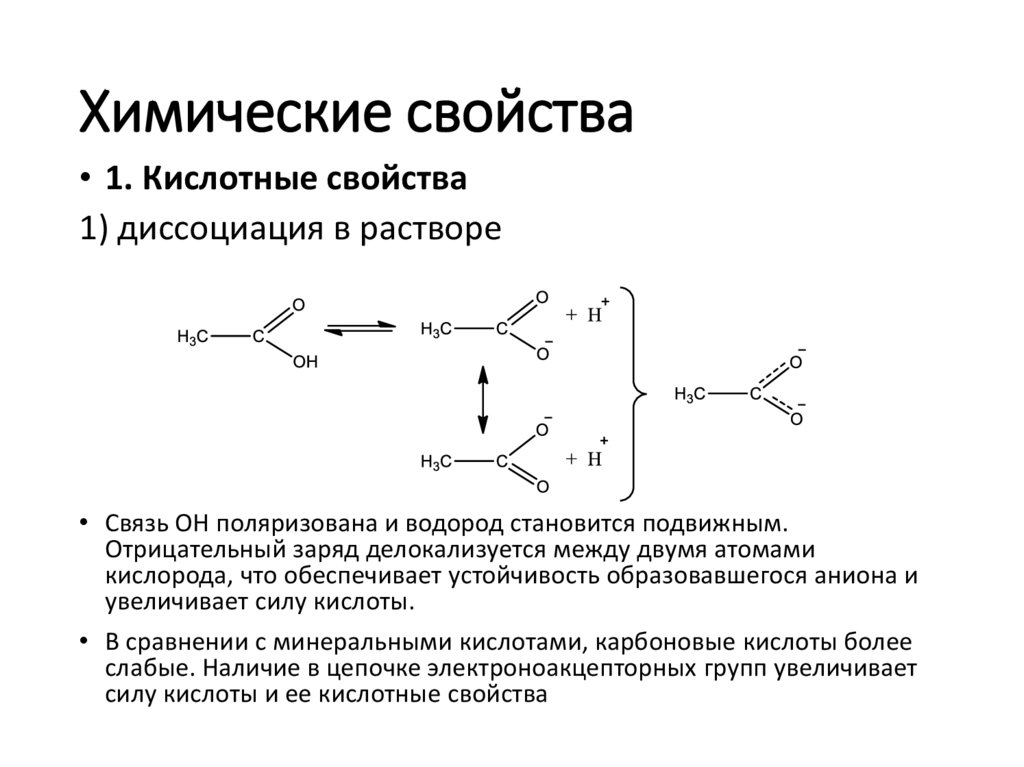
14. Химические свойства
• 1. Кислотные свойства1) диссоциация в растворе
• Связь ОН поляризована и водород становится подвижным.
Отрицательный заряд делокализуется между двумя атомами
кислорода, что обеспечивает устойчивость образовавшегося аниона и
увеличивает силу кислоты.
• В сравнении с минеральными кислотами, карбоновые кислоты более
слабые. Наличие в цепочке электроноакцепторных групп увеличивает
силу кислоты и ее кислотные свойства
15.
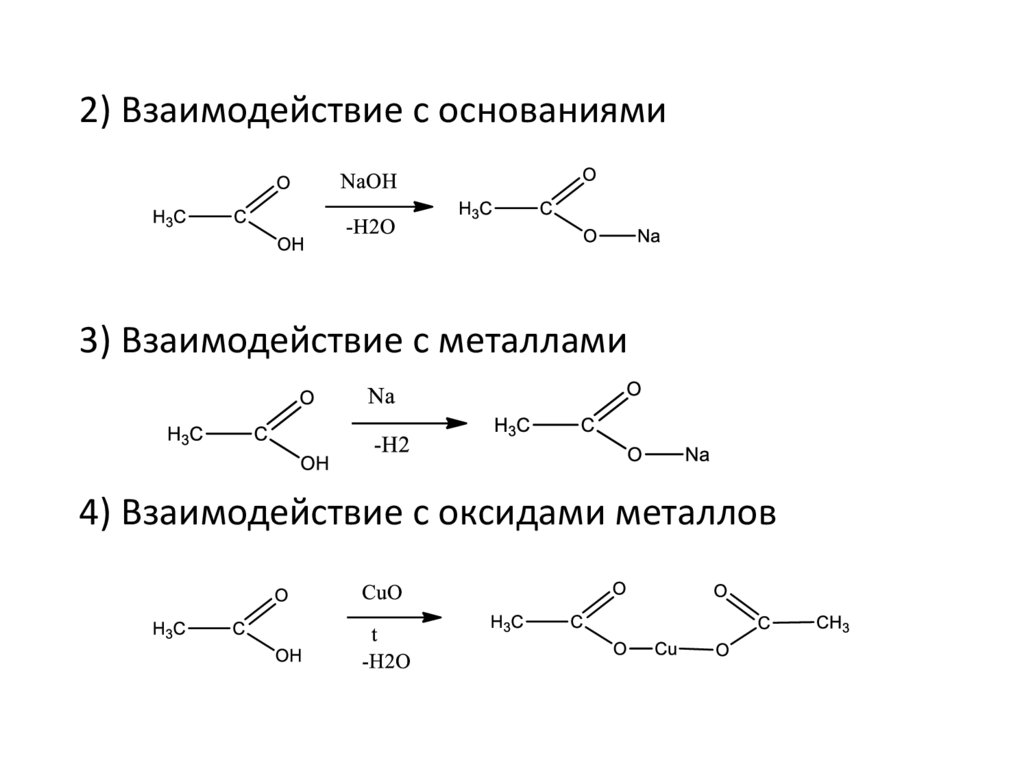
2) Взаимодействие с основаниями3) Взаимодействие с металлами
4) Взаимодействие с оксидами металлов
16.
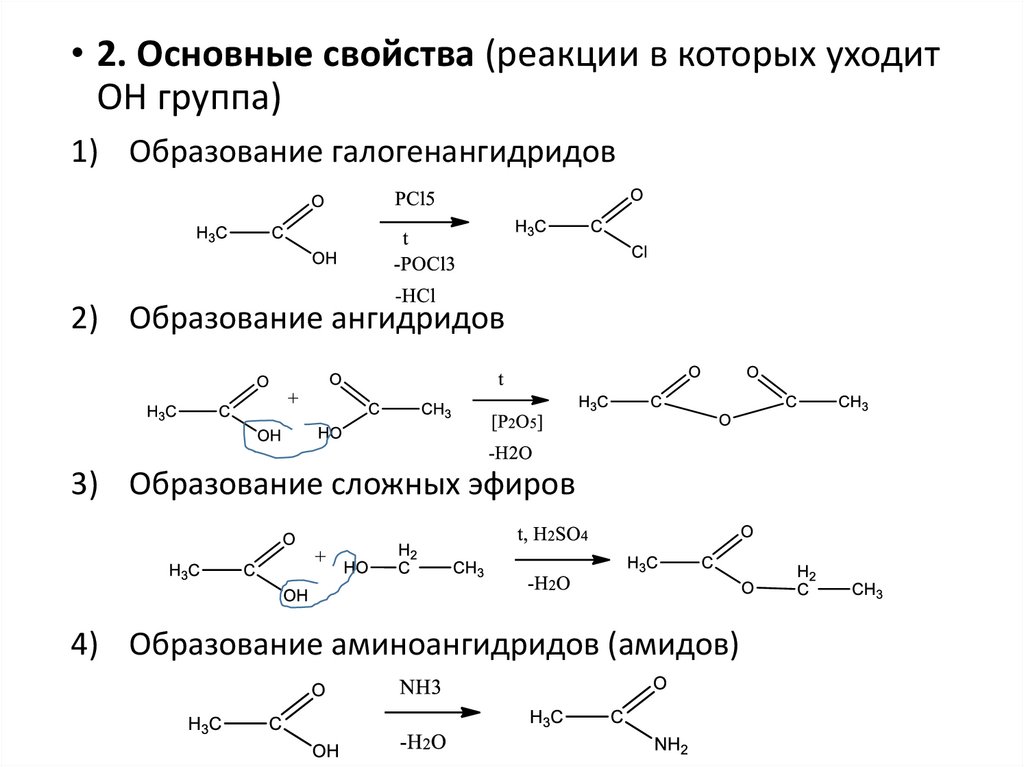
• 2. Основные свойства (реакции в которых уходитОН группа)
1) Образование галогенангидридов
2) Образование ангидридов
3) Образование сложных эфиров
4) Образование аминоангидридов (амидов)
17.
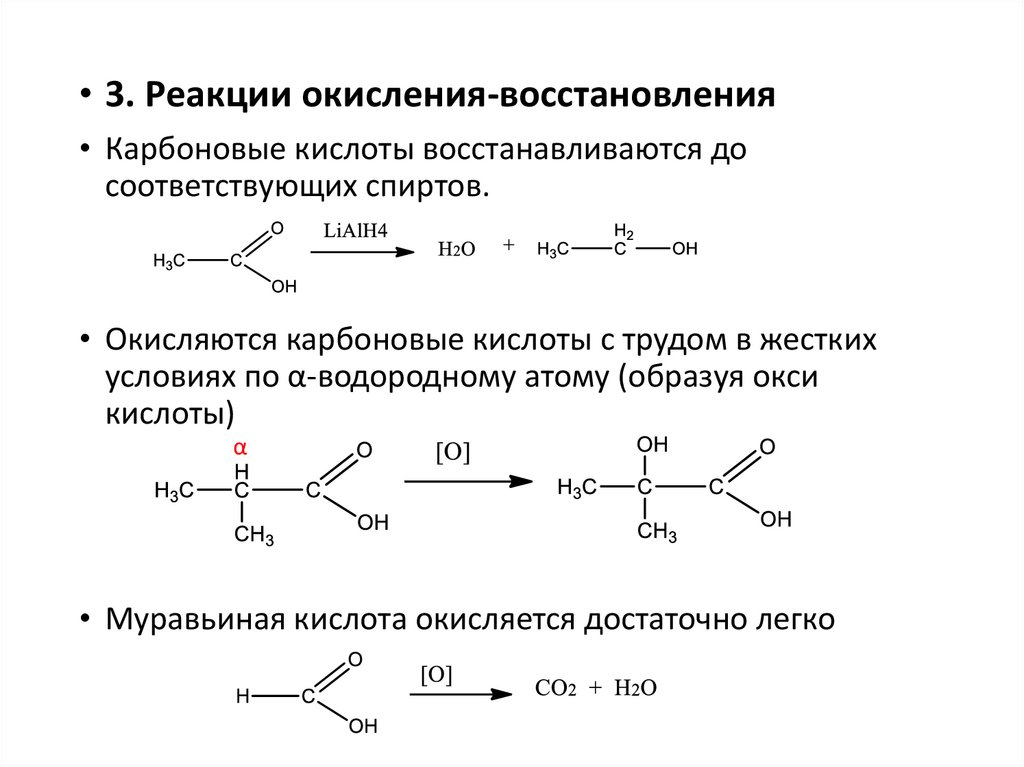
• 3. Реакции окисления-восстановления• Карбоновые кислоты восстанавливаются до
соответствующих спиртов.
• Окисляются карбоновые кислоты с трудом в жестких
условиях по α-водородному атому (образуя окси
кислоты)
α
• Муравьиная кислота окисляется достаточно легко
18.
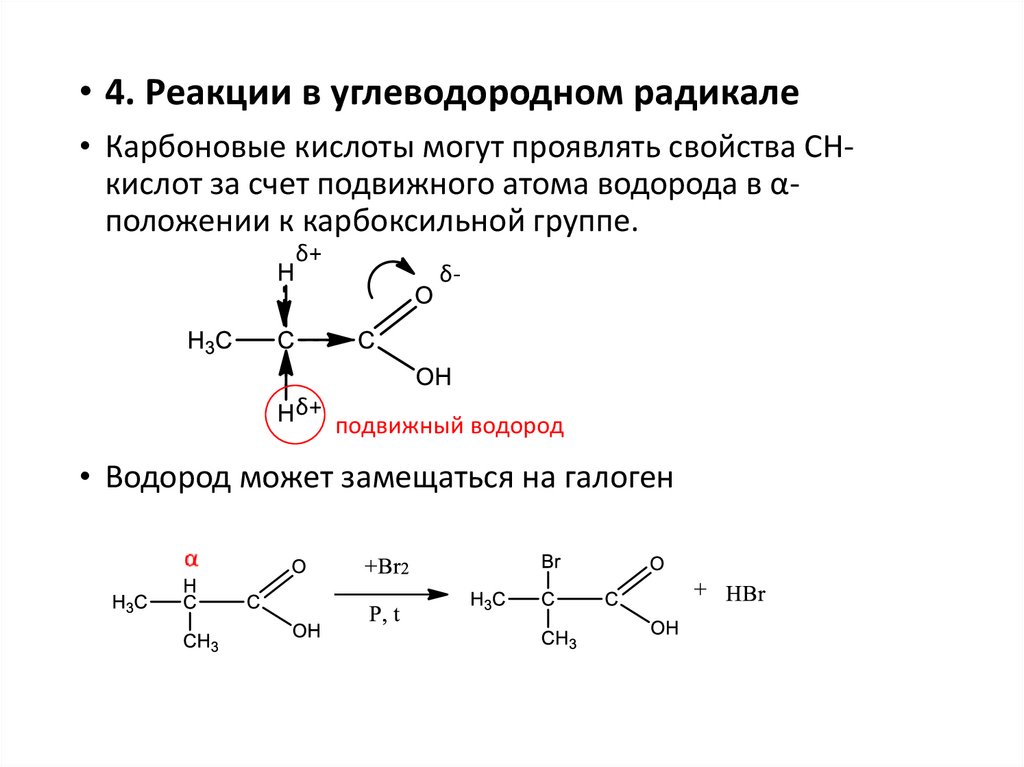
• 4. Реакции в углеводородном радикале• Карбоновые кислоты могут проявлять свойства СНкислот за счет подвижного атома водорода в αположении к карбоксильной группе.
δ+
δ+
δ-
подвижный водород
• Водород может замещаться на галоген
19.
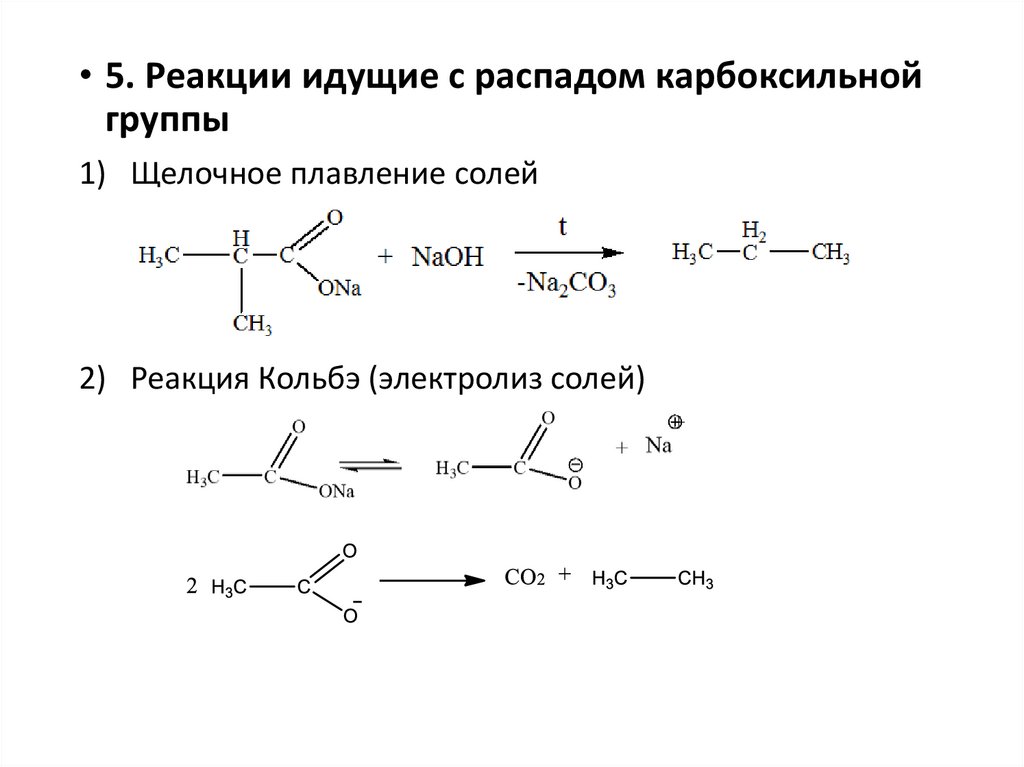
• 5. Реакции идущие с распадом карбоксильнойгруппы
1) Щелочное плавление солей
2) Реакция Кольбэ (электролиз солей)
20.
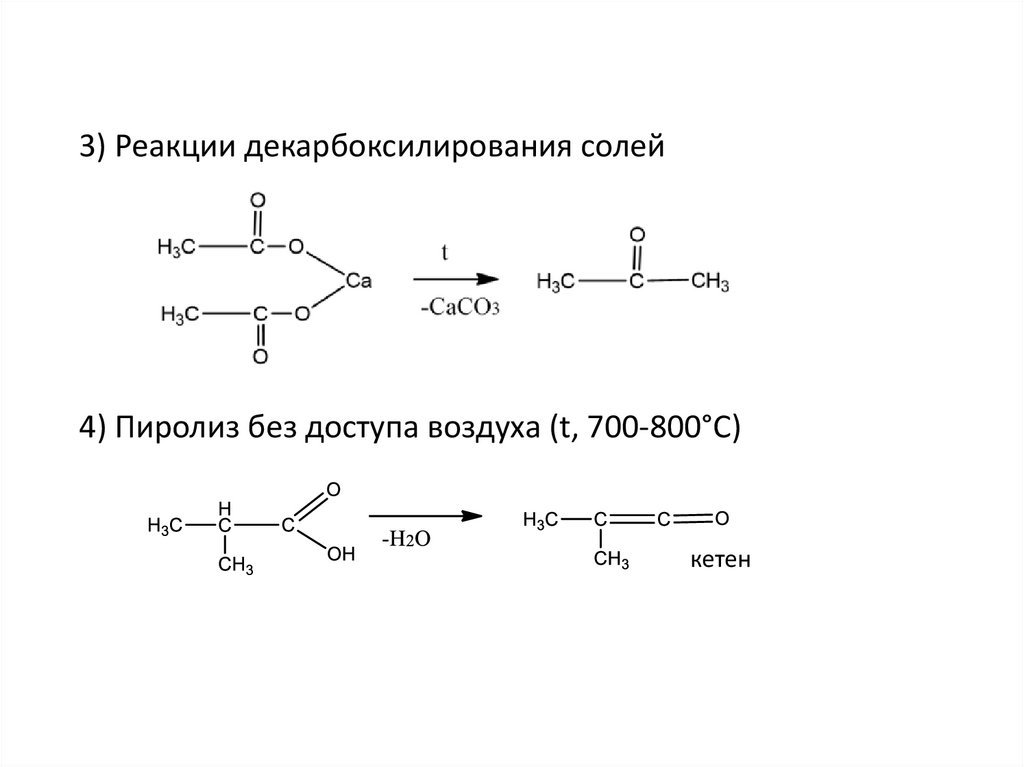
3) Реакции декарбоксилирования солей4) Пиролиз без доступа воздуха (t, 700-800°C)
кетен
21. Применение карбоновых кислот
• Карбоновые кислоты — исходные соединения для получения промежуточных продуктоворганического синтеза. Соли карбоновых кислот и щелочных металлов применяют как
мыла, эмульгаторы, смазочные масла; соли тяжелых металлов – инсектициды и
фунгициды, катализаторы.
• Муравьиная кислота является сильным восстановителем и обладает сильным
бактерицидным эффектом. На этих свойствах основано её применение в медицине, как
консерванта (при силосовании зелёной массы и фруктовых соков) и для дезинфекции.
Также применяется для обработки кожи и отделке текстиля и бумаги.
• Уксусная кислота – в пищевой и химической промышленности (производство
ацетилцеллюлозы). В домашнем хозяйстве как вкусовое и консервирующее вещество. В
промышленности – растворитель лаков, коагулянт латекса, ацетилирующий агент.
• Масляная кислота – для получения ароматизирующих добавок, пластификаторов и
флотореагентов, как экстрагент щелочно-земельных металлов.
• Щавелевая кислота – в металлургической промышленности (удаление окалины), в
качестве протравы при крашении, для отбелки соломы, при приготовлении чернил, как
реагент в аналитической органической химии
• Стеариновая C17H35COOH и пальмитиновая кислоты C15H31COOH – в качестве
поверхностно-активных веществ (натриевая соль), смазочных материалов в
металлообработке, как компонент и эмульгатор кремов и мазей.
• Олеиновая кислота C17H33COOH – флотореагент при обогащении руд цветных металлов.





 Химия
Химия








