Похожие презентации:
Карбоновые кислоты
1. Карбоновые кислоты
2.
Карбоновые кислоты – это производныеуглеводородов , в состав молекул которых
входит одна или несколько
карбоксильных групп.
3. Классификация
В зависимости от числа карбоксильныхгрупп в составе одной молекулы
различают:
Одноосновные
CH2
CH
C
O
O
C
H
CH2
CH3
O
O
H
C
C
O
O
O
O
H
H
4.
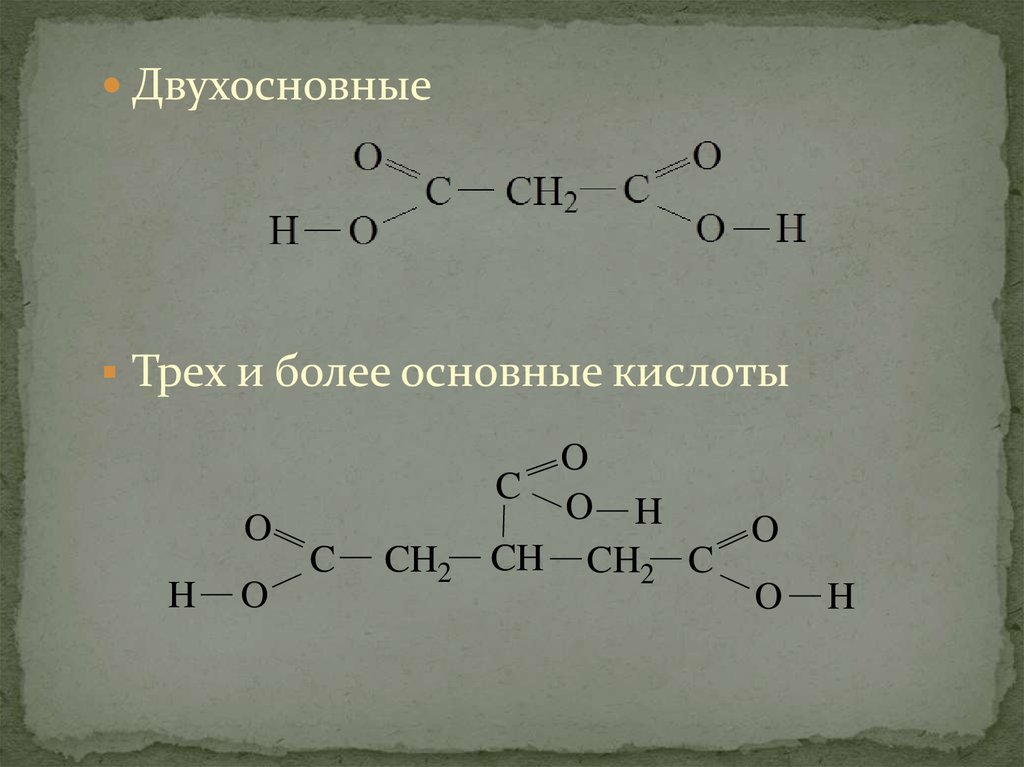
ДвухосновныеТрех и более основные кислоты
O
H
O
C
CH2
O
C
O H
O
CH CH2 C
O
H
5. Номенклатура
Систематическая или IUPAKСпособ I. Названия карбоновых кислот
образуют от названия родоначальных
углеводородов с тем же числом атомов
углерода, считая атом углерода
карбоксильной группы, и окончания –
овая кислота.
название углеводорода
ෟ
+ овая
кислота
6.
Способ II. Название карбоновых кислотобразуют от названия углеводорода,
содержащего карбоксильную группу в
качестве заместителя, и окончания –
карбоновая кислота. Номер атома
углерода, у которого находится
карбоксильная группа, должен иметь
наименьшее из возможных значение.
название углеводорода
ෟ
+ карбоновая
кислота
7.
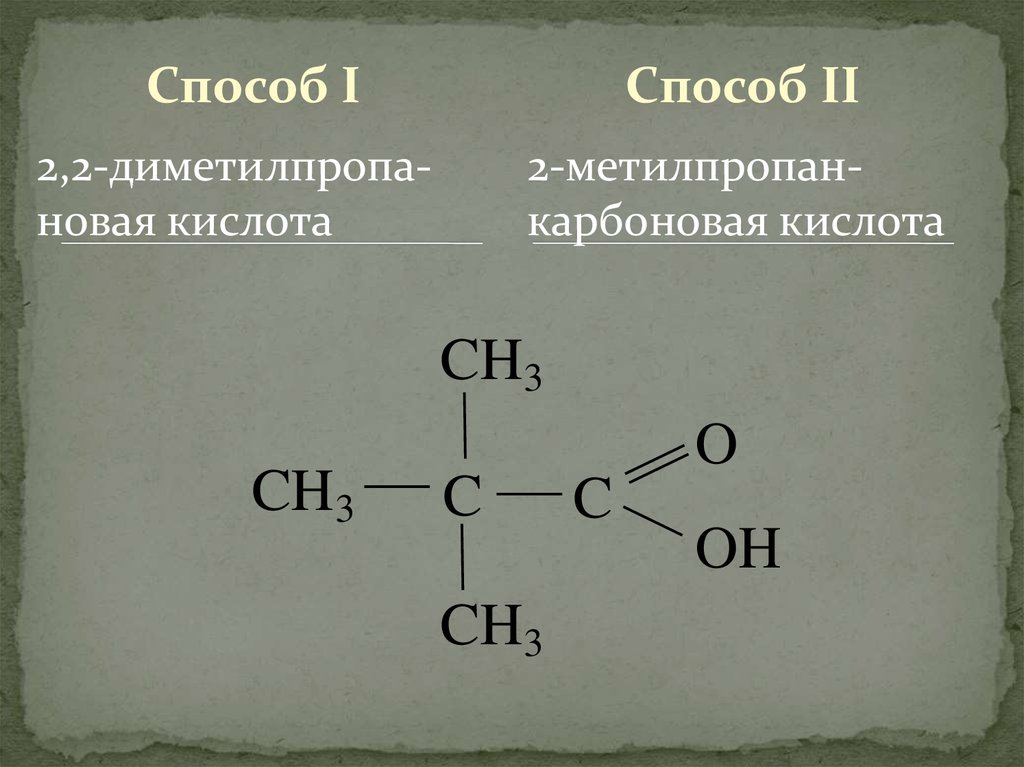
Способ IСпособ II
2,2-диметилпропановая кислота
2-метилпропанкарбоновая кислота
CH3
CH3
C
CH3
O
C
OH
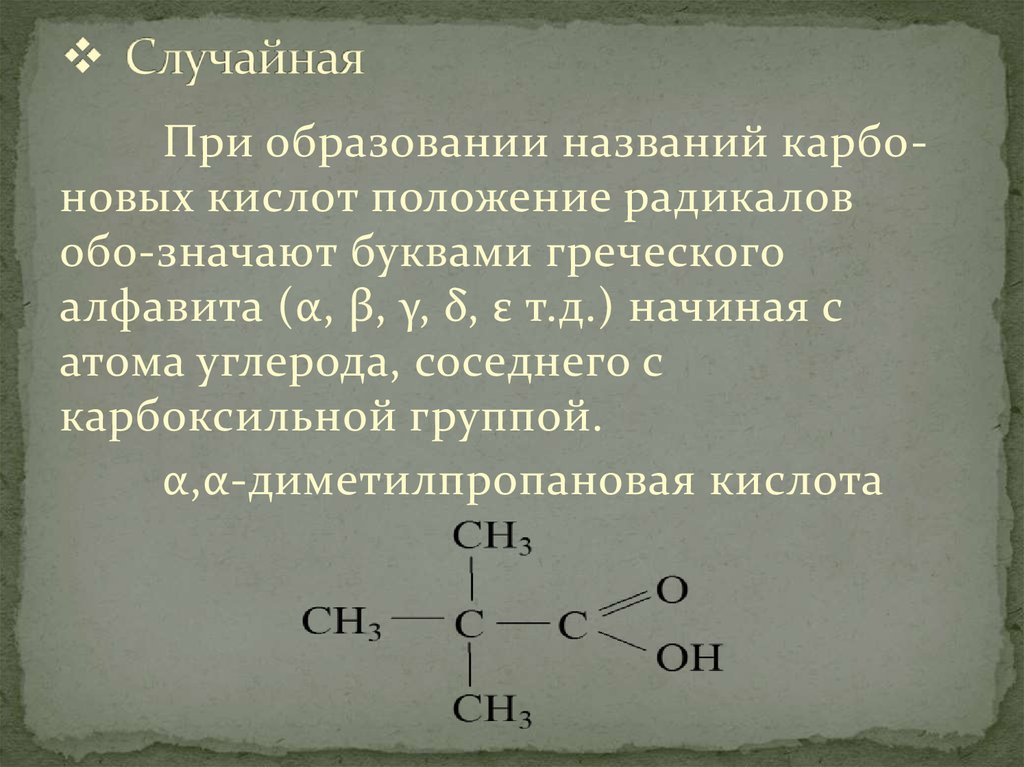
8. Случайная
При образовании названий карбоновых кислот положение радикаловобо-значают буквами греческого
алфавита (α, β, γ, δ, ε т.д.) начиная с
атома углерода, соседнего с
карбоксильной группой.
α,α-диметилпропановая кислота
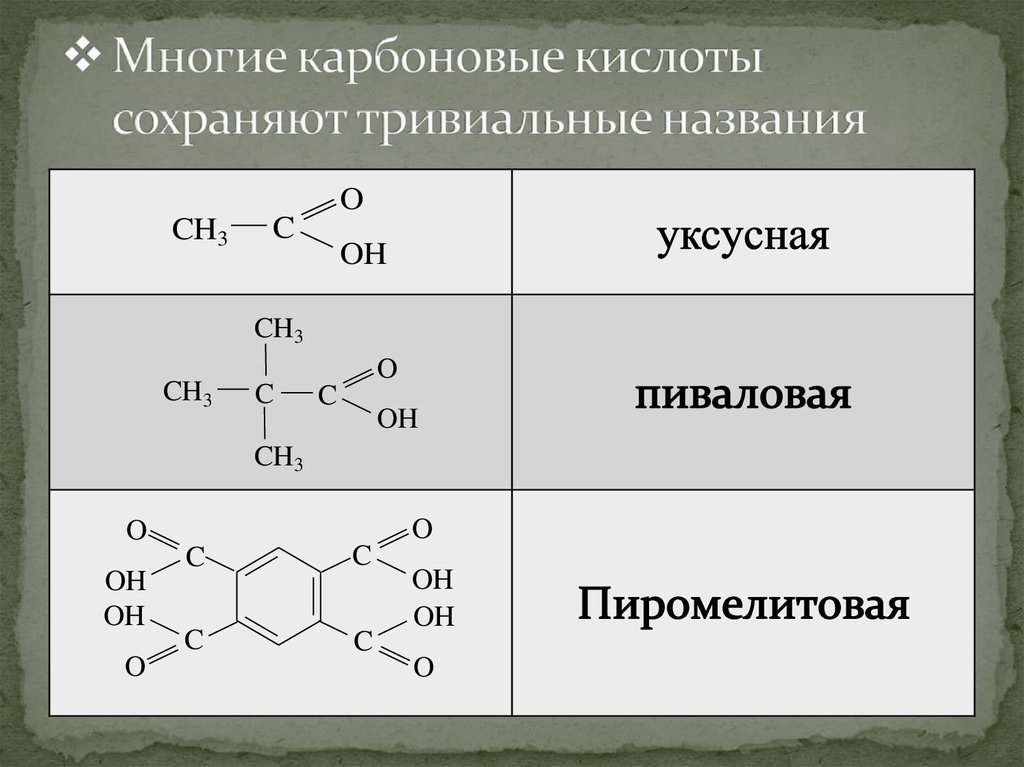
9. Многие карбоновые кислоты сохраняют тривиальные названия
OCH3
C
OH
CH3
CH3
C
O
C
OH
CH3
O
O
OH
OH
O
C
C
C
C
OH
OH
O
10. Одноосновные насыщенные (предельные) карбоновые кислоты
11.
НазваниеГомологический ряд
Способ I
O
H
C
метановая
OH
O
CH3
C
Способ II
OH
Тривиальное
муравьиная
этановая
метилкарбоновая
уксусная
пропановая
этилкарбоновая
пропионовая
бутановая
пропилкарбоновая
масляная
пентановая
бутилкарбоновая
валериановая
гексановая
пентилкарбоновая
капроновая
гептановая
гексилкароновая
энантовая
O
CH3
CH2
C
OH
O
CH3
CH2
CH3
CH2
(CH2 )3
C
OH
O
C
OH
O
CH3
(CH2 )4
C
CH3
(CH2 )5
C
OH
O
OH
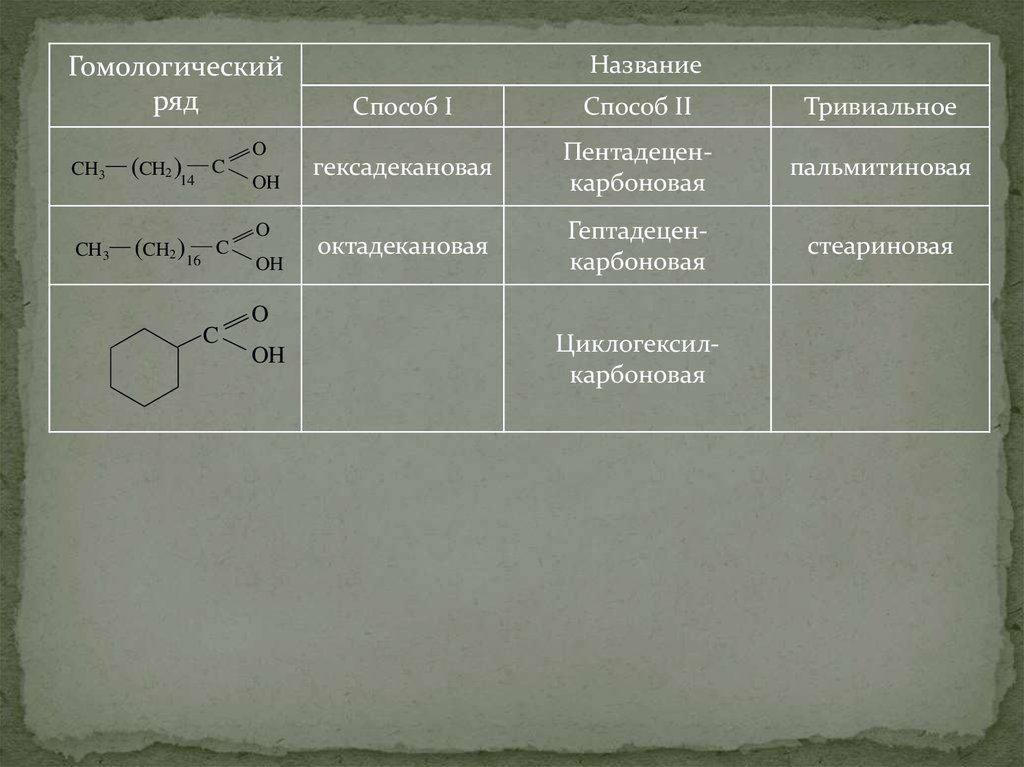
12.
Гомологическийряд
O
CH3
(CH2 )14
C
CH3
(CH2 )16
C
OH
O
OH
Название
Способ I
Способ II
Тривиальное
гексадекановая
Пентадеценкарбоновая
пальмитиновая
октадекановая
Гептадеценкарбоновая
стеариновая
O
C
OH
Циклогексилкарбоновая
13. Изомерия
насыщенных карбоновыхкислот определяется строением
углеводородного радикала (или
структурная изомерия)
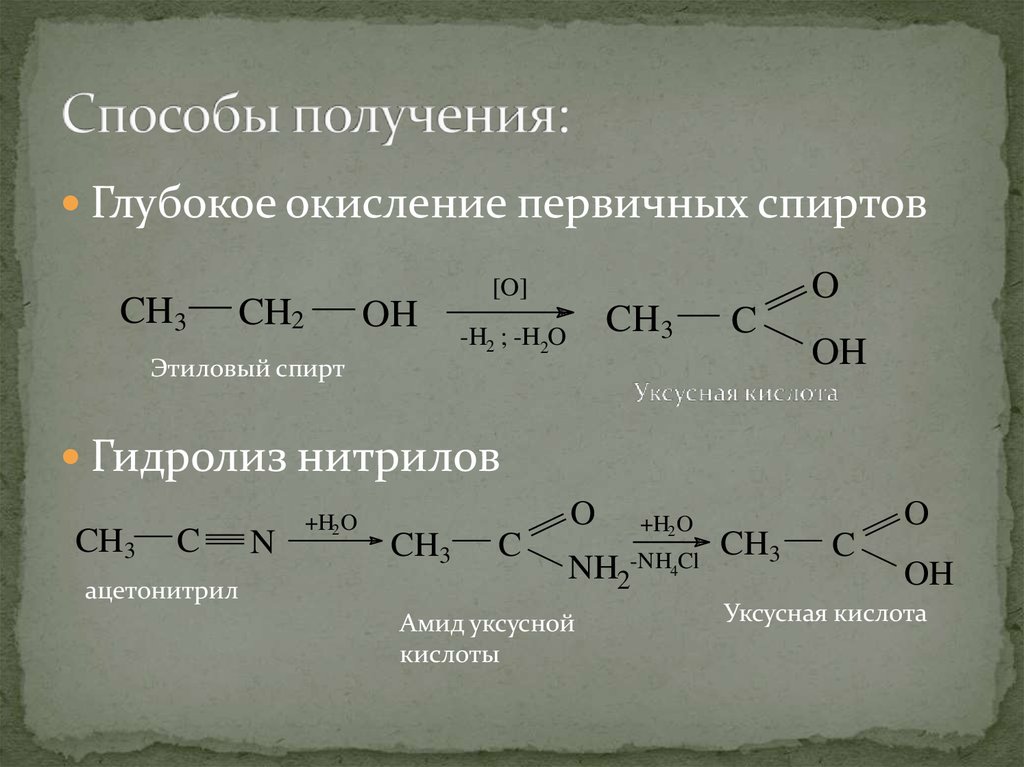
14. Способы получения:
Глубокое окисление первичных спиртовCH3
CH2
OH
Этиловый спирт
O
[O]
CH3
-H2 ; -H2O
C
OH
Гидролиз нитрилов
CH3
C
ацетонитрил
N
+H2 O
O
CH3
C
+H2 O
-NH4Cl
NH2
Амид уксусной
кислоты
CH3
O
C
OH
Уксусная кислота
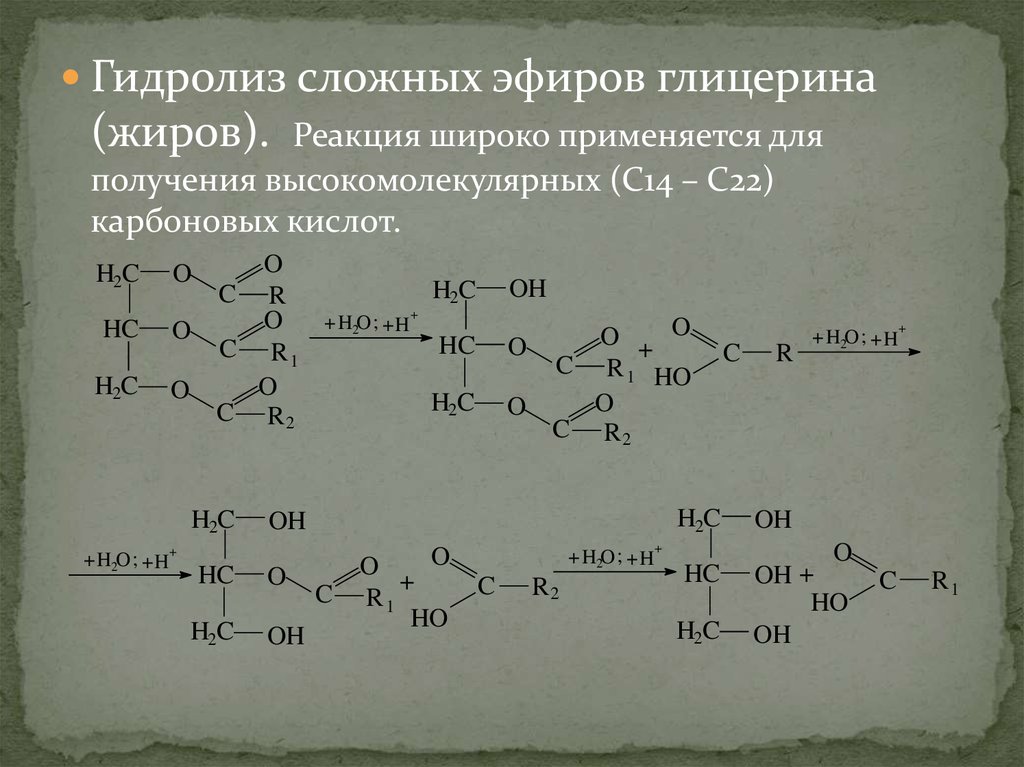
15.
Гидролиз сложных эфиров глицерина(жиров).
Реакция широко применяется для
получения высокомолекулярных (С14 – С22)
карбоновых кислот.
H2C
HC
H2C
O
C R
O
O
C R1
O
O
C R2
O
H2C
+ H2O ; + H
OH
H2C
+ H2O ; + H
+
O + O
O
C R 1 HO
O
O
C R2
HC
H2C
H2C
OH
+
HC
O
H2C
OH
C
O
O
+
R1
HO
+ H2O ; + H
C
R2
+
HC
H2C
C
R
+ H2O ; + H
+
OH
O
OH +
HO
OH
C
R1
16. Химические свойства
Химическое поведение кислот, впервую очередь, связано с наличием в их
молекуле карбоксильной группы, а так же
строением углеводородного радикала.
δδ+
C
O
O
∙∙
δ+
H
δ+
Атом водорода становится подвижным и
приобретает способность отщепляться в виде
протонов.
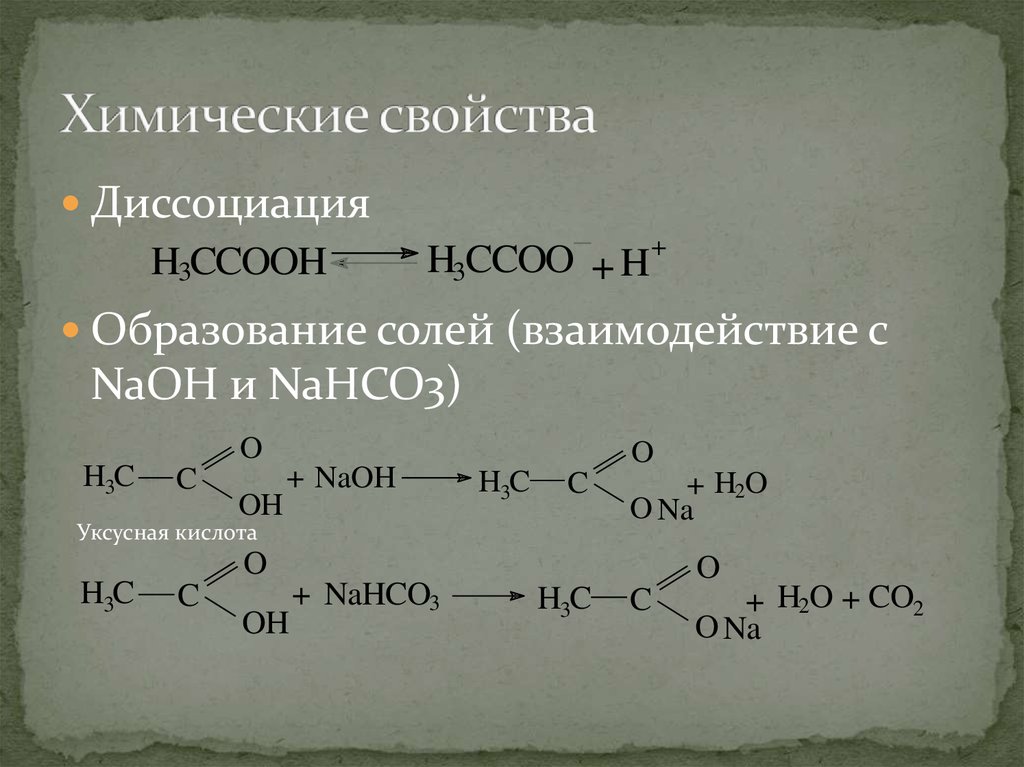
17. Химические свойства
ДиссоциацияH3CCOOH
H3CCOO + H+
Образование солей (взаимодействие с
NaOH и NaHCO3)
O
H3C
C
OH
+ NaOH
O
H3C
C
Уксусная кислота
+ H2O
O Na
O
H3C
C
OH
+ NaHCO3
O
H3C
C
+ H2O + CO2
O Na
18.
Образование галогенангидридов(взаимодействие с PCl5, PCl3 или HCl)
O
H3C
C
OH
O
+ PCl5
H3C
C
Хлорангидрид Cl
уксусной кислоты
Уксусная кислота
+ POCl3 + HCl
Образование ангидридов
O
H3C
H3C
C
O
OH
OH
C
H3C
H2SO4
C
O
-H2O
H3C
C
O
O
Ангидрид уксусной кислоты
O
O
H3C
C
Cl
O
+
Na O
C
CH3
Ацетат натрия
-NaCl
H3C
C
H3C
C
O
O
19.
Образование сложных эфиров. Реакцияэтерификации.
H3C
O
C
OH
+ HO
CH2
CH3
H2SO4
O
H3C
Этиловый спирт
C
O
CH2
CH3
Этиловый эфир уксусной
Образование амидов. Разложение солей
аммония.
O
O
H3C
C
+ NH3
OH
H3C
C
O NH4
Ацетат аммония
t
-H2O
O
H3C
C
NH2
Амид уксусной кислоты
20.
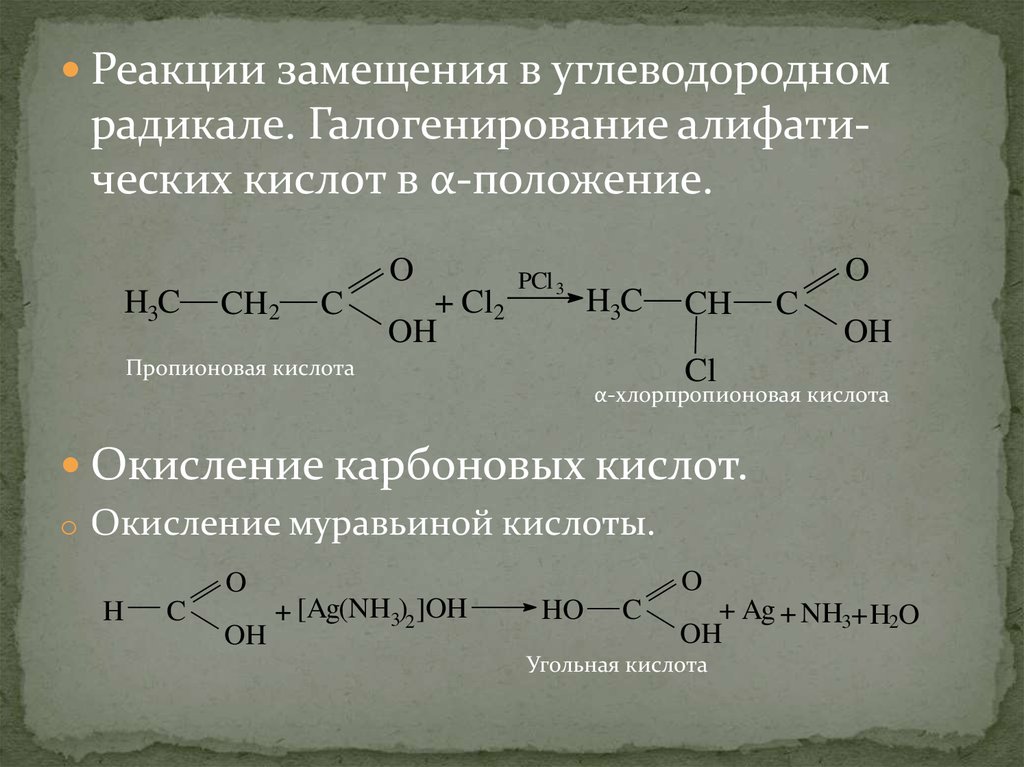
Реакции замещения в углеводородномрадикале. Галогенирование алифатических кислот в α-положение.
O
H3C
CH2
C
+ Cl2
OH
PCl 3
O
H3C
Пропионовая кислота
CH
C
OH
Cl
α-хлорпропионовая кислота
Окисление карбоновых кислот.
o Окисление муравьиной кислоты.
O
O
H
C
OH
+ [Ag(NH3)2]OH
HO
C
+ Ag + NH3+ H2O
OH
Угольная кислота
21.
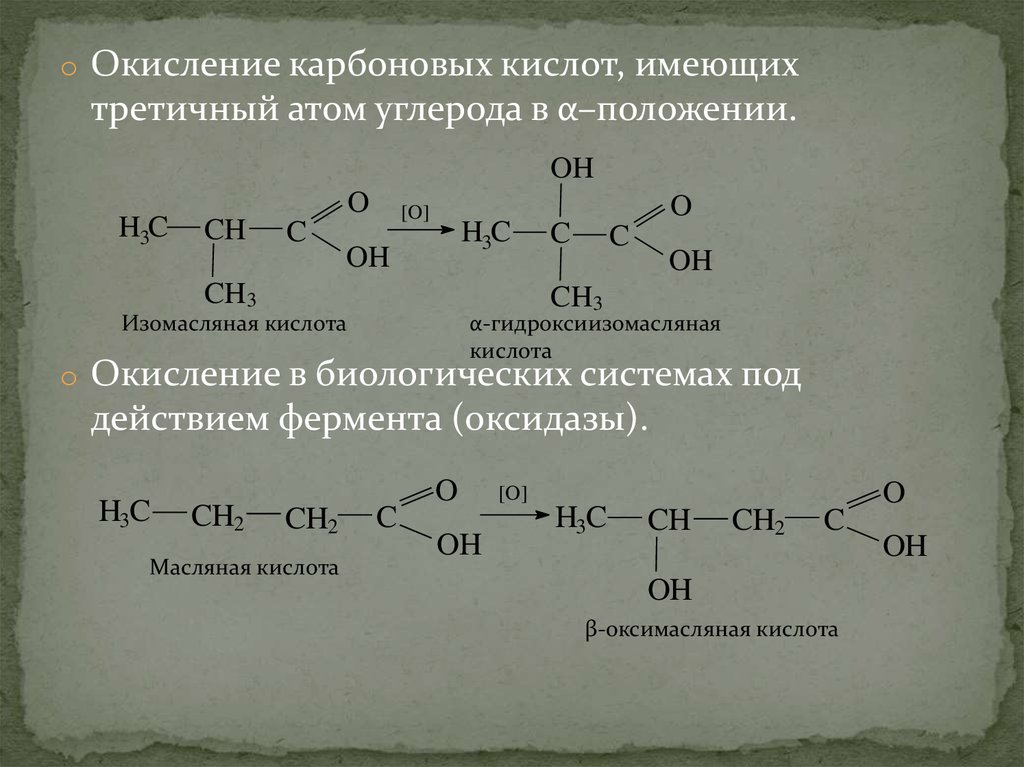
o Окисление карбоновых кислот, имеющихтретичный атом углерода в α–положении.
OH
H3C
O
CH
C
[O]
H3C
OH
CH3
O
C
C
OH
CH3
Изомасляная кислота
α-гидроксиизомасляная
кислота
o Окисление в биологических системах под
действием фермента (оксидазы).
H3C
CH2
CH2
Масляная кислота
C
O
OH
[O]
H3C
CH
CH2
C
OH
β-оксимасляная кислота
O
OH
22. Одноосновные ненасыщенные (непредельные) карбоновые кислоты
23.
НазваниеГомологический ряд
H2C
CH
H2C
C
O
C
OH
O
C
OH
CH3
H3C
H
H
H3C
H3C
C
H
HC
C
C
(CH2) 7
C
H
C
C
OH
H
C
C
O
C
C
O
OH
(CH2)7
H
O
OH
C
O
OH
Способ I
Способ II
Тривиальное
пропеновая
Этиленкарбоновая
акриловая
2-метилпропеновая
Пропенкарбоновая-2
Метакриловая
транс-бутен2-овая
транспропенкарбоновая
кротоновая
цис-бутен-2овая
циспропенкарбоновая
изокротовая
цисоктадецен-9овая
цисгептодецен-8карбоновая
олеиновая
пропиновая
Ацетиленкарпропиоловая
боноваяя
24. Изомерия
ненасыщенных карбоновыхкислот определяется:
строением углеводородного радикала
(или структурная изомерия)
Положением двойных или тройных
связей
Пространственная (геометрическая или
цис-транс-)
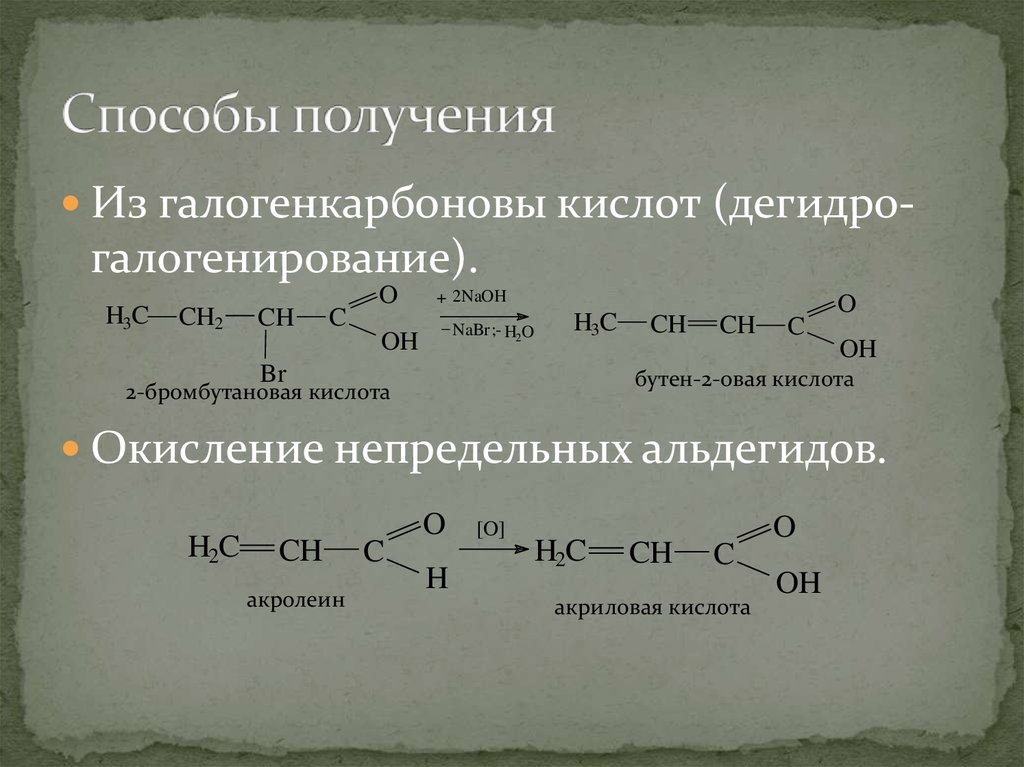
25. Способы получения
Из галогенкарбоновы кислот (дегидро-галогенирование).
H3C
CH2
CH
C
O
OH
+ 2NaOH
_ NaBr ;H2 O
H3C
Br
CH
CH
C
O
OH
бутен-2-овая кислота
2-бромбутановая кислота
Окисление непредельных альдегидов.
H2C
CH
акролеин
C
O
H
[O]
H2C
CH
C
акриловая кислота
O
OH
26. Химические свойства
Ненасыщенные одноосновные кислотывступают во все реакции, характерные для кислот (образование солей, сложных эфиров, ангидридов, галогенангидридов, амидов и т.д.), а в связи с наличием кратной связи – в реакции присоединения, окисления, полимеризации.
α-ненасыщенные кислоты отличаются некоторыми особенностями в химическом поведении. (Например: присоединение галогеноводородов и воды протекает против правила Марковникова.
27.
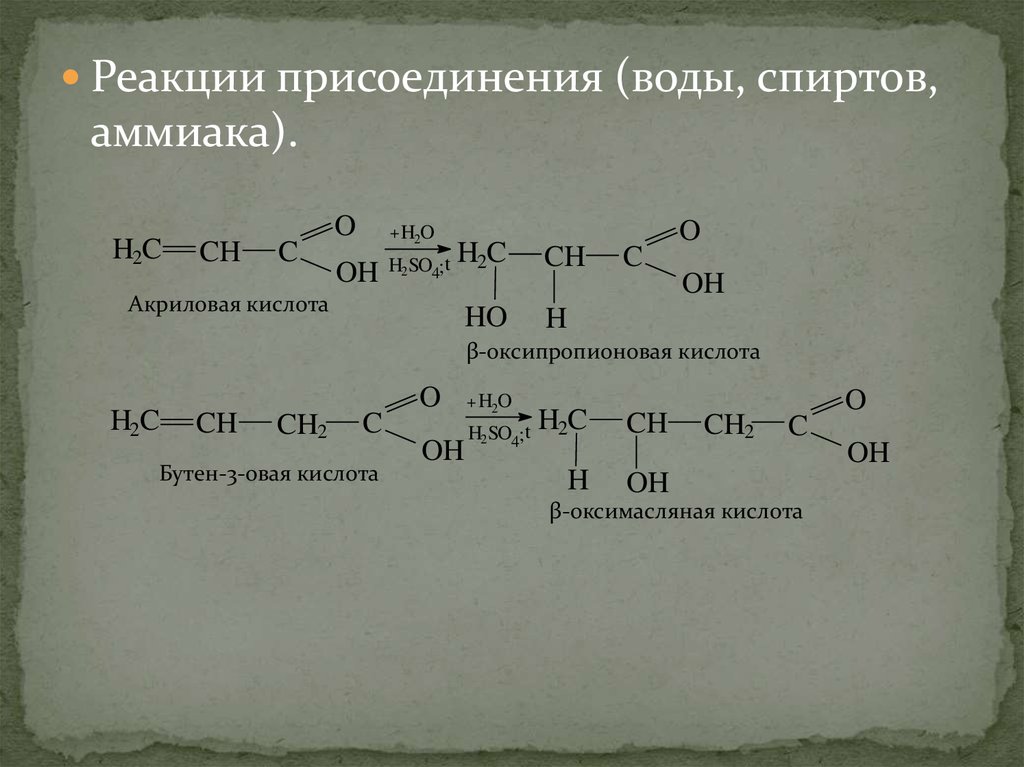
Реакции присоединения (воды, спиртов,аммиака).
H2C
CH
C
O
+ H2O
OH
H2 SO4; t
H2C
Акриловая кислота
CH
C
O
OH
HO
H
β-оксипропионовая кислота
H2C
CH
CH2
C
Бутен-3-овая кислота
O
OH
+ H2O
H2 SO4; t
H2C
H
CH
CH2
C
OH
β-оксимасляная кислота
O
OH
28.
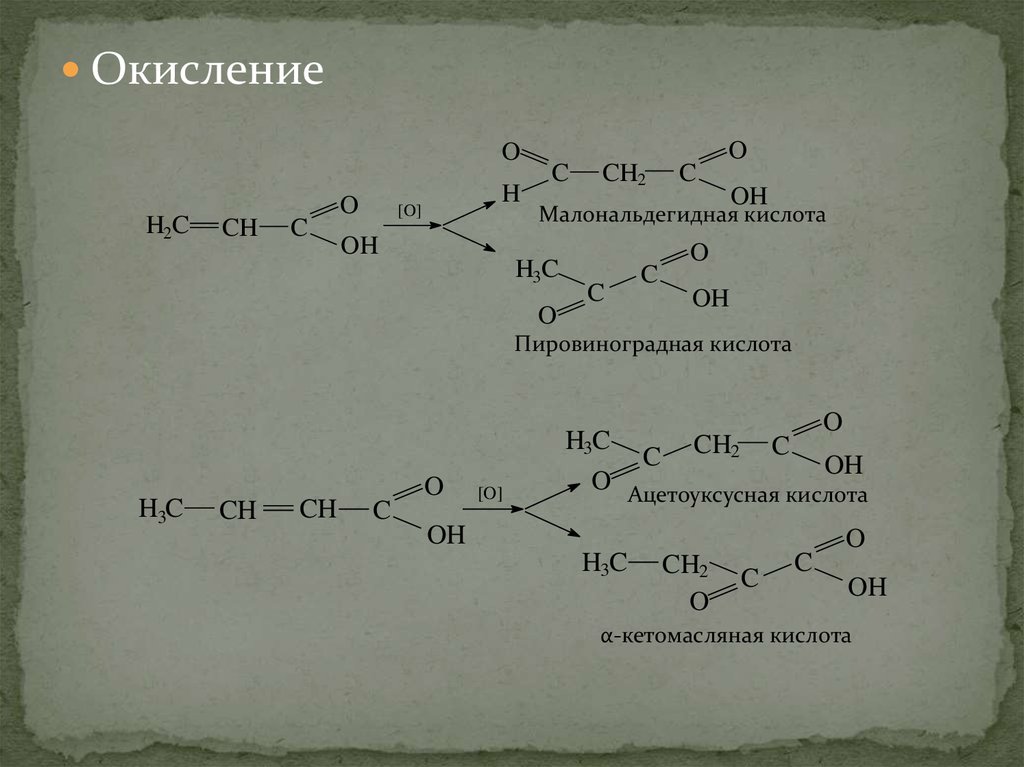
ОкислениеO
H2C
CH
C
O
H
[O]
C
CH2
C
O
OH
Малональдегидная кислота
OH
H3C
O
C
C
O
OH
Пировиноградная кислота
H3C
CH
CH
C
O
[O]
O
H3C
C CH2 C OH
O Ацетоуксусная кислота
OH
H3C
CH2
O
C
C
O
OH
α-кетомасляная кислота
29.
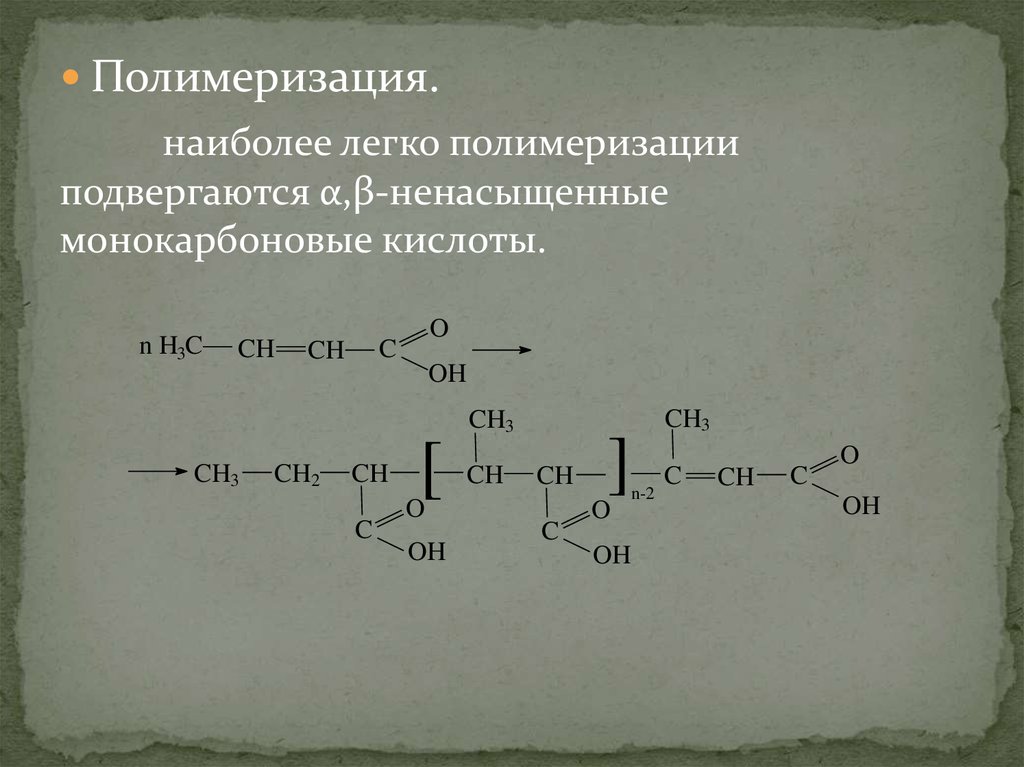
Полимеризация.наиболее легко полимеризации
подвергаются α,β-ненасыщенные
монокарбоновые кислоты.
n H3C
CH
O
C
CH
OH
CH3
CH3
CH3
CH2
CH
C
[
O
OH
CH
CH
C
]
O
OH
n-2
C
CH
C
O
OH
30.
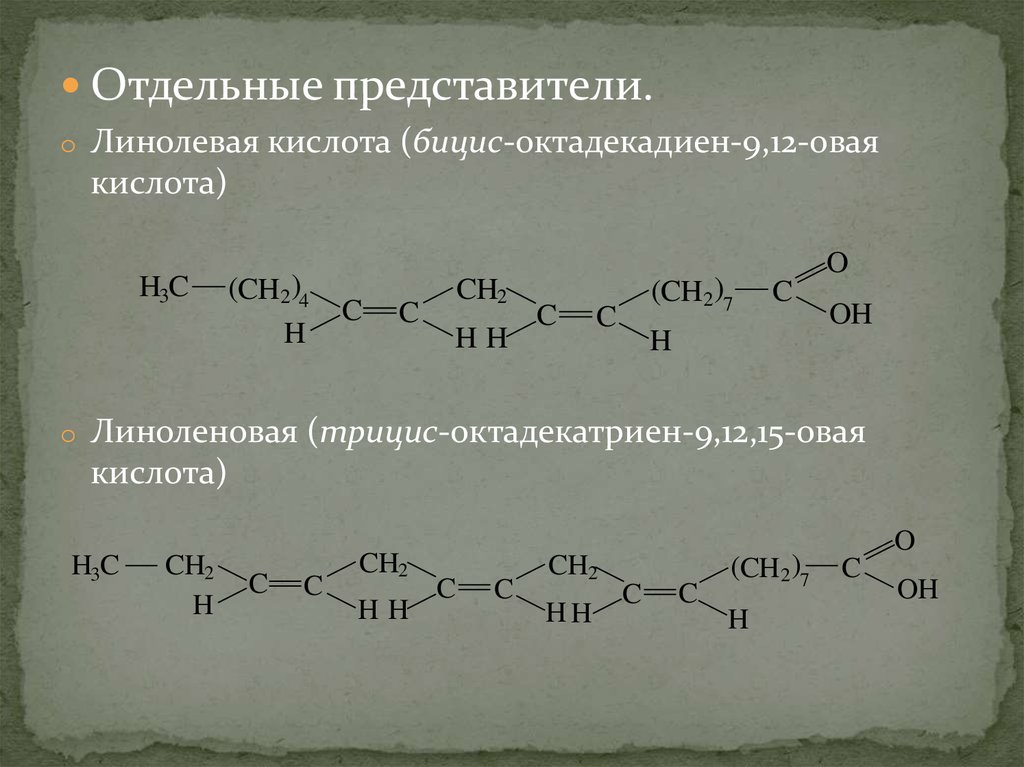
Отдельные представители.o Линолевая кислота (бицис-октадекадиен-9,12-овая
кислота)
H3C
(CH2 )4
H
C
C
CH2
HH
C
(CH2 )7
C
O
C
H
OH
o Линоленовая (трицис-октадекатриен-9,12,15-овая
кислота)
H3C
CH2
H
C
C
CH2
HH
C
C
CH2
HH
C
C
(CH2 )7
H
O
C
OH
31. Ароматические кислоты
32.
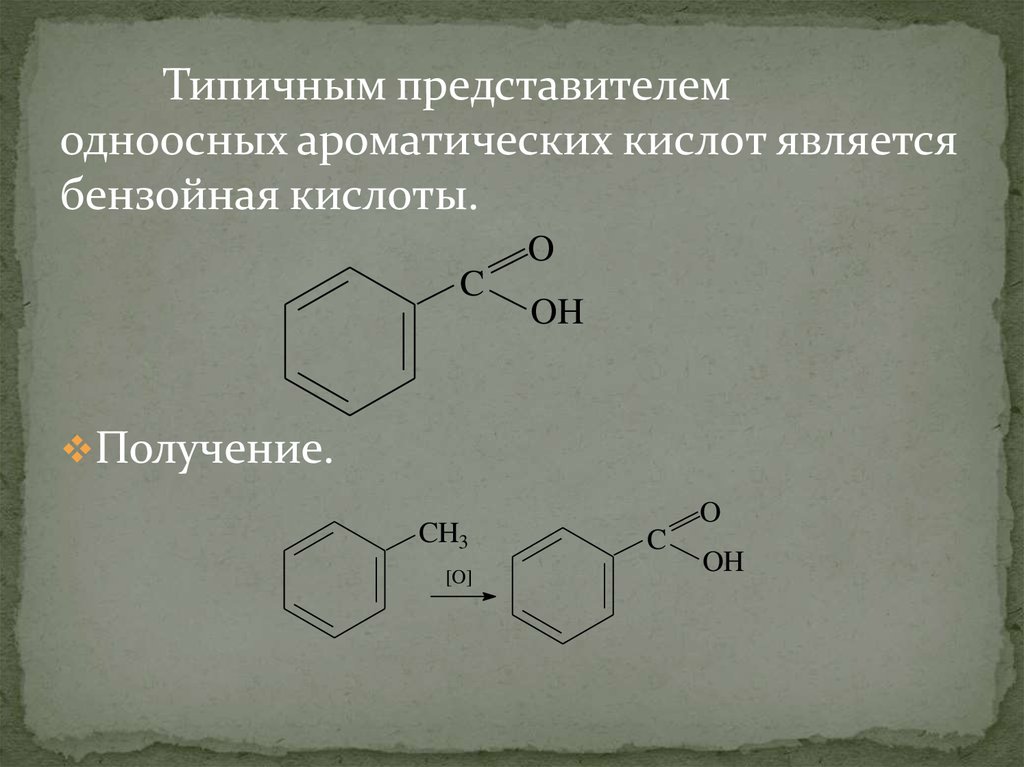
Типичным представителемодноосных ароматических кислот является
бензойная кислоты.
O
C
OH
Получение.
CH3
[O]
O
C
OH
33. Химические свойства
Реакции карбоксильной группы.Для аренкарбоновых кислот характерны
все реакции насыщенных карбоновых кислот в
карбоксильной группе.
34.
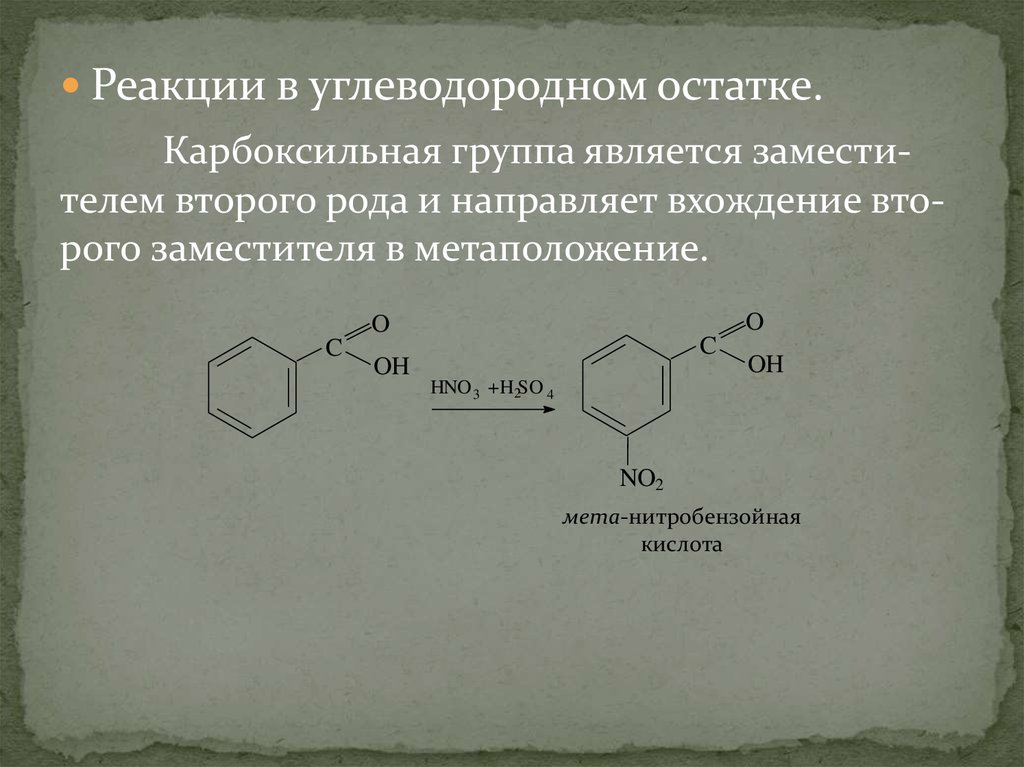
Реакции в углеводородном остатке.Карбоксильная группа является заместителем второго рода и направляет вхождение второго заместителя в метаположение.
O
O
C
OH
C
OH
HNO 3 +H2SO 4
NO2
мета-нитробензойная
кислота
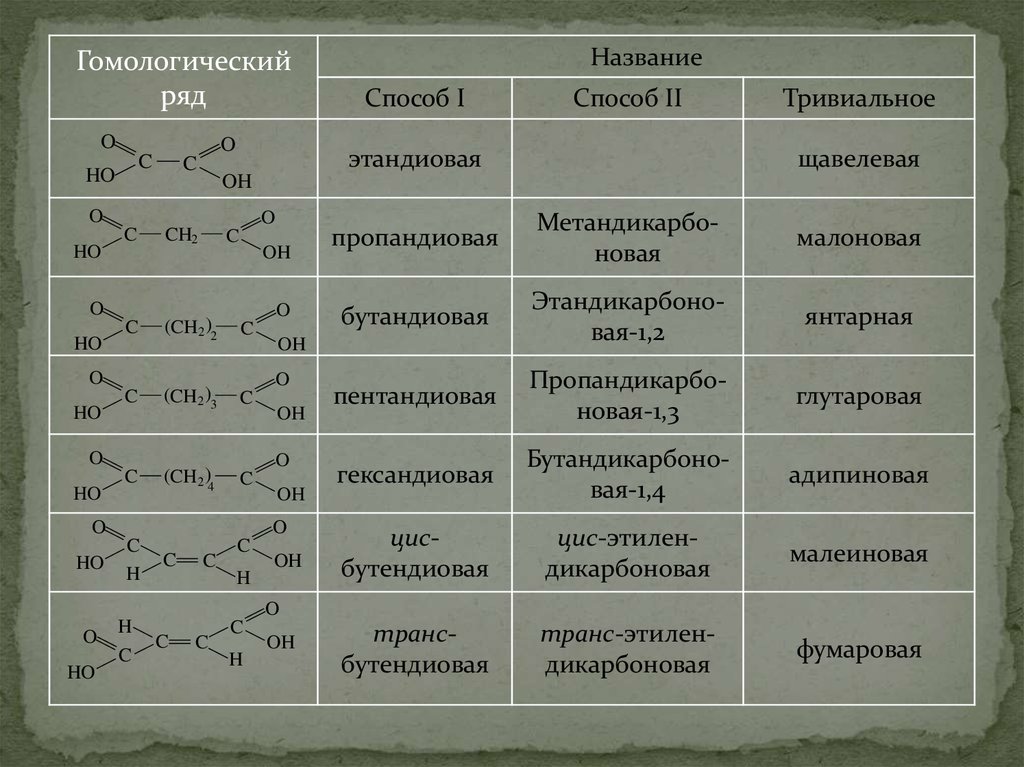
35. Двухосновные кислоты
36.
Гомологическийряд
O
O
C
HO
C
HO
O
HO
C
O
HO
C
O
HO
C
HO
O
CH2
C
(CH2 )2
(CH2 )3
(CH2 )4
OH
O
C
Тривиальное
щавелевая
O
C
OH
O
C
C
C
H
пропандиовая
Метандикарбоновая
малоновая
бутандиовая
Этандикарбоновая-1,2
янтарная
пентандиовая
Пропандикарбоновая-1,3
глутаровая
гександиовая
Бутандикарбоновая-1,4
адипиновая
цисбутендиовая
цис-этилендикарбоновая
малеиновая
трансбутендиовая
транс-этилендикарбоновая
фумаровая
OH
OH
O
C
Способ II
OH
O
C
H
Способ I
этандиовая
O
C
Название
OH
O
O
HO
H
C
C
C
C
H
OH
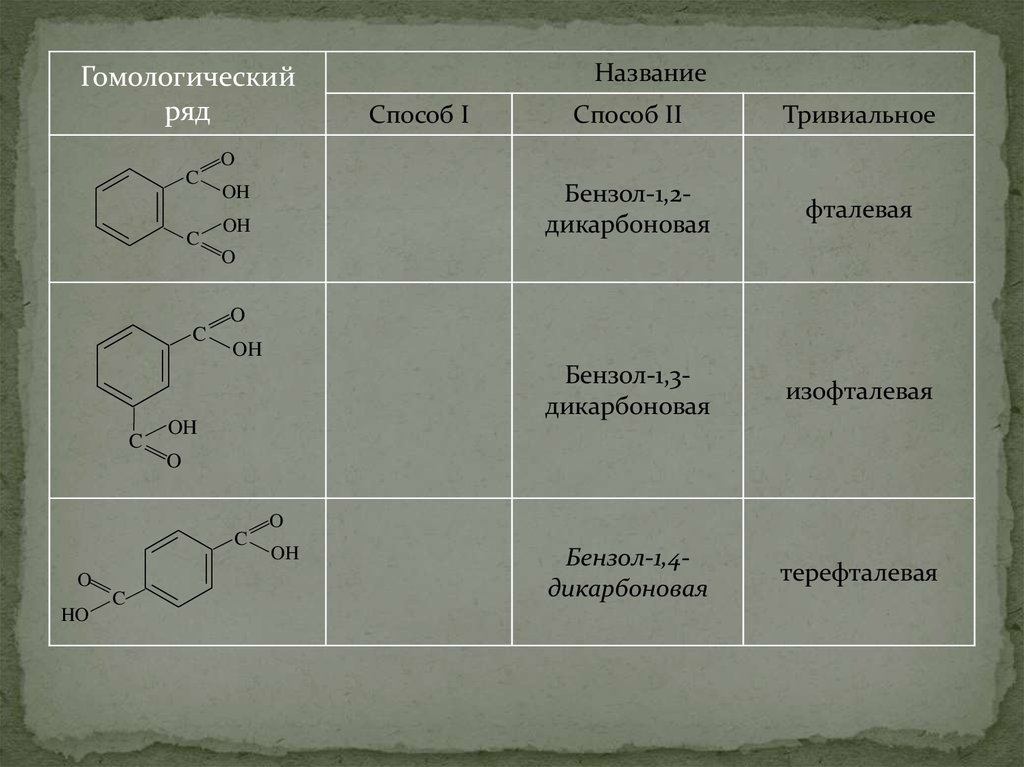
37.
Гомологическийряд
Название
Способ I
Способ II
Тривиальное
Бензол-1,2дикарбоновая
фталевая
Бензол-1,3дикарбоновая
изофталевая
Бензол-1,4дикарбоновая
терефталевая
O
C
C
OH
OH
O
O
C
C
OH
OH
O
O
C
O
HO
C
OH
38. Изомерия
Структурная изомерия насыщенных али-фатических двухосновных карбоновых
кислот.
У ненасыщенных кислот имеет место
геометрическая изомерия.
У ароматических двухосновных кислот
изомерия также изомерия положения
карбоксильных групп.
39. Способы получения.
Для получения двухосновных кислот используютпринципиально те же методы, что и для
одноосновных, с той разницей, что в молекуле
необходимо создать не одну, а две карбоксильные
группы. Например:
H2C
HO
CH2
OH
[O]
O
HO
C
O
C
OH
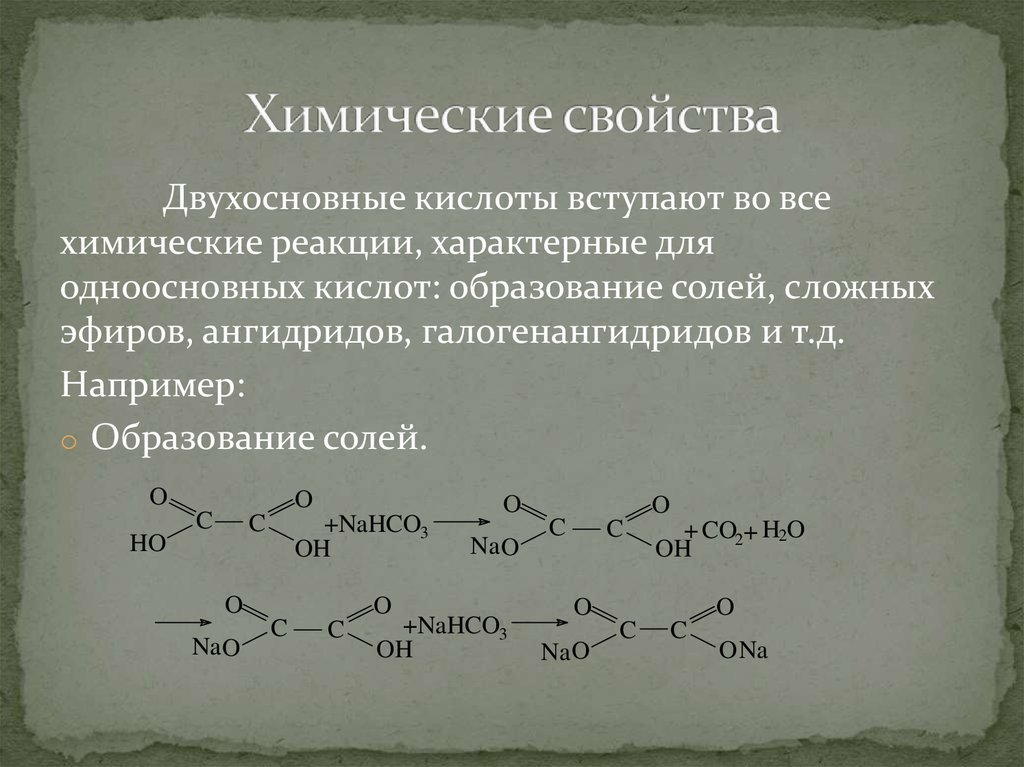
40. Химические свойства
Двухосновные кислоты вступают во всехимические реакции, характерные для
одноосновных кислот: образование солей, сложных
эфиров, ангидридов, галогенангидридов и т.д.
Например:
o Образование солей.
O
HO
O
C
C
+NaHCO3
OH
O
Na O
O
C
C
O
Na O
+NaHCO3
OH
O
C
C
+ CO2 + H2O
OH
O
Na O
O
C
C
O Na
41.
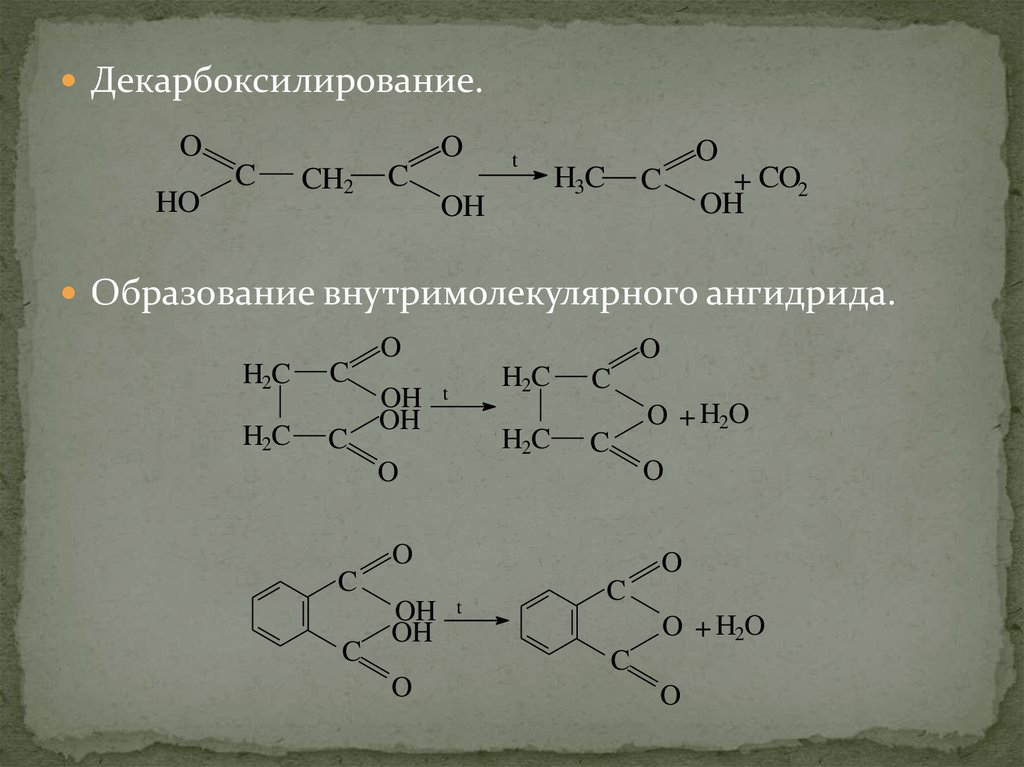
Декарбоксилирование.O
HO
O
C
CH2
C
t
OH
O
H3C
+ CO2
OH
C
Образование внутримолекулярного ангидрида.
H2C
H2C
C
C
O
OH
OH
O
H2C
t
H2C
C
O + H2O
C
O
O
O
O
C
C
OH
OH
t
C
O + H2O
C
O
O




















 Химия
Химия








